Las técnicas de radioterapia asociadas a la cirugía conservadora del cáncer de mama precoz han evolucionado gracias a un mayor conocimiento de la radiobiología tumoral, destacando entre ellas la radioterapia intraoperatoria (RIO). Sin embargo, se han documentado complicaciones con dicha técnica, principalmente la fibrosis. El factor de crecimiento transformante beta (TGF-β) es una citocina relacionada con la fibrosis inducida después de la radiación que podría servir como marcador temprano del riesgo de desarrollo de la misma.
MétodosEstudio prospectivo multicéntrico de 60 pacientes a las que se les ha sometido a cirugía conservadora por cáncer de mama, asociada a RIO en 30 de ellas. Se evalúan los valores de TGF-β en muestras de suero preoperatorio y a las 24h desde la cirugía, y de muestras de drenaje a las 6 y 24h desde la cirugía.
ResultadosLos valores de TGF-β objetivados en el suero y en el débito de drenaje a las 24h desde la cirugía de las pacientes que recibieron RIO fueron significativamente mayores que los de aquellas que no la recibieron (p<0,0001). De entre ellas, 8 pacientes presentaron valores superiores a 1.000pg/ml. Estas diferencias entre los grupos no se modifican por el tipo de muestra utilizada, bien sea suero, bien débito de drenaje (p=0,5881).
ConclusionesAunque deben realizarse más estudios, valores elevados de TGF-β en las pacientes con cáncer de mama a las que se les realiza cirugía conservadora asociada a RIO pueden predecir el riesgo de fibrosis.
Radiotherapy techniques associated with breast-conserving surgery have evolved in early breast cancer thanks to a better knowledge of tumor radiobiology, highlighting intraoperative radiotherapy (IORT). However, complications have been documented with this procedure, mainly fibrosis. Transforming growth factor beta (TGF-β) is a cytokine with an active role in radiation-induced fibrosis, which could be used as an early biomarker for the development of fibrosis.
MethodsMulticentric prospective analysis of 60 patients with breast cancer who underwent breast-conserving surgery, 30 of whom had received additional IORT. TGF-β values were evaluated in serum pre-surgery and in serum collected 24h after surgery. In addition, we evaluated surgical wound fluids collected 6h and 24h following surgery.
ResultsSerum and surgical wound fluids TGF-β values collected over 24h following surgery were significantly higher in patients who received additional IORT (P<.0001). Notably, 8 of these patients showed values above 1,000pg/ml. There were no differences between the samples (serum or surgical wound fluids) (P=.5881).
ConclusionsAlthough further investigation is needed, higher TGF-β values in IORT during breast-conserving surgery can be used as an early biomarker for the development of fibrosis.
El tratamiento del cáncer de mama precoz basado en cirugía conservadora junto con radioterapia es en la actualidad de elección en la mayoría de las pacientes1–3.
La radioterapia externa constituye el tratamiento estándar, siendo un componente fundamental que afecta tanto al control local como a la supervivencia. Sin embargo, gracias a un mayor conocimiento de la radiobiología tumoral, un grupo seleccionado de pacientes pueden beneficiarse de técnicas de irradiación parcial acelerada tratando el lecho tumoral en menor número de sesiones con dosis más elevadas1,4–6.
La radioterapia intraoperatoria (RIO) asociada a la cirugía conservadora como tratamiento del cáncer de mama es el exponente del importante desarrollo de estas técnicas. Con ella conseguimos aplicar dosis superiores en una única dosis de radiación de forma directa en el lecho quirúrgico, con un posible beneficio en las tasas de recurrencia y la toxicidad de los órganos en riesgo1,4–10.
Veronesi et al.11 encontraron que un 6% de sus pacientes presentaron complicaciones tras la aplicación de la RIO, de las cuales, las más frecuentes fueron la fibrosis y la necrosis grasa. Sin embargo, en un estudio desarrollado por Key et al. se objetivó que después de la RIO solamente presentó fibrosis grado ii o superior un 2,4%, mientras que si se asociaba con radioterapia externa esta cifra se elevaba al 43,3%12. Según la bibliografía publicada, las complicaciones más severas se han asociado a dosis superiores de 24Gy, situándose en torno a una incidencia del 30%, que desciende al 25% con dosis de 20-21Gy7,11,13–15.
La fibrosis consiste en la formación en exceso de tejido conectivo caracterizada por la producción aumentada de proteínas de la matriz extracelular y la acumulación de fibroblastos activados durante el proceso de cicatrización16,17. Aunque esta complicación puede detectarse años después de la exposición a la radiación, el factor de crecimiento transformante beta (TGF-β) es el componente regulador principal de la fibrosis desde sus fases iniciales16,18–20, habiéndose demostrado su relación con la fibrosis inducida después de la radiación en pacientes16,21.
Por lo tanto, el TGF-β constituye una citocina involucrada en diferentes procesos como la fibrosis relacionada con la radiación, aumentando la producción de proteínas de la matriz extracelular y la acumulación de fibroblastos diferenciados16,17.
Estudios previos la han relacionado con el desarrollo de fibrosis tras el tratamiento del cáncer de mama, por lo que podría servir como un marcador temprano de desarrollo de estas complicaciones16,22,23. Se hace por tanto necesario conocer el efecto que la aplicación de la RIO tiene sobre este factor determinante, ya que la inhibición de la actividad del mismo en pacientes seleccionadas podría reducir estos efectos adversos.
El objetivo de nuestro estudio, por tanto, es analizar el efecto que la RIO tiene sobre los valores de TGF-β en las muestras de suero y débito de drenaje de nuestras pacientes, ya que podría servir como un marcador temprano del desarrollo de fibrosis.
MétodosDiseño del estudio. Se ha realizado un estudio prospectivo multicéntrico dividido en 2 grupos comparativos con casos consecutivos para evaluar la relación de la RIO con los valores de TGF-β objetivados en las muestras de drenaje y suero de las pacientes a las que se les ha sometido a una cirugía conservadora por cáncer de mama asociada o no a RIO.
Para ello se han recogido en todos los casos muestras de suero preoperatorio y a las 24h desde la cirugía y muestras de drenaje a las 6 y 24h desde la cirugía.
Los criterios de inclusión en el grupo correspondiente a las pacientes a las que se les ha administrado la RIO, grupo de casos, responden a los criterios de selección de la RIO en nuestro centro que se exponen en la tabla 1.
Criterios de selección RIO
| Edad | >50 años |
| Etapa del climaterio | Posmenopausia |
| Estudio genético | BRCA 1 y BRCA 2 negativo |
| Tamaño tumoral | <3cm (T1,T2,T3) |
| Estudio de extensión | Sin afectación ganglionar o distante |
| Estudio de márgenes intraoperatorios de la pieza | Negativos (≥2mm) |
| Pruebas de imagen | Unicéntrico y unifocal |
| Invasión linfovascular | Negativa |
| Receptores hormonales | Positivos |
| Tipo anatomopatológico | Ductal, mucinoso, tubular, coloide |
| Carcinoma intraductal | <30% |
El grupo de controles está formado por las pacientes con cáncer de mama a las que se les ha realizado cirugía conservadora sin aplicación de la RIO con los mismos criterios de inclusión que el grupo de casos.
Se ha excluido de este estudio a las pacientes con enfermedades sistémicas benignas con conocida alteración en las vías moleculares del TGF-β, así como a las pacientes con tumor primario múltiple.
Tratamiento de radioterapia. La RIO se ha aplicado mediante una fuente radiactiva Xoft AxxentTM x-Ray Source modelo S700 que trabaja con tensión de 50KV, proporciona isodosis esféricas e imparte 20Gy en la superficie del aplicador tipo balloon. Para el cálculo de dosis, el fabricante proporciona todos los valores de caracterización de la fuente de rayos X necesarios para modelar el sistema de planificación, en nuestro caso, BrachyVisionTM de Varian. El espesor de tejido entre el balloon y la piel ha sido siempre superior a 1cm comprobado mediante ecografía1.
Inmunodetección de TGF-β. Las muestras de suero y de drenaje quirúrgico son centrifugadas, esterilizadas y almacenadas a −80°C en el momento de recogida de las mismas para conservarlas intactas.
Posteriormente, se ha realizado en cada una de las muestras recogidas el análisis de TGF-β mediante ELISA kits específico para proteínas humanas (Invitrogen, Thermo Fisher Scientific) usando controles positivos y negativos según las instrucciones de la casa comercial. Todas las determinaciones se han realizado por duplicado para considerarse específicas.
Cálculo de tamaño muestral. El cálculo del tamaño de muestra se basa en el cálculo para comparación de medias, de 2 grupos independientes, asumiendo que la variable correspondiente al TGF-β sigue una distribución normal y usando la prueba t de Student.
Suponemos que la varianza de dicha variable es similar en ambos grupos pero desconocida. Para cuantificar la magnitud de la diferencia entre los grupos hemos utilizado la denominada diferencia estandarizada (?) de medias utilizada por Machin et al.24 siguiendo las recomendaciones de Cohen25 y asumiendo que el efecto es grande con ?=0,8.
A un nivel de confianza del 95% y una potencia mínima del 80% son necesarias 25 personas por grupo. Suponiendo un 5% de posibles pérdidas, la muestra necesaria estimada es de 27 pacientes por grupo.
Cumplimiento de normas éticas. Todas las pacientes incluidas en el estudio han firmado el consentimiento informado específico requerido. El estudio ha sido aprobado por el Comité de Ética de la Investigación de nuestra comunidad.
Análisis estadísticoLas variables cualitativas se han descrito mediante frecuencias absolutas y relativas, y las cuantitativas se han descrito con media y desviación estándar si eran paramétricas, y con mediana, primer cuartil y tercer cuartil en el caso de las no paramétricas.
Posteriormente se ha realizado un análisis bivariante. Se ha estudiado la asociación estadística entre variables cualitativas mediante la prueba de Chi-cuadrado o el test de Fisher, y entre variables cuantitativas utilizando test de t de Student o la prueba de U de Mann Whitney para variables paramétricas o no, respectivamente.
Para toda la investigación se ha utilizado el software estadístico R 3.5.1, estableciéndose el nivel de significación estadística en p<0,05.
ResultadosSe reclutaron un total de 60 pacientes para el estudio, 30 de ellas recibieron la RIO tras la cirugía conservadora del cáncer de mama.
La edad media de las pacientes fue de 65,53 años (DT 9,44), en el caso de los controles fue de 66,47 años (DT 7,49), mientras que en los casos fue ligeramente menor, 64,60 años (DT 11.10), sin que se observen diferencias estadísticamente significativas.
Todas las pacientes incluidas cumplían los criterios de inclusión sin observar diferencia estadística entre los grupos.
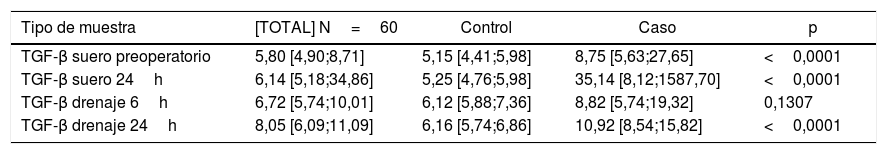
En primer lugar, comparamos los valores de TGF-β objetivados en los diferentes tipos de muestra entre las pacientes a las que se les ha realizado cirugía conservadora de cáncer de mama recibiendo posteriormente la RIO (casos) o no (controles), y encontramos que hay diferencias estadísticamente significativas en todos los casos salvo para los valores obtenidos en la muestra de drenaje a las 6h desde la cirugía (tabla 2).
Comparación univariante entre casos y controles
| Tipo de muestra | [TOTAL] N=60 | Control | Caso | p |
|---|---|---|---|---|
| TGF-β suero preoperatorio | 5,80 [4,90;8,71] | 5,15 [4,41;5,98] | 8,75 [5,63;27,65] | <0,0001 |
| TGF-β suero 24h | 6,14 [5,18;34,86] | 5,25 [4,76;5,98] | 35,14 [8,12;1587,70] | <0,0001 |
| TGF-β drenaje 6h | 6,72 [5,74;10,01] | 6,12 [5,88;7,36] | 8,82 [5,74;19,32] | 0,1307 |
| TGF-β drenaje 24h | 8,05 [6,09;11,09] | 6,16 [5,74;6,86] | 10,92 [8,54;15,82] | <0,0001 |
Posteriormente, analizamos los valores obtenidos a través de modelos en los que hemos tenido en cuenta si las pacientes han recibido o no la RIO, así como el tipo de muestra, suero o débito del drenaje y el tiempo transcurrido desde la cirugía.
En la medición de TGF-β en suero comparando sus valores preoperatorios y a las 24h desde la cirugía, observamos diferencias estadísticamente significativas entre los grupos, así como en su evolución en el tiempo y la forma de comportarse a través de él (p<0,001; 0,009 y 0,0409 respectivamente). Mientras que en el grupo de pacientes que no han recibido la RIO no se observa una variación en el tiempo, medianas de 5,15 y 5,25 preoperatorias y a las 24h desde la cirugía respectivamente, en el grupo de pacientes que sí recibieron la RIO las medianas aumentaron a las 24h respecto a los valores preoperatorios, 8,75 y 35,14 respectivamente. Cabe destacar que los valores objetivados en las muestras de suero de las pacientes que han recibido la RIO son superiores a los obtenidos en las muestras de las pacientes a las que se sometió únicamente a cirugía conservadora, destacando en este grupo una serie de pacientes con cifras superiores a 1.000pg/ml, lo que concuerda con la bibliografía (tabla 3).
Cuando comparamos los valores obtenidos en la muestra de drenaje a las 6 y 24h desde la cirugía respectivamente entre los grupos, objetivamos diferencias estadísticamente significativas entre ellos, siendo los valores superiores en el grupo de pacientes que han recibido la RIO (p=0,0001). Sin embargo, no se evidencian diferencias con relación al tiempo transcurrido desde la cirugía ni en la forma de comportarse de ambos grupos (tabla 4).
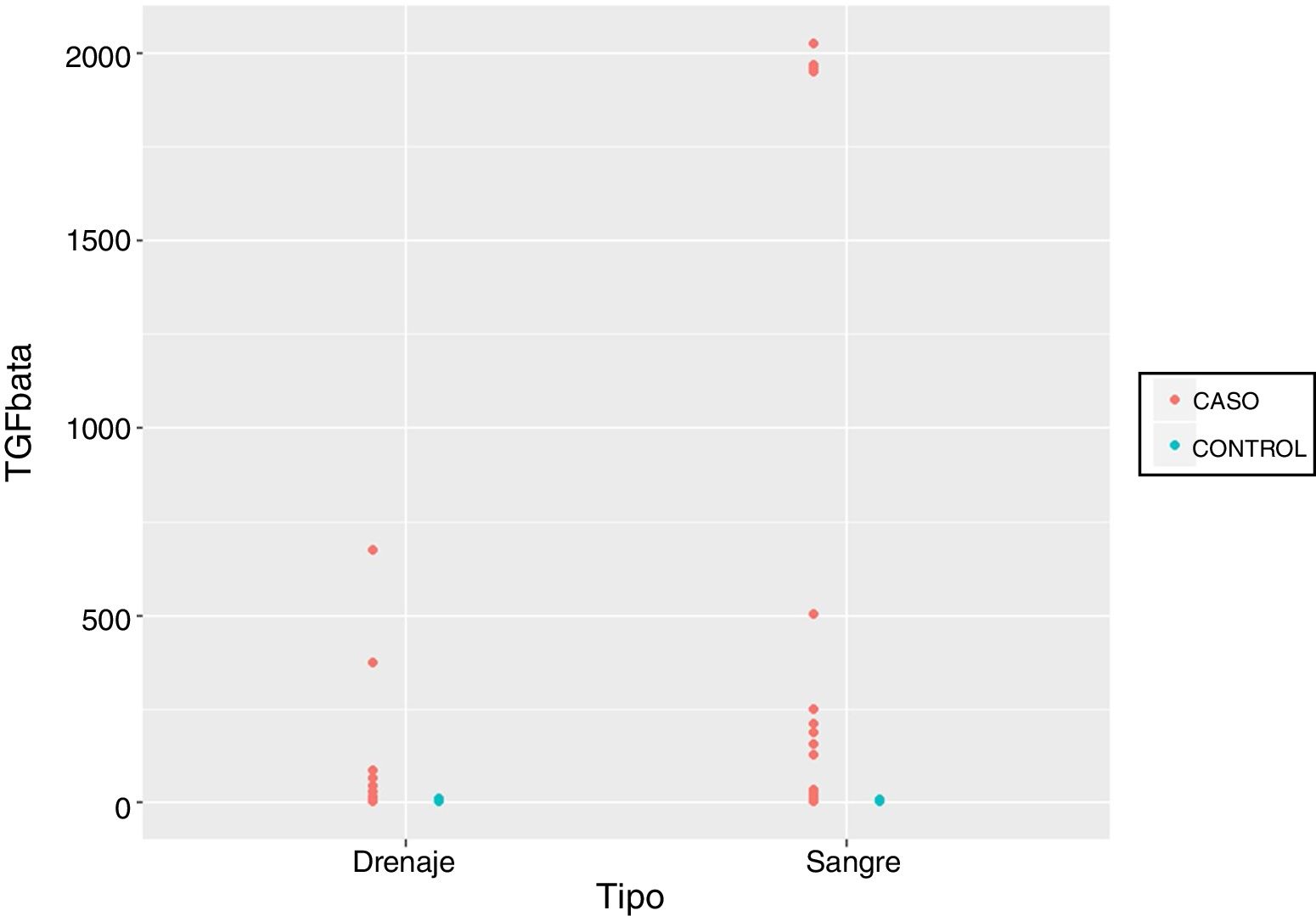
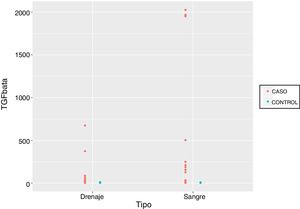
Por último, comparamos los valores obtenidos de la muestras recogidas a las 24h desde la cirugía tanto de suero como de débito de drenaje en ambos grupos, objetivando diferencias de magnitud significativas que producen cambios a nivel longitudinal y según pertenezcan las muestras al grupo de pacientes que han recibido la RIO o no. Sin embargo, es importante destacar que no se han encontrado diferencias estadísticamente significativas en cuanto al tipo de muestra que se utilice, bien sea suero, bien débito del drenaje (p=0,5881) (fig. 1, tabla 5).
DiscusiónEn los últimos años asistimos a un desarrollo en las técnicas utilizadas en el tratamiento del cáncer de mama, apareciendo nuevas terapias como la RIO asociada a la cirugía conservadora9,10. La mayoría de los estudios coinciden en que la complicación más frecuente tras este tratamiento es la fibrosis, por lo que se hace mandatorio identificar marcadores que nos ayuden a predecirla1,7,26.
Li et al.27 objetivaron en su estudio que los niveles de TGF-β en suero eran significativamente mayores en aquellas pacientes que posteriormente desarrollaron fibrosis moderada o severa, estableciendo que valores superiores a 96pg/ml en suero después de la cirugía y previo a la radioterapia tenían una sensibilidad del 76% y una especificidad del 74% para el desarrollo de esta complicación. Además, concluyen que debido a que las pacientes a estudio presentan estadios iniciales de cáncer de mama con tamaños tumorales pequeños, los niveles alterados de TGF-β encontrados pueden ser atribuidos a una variabilidad genética propia del individuo sin verse afectado por las propias células tumorales. Por su parte, Boothe et al.23 demostraron que los valores de TGF-β en suero sirven como marcador temprano para predecir la fibrosis tanto después de la cirugía y previo al tratamiento con radioterapia, como posteriormente a la misma. Asimismo, los autores concluyen que los valores encontrados no se vieron alterados por la aplicación de la radioterapia.
En nuestro estudio, sin embargo, hemos objetivado cómo el grupo de pacientes que reciben la RIO presentan valores de TGF-β en suero significativamente mayores que aquellas a las que solo se les sometió a cirugía conservadora del cáncer de mama, considerando que dicha alteración es consecuencia de la RIO (p<0,0001). Por otro lado, cabe destacar, que en 8 de las pacientes los valores obtenidos son superiores a 1.000pg/ml. Este hallazgo está en consonancia con la bibliografía, ya que nuestras pacientes presentaban estadios iniciales de cáncer de mama con tumores pequeños, por lo que podemos atribuir dicha alteración a la variabilidad genética del individuo27, lo que haría a este grupo de pacientes especialmente susceptibles de ser elegidas para planificación del tratamiento posterior con el fin de prevenir la fibrosis.
De la misma forma, cabe destacar que los valores objetivados de TGF-β en suero preoperatorio pueden ser atribuidos igualmente a la variabilidad genética del individuo, ya que no se han observado diferencias estadísticamente significativas entre los grupos. Aunque se deben realizar más estudios, consideramos que las diferencias de magnitud objetivadas en los valores de TGF-β obtenidos a las 24h desde la cirugía son suficientemente considerables como para no verse alteradas por estos valores iniciales.
Otros autores han investigado la alteración de los valores de TGF-β tras la radioterapia encontrados en el débito del drenaje. Scherer et al.22 recogieron los débitos de drenaje durante 24h de pacientes a las que les habían aplicado RIO o no respectivamente, y objetivaron que la RIO no tenía un efecto significativo en los niveles de TGF-β en el drenaje. Sin embargo, los valores que encontraron eran superiores a aquellos que se relacionan con fibrosis y demostraron asimismo que el TGF-β hallado era activo en el débito de drenaje.
En el presente estudio, en concordancia con la literatura publicada, no se han objetivado diferencias estadísticamente significativas en los valores de TGF-β en el débito del drenaje por el hecho de aplicar la RIO, pero del mismo modo que Scherer et al.22, se han hallado valores elevados que aunque no demuestran diferencia entre las pacientes a las que se les ha aplicado RIO o no a las 6h, sí lo hacen cuando han pasado 24h desde la cirugía asociada a RIO (p<0,0001).
Por otra parte, según nuestro conocimiento de la bibliografía publicada, este es el primer estudio que compara los valores obtenidos de TGF-β en pacientes a las que se ha sometido a cirugía conservadora del cáncer de mama aplicándoles RIO o no respectivamente en muestras de suero y de débito del drenaje, objetivando diferencias entre los grupos sin que estos hallazgos se vean alterados por el tipo de muestra a las 24h desde la cirugía (p=0,5881).
Como conclusión podemos decir que, aunque deben realizarse más estudios, valores elevados de TGF-β en las pacientes con cáncer de mama a las que se les realiza cirugía conservadora asociada a RIO pueden predecir el riesgo de fibrosis.
Por lo tanto, estas pacientes deben ser elegidas para tratamientos que pretendan contrarrestar el efecto profibrótico que tiene esta citocina para evitar los efectos adversos sin comprometer el control tumoral. Numerosas estrategias se encuentran en estudio, utilizándose principalmente las siguientes: oligonucleótidos antisentido que reducen la expresión de TGF-β, anticuerpos neutralizantes que impiden la interacción con el receptor ligando de TGF-β, proteínas recombinantes quiméricas para secuestrar la TGF-β y moléculas inhibidoras de los receptores cinasa de TGF-β22,28. La inhibición de TGF-β después de la cirugía a nivel local puede ser una opción viable como ya se ha demostrado en la cirugía del glaucoma utilizando el anticuerpo lerdelimumab mediante inyección subconjuntival después de la cirugía29.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.