La cirugía guiada por fluorescencia (CGF) es una técnica de imagen basada en la óptica que permite la visualización de estructuras invisibles para el ojo humano, así como evaluar actividades dinámicas como es la perfusión de los órganos. La imagen fluorescente se obtiene tras la administración de contraste fluorado, el cual puede emitir una señal fluorescente cuando se excita adecuadamente mediante un haz de luz tipo láser. La señal fluorescente puede ser visualizada directamente en el campo operatorio, en procedimientos quirúrgicos abiertos, o puede ser captada por una cámara y proyectarse en una pantalla, en el contexto de la cirugía mínimamente invasiva. La CGF se puede adaptar fácilmente a las necesidades de la actividad quirúrgica, ya que no requiere una tecnología voluminosa y provee de imágenes en tiempo real, sin alterar el ritmo habitual del quirófano.
Existe un interés creciente en el impacto potencial de la navegación molecular durante la CGF en cuanto a la evolución clínica postoperatoria. Ello está justificado por el progresivo número de estudios y el número de empresas que proveen sistemas de imagen que permiten la CGF: la CGF ha sido utilizada con éxito en un gran número de situaciones clínicas relacionadas con el aparato digestivo. Las aplicaciones clínicas más populares a nivel mundial incluyen la colangiografía fluorescente1, la investigación del ganglio centinela y la valoración de la perfusión tisular a nivel de la anastomosis2. Sin embargo, la indicación más prometedora, que está todavía en un nivel embrionario, es la identificación fluoroscópica en tiempo real de tejido tumoral utilizando sondas fluorescentes cáncer-específicas3.
La actual actividad investigadora y la inquietud de múltiples líderes de opinión sobre el tema ha permitido identificar las direcciones maestras hacia donde se dirigen las futuras investigaciones, que incluyen: 1) la integración de la interpretación asistida por ordenador de la señal fluorescente a través de un software específico; 2) el desarrollo de sondas fluorescentes específicamente dirigidas, que pueden reconocer con precisión dianas biológicas o células tumorales y permitir la exéresis neoplásica guiada por imagen, 3) el desarrollo de plataformas de endoscopia flexible miniaturizada que permitan el diagnóstico y tratamiento más preciso de tumores gastrointestinales. La CGF puede mejorar los resultados con relación a tratamientos quirúrgicos digestivos, actuando a diferentes niveles, los cuales describimos brevemente a continuación.
La cirugía guiada por fluorescencia permite la evaluación en tiempo real de la perfusión intestinalLa perfusión intestinal es un requerimiento crucial para asegurar la cicatrización anastomótica óptima. La justificación de la angiografía fluorescente para evaluar la perfusión se basa en la asunción de que la visualización homogénea de un fluoróforo inyectado de forma sistémica que tiñe la superficie intestinal es la demostración de que la perfusión sanguínea está preservada. La revisión más reciente de la literatura (2016) de los estudios clínicos que valoraban la angiografía basada en fluorescencia incluyen 10 estudios en cirugía colorrectal y 4en cirugía esofágica resectiva2, con un total aproximado de 1.000 y 200 pacientes, respectivamente. La única posible conclusión fue que la evaluación fluoroscópica es una técnica prometedora, pero que, en ausencia de estudios prospectivos bien diseñados, el potencial efecto sobre la reducción de la incidencia de fallo de sutura continua sigue pendiente de ser demostrado de una forma definitiva. Sin embargo, en todos estos estudios la perfusión se evaluó basada en la relativa intensidad de la fluorescencia, sin considerar la difusión de los fluoróforos durante el tiempo. De hecho, el contraste puede alcanzar los límites de áreas isquémicas por difusión en el flujo capilar con el tiempo y puede significar una sobrestimación de la zona perfundida.
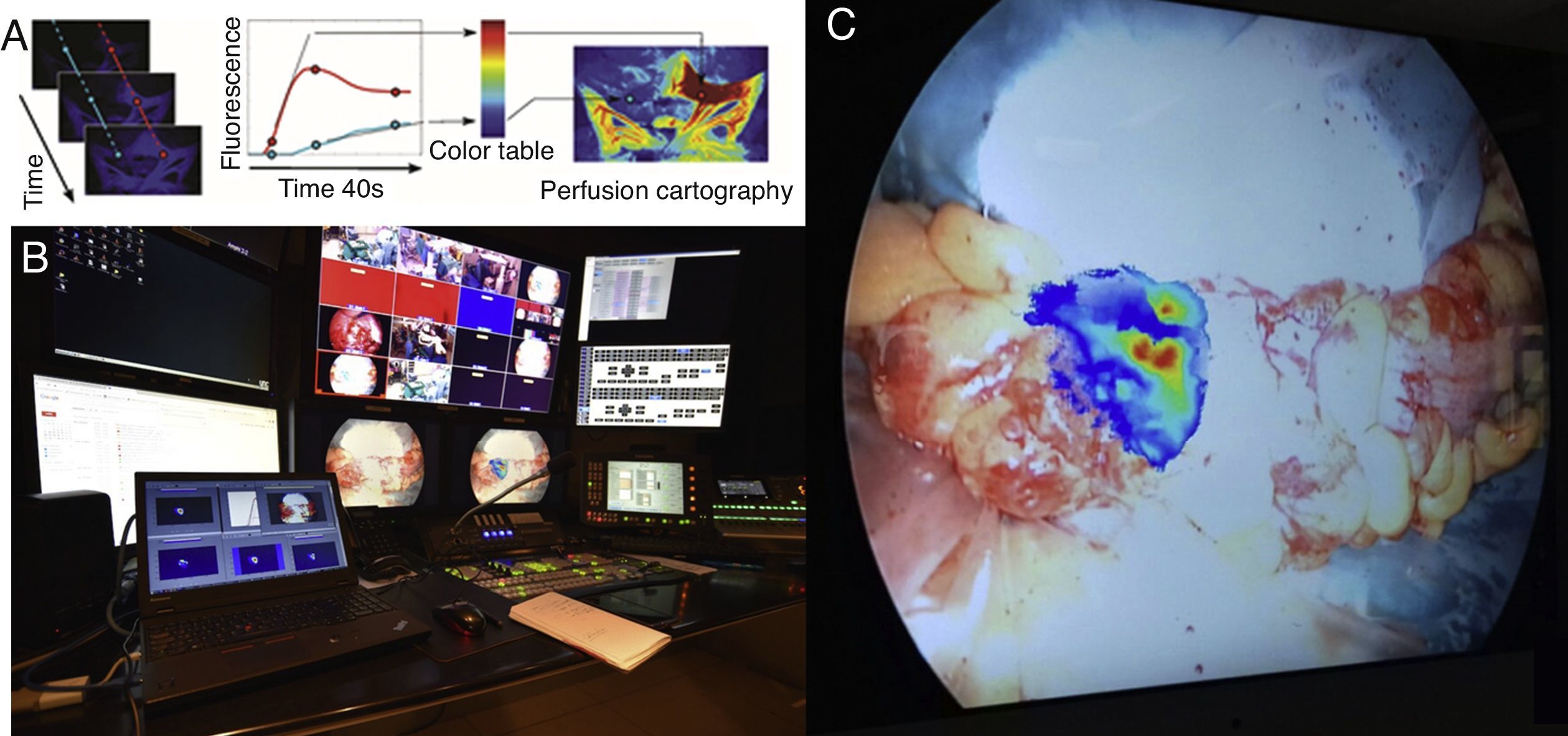
Nuestro departamento de investigación y desarrollo ha puesto a punto un software para analizar la imagen más detalladamente (ER-PERFUSION, IRCAD, Francia) y así obtener una cartografía de perfusión virtual que puede sobreponerse en la pantalla y permite obtener una imagen en realidad aumentada del nivel de perfusión4. Esta tecnología ofrece una estimación dinámica, cuantitativa y reproducible de la perfusión del órgano y permite estimar con más precisión los niveles de perfusión y visualizar en tiempo real las líneas de resección adecuadas directamente en la pantalla del monitor laparoscópico. En la actualidad estamos llevando a cabo un estudio clínico (PERFECT trial: Perfusion evaluation by real-time fluorescence-based EnhanCed reality; NCT02626091) con resultados iniciales esperanzadores (fig. 1).
A) Descripción del concepto de FLER (fluorescence-based enhanced reality): tras la inyección del fluoróforo, la señal fluorescente es analizada durante 40 s por un software adecuado (VR-PERFUSION, IRCAD, Francia). El tiempo hasta la máxima fluorescencia es computado píxel a píxel y los valores de la curva se convierten en un código de color para generar una cartografía de perfusión virtual. La cartografía resultante se sobrepone utilizando un vídeo mezclador (B: estudio de grabación del IRCAD) y es sobrepuesta en tiempo real sobre el intestino (C: punto de sección proximal durante una sigmoidectomía).
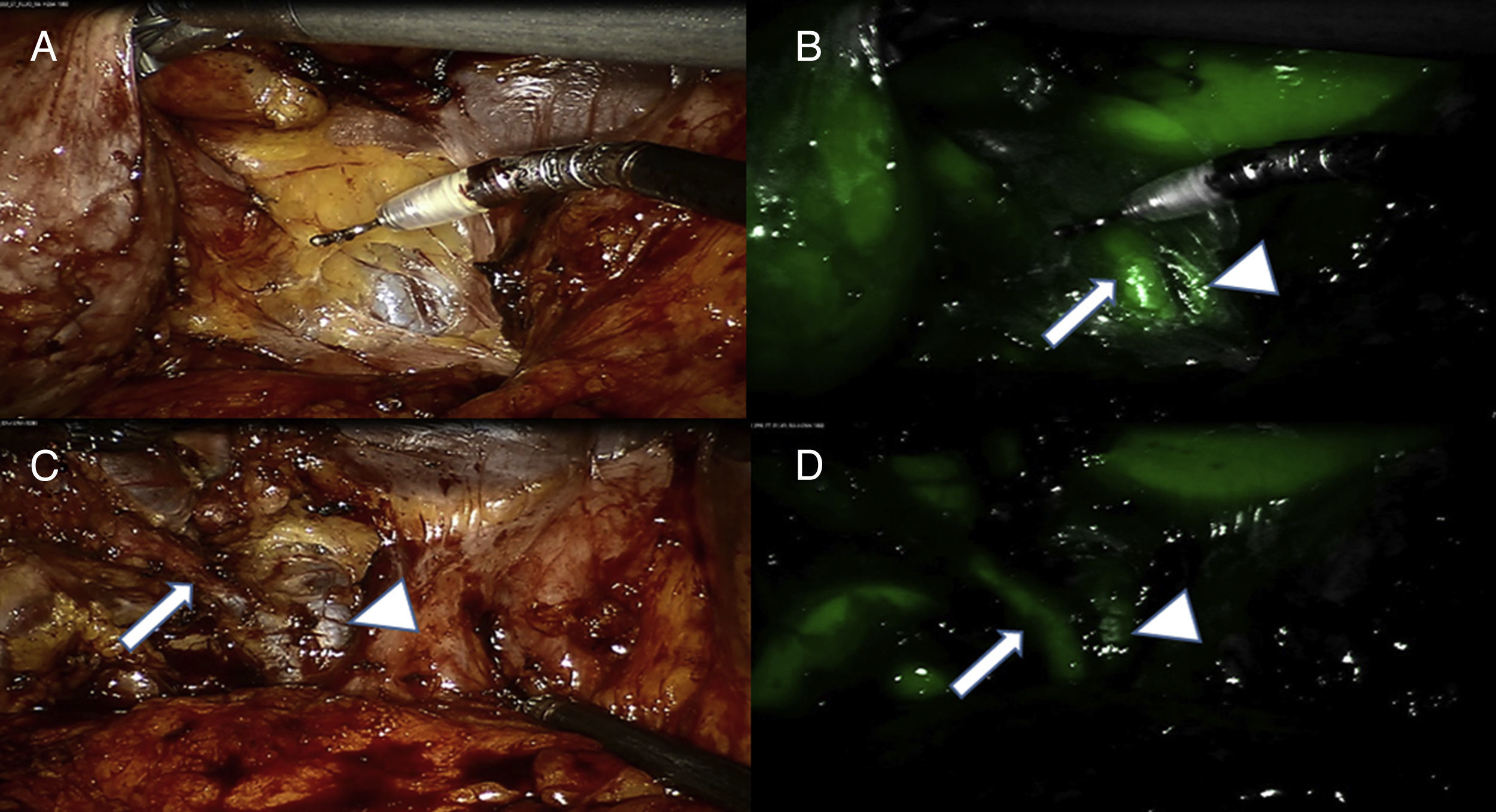
La mejora de la imagen con fluorescencia puede ayudar a prevenir lesiones inadvertidas durante procedimientos quirúrgicos de estructuras anatómicas críticas que incluyen el árbol biliar, nervios, uréteres, etc. Como ejemplo, la colangiografia con fluorescencia infrarroja es un método muy preciso para identificar las estructuras biliares y, posiblemente, evitar lesiones de la vía biliar (fig. 2)1. La colangiografia con fluorescencia se basa en la inyección intravenosa de un fluoróforo que se excreta por la bilis (indocyanine green [ICG]), que se hace fluorescente cuando se excita por un haz de luz infrarrojo. Esta modalidad de obtención de imágenes tiene la ventaja de que es de fácil realización, en tiempo real, de bajo coste y libre de radiación. El inconveniente de la técnica es la tinción simultánea del hígado, que puede ser molesta para la correcta interpretación del árbol biliar.
A) Imagen del área del triángulo de Calot con luz blanca tras la disección inicial del tejido adiposo del hilio vesicular. Se puede identificar una estructura tubular. B) Bajo luz infrarroja se identifica una nueva estructura adyacente a la otra, que permite identificarla como conducto cístico (CD, flecha) y la vía biliar (CBD) flecha gruesa). C) Imagen con luz blanca tras progresar la disección visualizando el conducto cístico. D) La imagen infrarroja confirma la adecuada interpretación de la anatomía.
Existen varias estrategias para evitar la fluorescencia simultánea del hígado. La primera es optimizar la dosificación y el intervalo entre la inyección del fluoróforo y la visualización del área quirúrgica. El rango de dosificación del contraste oscila entre 0,5 y 2,5 mg/kg en una única administración intravenosa1. En un estudio previo se observó que el mejor «ratio» entre la visualización de los conductos biliares y la fluorescencia hepática se obtuvo con 0,25mg/kg de ICG, administrados al menos 45 min antes de obtener las imágenes5. Un periodo de tiempo más prolongado, de hasta 24 h, permite el lavado del fluoróforo con una clara imagen del árbol biliar sin fluorescencia hepática en el fondo de la imagen6. Una estrategia alternativa es inyectar directamente el contraste en el interior de la vesícula7. Esta colecistocolangiografía fluorescente permite obtener una nítida delineación del contorno de la vesícula e incrementar la delineación del árbol biliar. Hemos incluido esta técnica en la práctica clínica y los resultados preliminares están pendientes de publicación. Otra estrategia se basa en la manipulación digital con un software adecuado, lo que permite el borrado selectivo del fondo hepático. A pesar de estas limitaciones, podemos esperar que, con algunos refinamientos, la colangiografía fluorescente sea una de las aplicaciones clínicas de la CGF mejor aceptadas.
Otra estructura anatómica que puede estar en riesgo de lesión intraoperatoria es el uréter, especialmente en pacientes con cirugía abdominal previa. A la vez, el desarrollo de nuevos abordajes mínimamente invasivos como el Ta-TME, con una visión radicalmente diferente de la anatomía, puede aumentar el riesgo de lesión ureteral8.
La mejora de la visualización del trayecto ureteral es una obvia estrategia para minimizar el riesgo de lesiones iatrogénicas. La CGF puede ofrecer una efectiva y no invasiva visualización del uréter. Sin embargo, el uso actual de contrastes fluorescentes para localizar los uréteres es limitado, ya que el verde de indiocianina no se excreta por la vía urinaria.
Existen estudios experimentales prometedores que utilizan fluoróforos modificados que se pueden secretar por la vía urinaria como el IRDye800CW, que en el momento actual es motivo de evaluación en diferentes estudios (NCT01987375, NCT01508572, NCT02113202, NCT02129933)9.
La CGF tiene también la posibilidad de identificar nervios, con el uso de trazadores específicos para nervios, lo que haría posible la potencial reducción del riesgo de lesiones nerviosas, especialmente en cirugía de la pelvis, que pueden provocar disfunción urogenital, del suelo pélvico o del esfínter. En la actualidad, la visualización nerviosa representa un área de especial interés en la investigación de la obtención de imágenes con moléculas fluorescentes.
La cirugía guiada por fluorescencia permite la estadificación intraoperatoria en tiempo realLa localización exacta y el análisis del ganglio centinela (GC) puede ser crítica en el proceso de decisión quirúrgica, especialmente cuando se aplican estrategias órgano-conservadoras, como en el caso de la disección endoscópica submucosa o en resecciones limitadas de espesor total, que pueden ser consideradas adecuadas solo si los ganglios no están afectos.
La identificación del GC mediante navegación guiada por flurescencecia utilizando ICG es una técnica relativamente nueva y efectiva que ha sido utilizada satisfactoriamente en varios tipos de tumores, incluyendo tumores gastrointestinales, con una alta tasa de detección e identificación del GC. Sin embargo, el ICG no es un buen contraste para la detección del GC por al menos 2 razones: 1) tiene un bajo brillo fluorescente y 2) posee una baja capacidad de retención del contraste a nivel ganglionar, ya que es una molécula demasiado pequeña que rápidamente se dispersa entre múltiples ganglios linfáticos10. Por esta razón, las técnicas de detección del GC basadas en la utilización de ICG tiene claras limitaciones, tal como se ha resumido en una publicación del Japan Clinical Oncology Group11, que ha documentado una inesperada proporción de falsos negativos, lo que obligó a la suspensión del estudio tras incluir 440 casos de cáncer gástrico.
La identificación del GC utilizando ICG puede mejorarse a diferentes niveles. Primero, se puede mejorar investigando contrastes mejor adaptados que solucionen las deficiencias del ICG incrementando la capacidad de fijación y la liberación de una mayor luminosidad selectivamente en el tejido tumoral diana. Como ejemplo, la capacidad de fijación tisular se puede mejorar combinando las moléculas fluorescentes con moléculas grandes como la albúmina humana o nanocoloides, lo que se acompaña de una menor dispersión y mayor retención del contraste en los ganglios en comparación con el ICG solo12. En segundo lugar, se puede mejorar también modificando la dosificación y el método de inyección (menor concentración y mayor volumen) lo cual debe ser convenientemente evaluado en estudios prospectivos. En tercer lugar, puede mejorarse utilizando una navegación doble mediante linfografia con imagen en 3D y la navegación basada en fluorescencia.
La ICG permite llevar a cabo una resección tumoral radical, evaluando los márgenes del tumor y la respuesta al tratamientoLa resección radical de células tumorales es especialmente importante para reducir la tasa de recurrencias e incrementar el intervalo libre de enfermedad. La administración de un anticuerpo tumor-específico que emite fluorescencia puede ser reconocido inequívocamente a un nivel celular, lo que permite una rápida y exacta evaluación de la radicalidad de la resección tumoral. En el contexto de la cirugía de precisión, el desarrollo de contrastes fluorescentes tumor-específicos ha avanzado de una forma importante en los últimos años y permite la identificación mejorada de tumor residual y de metástasis en los ganglios linfáticos. En un estudio pionero publicado en 2011, se describió el primer caso de cirugía en humanos guiada por fluorescencia tumor-específica13. Los autores resecaron efectivamente 34 implantes peritoneales de cáncer de ovario que eran invisibles al ojo humano. Esta evidente demostración del concepto señala claramente el potencial impacto de la visualización intraoperatoria de fluorescencia tumor-específica al menos en 2momentos de la historia natural del tumor: primero, como screening tumoral, que puede ser personalizado y más exacto, y en segundo lugar en la obtención de resultados oncológicamente radicales. Existe un gran número de contrastes dirigidos que han sido desarrollados para visualizar células tumorales y que permiten la identificación de tumores en fase inicial y la resección tumoral precisa y exacta. De particular interés es la estrategia en acoplar un contraste fluorescente (IRDye800CW) con anticuerpos monoclonales de origen humano habitualmente utilizados en tratamiento antineoplásico (por ejemplo, bevacizumab, dirigido al vascular endothelial growth factor o cetuximab, al epithelial growth factor receptor) con el contraste IRDye800. Los estudios clínicos en marcha en cirugía GI están dirigidos al esófago de Barrett (NCT02129933) y al cáncer de colon (NCT01972373).
Para concluir, existe en los últimos años un vibrante interés alrededor de la CGF, que promete ser un gran avance hacia las terapias de precisión, al ofrecer un mejor diagnóstico, la posibilidad de decidir mediante estrategias en tiempo real y de exacta valoración. Existe un importante volumen de investigación a diferentes niveles, incluyendo hardware, software y fluoróforos para mejorar las posibilidades disponibles en la actualidad.