El tratamiento quirúrgico del colangiocarcinoma hiliar representa un verdadero desafío. Múltiples factores pronósticos han sido propuestos. El número de ganglios positivos y la relación ganglios positivos y ganglios totales (G+/Gt) son considerados por algunos autores como los más importantes.
Material y métodoSe analiza una serie de 58 pacientes con tumores de Klatskin. Se evalúan los factores pronósticos y la supervivencia con especial interés en el impacto pronóstico del número de ganglios positivos y su relación con los ganglios totales.
ResultadosLa resecabilidad fue de 78% con una sobrevida a 5 años del 32%. La mediana de ganglios estudiados fue de 9,5. No se encontraron diferencias significativas en varios de los factores pronósticos analizados. La presencia de 2 o más ganglios positivos o una relación G+/Gt ≥ 0,2 resultaron ser factores de mal pronóstico.
ConclusiónLa relación entre ganglios positivos sobre los ganglios totales y el número de ganglios positivos son factores pronósticos importantes.
Surgical treatment of hilar cholangiocarcinoma remains a challenge. Multiple prognostic factors have been proposed. The number of positive nodes and the ratio between positive lymph node and total lymph node (G+/Gt) are considered by some authors as the most important factor.
Material and methodsWe analyzed a series of 58 patients with Klatskin tumors. We evaluated the prognostic factors and survival with emphasis on the prognostic impact of the number of positive nodes and its relation to total lymph nodes.
ResultsResectability was 78% with a 5-year survival of 32%. The median number of nodes examined was 9.5. No significant differences were found in several of the proposed prognostic factors. The presence of 2 or more positive nodes or a ratio G+/Gt ≥ 0.2 were found to be poor prognostic factors.
ConclusionThe relationship between positive lymph nodes and total lymph nodes and the number of positive lymph nodes are important prognostic factors.
El colangiocarcinoma hiliar o tumor de Klatskin es una neoplasia poco frecuente y su tratamiento quirúrgico representa un verdadero desafío. Las resecciones radicales representan, para estos pacientes, la única posibilidad de curación1,2. Un gran número de factores pronósticos han sido valorados y propuestos con relación a la supervivencia.
El compromiso ganglionar a nivel de diferentes tumores del aparato digestivo (páncreas, colon, estómago, etc.) es un importante factor predictivo de supervivencia de los mismos3–9. La afectación linfática en los tumores de Klatskin también es un importante factor pronóstico10–13. Por otra parte, la relación ganglios positivos/ganglios totales (G+/Gt) ha sido mencionada como un fuerte predictor de sobrevida por algunos autores, aunque son pocos los estudios a este respecto14,15.
El objetivo del presente trabajo ha sido valorar el estado ganglionar de los pacientes que fueron tratados con resección por colangiocarcinoma hiliar y corroborar en nuestra serie si el índice G+/Gt efectivamente representa un factor pronóstico de supervivencia.
Material y métodosSe analizó de manera conjunta (España y Argentina) una serie de pacientes con diagnóstico de tumor de Klatskin, operados en 2 hospitales por solo 2 cirujanos (JF y GAN), y tratados entre 1998 y 2012.
Como datos generales se evaluaron el sexo, la edad, la presencia de diabetes, hepatopatía o colangitis, si se les efectuó drenaje biliar preoperatorio o requirieron embolización y el porcentaje de resecabilidad. El drenaje biliar preoperatorio se indicó en pacientes que superaron los 15mg de bilirrubinemia. La embolización portal preoperatoria se indicó en pacientes con un futuro volumen hepático remanente inferior al 30% mesurado por volumetría hepática por TAC.
Se recogieron la localización del tumor según la clasificación de Bismuth-Corlette16, las diferentes técnicas quirúrgicas empleadas y si en las hepatectomías mayores se incluyó la resección del lóbulo caudado. En ambos centros se utilizaron los mismos criterios para la indicación quirúrgica. En caso de las resecciones hepáticas, la nomenclatura utilizada fue la sugerida y publicada en la página de la International Hepato-Pancreato Biliary Association en Brisbane17. La linfadenectomía incluía los ganglios de la cadena de la arteria hepática común, del pedículo hepático, incluyendo los retroportales y los retropancreáticos. No se hizo maniobra de Kocher ni linfadenectomía interaortocava. Durante los últimos años la tendencia ha sido hacia la inclusión de los ganglios del tronco celíaco.
También se evaluó la realización de pinzamiento vascular, la asociación de resección venosa o arterial y los requerimientos transfusionales. La morbilidad fue tipificada según la clasificación de Dindo-Clavien18.
Se consideró mortalidad perioperatoria el fallecimiento dentro de los 90 días posteriores a la cirugía. También se analizaron la estancia hospitalaria en días, el índice de reintervenciones quirúrgicas y el reingreso hospitalario. En aquellos pacientes que fueron resecados se evaluó el tipo de resección efectuada (R0, R1, R2). El tumor se estatificó siguiendo la clasificación TNM de la UICC19. Se analizó el grado de diferenciación tumoral y la presencia de invasión perineural. Todos los pacientes fueron seguidos por el cirujano responsable, realizándose analítica y ecografía cada 3 meses el primer año y posteriormente cada 6 meses hasta los 5 años. Se evaluó la recidiva y supervivencia expresadas en meses.
EstadísticaLos datos fueron analizados usando el software SPSS (versión 13, SPSS, Inc, Chicago, IL, EE. UU.). El tiempo de sobrevida se calculó desde el momento de la cirugía hasta su fallecimiento o hasta la fecha de su último control.
Las variables cuantitativas se expresan como: media ± desviación estándar si presentaban una distribución «normal» o como mediana y rango en otro caso. Las variables cualitativas se presentan en números absolutos y porcentaje. La supervivencia fue calculada con el método de Kaplan-Meier y las diferencias en las curvas de sobrevida fueron comparadas utilizando el test log-rank. Los pacientes que tuvieron mortalidad perioperatoria fueron excluidos del análisis de los factores pronósticos. Como factores pronósticos se evaluaron el grado de diferenciación (bajo, moderado e indiferenciado), hepatectomía vs. resección de la vía biliar aislada, transfundidos vs. no transfundidos, número de ganglios resecados (más o menos de 5 y más o menos de 7), número de ganglios positivos, y la relación G+/Gt. Se consideró significativa una p < 0,05. Se realizó un análisis de los factores predictivos de supervivencia para distinguir los que eran explicativos o causales y los posibles factores de confusión mediante el análisis de regresión de Cox. En el análisis multivariante se introdujeron aquellos factores con una p < 0,1 o aquellos que consideramos importantes como investigadores.
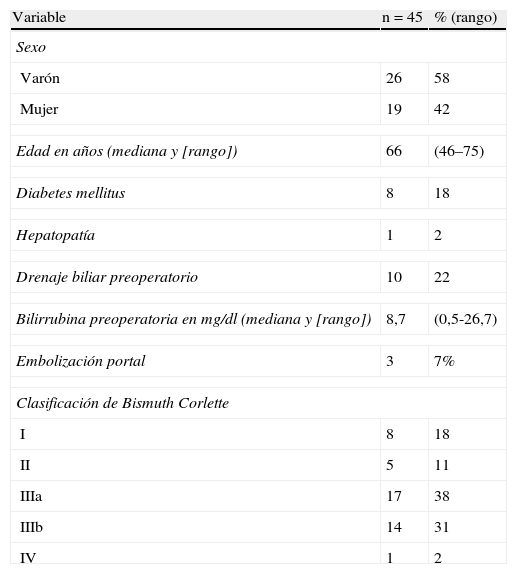
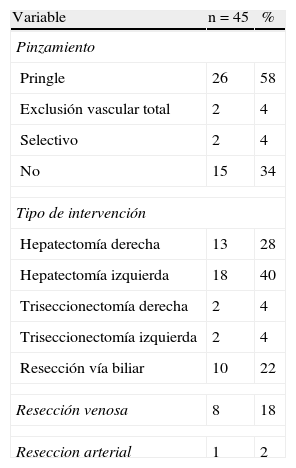
ResultadosEntre 1998 y 2012 un total de 58 pacientes afectados de colangiocarcinoma hiliar fueron incluidos dentro del presente análisis. De los 58 pacientes, 13 fueron considerados irresecables o inoperables de manera preoperatoria (n = 9) o durante la cirugía (n = 4), en estos últimos se utilizó alguna técnica de intubación transtumoral. Los 45 restantes fueron resecados, lo cual representa un índice de resecabilidad del 78%. Los datos epidemiológicos de los 45 pacientes pueden observarse en la tabla 1. La mayoría eran del sexo masculino y la mediana de edad era de casi 65 años. Se realizó drenaje biliar preoperatorio en una cuarta parte de los pacientes por ictericia. La embolización portal fue utilizada en 3 casos. La estadificación preoperatoria mediante la clasificación de Bismuth-Corlette demostró que la mayoría eran estadio III, repartiéndose de forma similar entre vías biliares derechas e izquierdas.
Datos epidemiológicos, y estudio preoperatorio
| Variable | n=45 | % (rango) |
| Sexo | ||
| Varón | 26 | 58 |
| Mujer | 19 | 42 |
| Edad en años (mediana y [rango]) | 66 | (46–75) |
| Diabetes mellitus | 8 | 18 |
| Hepatopatía | 1 | 2 |
| Drenaje biliar preoperatorio | 10 | 22 |
| Bilirrubina preoperatoria en mg/dl (mediana y [rango]) | 8,7 | (0,5-26,7) |
| Embolización portal | 3 | 7% |
| Clasificación de Bismuth Corlette | ||
| I | 8 | 18 |
| II | 5 | 11 |
| IIIa | 17 | 38 |
| IIIb | 14 | 31 |
| IV | 1 | 2 |
En la tabla 2 se pueden observar los datos intraoperatorios. A la mayoría de los pacientes se les realizó hepatectomía (78%). A 10 pacientes se les realizó solo resección de la vía biliar, linfadenectomía y reconstrucción mediante hepático-yeyunostomía. En la mayoría de los pacientes se tuvo que realizar pinzamiento hiliar o exclusión vascular total. En 8 casos se asoció una resección de la vena porta y anastomosis. Solo en un caso se resecó la arteria hepática derecha con anastomosis T-T.
Datos operatorios
| Variable | n = 45 | % |
| Pinzamiento | ||
| Pringle | 26 | 58 |
| Exclusión vascular total | 2 | 4 |
| Selectivo | 2 | 4 |
| No | 15 | 34 |
| Tipo de intervención | ||
| Hepatectomía derecha | 13 | 28 |
| Hepatectomía izquierda | 18 | 40 |
| Triseccionectomía derecha | 2 | 4 |
| Triseccionectomía izquierda | 2 | 4 |
| Resección vía biliar | 10 | 22 |
| Resección venosa | 8 | 18 |
| Reseccion arterial | 1 | 2 |
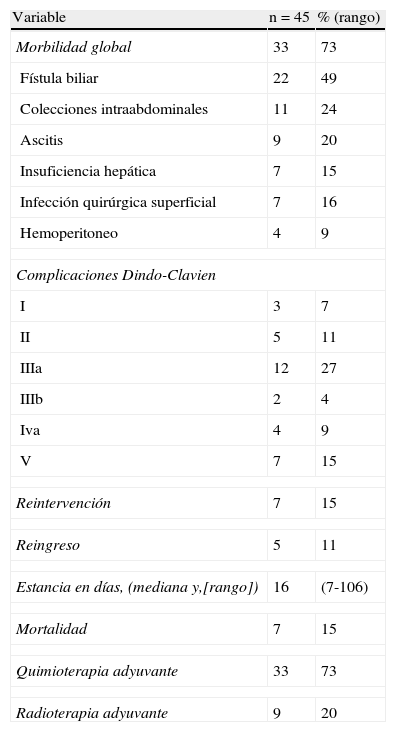
En la tabla 3 se pueden observar los resultados postoperatorios. La complicación más frecuente fue la fístula biliar seguida de la colección intraabdominal. Teniendo en cuenta la clasificación de Dindo-Clavien, 8 pacientes presentaron complicaciones leves. En 14 pacientes para solucionar la complicación se tuvo que realizar algún tipo de intervención. En 4 pacientes la complicación fue grave con necesidad de ingreso en UCI, y 7 pacientes fallecieron. Todos los pacientes con tumor avanzado ≥ pT3 o con ganglios positivos recibieron quimioterapia y radioterapia adyuvante.
Evolución postoperatoria
| Variable | n = 45 | % (rango) |
| Morbilidad global | 33 | 73 |
| Fístula biliar | 22 | 49 |
| Colecciones intraabdominales | 11 | 24 |
| Ascitis | 9 | 20 |
| Insuficiencia hepática | 7 | 15 |
| Infección quirúrgica superficial | 7 | 16 |
| Hemoperitoneo | 4 | 9 |
| Complicaciones Dindo-Clavien | ||
| I | 3 | 7 |
| II | 5 | 11 |
| IIIa | 12 | 27 |
| IIIb | 2 | 4 |
| Iva | 4 | 9 |
| V | 7 | 15 |
| Reintervención | 7 | 15 |
| Reingreso | 5 | 11 |
| Estancia en días, (mediana y,[rango]) | 16 | (7-106) |
| Mortalidad | 7 | 15 |
| Quimioterapia adyuvante | 33 | 73 |
| Radioterapia adyuvante | 9 | 20 |
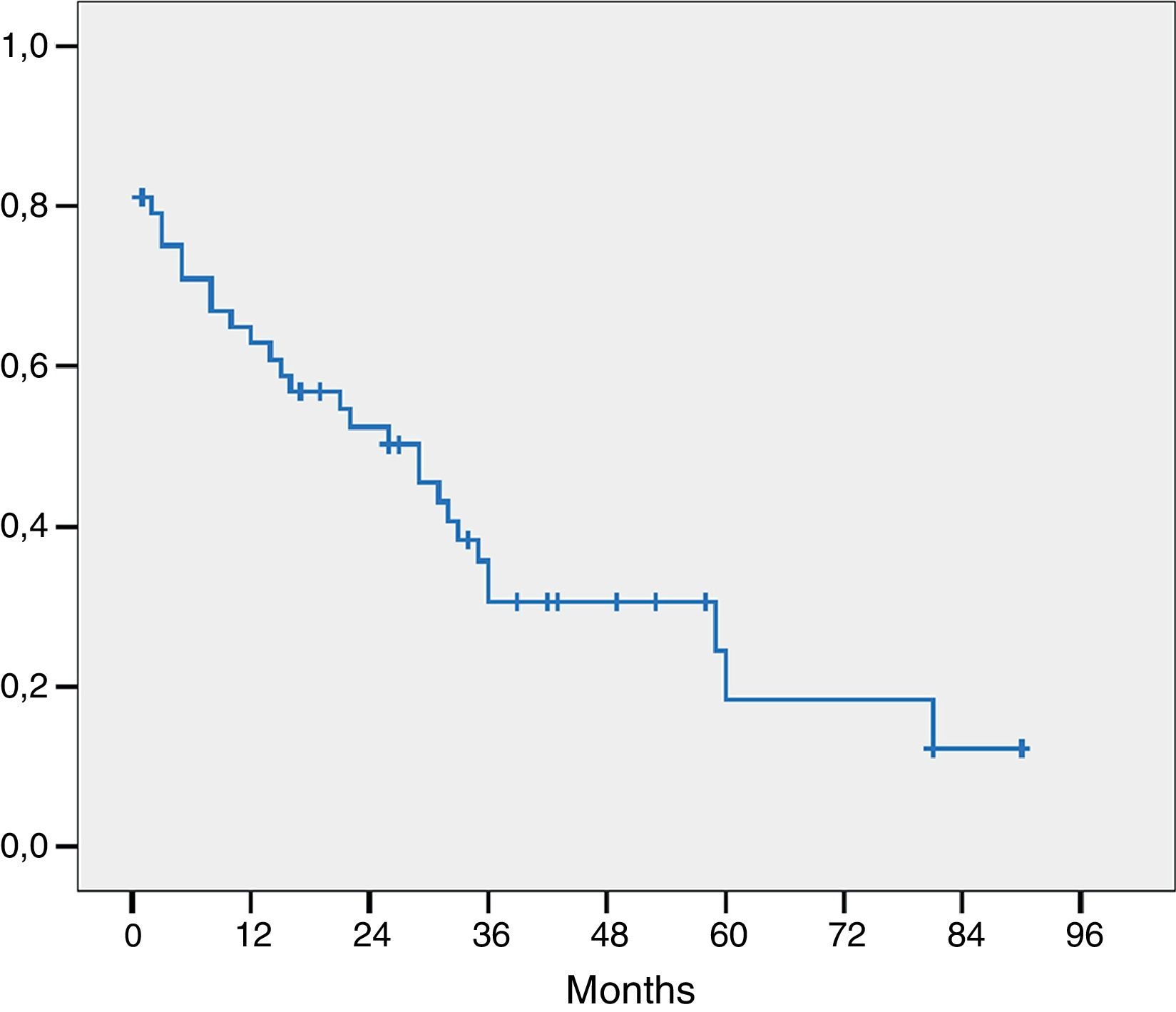
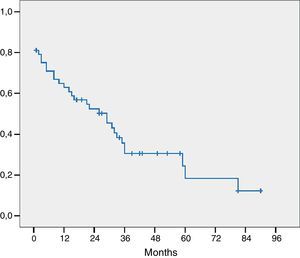
El estudio histológico de la pieza se presenta en la tabla 4. Tres pacientes presentaban invasión macroscópica del margen (R2) y en 15 pacientes el margen microscópico era inferior a 1mm y fueron considerados R1 para el análisis de los factores pronóstico. El estadio histológico más frecuente fue pT2 o pT3 y en 21 pacientes los ganglios extirpados eran positivos para adenocarcinoma. La mayoría de los tumores eran moderadamente diferenciados. La mediana de ganglios positivos fue de 1 (rango de 0-7). La mediana de ganglios estudiados por paciente fue de 9,5 (rango 4-27). La supervivencia global, incluyendo mortalidad postoperatoria fue de 77, 35 y 21% respectivamente a los 12, 36 y 60 meses con una mediana de supervivencia de 31 meses (fig. 1).
Datos histológicos
| Variables | ||
| Tipo de resección | ||
| R0 | 28 | 62 |
| R1 | 14 | 31 |
| R2 | 3 | 7 |
| pT (faltan 2) | ||
| pT1 | 3 | 7 |
| pT2 | 19 | 42 |
| pT3 | 18 | 40 |
| pT4 | 3 | 7 |
| pN (faltan 2) | ||
| N0 | 22 | 49 |
| N1 | 21 | 47 |
| Infiltración perineural | 42 | 93 |
| Diferenciación | ||
| Bien diferenciado | 15 | 33 |
| Moderadamente diferenciado | 20 | 44 |
| Indiferenciado | 10 | 22 |
| Número de ganglios positivos (mediana y [rango]) | 1 | (0-7) |
| Número de ganglios totales (mediana y [rango]) | 9,5 | (4-27) |
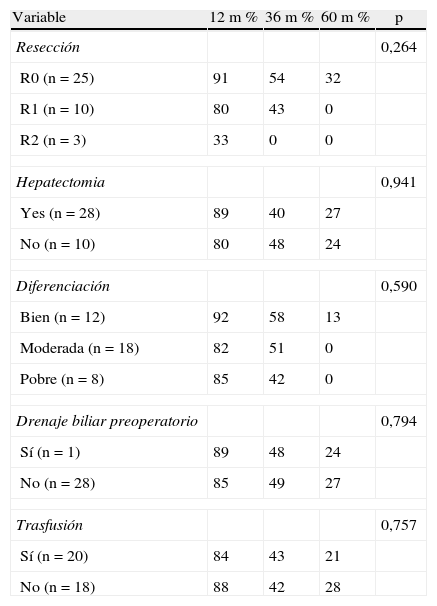
En lo que se refiere a la evaluación de los factores que podrían afectar la supervivencia, cuando se compararon los pacientes de acuerdo al tipo de resección (R0, R1, R2), la supervivencia a 1, 3 y 5 años fue de 91, 54 y 32% respectivamente en los R0; 80, 43 y 0% en los R1 y 33, 0 y 0% para los R2. En los pacientes con resección R1 y R2 no hubo supervivientes a los 5 años, no obstante la diferencia no fue estadísticamente significativa (p = 0,264) (tabla 5).
Factores pronósticos de supervivencia excluyendo mortalidad operatoria
| Variable | 12 m % | 36 m % | 60 m % | p |
| Resección | 0,264 | |||
| R0 (n = 25) | 91 | 54 | 32 | |
| R1 (n = 10) | 80 | 43 | 0 | |
| R2 (n = 3) | 33 | 0 | 0 | |
| Hepatectomia | 0,941 | |||
| Yes (n = 28) | 89 | 40 | 27 | |
| No (n = 10) | 80 | 48 | 24 | |
| Diferenciación | 0,590 | |||
| Bien (n = 12) | 92 | 58 | 13 | |
| Moderada (n = 18) | 82 | 51 | 0 | |
| Pobre (n = 8) | 85 | 42 | 0 | |
| Drenaje biliar preoperatorio | 0,794 | |||
| Sí (n = 1) | 89 | 48 | 24 | |
| No (n = 28) | 85 | 49 | 27 | |
| Trasfusión | 0,757 | |||
| Sí (n = 20) | 84 | 43 | 21 | |
| No (n = 18) | 88 | 42 | 28 | |
Cuando por otra parte se compararon los índices de supervivencia de los pacientes con R1 vs. R2, tampoco hubo diferencias significativas (p = 0,906).
En cuanto a la supervivencia de acuerdo al grado de diferenciación, la misma fue evaluada no encontrándose diferencias estadísticamente significativas (p = 0,590) (tabla 5).
Cuando se estudió a los pacientes que habían recibido como parte de la operación una resección hepática vs. aquellos que solo habían recibido una resección de la vía biliar, tampoco se encontraron diferencias significativas en cuanto a supervivencia (p = 0,941).
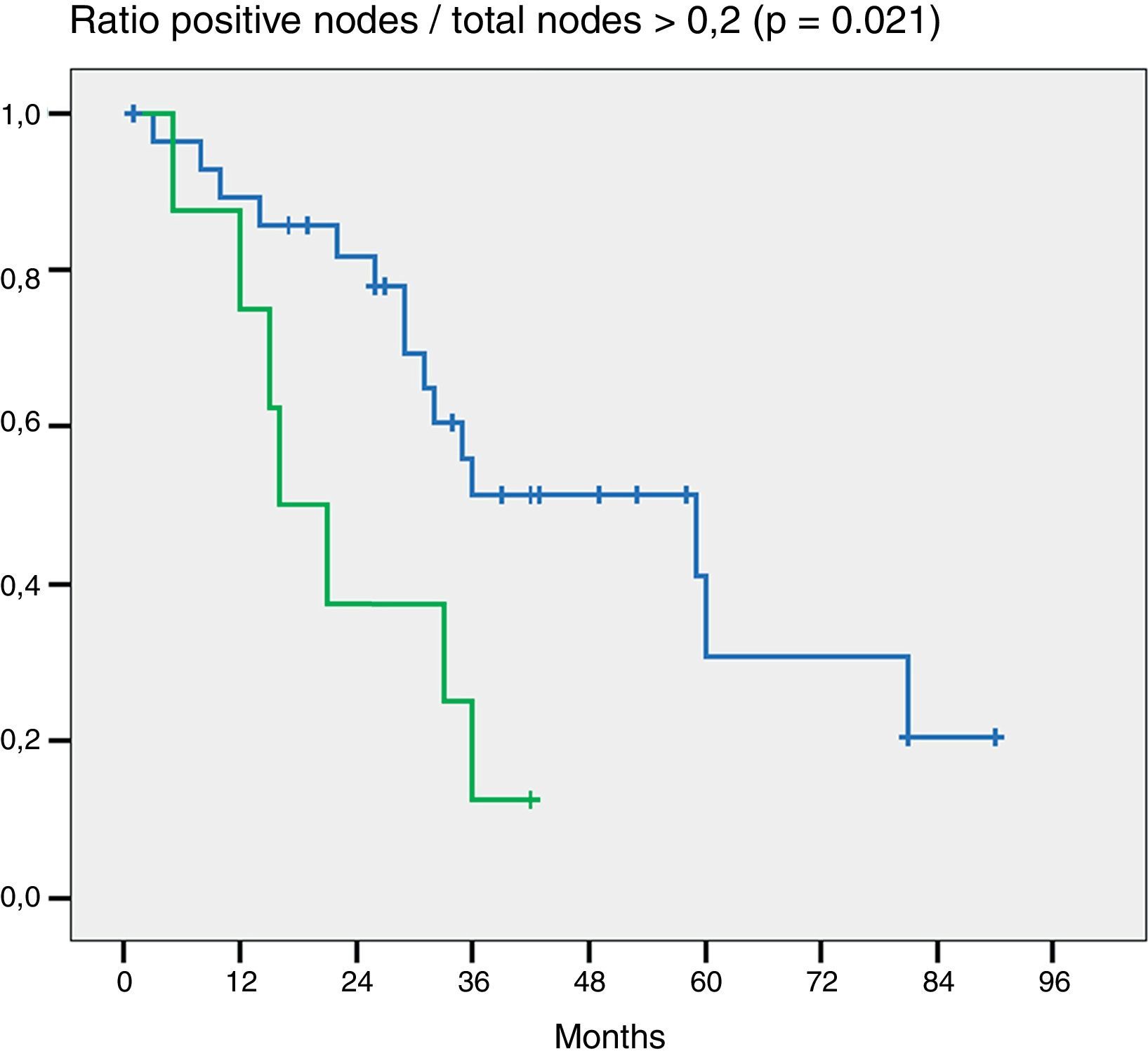
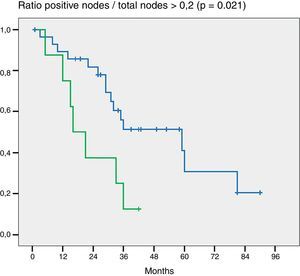
En la valoración del impacto en la supervivencia que tiene el número de ganglios resecados (más o menos de 5 y más o menos de 7) en ninguno de los 2 grupos el número de ganglios mostró ser un factor pronóstico (p = 0,132 y p = 0,427). Por otra parte, en la evaluación de la ratio G+/Gt ≥ 0,2 la diferencia fue estadísticamente significativa (p = 0,021) (fig. 2).
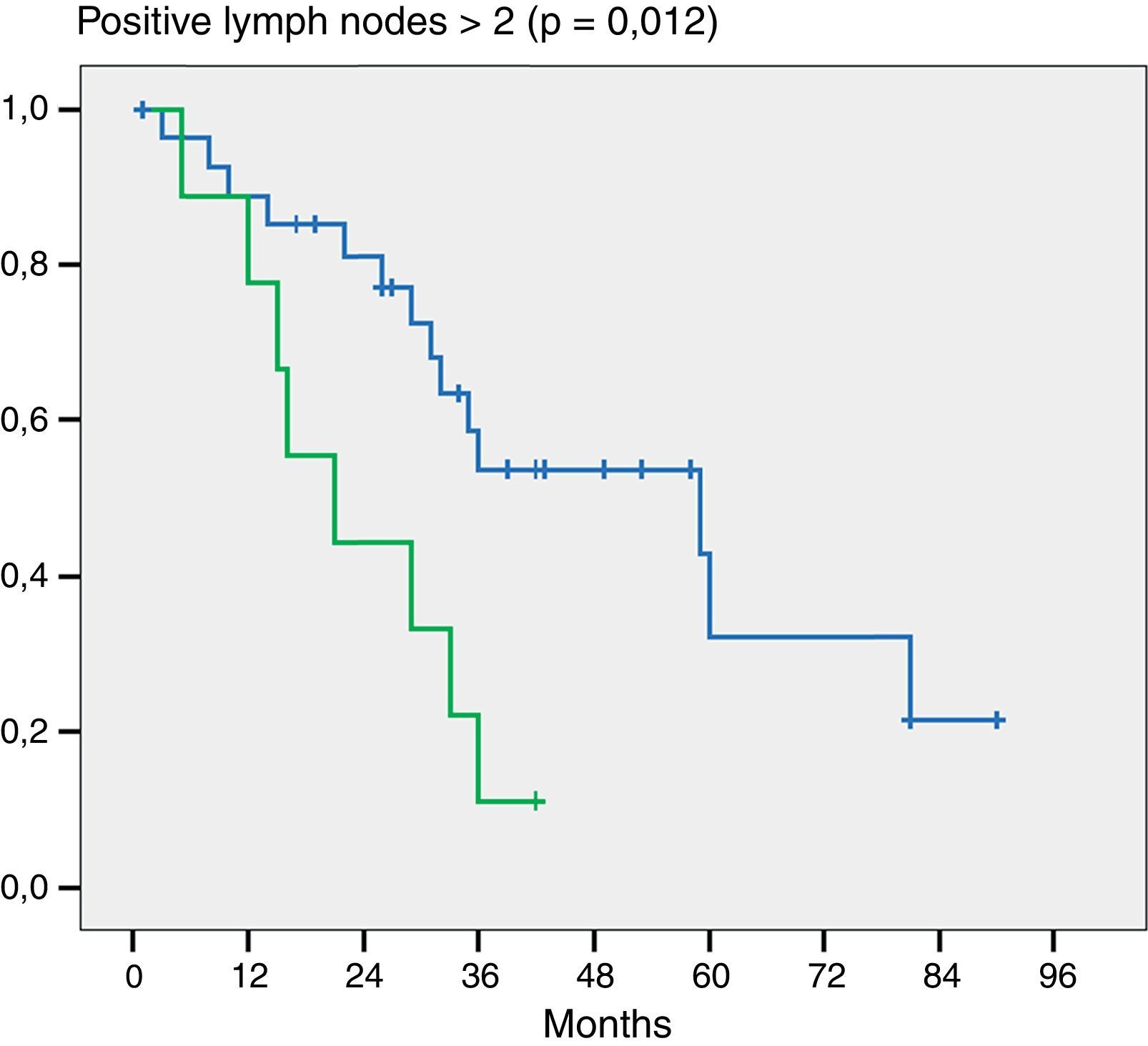
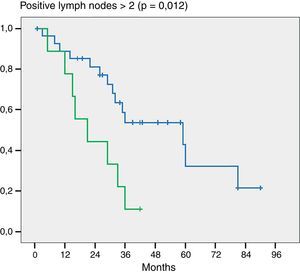
Por otra parte y como dato importante, cuando evaluamos la cantidad de ganglios positivos notamos diferencia estadística en aquellos pacientes que tenían 2 o más ganglios positivos (p = 0,012) (fig. 3).
Dentro de la evaluación de otros factores considerados pronósticos tales como transfusiones y colocación de drenaje biliar preoperatorio, los mismos no presentaron diferencias estadísticamente significativas (p = 0,726 y p = 0,585 respectivamente) (tabla 5).
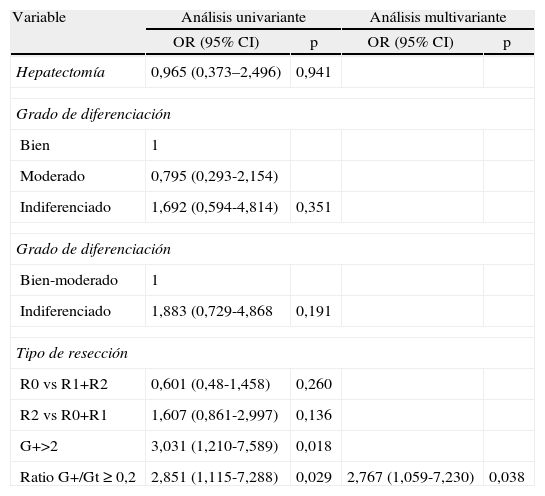
Análisis uni- y multivariante de CoxEn el análisis univariante se introdujeron todos aquellos factores que se citan en la mayoría de publicaciones: realización de hepatectomía, grado de diferenciación, margen de resección e invasión vascular. Solo la ratio ≥ 2 G+/Gt con un riesgo de 2,851 y para los pacientes con ≥ 2 ganglios positivos con un riesgo de 3 fueron significativos. En el análisis multivariante solo la ratio ≥ 2 G+/Gt fue significativo con una p = 0,038 (tabla 6).
Regresión de Cox
| Variable | Análisis univariante | Análisis multivariante | ||
| OR (95% CI) | p | OR (95% CI) | p | |
| Hepatectomía | 0,965 (0,373–2,496) | 0,941 | ||
| Grado de diferenciación | ||||
| Bien | 1 | |||
| Moderado | 0,795 (0,293-2,154) | |||
| Indiferenciado | 1,692 (0,594-4,814) | 0,351 | ||
| Grado de diferenciación | ||||
| Bien-moderado | 1 | |||
| Indiferenciado | 1,883 (0,729-4,868 | 0,191 | ||
| Tipo de resección | ||||
| R0 vs R1+R2 | 0,601 (0,48-1,458) | 0,260 | ||
| R2 vs R0+R1 | 1,607 (0,861-2,997) | 0,136 | ||
| G+>2 | 3,031 (1,210-7,589) | 0,018 | ||
| Ratio G+/Gt ≥ 0,2 | 2,851 (1,115-7,288) | 0,029 | 2,767 (1,059-7,230) | 0,038 |
G+2 = 2 o más ganglios invadidos; Ratio G+/Gt ≥ 0,2: ratio ganglios positivos/ganglios totales; Tipo de resección: R0: margen no invadido; R1: margen microscópico invadido, margen macroscópico invadido.
Se ha descrito un incremento en la incidencia de colangiocarcinoma hiliar por algunos autores13. La cirugía es en la actualidad la única posibilidad de curación que se les puede ofrecer a estos pacientes, a través de resecciones completas del tumor (R0)1,2,20–24. La mejora en los métodos diagnósticos complementarios ha permitido, por un lado, estadificar mejor de manera preoperatoria a estos pacientes, logrando evitar la cirugía en aquellos pacientes con criterios de irresecabilidad25,26. Por otro, el desarrollo de la técnica quirúrgica ha permitido, en el caso de pacientes con compromiso vascular, incrementar el número de resecados gracias a la posibilidad de efectuar exéresis venosas y arteriales27–29. El uso de la embolización portal propuesta por Makuuchi ha sido otro factor que ha permitido engrosar el número de pacientes resecados al permitir la hipertrofia del futuro remanente y disminuir las posibilidades de insuficiencia hepática postoperatoria30,31.
Con todo, los porcentajes de pacientes resecados en las principales series rondan el 75%, cifra que es similar a la obtenida en nuestra casuística (78%). De esta, el 62% fueron R0, número comparable con diferentes autores21,32. En 35 pacientes se asoció una hepatectomía (78%) y en 10 se realizó resección de la vía biliar con linfadenectomía y hepático-yeyuno anastomosis. No hubo diferencias significativas en cuanto a sobrevida entre los que recibieron hepatectomías y los que no. Estos resultados coinciden con los publicados por algunos autores y difieren de otros, siendo aún un punto controversial en los tumores tipo I y algunos II de la clasificación de Bismuth33–36. Es importante tener en cuenta que la mayoría de nuestros pacientes que fueron tratados solo con resección de la vía biliar y linfadenectomía tenían tumores tipo I de la clasificación de Bismuth-Corlette.
La morbilidad fue de 73%, siendo las fístulas biliares y las colecciones intraabdominales las más numerosas; esta cifra es un poco más elevada que en otras series y probablemente se deba al esfuerzo por lograr la alta tasa de resecabilidad obtenida. Lo mismo sucede con la mortalidad, que estuvo presente en 7 pacientes (15%). En este punto es importante tener en cuenta que la supervivencia a 3 y 5 años, sin descontar la mortalidad operatoria y con la mortalidad, fue respectivamente de 45 y 32%, similar a la publicada en otras series10,37.
Diversos factores pronósticos han sido propuestos en la literatura11,38–40. Las resecciones R0 han sido asociadas con mayor sobrevida, en nuestra serie no hubo diferencias significativas cuando se las comparó con las R1 y R2, aunque aquellos en los que se logró una R0 fueron los únicos supervivientes a los 5 años. La sobrevida de los pacientes con R0 a 5 años fue de 32%, cifra que coincide con la mayoría de las series publicadas10,37. Otros autores41–43 han propuesto que los pacientes que han requerido transfusiones de hemoderivados o aquellos que habían sido sometidos a drenaje biliar preoperatorio tenían peor pronóstico que aquellos que no. En el análisis de estos 2 puntos no hemos encontrado tampoco diferencias significativas que hablen a favor de evitar las transfusiones o el drenaje biliar.
El grado de diferenciación es también mencionado en la literatura como otro factor pronóstico a tener presente10,44. La diferenciación celular no tuvo en nuestra experiencia diferencias significativas en cuanto a sobrevida a 1, 3 y 5 años. El 93% de nuestros pacientes presentaban invasión perineural, que también ha sido asociada a un mal pronóstico, pero que en nuestra serie no fue significativo. En este punto, y ante el alto porcentaje de invasión hallada en nuestra casuística, tendemos a creer que es un factor dependiente del interés en su búsqueda por parte del patólogo.
Nagino et al.12 sugieren que las metástasis ganglionares son el factor predictivo más importante. En la evaluación de nuestros resultados el número total de ganglios revisados por anatomía patológica tuvo una media de 9,5; esta cifra es un poco menor a la referida por Aoba et al.13 que era de 12,9 pero superior a la del grupo del Sloan-Kettering Cancer Center que era de 313,45. En la séptima edición de la clasificación TNM de la UIIC el número de ganglios recomendados para análisis anatomopatológico en el colangiocarcinoma hiliar es de 15, coincidiendo con algunos autores, pocos pacientes de nuestra serie y de otras alcanzan esta cifra13.
Cuando analizamos el impacto en la sobrevida de pacientes en los que se resecó más o menos de 5 y 7 ganglios encontramos que no existió diferencia significativa. En este punto, coincidimos con Aoba et al.13 en que la resección de 5 o más ganglios es una cifra aceptable por un lado y, por otro, en que probablemente el número total de ganglios resecados así como la ubicación de los mismos no tenga un impacto pronóstico de importancia. Por otra parte el número de ganglios positivos sería un factor pronóstico de peso. Aoba et al.13 manifiestan que existe una diferencia importante entre aquellos pacientes que tienen un ganglio positivo y aquellos que tienen más, y refieren que este es el factor pronóstico más importante. En nuestra serie, encontramos una diferencia estadísticamente significativa entre aquellos pacientes que tenían 2 o más ganglios positivos y aquellos que tenían menos.
En el mismo sentido, algunos autores en otros tumores (esófago, colon, páncreas, etc.) han sugerido como un importante factor predictivo la relación G+/Gt3–9. Guglielmi et al.14 y Oshiro et al.15 han reportado que una ratio superior a 0,25 para el primero y de 0,2 para el segundo han tenido una sobrevida mucho más pobre que aquellos que tenían menos. En el análisis de nuestros pacientes una ratio superior a 0,2 tuvo peor sobrevida que aquellos que tenían una ratio inferior y la diferencia fue estadísticamente significativa en el análisis multivariante de Cox.
Por su parte, algunos autores13 no reportan resultados similares y manifiestan que la ratio estaría afectada por el número total de ganglios linfáticos y que, además, sería difícil obtener datos homogéneos comparables ya que hay series con alta tasa de ganglios y otras series13,45 que tienen un número muy bajo en sus linfadenectomías o donde los patólogos solo estudiarían un bajo número del total.
En conclusión, si bien existen pocos estudios en los que se valora la relación de ganglios positivos de los pacientes resecados en el colangiocarcinoma hiliar, consideramos que el número de ganglios positivos resecados y la ratio G+/Gt son probablemente los 2 factores pronósticos de sobrevida más importantes. Estos resultados serían importantes a la hora de decidir una terapia adyuvante después de la cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.