Introducción
En la resección esofágica por cáncer se ha refinado la técnica quirúrgica, y también se ha producido una mejora en la atención anestésica y en los cuidados perioperatorios, lo que se ha traducido, sobre todo en los centros de gran volumen, en una disminución apreciable de la mortalidad operatoria1. De todos modos, aunque en opinión de Law et al2, del grupo de Wongs, caminemos hacia la mortalidad cero, esas cifras aún parecen utópicas incluso para grupos muy especializados occidentales, a no ser que disminuyamos las cifras de resección a valores inadmisibles. En un estudio reciente de revisión publicado por Dimick et al3 del grupo de Orringer, se señala que en Estados Unidos la mortalidad global operatoria es del 11,3%, parecida a la nuestra, y la estancia media hospitalaria es de 15 días. No obstante, de acuerdo con la revisión efectuada por Jamieson et al4, es posible que estas cifras sean bastante más elevadas ya que muchos autores no presentan la supervivencia en el primer año, sin duda más informativa que la de 30 días o al alta hospitalaria. La morbilidad operatoria no baja del 40% y ronda el 60% en nuestros casos, si se considera cualquier tipo de incidencia.
Con estas cifras in mente y a partir de nuestra propia experiencia, hemos hecho una revisión del tema: grupos de riesgo, complicaciones más frecuentes y su tratamiento, con el objeto de mejorar los resultados actuales. Las cifras de operabilidad siempre han de compararse con las de mortalidad.
Factores de morbimortalidad y su prevención
Aunque a la hora de seleccionar a un paciente para exéresis siempre será necesario individualizar el caso, debe haber un criterio establecido e incluso, si es posible, unos índices pronósticos que permitan conocer de antemano, con la mayor exactitud posible, en qué riesgo/beneficio nos movemos. Un estudio de nuestro grupo5 puso en evidencia que el antecedente de neoplasia maligna, o la presencia de cirrosis, multiplican por 3 el riesgo de mortalidad operatoria, en tanto que las pruebas de función respiratoria, o los valores bajos de colesterol y albúmina, añaden un punto en la confección de una puntuación global.
Edad
Si la edad es un factor de primer orden en cualquier intervención quirúrgica, en la cirugía esofágica ha de serlo aún más1. Esto no es obstáculo para que algunos autores señalen que la resección esofágica puede realizarse con garantías en pacientes de edad avanzada y que, en sí misma, sea un factor secundario en relación con el estado fisiológico del paciente o la experiencia del equipo quirúrgico. La edad incrementa el riesgo de complicaciones pulmonares y la mortalidad2.
Pleuropulmonares
Dentro de las complicaciones mayores las pulmonares son las más frecuentes y la causa número uno de mortalidad en la bibliografía reciente2. De ellas, la neumonía (32%) (22,3% en nuestros casos) y el derrame pleural ocupan los primeros lugares, y las personas de edad, fumadoras y con pruebas respiratorias preoperatorios alteradas son las más expuestas a este riesgo6. Otros factores de riesgo conocidos son las politransfusiones, o las alteraciones deglutorias, sea por lesión recurrencial evidente en el 2,1% o, de modo más frecuente, alteraciones sutiles difíciles de demostrar pero que incrementan el riesgo de broncoaspiración.
A la vista de lo expuesto, es evidente que la fisioterapia respiratoria pre y postoperatoria debe formar parte de la atención de estos pacientes, en especial de los grupos de más riesgo: edad avanzada o alteraciones de las pruebas respiratorias, sobre todo el volumen máximo espirado en el primer segundo y la presión parcial de oxígeno (PaO2) bajas. El tabaco incrementa la secreción bronquial y favorece las atelectasias pulmonares, por lo que de modo ideal debería ser retirado 1-2 meses antes de la intervención, difícil en estos pacientes. Otros factores recogidos en la bibliografía son la hipoalbuminemia que potencia la salida de líquidos al espacio intersticial y favorece la sobreinfección6.
Se ha referido la extubación temprana como un método eficaz para reducir las complicaciones respiratorias7. Hasta el 95% de los pacientes puede ser extubado en las primeras 12 h del postoperatorio. En este sentido, la analgesia epidural se ha mostrado como el tratamiento más eficaz para controlar el dolor y promover la fisioterapia respiratoria, y así mejorar la función pulmonar y reducir el número de complicaciones respiratorias. Además, su uso mejora la microcirculación digestiva y, por tanto, la oxigenación de los tejidos, sobre todo en la cirugía del tracto gastrointestinal superior, como es la cirugía del esófago. En algunos estudios, incluso se sugiere que la analgesia epidural podría disminuir el riesgo de dehiscencia de suturas y fístulas7,8. Aun así, la reintubación de estos pacientes, una vez extubados tras la intervención quirúrgica, ocurre en un 10% de los casos.
Corazón
Los datos de la bibliografía no conceden factor de riesgo adicional a la esofaguectomía con respecto a otra intervención quirúrgica mayor, sobre todo torácica. La fracción de eyección y otros antecedentes cardiológicos se tendrán en consideración como en cualquier cirugía mayor. Un hecho preocupante ha sido en qué medida, sobre todo en cardiópatas conocidos, la plastia de sustitución podía alterar la función cardíaca. Coral et al9 realizan ecocardiograma pre y postoperatorio tras esofaguectomía y gastroplastia mediastínica sin encontrar diferencias en la fracción de eyección u otros parámetros de función ventricular.
Hígado
El incremento de la morbimortalidad operatoria en el paciente cirrótico es bien conocido. En el caso de la cirugía esofágica, un grupo experto francés10 publicó al comienzo de la década de los años noventa del siglo pasado unas cifras prohibitivas de mortalidad, incluso con cirugía menos radical. Algunos años más tarde un trabajo de la Clínica Mayo11 de todos los pacientes sometidos a cirugía bajo anestesia general señala complicaciones del 31% y mortalidad del 11,3%, con factores de riesgo añadidos: la mala reserva funcional hepática (Child), el sexo masculino, la cirrosis criptogenética, la infección preoperatoria y la cirugía torácica y cardiovascular. Tachibana et al12 estudian a un grupo de cirróticos sometidos a cirugía en 3 campos por carcinoma epidermoide de esófago y concluyen que las complicaciones son frecuentes y la mortalidad importante respecto al control. De nuevo la reserva funcional hepática se mostró como un factor pronóstico de primer orden y las complicaciones infecciosas fueron las más frecuentes. Debe destacarse que superado el postoperatorio, los pacientes tuvieron una esperanza de vida similar al grupo no cirrótico. Ya que en nuestra experiencia5 la cirrosis hepática es un factor altamente predictivo de morbimortalidad, no operamos pacientes con cirrosis conocida.
Virus de la inmunodeficiencia adquirida positivo/sida
Desde la primera descripción de la infección por el virus de la inmunodeficiencia adquirida (VIH)/sida hace 20 años, ha habido un cambio drástico en el control de la enfermedad y en consecuencia del riesgo operatorio tanto por enfermedad relacionada (Kaposi, linfomas, etc.), como no. Lo mismo ha ocurrido con el riesgo de contagio del personal sanitario. De hecho la transmisión accidental del VIH se estima en 0,5% para lesiones con agujas13. Puesto que la evolución quirúrgica, sobre todo en cirugía de alto riesgo, se cree que depende en gran medida del estado inmunológico del paciente, se ha tratado de descubrir indicadores preoperatorios tanto en el grupo de infectados como en el de pacientes de sida capaces de predecir el riesgo operatorio. El recuento de linfocitos CD4 ha sido estimado por muchos autores con resultados dispares. Yii et al14 hallan una relación directa entre valores bajos de linfocitos CD4 y complicaciones postoperatorias generales, infecciosas y de la cicatrización. Tran et al15 encuentran que el estado inmune predice la posibilidad de complicaciones y muerte en VIH+/sida, en concreto el recuento preoperatorio de leucocitos y el porcentaje de linfocitos, así como el recuento postoperatorio de linfocitos CD4 y la carga viral plasmática fueron factores de mortalidad. De todos ellos el recuento postoperatorio de linfocitos CD4 ha sido factor independiente de mortalidad, y el cambio en el porcentaje CD4 pre y postoperatorio, de morbilidad. Nuestra experiencia, escasa, avala la cirugía en estos pacientes, alguno con muy buena supervivencia a largo plazo.
Quimiorradioterapia neoadyuvante
La amplia difusión de protocolos de quimiorradioterapia neoadyuvante en el cáncer epidermoide de esófago, y en menor medida en el adenocarcinoma, con mejoras discutibles en la supervivencia, ha suscitado el temor al incremento de la morbimortalidad operatoria. Los resultados son dispares quizá como consecuencia al menos de los hechos siguientes: protocolos terapéuticos diferentes (quimioterapia frente a quimiorradioterapia), pautas distintas (fármacos y dosis), ausencia de estudios aleatorizados, mezcla de pacientes con tumores epidermoides y adenocarcinomas, o tamaños muestrales pequeños.
Centrándonos en el protocolo universalmente admitido, radioterapia de 45 Gy y quimioterapia sensibilizadora concomitante a partir de derivados del platino y 5 fluorouracilo en el carcinoma epidermoide, puede señalarse que la mayoría de los grupos no perciben incremento en la morbimortalidad operatoria2,16. Sin embargo, otros autores, sea en trabajos personales17 o en metaanálisis18, concluyen que aunque la supervivencia global a 3 años es mejor, la mortalidad operatoria es sin duda más elevada. Ante estas dudas, parece razonable seleccionar al máximo qué pacientes se pueden beneficiar de la neoadyuvancia (enfermedad local/locorregional avanzada frente a estadios más incipientes) y qué régimen terapéutico es el ideal (eficacia con menor morbimortalidad).
Localización de la anastomosis
Si en cuanto al pronóstico de la enfermedad el tratamiento transhiatal se ha mostrado comparable a la vía transtorácica, hay coincidencia mayoritaria, incluidos nuestros datos, que la anastomosis cervical, obligada en el primer caso, se sigue de un número mayor de fístulas y, en consecuencia, estenosis a corto plazo19, a pesar de que el grupo de Orringer20 haya logrado reducir las fístulas de entre el 10 y el 15% en las anastomosis manuales al 2,7% con su técnica de sutura mecánica. Este punto cobra aún más interés si tenemos en cuenta que la cirugía mínimamente invasiva, de moda en este momento, se asocia en general a anastomosis en el cuello21.
Tipo histológico
Aunque no hay resultados uniformes, parece claro el mayor riesgo operatorio de los pacientes sometidos a exéresis por carcinoma epidermoide22. Es evidente que la diferencia no estriba en la extirpe celular, sino en la propia epidemiología de la enfermedad (alcohol, tabaco, desnutrición, protocolos de neoadyuvancia más agresivos, habituales en los tumores escamosos y que condicionarán una frecuencia mayor de complicaciones pulmonares, frente a los típicos adenocarcinomas sobre Barrett en los que el paciente suele conservar un excelente estado general). El grupo de Parrilla23 señala más del doble de mortalidad en estos pacientes (12 frente a 5%).
Volumen hospitalario
En las últimas décadas se ha apreciado que ciertos procedimientos quirúrgicos de alto riesgo tienen menor mortalidad y mejor evolución cuando se efectúan en hospitales con mucha casuística. Sin embargo, es probable que el volumen no lo sea todo y quizá refleje un conjunto de variables como mejor selección de los pacientes, tratamientos complementarios, metodología diagnóstica, especialización médica y quirúrgica, cuidados intensivos, etc.24. En un metaanálisis realizado por Metzger et al25 que recoge a más de 18.000 pacientes sometidos a esofaguectomía se cita que son necesarias más de 20 resecciones anuales para que la mortalidad se aproxime al 5%. De acuerdo con Dimick et al3, si bien en los grupos más activos las complicaciones graves (pulmonares, cardíacas, quirúrgicas, etc.) no son infrecuentes, su atención es mucho mejor y la gravedad menor en los centros con más volumen (influencia del cirujano más otros factores hospitalarios). De otra parte, este mismo grupo demuestra que mientras los centros con poca casuística apenas mejoran sus resultados con el paso del tiempo, en los que la tienen más amplia se reseca más, y con menor mortalidad. Wenner et al26 comprueban asimismo que la supervivencia a los 5 años es superior en los centros con mayor número de pacientes.
Cirugía endoscópica
Ya que la principal fuente de complicaciones y mortalidad en la resección esofágica es el pulmón, se pensó que la cirugía mínimamente invasiva, en apariencia menos traumática, podría dar mejores resultados. Hasta el momento se ha comprobado que las resecciones, la mayoría combinando abordaje abdominal, torácico y cervical, son factibles, tienen futuro, pero en este momento no mejoran los resultados de la técnica abierta21,27, que sigue siendo la estándar.
Complicaciones pleuropulmonares
Si a los factores de riesgo conocidos en los tumores epidermoides (alcohol, tabaco, desnutrición, etc.), y menos en los adenocarcinomas, añadimos que la toracotomía produce una alteración en la mecánica de la caja torácica y, por tanto, en la compliancia pulmonar, que dará lugar a la disminución de la capacidad vital, volumen residual, capacidad pulmonar total y capacidad residual funcional, que alteran la reserva ventilatoria y el intercambio gaseoso, como consecuencia del cierre de las pequeñas vías aéreas y de trastornos en el cociente ventilación/perfusión, no debe extrañar la frecuencia y gravedad de estas complicaciones.
Insuficiencia respiratoria aguda
Se define como el cociente presión parcial de oxígeno arterial/fracción inspirada de oxígeno (PaO2/FiO2) < 200 mmHg o frecuencia respiratoria > 30 por min con imposibilidad para mantener una saturación de O2 > 90% con mascarilla y concentración de O2 > 35% (excepto los pacientes con enfermedad pulmonar obstructiva crónica) o necesidad de soporte ventilatorio. Dependiendo de las series7 su incidencia varía entre el 7 y el 27%. Entre las causas que la producen se encuentran:
Atelectasias
Representan el 85% de todas las complicaciones pulmonares postoperatorias. Se deben a la obstrucción de la vía aérea ante la incapacidad para toser y movilizar secreciones bronquiales, generalmente por hipoventilación secundaria a la disminución de la movilidad diafragmática por un inadecuado control del dolor o la sedación. Otras causas incluyen: broncoespasmo, edema, compresión pulmonar por aire o colecciones pleurales mal drenadas, fisioterapia respiratoria inadecuada y humidificación del oxígeno administrado, o deshidratación. Tienen elevado riesgo de infección y progresión hacia una neumonía28. Para evitar las atelectasias, el drenaje postural y la fisioterapia pre y postoperatoria coincidiendo con el momento de máxima analgesia son muy útiles. Es muy rara la necesidad del fibrobroncoscopio para su resolución. El tratamiento con mucolíticos (N-acetilcisteína) no ha demostrado utilidad en estos casos.
En un trabajo reciente de Jaber et al29 se señala cómo el empleo de ventilación mecánica no invasiva (modo CPAP, continuous positive airway pressure) administrada con sistema de mascarilla tipo helmet, en el tratamiento de la insuficiencia respiratoria aguda secundaria a atelectasias, del postoperatorio de cirugía abdominal programada (incluida esofaguectomía y gastrectomía), disminuye en un 8,7% el riesgo absoluto de reintubación. El único inconveniente a este tratamiento se basa en el temor a someter las suturas de las anastomosis a presiones altas, con el consiguiente riesgo de dehiscencia. Por tanto, es necesario una selección adecuada de los pacientes antes de instaurar este tipo de soporte ventilatorio parcial.
Derrame pleural
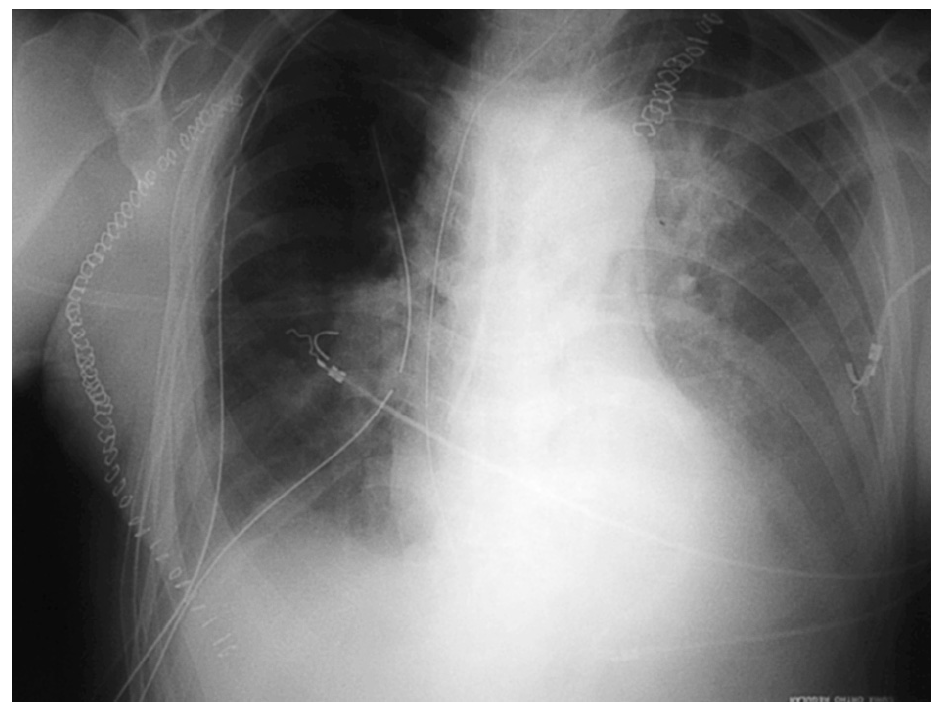
Segunda complicación en número de casos. El mecanismo de producción tiene lugar como resultado de un desequilibrio entre la producción y la reabsorción del líquido pleural, p. ej. durante la sobrecarga de volumen intravenoso. La insuficiencia cardíaca como causa de derrame pleural en estos pacientes es muy rara, de hecho durante las primeras horas del postoperatorio suele haber presiones cardíacas de llenado bajas en relación con la hemorragia secundaria a la cirugía, deshidratación, o falta de líquidos por pérdidas insensibles proporcionales a la duración de la intervención, junto con la vasoplejía que producen ciertos anestésicos. También la desnutrición, frecuente, provoca el descenso de la presión oncótica por hipoproteinemia (hipoalbuminemia) y favorece los derrames, así como el aumento de la permeabilidad en la microcirculación pleural y las alteraciones en el drenaje linfático. En general es estéril y puede ser uni o bilateral (fig. 1). Aunque la mayoría se resuelven sin tratamiento, hasta el 17% de los pacientes precisan un drenaje pleural extra. Su persistencia o reaparición en el postoperatorio más allá del cuarto día nos debe alertar hacia alguna de las complicaciones siguientes: dehiscencia de sutura, sección del conducto torácico o hemorragia pleural28.
Fig. 1. Radiografía de tórax de un postoperatorio de carcinoma de esófago, en ventilación espontánea con importantes derrames pleurales bilaterales, de los que el izquierdo es mayor que el derecho asociado a atelectasias bibasales por compresión.
Empiema
La infección del líquido pleural o empiema no es una complicación habitual, pero sí potencialmente mortal. Entre sus causas más frecuentes se encuentran la dehiscencia de la sutura quirúrgica en el ámbito torácico, que provoca la fuga del contenido gastrointestinal a la pleura y al mediastino y produce el empiema y la mediastinitis, respectivamente. Secundariamente, los pacientes pueden desarrollar complicaciones graves, como sepsis, shock séptico, síndrome de distrés respiratorio del adulto (SDRA) y fallo multiorgánico8.
Neumotórax
Puede deberse a hiperpresión pulmonar, como resultado de la intubación selectiva y de la obstrucción del circuito espiratorio. Otras veces está en relación con una efracción pleural o, de manera retardada, tras el destete del respirador. Se debe verificar que no sea la traducción de una dehiscencia de la anastomosis intratorácica, lo que generalmente se acompaña de enfisema subcutáneo y/o derrame pleural. También los pacientes que desarrollan SDRA y son ventilados con presiones elevadas en la vía aérea pueden desarrollar un neumotórax como complicación (barotrauma)7,30.
Neumonitis química
Durante la maniobra de intubación orotraqueal o mientras se realiza la ventilación selectiva de un pulmón durante la propia cirugía, se puede producir la aspiración pulmonar de contenido orofaríngeo. También tras la extubación, cuando los pacientes no pueden restaurar su reflejo protector de la tos para aclarar las secreciones, p. ej. en anastomosis altas con tiempo quirúrgico cervical. En estos casos, además, una eventual lesión del nervio laríngeo recurrente condiciona la elevación normal de la laringe y favorece el reflujo gastroesofágico y la aspiración pulmonar de secreciones orales. En los casos más graves, puede evolucionar hacia un SDRA y/o neumonía bacteriana secundaria por contaminación28.
Neumonía nosocomial
La neumonía nosocomial postoperatoria es la complicación clínica más importante y la principal causa de muerte temprana tras la esofaguectomía (50%). Su incidencia varía según las series entre el 15 y el 32%1. Es la primera causa de reintubación y conexión a ventilación mecánica en los primeros 5 días del postoperatorio28. En más de la mitad de las muestras obtenidas crecen enterobacterias y Pseudomonas.
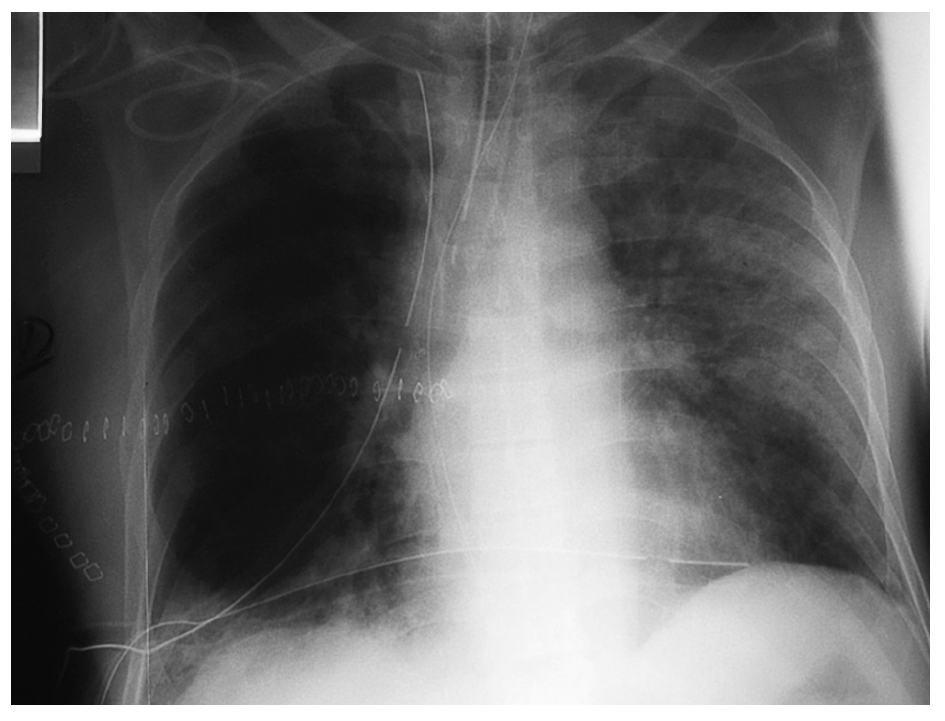
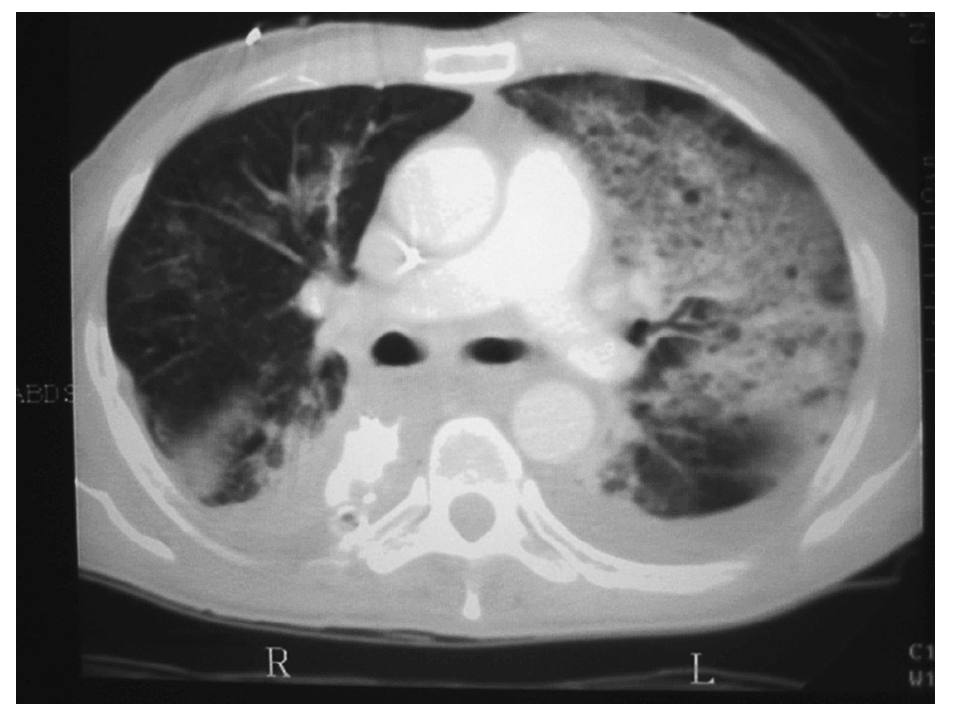
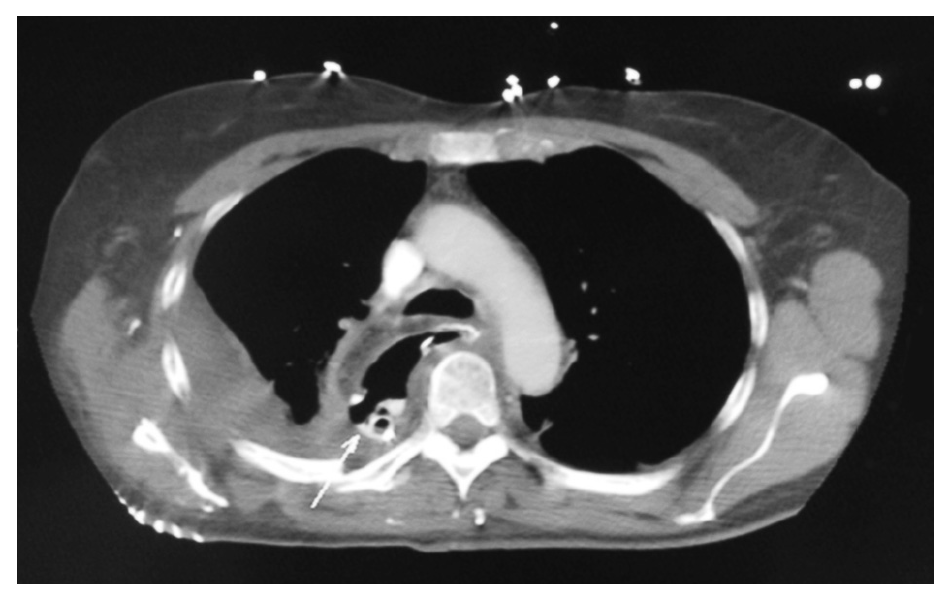
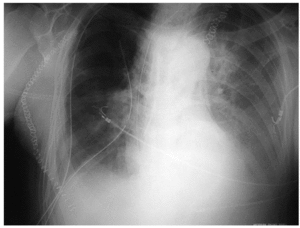
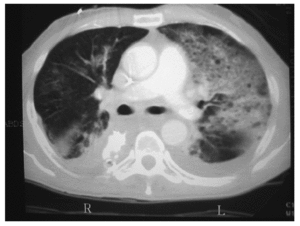
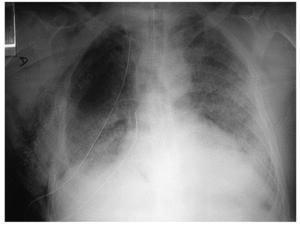
La neumonía asociada a ventilación mecánica (NAVM) es un tipo específico de neumonía nosocomial que pueden desarrollar los pacientes que están en ventilación mecánica más de 48 h de manera continuada. Su incidencia es del 1% por día durante el primer mes de ventilación. Se desarrolla como consecuencia de la traslocación bacteriana, la alteración de la función gastrointestinal y la aspiración de secreciones contaminadas con organismos patógenos que parecen adquirirse por vía endógena. Estos patógenos alcanzan la vía distal mediante el reflujo y aspiración mecánica de contenido gástrico contaminado y también mediante la inoculación repetitiva de secreciones de la vía aérea superior hacia el árbol traqueobronquial distal. Suele ser polimicrobiana (Pseudomonas aeruginosa, Acinetobacter spp. y S. aureus). El diagnóstico de la NAVM puede ser difícil (figs. 2 y 3), ya que otras causas de fiebre e infiltrados pulmonares, como las atelectasias y la lesión pulmonar aguda (LPA)28, pueden entrar en el diagnóstico diferencial.
Fig. 2. Radiografía de tórax de un paciente intubado y con ventilación mecánica en el quinto día del postoperatorio. Infiltrado alveolar con broncograma aéreo en prácticamente todo el pulmón izquierdo compatible con bronconeumonía.
Fig. 3. Tomografía computarizada del mismo paciente de la imagen anterior. En el pulmón izquierdo se puede observar infiltrados alveolares compatibles con proceso de consolidación neumónica junto con pequeños derrames pleurales bilaterales posteriores.
A pesar de la proliferación de estudios sobre estrategias de prevención de la NAVM, éste sigue siendo un terreno inseguro31. Algunas medidas aún no han logrado ser validadas y otras, para las que existe una evidencia positiva considerable, son aún cuestionadas e infrautilizadas. La elevación del cabecero de la cama hasta 45° se asocia con la reducción del reflujo gastroesofágico. El uso de camas oscilantes y sucralfato, en lugar de antagonistas H2. La aspiración de secreciones subglóticas (no de forma sistemática). En 7 metaanálisis sobre la descontaminación selectiva del tracto digestivo (DSD) hallan una reducción significativa de la NAVM y 4 de ellos concluyen que la adición de tratamiento antibiótico sistémico reduce considerablemente la mortalidad sin constatarse el posible impacto en las resistencias bacterianas que podría generar. Se recomienda además demorar el cambio de las tubuladuras del ventilador. En la actualidad, se plantea la selección de pacientes a quienes deben aplicarse estas medidas.
Síndrome de distrés respiratorio del adulto
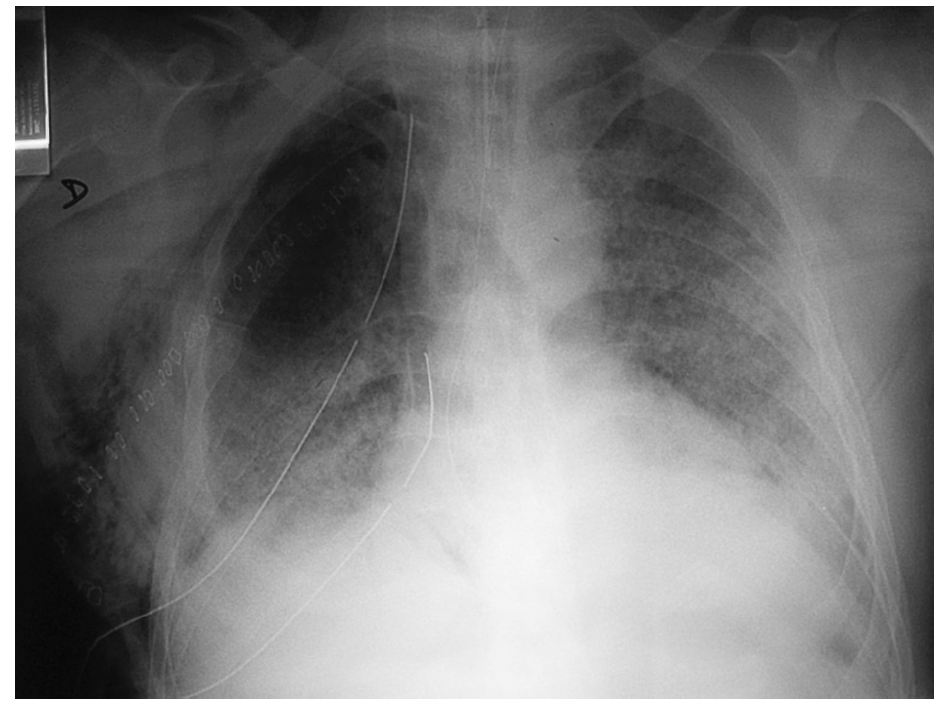
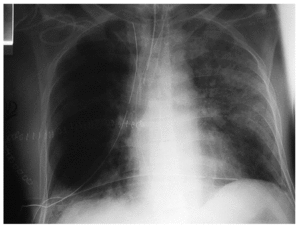
Según la Conferencia de Consenso Americana-Europea de 1994 los criterios clínicos que definen el SDRA son la hipoxemia aguda, PaO2/FiO2 ≤ 200 mmHg (independiente del valor de presión positiva al final de la espiración [PEEP]) e infiltrados pulmonares bilaterales en la radiografía, una vez descartada la neumonía y el fallo ventricular izquierdo (fig. 4). En la LPA el cociente PaO2/FiO2 es ≥ 201-300 mmHg.
Fig. 4. Radiografía de tórax de una ventilación mecánica en el duodécimo día del postoperatorio, patrón alveolar bilateral (SDRA). Derrame pleural izquierdo con atelectasias basales bilaterales. Enfisema subcutáneo por barotrauma.
Entre el 9 y el 50% de los pacientes a los que se ha realizado cirugía de carcinoma de esófago desarrollan SDRA en el postoperatorio7,28. Se considera la complicación respiratoria más grave, con una mortalidad del 50% en relación con disfunción multiorgánica e hipoxemia refractaria7. Durante la esofaguectomía transtorácica, suele realizarse ventilación selectiva de un solo pulmón. El pulmón dependiente recibe todo el volumen tidal y la mayoría de la circulación pulmonar, por lo que está sometido a altos volúmenes que podrían resultar en una lesión pulmonar inducida por el ventilador (liberación de mediadores inflamatorios) y durante la reexpansión el pulmón no dependiente está expuesto a la lesión conocida como isquemia-reperfusión. Estos 2 mecanismos también se han relacionado con el desarrollo de SDRA en el postoperatorio de esta cirugía7,30.
Varios estudios han comparado los resultados de la extubación temprana o tardía después de la esofaguectomía y han demostrado que la ventilación mecánica en el período postoperatorio, se asocia a una mayor incidencia de SDRA1,7,28. La neumonía de cualquier tipo (broncoaspiración, infección pulmonar difusa bacteriana) es la causa más frecuente.
Otras causas que pueden precipitar un SDRA son la sepsis de cualquier origen, la pancreatitis aguda y la politransfusión, a la que cada vez se da más importancia. Se ha demostrado que la realización de transfusiones de hemoderivados durante la intervención quirúrgica se acompaña de una situación de inmunodepresión postoperatoria que se produce en el receptor, conocida como efecto TRIM (TRIM effect: transfusion-related immunomodulation) y que está íntimamente ligado al tiempo de almacenamiento de ésta. Esto podría explicar el incremento del riesgo de las infecciones nosocomiales, incluso cuando se transfunde una mínima cantidad de sangre. Además también se ha asociado a mecanismos no inmunes que producen daño tisular y disfunción orgánica, como es el edema pulmonar asociado a la transfusión de sangre (TRALI: transfusion-related acute lung injury) causante del SDRA, como se ha comentado previamente. Por ello, se tiende a limitar al máximo las necesidades de hemoderivados, y se disminuye el umbral transfusional a hemoglobina de 7,5 g/dl y el tiempo de almacenamiento a menos de 15 días.
En la actualidad, la comunidad científica ya ha aceptado las estrategias ventilatorias de protección pulmonar en el SDRA, mediante la ventilación con volumen tidal bajo (6-8 ml/kg), como único tratamiento de eficacia probada, que disminuye la mortalidad al evitar no sólo la sobredistensión, sino también la apertura y el cierre cíclico del pulmón (cizallamiento), que es uno de los factores fundamentales que influyen en el daño asociado a la ventilación mecánica30.
Complicaciones quirúrgicas
Complicaciones intraoperatorias
Laceración traqueobronquial
En los pacientes con radioterapia neoadyuvante, mediastinitis previa o grandes tumores en la tráquea membranosa posterior, el plano de disección puede estar poco definido, lo que va a dificultar la disección entre el esófago y la tráquea y predisponer a la lesión del árbol respiratorio32,33. En la revisión colectiva de Katariya et al33 sobre las complicaciones de la esofaguectomía transhiatal (ETH), en 1.353 pacientes, hay un 0,68% de ellos con lesión traqueal. También Orringer et al34 encontraron menos del 1% de 800 pacientes intervenidos por cáncer de esófago mediante ETH. En nuestra propia experiencia en más de 200 resecciones de esófago, tanto por vía torácica como transhiatal, no hay ningún caso. Hulscher et al35 no ven diferencias en la incidencia de esta lesión entre los 269 pacientes intervenidos por ETH y los 114 de esofaguectomía transtorácica (ETT). No obstante, recomiendan hacer una selección cuidadosa de los pacientes que se someten a ETH y evitarla en los tumores próximos a la carina. Tampoco ven correlación entre el estadio del tumor y la lesión de la vía aérea.
Para evitarla, hay que prestar atención a la tomografía computarizada (TC) y a la broncoscopia, que deben informar o sugerir sobre la posible infiltración del árbol traqueobronquial y, en consecuencia, sobre la resecabilidad del tumor33.
El diagnóstico suelen hacerlo los cirujanos en el quirófano. Los anestesiólogos van a notar que hay una caída de la saturación de oxígeno y un descenso de volumen inspirado con elevación brusca de la concentración de dióxido de carbono medida por el capnógrafo35,36. En esta situación, es de gran ayuda la colaboración del anestesiólogo que avanza el tubo para situar el neumotaponamiento distal al desgarro. Esta maniobra es útil tanto en la ETH como en la ETT, con la ventaja de que en la primera puede permitir acabar la resección y el tiempo cervical y hacer después la reparación por toracotomía36.
La corrección debe ser lo más temprana posible, en el curso de la propia intervención o con carácter urgente si se diagnostica después. La técnica depende de la localización de la lesión. Las laceraciones próximas a la carina se pueden reparar por toracotomía derecha con sutura directa. Si hay pérdida importante de tejido en la membrana posterior que imposibilite la sutura primaria, será necesario poner un colgajo pediculado de pericardio o pleura32,35. La laceración membranosa de la tráquea alta debe abordarse por incisión cervical, pero en algunos casos es necesaria una esternotomía parcial para la reparación adecuada32,34.
Hemorragia
Las hemorragias masivas pueden ocurrir en muchas de las estructuras anatómicas de los campos quirúrgicos abdominal y torácico33,34,37,38. En el abdomen, la causa más frecuente es la rotura de la cápsula esplénica, que oscila entre el 2,6 y el 8,4%32,33,37. Suele deberse a la tracción del epiplón mayor que está adherido al bazo, o del fondo gástrico durante la ligadura de los vasos gástricos cortos. Para impedirla se debe omitir la tracción excesiva del epiplón y del estómago. En nuestra experiencia, un gesto útil es la sección con el bisturí ultrasónico de las adherencias entre el epiplón y el bazo, si se comprueba que las hay en la exploración rutinaria de la cavidad abdominal. Aunque en la mayoría de los casos esta lesión, de acuerdo con la bibliografía, da lugar a la esplenectomía y a un aumento de la pérdida de sangre y administración de transfusiones estadísticamente significativa37, nuestra experiencia personal muestra que el tratamiento conservador de la lesión (hemostásicos, sutura, etc.) es posible en un gran número de pacientes. Gockel et al37 no encuentran diferencias respecto a la morbilidad peroperatoria ni a las tasas de mortalidad postoperatoria en relación con grupos control. La hemorragia intratorácica puede ser secundaria a la lesión de la aorta, ácigos, de las ramas esófago-aórticas y bronquiales. El riesgo de hemorragia masiva es mayor en la ETH en contraste con la ETT, donde la hemorragia se puede controlar con rapidez. En el primer caso esta contingencia supone hacer una toracotomía urgente33,34.
La hemorragia masiva en el postoperatorio inmediato debe sospecharse si: a) en las 2-3 h siguientes a la intervención, el débito del drenaje es de 100 ml o más a la hora; b) el contenido de hemoglobina en el drenaje aumenta considerablemente, o c) hay cambios de los signos vitales del paciente. La disnea y la cianosis suelen coexistir con hemorragia intratorácica y la distensión del abdomen con sangrado intraabdominal38.
Lesión del nervio laríngeo recurrente
La lesión unilateral o bilateral del nervio laríngeo recurrente, que acarrea una parálisis de las cuerdas vocales, es una complicación bien conocida de la esofaguectomía subtotal que produce ronquera, disfagia, pérdida de peso, broncoaspiración, disnea y neumonía.
En la ETH oscila entre el 3 y el 22%32-34,39. Hulscher et al39 practicaron una laringoscopia indirecta antes y después de la intervención a 140 pacientes con ETH. Ninguno tenía disfunción de las cuerdas vocales antes de la operación y 31 (22%) sí la tenían después. En esta serie, la parálisis de la cuerda vocal se asoció con una morbilidad significativa. En 6 de 28 pacientes con parálisis unilateral y en 2 de 3 con parálisis bilateral fue necesaria la reintubación o hacer una traqueotomía, por fallo respiratorio, comparadas con sólo 4 de 109 cuando la función de las cuerdas vocales estaba íntegra. Otros autores tienen un aumento significativo de neumonías y estancia en la unidad de cuidados intensivos de los pacientes con parálisis recurrencial40.
La mayoría de las lesiones en la ETH ocurre en el lado izquierdo del cuello, que es donde con preferencia se hace la anastomosis40. En la revisión de Gandhi y Naunheim32, en 1.192 pacientes con ETH, la lesión se produjo en el cuello y menos en el tiempo de la movilización del esófago torácico. Orringer et al34 han comprobado que, al evitar el apoyo del retractor metálico en el surco traqueoesofágico, la incidencia ha bajado del 32 al 2% en los últimos años.
Suelen ser temporales y se resuelven espontáneamente en 3 meses33,34 y sólo el 4% presenta una parálisis permanente39. Si la lesión es unilateral puede esperarse a su resolución espontánea con tratamiento logopédico. Si es bilateral, se produce tal estrechamiento de la apertura glótica que muchos pacientes precisan traqueotomía y cirugía correctora40.
Complicaciones tempranas
Dehiscencia de sutura
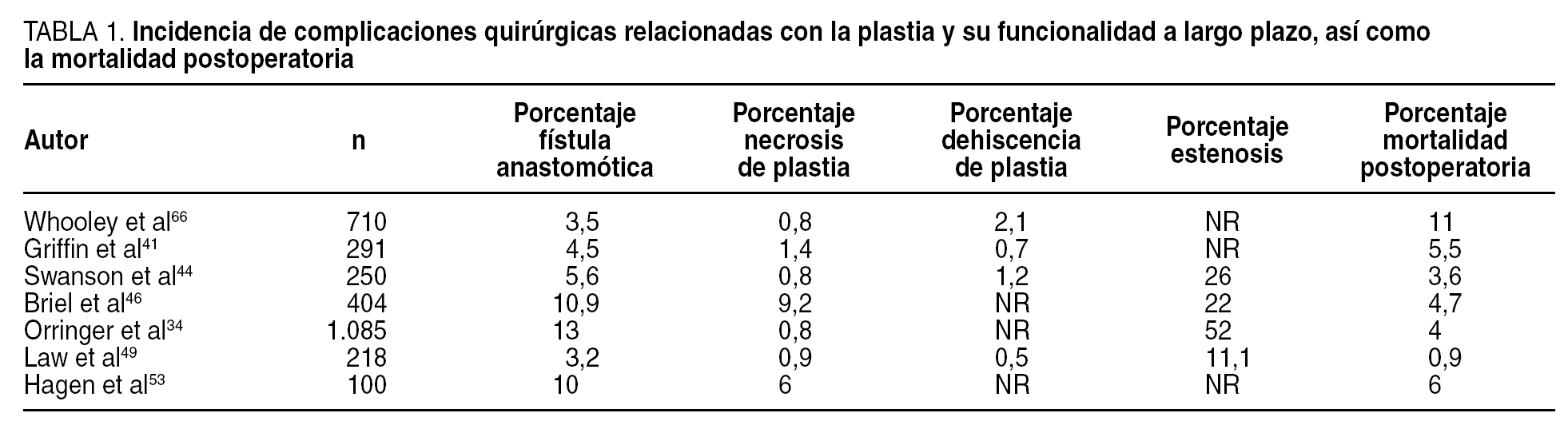
Es la complicación quirúrgica más temible tras la resección esofágica. La mortalidad global tras esofaguectomía ha disminuido en los últimos años, pasando del 10% en la década de los años noventa a menos del 2% en el 2000 en centros altamente especializados3,22,41. Sin embargo, en pacientes con dehiscencia de sutura, la mortalidad está entre el 9 y el 32%1,42,43. En la tabla 1 se recoge una revisión reciente. La dehiscencia puede afectar a la anastomosis o a la plastia. La dehiscencia de sutura en la plastia tiene una incidencia entre el 0,7 y el 2,1% y se asocia con frecuencia a isquemia. Su tratamiento es quirúrgico42,44,45.
Las anastomosis cervicales se fistulizan entre el 5,6 y el 15% de los casos20,44,46, pero la mortalidad asociada a esta complicación es baja debido a la facilidad con que drena la fístula al exterior, aunque en alguna serie la afectación torácica secundaria a la fístula cervical llega al 50%47, en forma de empiema como clínica más frecuente. A pesar de ello, la mortalidad relacionada con fístula anastomótica cervical ronda el 10%46.
La anastomosis cervical, aunque necesita una plastia más larga, quizá tiene algunas ventajas, como conseguir un margen proximal mayor, estar lejos del campo irradiado cuando se hace tratamiento neoadyuvante y, si hay una fístula, suele solucionarse con drenaje local44, ya que en menos del 5% de los casos la fístula cervical no se resuelve con tratamiento conservador20.
Orringer et al20 publican la realización de la anastomosis cervical con endograpadora (EndoGIA II 30-3,5 mm Autosuture), con la que consiguen disminuir las fístulas anastomóticas hasta el 2,6%. Recomiendan no cruzar las líneas de grapado de creación de la plastia con las de realización de la anastomosis. Hay que evitar cualquier traumatismo del estómago durante su ascenso hasta el cuello, abstenerse del uso de drenajes cosidos a la plastia y puntos de fijación a la fascia prevertebral. La creación de un tubo gástrico con la mayor parte posible del estómago, en opinión de algunos autores20, preserva mejor la circulación colateral de la submucosa.
Las dehiscencias de las anastomosis intratorácicas son menos frecuentes (1,2-18%)42,45, pero conllevan una elevada mortalidad, entre el 18 y el 35%1,43,48, debido a la sepsis intratorácica que generan.
En tumores epidermoides de esófago, el grupo de Wong49 ha descrito una técnica para la realización de la anastomosis manual en un plano con monofilamento absorbible 4/0, con unos resultados excelentes, sólo un 3,2% de fístulas y sin mortalidad relacionada con ellas. La anastomosis intratorácica mecánica también puede reforzarse con polipropileno 3/0, al telescopar el estómago sobre el esófago, así el porcentaje de fístulas es del 5,1%48. En otros estudios se comunica un 9% de fístulas anastomóticas, con grandes diferencias (el 13 frente al 3%) dependiendo de si la intervención se realiza en centros de bajo o alto volumen de casos, lo que aboga por la superespecialización50.
Además de la localización de la anastomosis, son factores de riesgo para dehiscencia: el tipo (manual o mecánica)43, el volumen de esofaguectomías anuales realizadas por el cirujano3, y otros factores comunes a cualquier tipo de anastomosis digestivas, como la tensión o la mala vascularización. La aplicación de tratamientos neoadyuvantes o la presencia de comorbilidades favorecen la formación de fístulas46. En muchas ocasiones hay dificultades técnicas intraoperatorias42. También el tipo de plastia influye, y para algunos se fistuliza más el colon, mientras que para otros, el estómago llevado al cuello46.
La presentación clínica cursa con fiebre, leucocitosis, enfisema subcutáneo, aumento del drenaje torácico, drenaje con bilis o aire, neumomediastino en la radiografía simple de tórax, derrame pleural, tos con la deglución o taquiarritmias48. La gravedad del proceso es muy variable, desde la dehiscencia subclínica a la insuficiencia respiratoria, sepsis y fallo multiorgánico. Dado que los estudios complementarios tienen una sensibilidad baja, debe haber un alto índice de sospecha clínica; sin embargo, las comprobaciones rutinarias de las anastomosis son importantes por las graves consecuencias de la fístula48.
La sensibilidad del estudio de contraste hidrosoluble oral es del 61% y tiene riesgo de broncoaspiración, mientras que la endoscopia es segura y visualiza el 100% de los defectos42. La mayoría de las dehiscencias (65%) aparecen entre los días 6 y 10 tras la intervención.
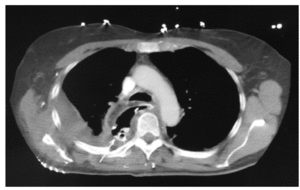
El tratamiento adecuado de las fístulas anastomóticas del esófago es controvertido, en parte por la imposibilidad inicial de diagnosticar la extensión de la fuga y su causa. En general, en ausencia de datos de sepsis, el tratamiento antibiótico de amplio espectro asociado a nutrición parenteral o enteral y un buen drenaje de la fístula48 (en el caso de fístulas cervicales, con el desbridamiento de la herida, y en el caso de fístulas torácicas, mediante drenajes torácicos, bien los tubos de tórax colocados en el momento de la intervención, bien drenando las colecciones pleurales o mediastínicas percutáneamente bajo guía por TC43,45), puede conseguir la curación en un período de tiempo variable, con cierres que desembocan en estenosis posterior con frecuencia. El tratamiento conservador es eficaz en más del 60% de los casos en anastomosis intratorácicas43. En la fig. 5 se puede observar una TC torácica de una paciente con una pequeña fístula anastomótica intratorácica que se trató conservadoramente con buenos resultados.
Fig. 5. Esofaguectomía Ivor-Lewis con fístula anastomótica recogida por el drenaje torácico. Derrame pleural derecho asociado.
En los últimos años se preconiza el uso de prótesis plásticas o metálicas para cubrir el defecto asociado al resto de medidas generales, con lo que se consigue el cierre fistuloso en mucho menos tiempo45. También se ha utilizado la vía endoscópica de reparación de fístulas, con desbridamientos del trayecto y sellado, bien con colas biológicas, clips o mallas51.
En presencia de sepsis, el tratamiento es quirúrgico41,42,45 y se realiza extirpación de los tejidos no viables. Si el defecto es pequeño y no hay gran contaminación mediastínica, puede repararse la anastomosis, o si existe suficiente longitud de plastia viable puede rehacerse. En el caso de no ser esto posible, la única opción es la exclusión bipolar esofágica con reconstrucción en un segundo tiempo. El hecho de no tratar quirúrgicamente la fístula en un paciente muy grave es peor que la agresión quirúrgica de la reintervención.
También se propugna la reintervención en pacientes con buen estado general e inicio temprano de la fístula, teniendo en cuenta que algún fallo técnico es la causa de la complicación52.
La esofaguectomía mínimamente invasiva se compara adecuadamente con la convencional, con un porcentaje de fístulas anastomóticas del 8,1-11,7%18,52, de las cuales el 4,5% eran subclínicas27.
Necrosis de la plastia
La necrosis de la plastia es una complicación muy grave y mortal si no se realiza tempranamente un tratamiento quirúrgico radical. Su incidencia varía entre el 0,8 y el 9,2%20,33,42,44,46,49,53.
Suele deberse a defectos técnicos en la construcción de la plastia, o a mala vascularización de ésta, no detectada durante la intervención quirúrgica. También influye la constricción del estómago a la entrada torácica, la radioterapia previa que afectará al fondo o la existencia de procedimientos quirúrgicos del tipo funduplicatura. Asimismo, las comorbilidades que disminuyen la perfusión y la oxigenación tisular, como la diabetes mellitus, la hipertensión arterial, la arritmia o la obstrucción crónica al flujo aéreo, son factores que influyen en el desarrollo de isquemia de la plastia. El empleo de vasoconstrictores o PEEP en el ventilador también puede favorecer la isquemia46. La anastomosis puede estar intacta20, pero en muchos casos la necrosis afecta al extremo proximal del estómago e implica la anastomosis, aunque en el tránsito superior no se visualiza fuga. La incidencia de necrosis también depende del órgano empleado en la reconstrucción, de manera que el colon presenta necrosis con más frecuencia que el estómago a causa de que su vascularización es más precaria y la técnica quirúrgica, más compleja. En una revisión reciente, la incidencia de necrosis en el sustituto gástrico es del 3,2% y del colon, del 5,1%54. Sin embargo, otros autores presentan unos resultados similares para la plastia gástrica (10,7% de isquemia) o colónica (7,4%)46.
Cuando la isquemia es suficientemente importante, la clínica es de fallo multiorgánico en el postoperatorio temprano, y sin embargo los estudios radiológicos (TC o contraste oral hidrosoluble) pueden no detectar la existencia del problema, por lo que ante la sospecha de necrosis de la plastia está indicada la realización de una endoscopia digestiva alta42. Incluso en el grupo de Briel et al46 se propone el empleo liberal "en la cabecera de la cama" de la endoscopia ante cualquier deterioro clínico, eventualidad o preocupación del cirujano. El aspecto de la isquemia en la endoscopia es variable, desde ulceración sin edema asociado a coloración negruzca de la mucosa o esfacelos verde metalizado que no se despegan de la mucosa con la irrigación.
La isquemia subclínica del sustituto puede cicatrizar sin producir complicaciones anastomóticas ni sépticas, especialmente en los pacientes con interposición colónica, ya que se evita la agresión asociada del jugo gástrico y duodenal en la zona isquémica. Pero si hay necrosis franca, con repercusión clínica, la intervención quirúrgica es obligada49, y en pocas ocasiones es posible resecar el segmento necrosado y reanastomosar. Suele ser norma tener que realizar una exclusión esofágica, con esofagostomía cervical y yeyunostomía o gastrostomía de alimentación. Es importante respetar el mayor segmento posible de esófago cervical para facilitar la cirugía reconstructiva ulterior55.
Quilotórax
La naturaleza del conducto torácico, su calibre amplio y su pared fina con casi ninguna capacidad contráctil, hacen que la mínima laceración conlleve una fístula y un prolongado proceso de reparación. El quilotórax es una complicación poco frecuente, entre el 1 y el 9%33,43,44,49,53,56,57, que se produce incluso con ligadura profiláctica del conducto torácico durante la esofaguectomía58,59, probablemente porque presenta variaciones anatómicas en el 50% de los casos. Tiene una mortalidad no despreciable debido a las alteraciones de los fluidos corporales, nutricionales e inmunológicas que produce, así como insuficiencia respiratoria por derrame masivo y empiema pleural56,58,59.
Se considera más frecuente tras la resección por vía transhiatal60 o por toracoscopia58, aunque existen series toracoscópicas con el 2,7% de incidencia27.
El diagnóstico definitivo lo da la fracción de colesterol/ triglicéridos < 1 con presencia de quilomicrones, aunque la existencia de un drenaje torácico mayor de 500 ml/24 h al tercer día postoperatorio con un recuento de linfocitos superior al 50% debe ser altamente sospechoso.
El tratamiento adecuado es controvertido. Se han comunicado buenos resultados con tratamiento conservador en pacientes con buen estado general y drenaje torácico inferior a 2 l/día. Los principios del tratamiento conservador son reducir el flujo de quilo, drenar la cavidad pleural, prevenir las complicaciones sépticas, aportar nutrición enteral con triglicéridos de cadena media que van directamente al sistema portal o nutrición parenteral. La reducción del flujo quiloso podría favorecerse con somatostatina o etilefrina61.
Si el débito del drenaje es superior o se prolonga en el tiempo, debería realizarse una intervención quirúrgica. Otros autores mantienen durante 12 días el tratamiento médico y si en ese momento el débito diario es superior a 500 ml se reinterviene58. En ese tiempo se permite una mejor cicatrización de la anastomosis. Sin embargo, un parámetro de alarma es un drenaje quiloso superior a 10 ml/kg en el quinto día del postoperatorio, lo que suele ser sinónimo de fallo del tratamiento conservador58. Para localizar el nivel de la fuga se introduce en el ámbito digestivo bien un preparado de nutrición enteral, aceite, bien una mezcla de huevos y leche, aunque sólo es útil si se pretende reparar el conducto, siendo la práctica habitual la ligadura en bloque supradiafragmática ya sea por toracotomía o por toracoscopia43,56,58, ya que además, al pretender buscar la fuga, se moviliza la plastia con el riesgo de provocar una fístula. En los últimos tiempos se han comunicado resultados muy buenos sin mortalidad asociada con tratamiento quirúrgico agresivo en las 48 h posteriores al diagnóstico59 para evitar el deterioro nutricional e inmunológico del paciente con fístula del conducto torácico. Nuestra postura, de valor limitado como casi todas las series personales por la casuística escasa, se orienta hacia la cirugía temprana, sobre todo en presencia de débito elevado, a pesar de tratamiento conservador adecuado y cualquier atisbo de sepsis que inexorablemente propician la muerte del paciente. El tratamiento médico ha tenido éxito en los casos más favorables.
Complicaciones tardías
Estenosis anastomótica
Aunque la estenosis benigna de la anastomosis no es un problema serio y puede solucionarse con dilataciones endoscópicas, cursa con disfagia, lo cual genera importante ansiedad en el paciente, ya que suele ser el mismo síntoma con el que comenzó su enfermedad. La incidencia comunicada es muy variable (3-52%)20,33,46,49,50 y depende de lo que se considere estenosis: si se realizan dilataciones liberales ante cualquier queja de disfagia, el 48% de las anastomosis manuales y el 35% de las mecánicas necesitarán al menos una dilatación en los primeros 3 meses20.
La estenosis anastomótica tardía suele asociarse a la existencia de fístula en el postoperatorio inmediato. Casi el 50% de las fístulas desarrollan posteriormente una estenosis debido a la fibrosis asociada a la cicatrización20. Las anastomosis cervicales, especialmente las manuales, se estenosan con más frecuencia48. Por ello se realizan anastomosis cervicales con endograpadora20,34, pero tienen el problema de requerir un muñón esofágico largo, que no puede conseguirse en algunos tumores del tercio superior. También influye la plastia de sustitución empleada, de manera que el colon y el estómago distal, debido a que se incluye sutura mecánica de la construcción de la plastia en la anastomosis, tienen más tendencia a la estenosis53. Sin embargo, en las anastomosis intratorácicas hay series que muestran más estenosis con el uso de sutura mecánica, hasta el 40%, frente al 9% de las anastomosis manuales53. Otros factores relacionados con la estenosis son la compresión de la plastia en el estrecho torácico superior, la mayor tensión de la anastomosis, las plastias gástricas llevadas al cuello y los pacientes con obesidad, ya que la presencia de más grasa en el mediastino comprime la plastia y aumentan las dificultades técnicas para realizar la anastomosis46.
El tratamiento es la dilatación neumática controlada bajo guía endoscópica/radiológica, y suele ser necesario realizar varias sesiones. Algunos recomiendan iniciar las dilataciones de forma preventiva en todas las anastomosis que han fistulizado una semana tras la cicatrización.
Retraso del vaciamiento de la plastia
Se define como una retención de bario en el estómago por más de 15 min después de la ingesta del contraste, mientras el paciente está de pie. En el caso de la esofagogastroplastia, la denervación vagal daría lugar a la alteración crónica del remanente gástrico y la disfunción del píloro que puede causar retraso del vaciamiento del estómago. Esta vagotomía producirá un amplio abanico de síntomas, tales como: saciedad temprana, plenitud posprandial, pirosis epigástrica, aspiración y neumonía. Aunque se ha señalado que la piloroplastia reduce la incidencia del retraso del vaciamiento del estómago residual, otros autores han demostrado que tanto los pacientes que se han sometido a ETH, como los intervenidos mediante ETT, sin piloroplastia en ambos casos, tenían un vaciamiento acelerado en comparación con los grupos controles62-64. La principal razón para este vaciamiento rápido parece ser la resección del fondo, que representa el reservorio gástrico62. Por otro lado, en el estudio de Velanovich63, realizado en 58 pacientes sin piloroplastia, se produce una tasa de retraso del vaciamiento gástrico similar a la de otros autores, tanto si éstos han practicado o no un procedimiento de drenaje gástrico.
También se ha señalado como causa de mal vaciamiento la angulación excesiva y la compresión de la plastia en el hiato esofágico. Para prevenirlo es conveniente que la plastia no quede muy holgada, evitar rotarla y ampliar generosamente el hiato esofágico.
Dumping precoz
Después de una esofaguectomía seguida de gastroplastia, muchos pacientes se quejan de dumping, cuya incidencia oscila entre el 10 y el 50%. Estos síntomas son tempranos como resultado del desvío de fluidos osmóticos que produce la liberación de neurotransmisores vasoactivos, y síntomas tardíos secundarios a hipoglucemia reactiva. Las principales quejas son diarrea, dolor abdominal, náuseas, sudoración posprandial aturdimiento e hipotensión.
Según Hölscher et al62 y Banki et al65, puede ser provocado por vaciamiento gástrico acelerado. Hölscher et al62 demostraron el vaciamiento acelerado de comida semisólida comparado con un grupo control, pero el vaciamiento del estómago intratorácico estaba muy retrasado en relación con el tránsito por el esófago normal. Banki et al65, en un estudio aleatorizado con 3 grupos de ETH, compararon los resultados de la esofaguectomía con preservación vagal más coloplastia con un grupo control y otro con gastroplastia, ambos con vagotomía troncular y piloroplastia. Los pacientes del grupo con preservación vagal no tenían diarrea y sólo el 7% aquejaban dumping. Sin embargo, en los pacientes con gastroplastia la incidencia de diarrea fue del 50% y la de dumping, del 10%.
Por lo expuesto, queda claro que la conveniencia de hacer una técnica de drenaje gástrico continúa siendo motivo de controversia. En este sentido, Velanovich63 demostró, en 58 pacientes con enfermedad maligna y benigna, que la esofagogastrectomía sin piloroplastia no influye sustancialmente en el retraso del vaciamiento gástrico, evita el dumping y disminuye el reflujo gastroesofágico.
La mejora de los síntomas de dumping suele lograrse con medidas dietéticas, posturales y tratamiento con medicación.
Esofagitis
Se produce por reflujo de secreción gástrica y/o biliopancreática al esófago. Se ha demostrado que, a pesar de la importante disminución de la secreción de ácido, relacionada con la vagotomía troncular, hay persistencia de secreción ácida. Hölscher et al62 encontraron sólo un 30% de reducción de la secreción ácida después de estimulación con pentagastrina. Por otro lado, la mayor parte de sus pacientes tenía reflujo biliar espontáneo en el estómago intratorácico. Los mismos autores han comprobado que un vaciamiento rápido de la plastia gástrica, que presentaron la mayoría de sus pacientes, se correlaciona con la presencia de reflujo duodenogástrico espontáneo. La correlación entre el vaciamiento gástrico rápido y el reflujo duodenogástrico la explican por la denervación pilórica. Esto implica que un píloro insuficiente no previene el reflujo duodenogástrico, lo que para los autores es otro argumento importante para abandonar los procedimientos de drenaje.
Finley et al64 observaron que los pacientes con ETH tenían menos incidencia de reflujo gastroesofágico que los intervenidos con ETT. En consecuencia, el grado de esofagitis será más acusado cuanto más baja sea la anastomosis.
Los síntomas más frecuentes son pirosis y regurgitaciones. Se recomienda el uso de los inhibidores de la bomba de protones de por vida, medidas posturales y protectores de la mucosa, como el sucralfato.
Correspondencia:
Dr. J.J. González-González.
Servicio de Cirugía General. Instituto Universitario de Oncología. Hospital Universitario Central de Asturias.
TrabazEl Escamplero, 24. 33191 Las Regueras.
Asturias. España.
Correo electrónico: jjglezglez@terra.es
Manuscrito recibido el 12-6-2006 y aceptado el 19-7-2006.