Introducción
La morbimortalidad de las resecciones hepáticas ha disminuido mucho en los últimos años gracias a la mejoría de los medios técnicos disponibles, de la técnica quirúrgica y de los cuidados anestésicos y postoperatorios. Esto ha incrementado el número de resecciones que se realizan, ampliándose su indicación a algunos pacientes en los que anteriormente se desestimaba el tratamiento quirúrgico. Sin embargo, la mortalidad, aunque baja, no es desdeñable, y la morbilidad sigue siendo alta. La complicación más temida por los cirujanos y principal causa de muerte en estos pacientes es el fallo hepático. Los estudios actuales se dirigen a la detección de factores clínicos, funcionales y/o volumétricos que solos o en combinación puedan predecir preoperatoriamente en qué pacientes se puede realizar la resección hepática que necesiten con bajo riesgo de disfunción hepática, y reducir así las cifras de morbimortalidad. El control de la hemorragia y la reducción de las transfusiones, factor asociado a mayor morbimortalidad, es otro campo en el que centran actualmente su atención los equipos de cirugía hepática.
Morbilidad
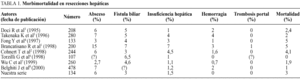
En las últimas series de resecciones hepáticas publicadas, el porcentaje de complicaciones oscila entre el 15 y el 50%, dependiendo que se tengan o no en cuenta algunas complicaciones menores como la infección de herida o el derrame pleural de pequeña cuantía, y que incluyan o no resecciones en cirróticos1-8. Múltiples factores han sido asociados a un mayor riesgo de morbilidad, coincidiendo la mayoría de autores en la transfusión, el tamaño de la resección, la ictericia previa, la cirrosis, la esteatosis y el ASA (American Society of Anesthesiologists Physical Status Score) mayor de uno, como los más determinantes1,3-5,7. Sobre la transfusión y los motivos por los que causa mayor morbilidad, así como de las resecciones en cirróticos hablaremos más adelante. El tamaño de la resección es un factor determinante de morbilidad no sólo en enfermos con reserva funcional hepática limitada, donde cobra mayor protagonismo que otros factores, sino también en pacientes con hígado "sano". Doci et al encuentran en un análisis multivariante de 208 resecciones por metástasis colorrectales que el tamaño de la resección es una variable independiente asociada al riesgo de complicaciones3. Resultados similares obtienen Belghiti et al en resecciones por múltiples etiologías respecto a la extensión de la resección, encontrando también como factores independientes el ASA y la presencia de esteatosis8. El ASA mayor de uno, como indicador de otras enfermedades asociadas, ha sido relacionado con mayor morbilidad por otros autores, sobre todo en enfermos de edad avanzada como veremos con más detalle en el apartado de complicaciones generales4,7. La presencia de esteatosis reduce la tolerancia del hígado remanente a la isquemia, lo que puede condicionar mayor número de complicaciones, no esperadas, en resecciones mayores sobre hígados no cirróticos, como demuestran en un estudio reciente Behrns et al, en el que un 14% de enfermos con esteatosis superior al 30% presentaron insuficiencia hepática posresección frente a un 9% en pacientes con menos del 30% de esteatosis y un 4% en el grupo sin esteatosis9. Respecto a la ictericia, refiriéndonos a la ictericia obstructiva y no a la motivada por insuficiencia hepática, ha sido asociada con menor tolerancia del hígado colestásico a la isquemia, mayor riesgo de sangrado, menor capacidad de regeneración hepática y desnutrición10-12. Esto, sumado a la mayor dificultad técnica de la resección y la necesidad de realizar una anastomosis biliodigestiva, hace que la morbimortalidad en resecciones por colangiocarcinomas sea superior a la de otras12. Frente a los autores que defienden el drenaje biliar preoperatorio sistemático mediante punción percutánea para evitar los efectos adversos de la ictericia mencionados10, otros autores, con el fin de evitar el riesgo de colangitis, fístula biliar o sangrado por la punción, proponen la resección y drenaje quirúrgico precoz, reservando el drenaje preoperatorio sólo para casos con desnutrición grave, colangitis o ictericia de larga evolución, y en los que se vaya a retrasar la intervención11,13. Cherqui et al11, en un estudio reciente, comparan los resultados de resecciones por colangiocarcinoma sin drenaje biliar previo frente a resecciones por otras causas en enfermos no ictéricos, no encontrando diferencias de insuficiencia hepática, mortalidad ni capacidad de regeneración hepática postoperatoria (medida esta última por los valores de gamma-glutamiltransferasa y fosfatasa alcalina), aunque sí en la transfusión, que asocian a la mayor dificultad técnica en los tumores de vía biliar, y concluyen que, a la vista de estos resultados, no es necesario someter a todos los enfermos al drenaje percutáneo y sus riesgos. Esta forma de actuación es actualmente posible gracias al empleo de la colangiorresonancia para el diagnóstico preciso de la extensión de los colangiocarcinomas. Otros factores intraoperatorios y postoperatorios precoces como la duración de la isquemia o la duración de la intervención que han sido asociados a mayor morbilidad, son actualmente poco considerados por no permitir predecir preoperatoriamente en qué pacientes está contraindicada la resección o ésta debe ser limitada2. Como veremos al hablar de las complicaciones generales, la edad no es un factor que se asocie por sí solo a mayor morbimortalidad.
Las complicaciones derivadas de las resecciones hepáticas las podemos dividir en complicaciones derivadas de la propia cirugía o complicacionas generales.
Complicaciones derivadas de la propia cirugía
Entre estas últimas se encuentran el absceso intraabdominal, la fístula biliar, la hemorragia, la insuficiencia hepática y mucho menos frecuente (0-1%) aunque posible, la trombosis portal1,14. La frecuencia de las mismas no parece verse influida por la enfermedad que motivó la resección, salvo cuando se trata de resección de hepatocarcinomas en cirróticos sin una estricta selección de los enfermos o, como ya hemos mencionado, colangiocarcinomas hiliares.
Absceso intraabdominal. Aunque sigue siendo la complicación más frecuente en la mayoría de series (tabla 1), ha disminuido mucho en la actualidad, presentándose generalmente en menos del 10% de los pacientes, frente a un 20% de épocas previas1-8. La cavidad residual amplia tras la hepatectomía, la colección de sangre o bilis, la contaminación de tejido hepático desvitalizado y la infección ascendente a través del drenaje son factores que se han implicado en la formación de los abscesos. Belghiti et al aleatorizaron a 81 pacientes con resecciones menores en dos grupos con drenaje y sin drenaje, encontrando mayor número de colecciones infectadas en el grupo con drenaje (14%) que sin drenaje (4%), aunque esta diferencia no era estadísticamente significativa15. Fong et al, en un estudio similar pero con un 73% de resecciones mayores, obtienen los mismos resultados en cuanto a colecciones infectadas (la diferencia tampoco fue estadísticamente significativa) y similar morbimortalidad en los dos grupos, concluyendo que el uso de drenaje no está indicado en las resecciones hepáticas16. Apoyan su conclusión en la posibilidad actual del drenaje percutáneo de las pocas fístulas biliares y colecciones que presentan estos pacientes, y la rareza del sangrado postoperatorio, no justificando estos pocos casos de hemorragia el uso generalizado de drenajes (que según sus resultados facilitan la infección ascendente de las colecciones). Sí son partidarios del uso de drenajes cuando realizan alguna anastomosis biliodigestiva. En nuestra opinión el uso sistemático de drenajes no está justificado, debiéndose reservar para casos con resecciones mayores que, por el motivo que fuera, pensemos que tienen mayor riesgo de sangrado postoperatorio, o cuando hagamos alguna anastomosis biliodigestiva.
El uso de antibióticos profilácticos, la hemostasia cuidadosa y el control de las fugas biliares en la superficie de sección hepática probablemente son responsables de la menor frecuencia actual de esta complicación. Ante un paciente con fiebre y leucocitosis, la ecografía o la tomografía computarizada (TC) nos confirmarán el diagnóstico y permitirán el tratamiento mediante punción percutánea, además del diagnóstico diferencial con un bilioma. El tratamiento antibiótico empírico, hasta recibir el cultivo de la muestra, será necesario. Actualmente es muy raro que esta complicación condicione la reintervención o el fallecimiento del enfermo.
Fístula biliar. Es la segunda complicación más frecuente. Se presenta entre un 3 y un 7% de los casos1-8,14, generalmente es autolimitada y suele proceder de algún canalículo biliar de la superficie de sección hepática, siendo suficiente en estos casos con mantener el drenaje hasta que deje de producir. Esto puede tardar en ocasiones varias semanas, pero no debe preocuparnos si el débito va disminuyendo. Cuando el débito es alto (> 300 ml/24 h) y no disminuye, se debe sospechar algún problema obstructivo distal a la fístula o una lesión de la vía biliar principal3. La colangiorresonancia ha sustituido en los últimos años al HIDA como prueba diagnóstica no invasiva para la localización de la fístula y la posible estenosis distal. En estas situaciones, una colangiografía percutánea o endoscópica retrógrada nos permitirán también el diagnóstico y, cuando se considere necesario, la colocación de un catéter externo o la realización de un esfinterotomía que disminuya la presión de la vía biliar, favoreciendo el cierre de la fístula. Salvo en estos casos con débito alto que no cede, no somos partidarios de la realización de esfinterotomías endoscópicas para favorecer el drenaje de la vía biliar, puesto que casi todas las fístulas acaban cerrándose con tratamiento conservador, evitando las posibles complicaciones, a veces graves, de la esfinterotomía17. En los últimos años han surgido otras posibilidades de descompresión de la vía biliar por vía endoscópica, que tampoco creemos que se deban usar sistemáticamente, como son la colocación de un stent transitorio en la papila que se retira cuando se ha cerrado la fístula18 o la esfinterotomía asociada a un tubo nasogástrico con su extremo distal introducido en colédoco a través de la papila, donde se deja hasta el cierre de la fístula, de manera que podemos medir diariamente la bilis eliminada y realizar colangiografías de control sin necesidad de nuevas endoscopias19. Gracias al abanico de posibilidades diagnósticas y terapéuticas poco invasivas que existe actualmente, en raras ocasiones es necesaria la reintervención por fístula biliar.
Hemorragia. En el postoperatorio es una complicación poco frecuente (0-4%), pero generalmente grave, que comporta reintervenciones y morbimortalidad asociada1-8,14. En una serie publicada por Blumgart et al4 la hemorragia se presentó sólo en un paciente, pero este paciente falleció como consecuencia de la misma. En la serie de 244 resecciones de Cohnert et al2 la hemorragia sólo fue responsable del 10% de los fallecimientos, pero de 4 pacientes que presentaron esta complicación, uno (25%) falleció.
La hemorragia intraoperatoria es cuantificada por los autores en función del volumen de transfusión sanguínea, que varía mucho de unas series a otras (entre 300 y 1.800 cm3)1-5. Varios autores han encontrado una asociación estadísticamente significativa entre el volumen transfundido y el riesgo de morbimortalidad postoperatoria1,3,5,16,20. La hemorragia, además de ser un signo indirecto de la existencia de factores negativos (peor situación basal del enfermo, mayor dificultad técnica por el tamaño o la posición del tumor, etc.), aumenta por sí misma el riesgo de complicaciones por causar coagulopatía, hipotermia, trastornos hemodinámicos, etc. Se ha demostrado que la transfusión causa depresión del sistema inmune por varios mecanismos: aumenta la actividad de linfocitos T supresores, disminuye la actividad de células natural killer, aumenta los valores de alfa-2-macroglobulina (que causa supresión linfocitaria) y aumenta la PGE2 (que a su vez activa los linfocitos T supresores e inhibe la producción de IL-2)21. Algunos autores han encontrado también asociación entre la transfusión de sangre y la recidiva más precoz del tumor resecado22. Todo esto hace que el control de la hemorragia y la reducción de las transfusiones haya cobrado gran interés en los últimos años.
Es labor del cirujano minimizar las pérdidas hemáticas durante la intervención mediante un estricto conocimiento de la anatomía vascular del hígado, de las técnicas de hepatectomía y de las técnicas de control vascular durante la misma. Deberá seleccionar, en función de las características del tumor, del paciente y de sus preferencias, entre una hepatectomía con sección vascular primaria, con sección parenquimatosa primaria o la combinación de ambas; modo de sección parenquimatosa con pinzas, electrobisturí, y/o bisturí de ultrasonidos, y el tipo de pinzamiento o control vascular que va a realizar en caso necesario (maniobra de Pringle, clampaje selectivo o exclusión vascular total [EVT] del hígado con o sin circulación extracorpórea, respetando o no el flujo de la vena cava inferior [VCI])23. La mayoría de resecciones hepáticas se pueden realizar con un control vascular selectivo mediante ligadura de la tríada portal correspondiente o la maniobra de Pringle, y ligadura de la vena suprahepática (VSH) correspondiente, bien extrahepática antes de la sección parenquimatosa o bien intrahepática al final de ésta. Aunque fue en 1908 cuando Pringle describió la maniobra de pinzamiento de la tríada portal para el control de la hemorragia en traumatismos hepáticos, hasta la década de los sesenta no se publicaron los primeros resultados del empleo de esta maniobra para resecciones hepáticas programadas en pacientes normotérmicos. Desde entonces, son numerosos los estudios que demuestran la tolerancia del hígado a la isquemia normotérmica. Man et al24, en un estudio prospectivo y aleatorizado reciente, en el que comparan grupos homogéneos en cuanto a función hepática y diagnóstico preoperatorio, demuestran no sólo la buena tolerancia a la isquemia sino menor sangrado total y por área de transección, así como una mejor función hepática postoperatoria en el grupo que recibió maniobra de Pringle intermitente (períodos de 20 min de Pringle alternando con 5 min sin pinzamiento) frente al grupo sin control vascular. Achacan este resultado al menor desequilibrio hemodinámico inducido por el sangrado. La limitación evidente de la maniobra de Pringle es que no controla la hemorragia procedente de las VSH y VCI, evitado con las técnicas de exclusión vascular. El conocimiento de la tolerancia del hígado a tiempos relativamente prolongados de isquemia y la mejoría en la técnica de disección y aislamiento de la vascularización hepática, favorecido por la práctica de trasplantes hepáticos, motivaron el desarrollo de técnicas de exclusión vascular total entre algunos equipos de cirugía hepática. La EVT consiste en el pinzamiento de la tríada portal, VCI infrahepática y VCI suprahepática, por este orden, para evitar la congestión hepática. El pinzamiento se puede mantener con seguridad para el paciente, en casos con función hepática normal, hasta 1 h25,26. Su principal desventaja son las alteraciones hemodinámicas por disminución del retorno venoso al pinzar y el aumento brusco del mismo al despinzar, que hace que los pacientes cardiópatas o cirróticos no toleren bien esta técnica. Para resolver este problema existe la posibilidad de realizar previamente un bypass venovenoso extracorpóreo que mantenga el retorno venoso y con ello el volumen minuto cardíaco y la presión arterial. En los cirróticos, además, hay que tener en cuenta la menor tolerancia a la isquemia, por lo que la mayoría de autores recomiendan reservar en cirróticos la EVT para resecciones menores en casos seleccionados25,26. También se ha propuesto el pinzamiento aórtico supracelíaco asociado a la EVT para el control de la circulación colateral hacia el hígado en cirróticos, evitar la congestión del territorio esplácnico y mesentérico y mantener la presión arterial. Sin embargo, todavía existe mucha controversia sobre esta técnica que puede causar isquemia medular, trombosis de territorios distales y arritmias ventriculares y no parece apropiado su empleo a la vista, en términos generales, de la buena tolerancia hemodinámica de la EVT25,26. Otro efecto adverso de la EVT son las alteraciones electrolíticas y del equilibrio ácido-base causadas por la liberación de radicales libres y mediadores de la respuesta inflamatoria, acumulados en la sangre estancada en el hígado, que pasan bruscamente a la circulación al liberar el pinzamiento. Frente a estos inconvenientes, la EVT disminuye el sangrado y la necesidad de transfusión con morbilidad, en las series publicadas, entre el 27 y el 50% y mortalidad inferior al 5%, aunque con mayor porcentaje de complicaciones pulmonares25,26. Como mencionamos anteriormente, la mayoría de resecciones hepáticas se pueden realizar con control vascular selectivo con o sin maniobra de Pringle, por lo que, en general, sólo se acepta la EVT en tumores muy grandes o próximos al hilio hepático, VCI o VSH.
En los últimos años se ha demostrado que la presión venosa central (PVC) durante la resección influye en el volumen de sangrado. Johnson et al encuentran correlación estadísticamente significativa entre el valor de la PVC y la hemorragia (a mayor PVC, mayor hemorragia) y recomiendan el mantenimiento de PVC baja durante la sección del parénquima21. Basados en estos hallazgos algunos autores administran relajantes musculares o nitroglicerina durante esa fase de la intervención25.
Nosotros, en hepatectomías mayores (lobectomías o trisegmentectomías), preferimos realizar una sección vascular primaria de la rama arterial y portal correspondiente, seguido de la sección parenquimatosa y la ligadura intraparenquimatosa de la vena suprahepática correspondiente (o extraparenquimatosa de la derecha cuando es posible sin grandes riesgos). En resecciones menores (resecciones atípicas o segmentectomías) realizamos una sección parenquimatosa primaria con ligadura de los elementos vasculares según los vamos encontrando en el espesor del parénquima que seccionamos. Siempre precedemos estas maniobras de un control del pedículo hepático, de manera que podamos realizar una maniobra de Pringle, en caso necesario, sin pérdida de tiempo. En cirróticos, en los que hacemos resecciones generalmente limitadas, seguimos el mismo procedimiento. En nuestra experiencia, se puede realizar con seguridad cualquier tipo de resección hepática sin necesidad de una exclusión vascular total.
Pese a todas las medidas mencionadas, sigue siendo necesaria la transfusión en un porcentaje no despreciable de casos. Para evitar los riesgos de ésta podemos recurrir a la autotransfusión o la hemodilución normovolémica, que pueden evitar la transfusión de sangre homóloga en pacientes con sangrados de poca cuantía20,22,23. Johnson et al20 en un estudio sobre la utilidad de la hemodilución normovolémica, encontraron, sin diferencias en edad, patología, tiempo quirúrgico ni volumen de sangrado, que en el grupo en el que se usó esta técnica se redujo en un 60% la media de sangre homóloga transfundida (0,8 frente a 2,2 unidades), y que el porcentaje de enfermos que recibieron sangre homóloga en este grupo fue muy inferior (38 frente a 77%). Son contraindicaciones para la autotransfusión y la hemodilución normovolémica la anemia, la insuficiencia cardíaca, la insuficiencia coronaria y la insuficiencia hepática avanzada.
Insuficiencia hepática. Es la complicación más importante por ser responsable de la mayoría de muertes en estos pacientes y porque su incidencia se podría reducir si dispusiéramos de un método exacto de medición de la reserva funcional hepática. Su frecuencia en las últimas series oscila entre el 1 y el 7%, siendo cercana al 1% en las series más recientes1-8. Origina una mortalidad del 0,7-2,5% y es responsable del 33 al 60% de muertes en estos pacientes. La insuficiencia hepática postoperatoria puede ser consecuencia de un tejido hepático remanente escaso, de isquemia prolongada por las maniobras de control vascular durante la intervención o de una combinación de ambas4. La cantidad de tejido hepático remanente necesario para mantener una función hepática suficiente dependerá del estado en el que se encuentre el hígado, es decir, la cantidad de hepatocitos sanos por cm3 de hígado, y de su capacidad de regeneración. En pacientes con hígado sano la insuficiencia puede ser transitoria, recuperándose una función hepática normal gracias a la capacidad de regeneración hepatocitaria. Es importante saber que en un hígado no cirrótico se pueden hacer resecciones del 75% del parénquima hepático sin riesgo para la supervivencia. Sin embargo, hay que tener en cuenta ciertas situaciones en las que, aunque el hígado no sea cirrótico, la función hepática puede estar comprometida, como sucede cuando hay esteatosis o quimioterapia o embolización previas. Ya hemos mencionado el trabajo de Behrns et al sobre el mayor riesgo de insuficiencia hepática cuanto mayor es el porcentaje de esteatosis 9. La quimioterapia o embolización previas a la resección también pueden favorecer la insuficiencia hepática en el postoperatorio, por lo que no se debe intervenir a un paciente hasta, por lo menos, 3 semanas después del último ciclo de quimioterapia. En los cirróticos, al tener una reserva funcional más limitada y ser muy escasa la capacidad de regeneración, es una complicación más frecuente cuando no se seleccionan adecuadamente los pacientes, como demuestra una serie de resecciones por hepatocarcinoma publicada en 1990 por Choi et al 27, en la que un 15,9% de cirróticos desarrollaron fallo hepático, frente al 1,8% en no cirróticos. El estudio preoperatorio más detallado de los pacientes cirróticos, así como la existencia de otras opciones terapéuticas para el tratamiento de los hepatocarcinomas (quimioembolización, alcoholización o trasplante hepático), nos permite actualmente una mejor selección de los candidatos a resección, habiendo disminuido la incidencia de fallo hepático postoperatorio en los cirróticos y obteniéndose cifras similares a las de los no cirróticos5,6,28.
Por lo tanto, para disminuir el riesgo de fallo hepático postoperatorio tendremos que saber individualmente en cada paciente si el hígado remanente tras la resección podrá mantener la función hepática, lo cual va a depender de la reserva funcional hepática preoperatoria y de la amplitud de la resección. Respecto a al amplitud de la resección habrá que tener en cuenta la cantidad de tejido hepático sano incluido en la pieza de resección junto al tumor. Aunque hagamos una resección del 50% del volumen total del hígado, si el tumor ocupa el 80% de la pieza de resección, sólo habremos resecado menos del 20% del volumen funcional total de ese hígado. En los casos de resecciones en pacientes sin hepatopatía conocida, una valoración de la función hepática con los valores analíticos habituales (bilirrubina, estudio de coagulación y albúmina sérica) puede ser suficiente. En los pacientes cirróticos el estadio de Child sigue siendo útil, estando contraindicada la cirugía en aquellos con estadio C. En los demás pacientes (cirróticos estadio A o B, hepatopatía crónica, esteatosis y quimioterapia o embolización previa) es conveniente realizar un estudio de la reserva funcional hepática para saber, con ciertas garantías, la cantidad de parénquima hepático que podemos resecar preservando una función hepática suficiente. Existen numerosas pruebas para valorar la reserva funcional hepática: eliminación de verde de indocianina, bromosulfotaleína, galactosa o aminopirina; tolerancia a una sobrecarga de glucosa; medición arterial de la relación acetoacetato/beta-hidroxibutirato o gammagrafía con albúmina humana marcada23,29,30. Nosotros preferimos usar el test de eliminación de verde de indocianina, que consiste en la inyección venosa de 0,5 mg/kg del colorante en un brazo y su medición en sangre del otro brazo a intervalos concretos de tiempo, de manera que podamos analizar su farmacocinética. La retención de más del 10-15% de la dosis a los 15 min refleja una función hepática alterada, más cuanto mayor sea el porcentaje retenido. En la tabla 2 se detallan los resultados de este test en 34 pacientes intervenidos recientemente en nuestro servicio. Se puede observar cómo la clasificación de Child no permite establecer diferencias de reserva funcional hepática entre los estadios A y B. En estos estadios no existe correlación entre la clasificación de Child y la reserva funcional hepática medida con el test de verde de indocianina. Sí en el estadio C. Por lo tanto, en los estadios A y B, esta clasificación no permite establecer qué pacientes tolerarán la resección y cuáles no, y será necesario seleccionar a los pacientes en función de su reserva funcional hepática. En 1986 Makuuchi et al establecieron un algoritmo de selección de pacientes cirróticos para resección quirúrgica de hepatocarcinomas que hoy todavía usan, habiendo publicado recientemente los resultados a largo plazo utilizando este algoritmo6. Como primer criterio de selección usan la ascitis, descartando la cirugía en los que la tengan. El segundo criterio es la bilirrubina, no interviniendo a los que tienen 2 o más mg/dl y realizando sólo enucleación a los que tienen entre 1,6 y 1,9 mg/dl o resección limitada cuando la bilirrubina es de 1,1 a 1,5 mg/dl. En los pacientes con bilirrubina normal, candidatos a cirugía, emplean el test de verde de indocianina para decidir qué tipo de resección puede tolerar el enfermo. Cuando la retención a los 15 min es inferior al 10%, el paciente tolerará una hepatectomía derecha, una hepatectomía derecha ampliada o una trisegmentectomía izquierda. Si la retención es del 10-19% tolerará una hepatectomía izquierda o una sectorectomía, si es del 20-29% una segmentectomía, si retiene el 30-39% una resección limitada y tolerará sólo una enucleación si retiene más del 39%. En los pacientes con retenciones inferiores al 10% con un volumen de hígado remanente esperado, medido con TC, inferior al 40% y en los que tienen retenciones del 10-20%, realizan una embolización portal preoperatoria para hipertrofiar el futuro hígado remanente. Utilizando este algoritmo, Makuuchi et al publican una serie de 107 resecciones sin mortalidad y con morbilidad del 29,7%. Estos mismos autores, en un análisis multivariante comparando con resecciones en no cirróticos, sólo encontraron diferencias significativas en el sangrado en resecciones limitadas (atípicas), que era superior en cirróticos. No encontraron diferencias de morbilidad, ni ésta se asoció con los valores de bilirrubina, protrombina, retención de verde de indocianina, etc. El único factor asociado con mayor morbilidad fueron las resecciones limitadas, lo que hace pensar que en los pacientes con retenciones superiores al 29% tampoco estarían indicadas las resecciones limitadas. Hsia et al, comparando resecciones en cirróticos con retención menor de 10% con resecciones (segmentectomías o menos) en cirróticos con retención superior al 20%, tampoco encuentran diferencias de morbimortalidad ni transfusión sanguínea28. Estos dos estudios, entre otros, confirman que el verde de indocianina es un buen test para seleccionar qué pacientes cirróticos (o con disfunción hepática por el motivo que fuera) pueden tolerar una resección hepática y la amplitud de ésta.
Las pruebas de imagen permiten actualmente calcular el volumen de tejido hepático que vamos a resecar y el que vamos a preservar, lo cual, en combinación con los tests funcionales, nos permite una valoración bastante aproximada de la función hepática posresección de cada paciente6,31. En los últimos años algunos autores han publicado modelos o fórmulas matemáticas para predecir el riesgo de fallo hepático tras la resección, basados en la combinación de parámetros clínicos, funcionales y volumétricos32. Cohnert et al2 proponen el índice de resección hepática (LRI): (test de C-aminopirina [%] * 100]/[PHRR * edad * [volumen tumoral/volumen hepático]), donde PHRR es la tasa de resección de parénquima hepático que calculan mediante la fórmula:
[volumen resecado volumen tumoral]
[volumen hepático volumen tumoral]
En su serie de 244 resecciones esta fórmula predice las complicaciones letales con una sensibilidad del 75% y una especificidad del 83%. Es probable que en pocos años la combinación de modernas técnicas de imagen y tests funcionales más precisos permitan una valoración muy exacta de la cantidad de parénquima que podemos resecar a un paciente, sin riesgo de disfunción hepática.
Los resultados de nuestra experiencia reciente en relación con morbilidad en resecciones hepáticas por metástasis de carcinoma colorrectal y hepatocarcinoma (pendientes de publicación) coinciden con los publicados por otros autores (tabla 1). De 134 pacientes intervenidos, el 14,9% presentó complicaciones hepáticas, siendo el absceso la más frecuente (6%), seguido de fístula biliar (3%) y fallo hepático (1,5%). Seis enfermos (4,5%) presentaron disfunción hepática leve transitoria. Ninguno presentó hemorragia postoperatoria.
Complicaciones generales
En cuanto a las complicaciones generales, las más frecuentes en estos pacientes son: derrame pleural (5-24%, según se consideren todos o sólo los de mayor volumen), neumonía (0,5-5%), infarto agudo de miocardio (0,5-1,5%), sepsis (1-6%), insuficiencia renal (0-1%) y tromboembolismo pulmonar (0,75-1%)1-5. En nuestros pacientes también fue el derrame pleural (5,9%) más frecuente que la sepsis (0,7%) y la insuficiencia renal (1,5%). Aunque algunas de estas complicaciones se relacionan con la enfermedad de base del enfermo, más frecuente en edades avanzadas, es interesante señalar que Blumgart et al4, tras el análisis de 133 resecciones hepáticas en mayores de 65 años, concluyen que no existen diferencias de morbimortalidad respecto a pacientes más jóvenes y que, como en éstos, la ictericia, el electrocardiograma anormal o un ASA alto son factores que deberían usarse para seleccionar a los pacientes, no debiendo ser la edad un factor que contraindique por sí solo la intervención. Wu et al7, en un estudio comparando la resección de hepatocarcinomas en 21 pacientes mayores de 80 años con ASA I o II (81% cirróticos, 76% A de Child), con 239 enfermos jóvenes (77% cirróticos, 81% A de Child), tampoco encontraron diferencias de morbimortalidad pese a que el primer grupo tenía más enfermedades extrahepáticas y peor reserva funcional hepática. Según estos autores la edad tampoco debe ser una contraindicación para la resección hepática en cirróticos, pero existen cuatro factores que se deben tener en cuenta cuando se valora una hepatectomía en un paciente mayor y sobre todo si es cirrótico:
1. La resección debe ser limitada y sólo se realizará una resección mayor cuando exista un tumor grande y la retención de verde de indocianina a los 15 min sea inferior al 10%.
2. Las personas mayores no toleran la pérdida de sangre o transfusión masiva. En ellos la maniobra de Pringle intermitente puede ser útil en este sentido.
3. La función cardiopulmonar, renal y metabólica debe ser bien evaluada.
4. Necesitan una recuperación postoperatoria más prolongada en la que se debe vigilar atentamente la aparición de complicaciones cardiopulmonares.
Mortalidad
La mortalidad en las series que hemos revisado fue de 0-5%1-8, siendo mayor (7%) en una serie que analizaba las resecciones mayores por separado4. Cohnert et al2 tienen mayor mortalidad entre los pacientes intervenidos por tumor primario (6,1%) que por metástasis (3,9%). Las causas de fallecimiento fueron: fallo hepático (40-60%), hemorragia (10-20%), sepsis (20-45%), IAM (20%) y neumonía (20%). Entre nuestros pacientes hubo 4 muertes postoperatorias (3%), cuya causa fue: insuficiencia hepática en dos, distrés respiratorio del adulto y sepsis.
En resumen, los medios técnicos y la mayor experiencia de los equipos quirúrgicos permiten actualmente resecciones hepáticas amplias con baja mortalidad y menor morbilidad, aunque todavía elevada. Es necesario que todo cirujano que vaya a realizar una hepatectomía esté familiarizado con la anatomía vascular del hígado y las técnicas de hepatectomía y control vascular. El desarrollo de tests de reserva funcional y métodos volumétricos que puedan predecir con exactitud la aparición de fallo hepático podrá disminuir más aún la morbimortalidad en el futuro.
Correspondencia: Dr. C. Loinaz Segurola. Servicio de Cirugía Digestivo II, 4.a planta. Hospital 12 de Octubre. Ctra. de Andalucía, Km 5,4. 28041 Madrid.