Introducción
El adenocarcinoma de páncreas, que constituye más del 90% de los tumores pancreáticos, es una lesión de una extraordinaria agresividad, que presenta una incidencia progresiva en las sociedades occidentales1. En menos del 10% de los casos el tumor permanece confinado en el páncreas en el momento del diagnóstico, presentando el 40% una enfermedad localmente avanzada y el 50% extensión a distancia1. Más del 95% de los pacientes morirán como consecuencia de la enfermedad, la mayoría dentro del primer año1.
La resección sigue siendo la única alternativa válida para lograr la curación en el cáncer de páncreas, puesto que la quimioterapia y la radioterapia han demostrado un efecto beneficioso marginal y la inmunoterapia y la terapia génica constituyen sólo una esperanza1. Sin embargo, únicamente un 20-25% de los pacientes presentan lesiones potencialmente resecables1, resecabilidad que se reduce a un 5-10% en las lesiones de cuerpo y cola, asiento del 25-30% de los tumores pancreáticos2.
La duodenopancreatectomía cefálica es, desde su descripción por Kausch3, en 1912, y su posterior popularización por Whipple4, el procedimiento quirúrgico de elección para tratar los tumores resecables de la cabeza pancreática, a pesar de su complejidad y gran exigencia técnica. Desde su introducción, la duodenopancreatectomía cefálica ha sido objeto de dos tipos de modificaciones, unas orientadas a eliminar sus efectos indeseables, y otras a mejorar su valor terapéutico. El primer tipo de modificaciones tiene como objetivo limitar las secuelas de la gastrectomía, mediante la duodenopancreatectomía con preservación pilórica, en la que no se lleva a cabo resección gástrica5,6. El segundo tipo de modificaciones tiene como objetivo mejorar su eficacia como intervención oncológica, mediante la extensión de la resección: pancreatectomía total, pancreatectomía regional y linfadenectomía extensa7,8. A pesar de ello la duodenopancreatectomía ha mantenido durante largos años una reputación de procedimiento de alto riesgo, elevada morbilidad y baja rentabilidad terapéutica, de tal forma que algunos autores9,10 llegaron a considerar que la cirugía, en el cáncer de páncreas, debía tener una finalidad exclusivamente paliativa.
Mortalidad
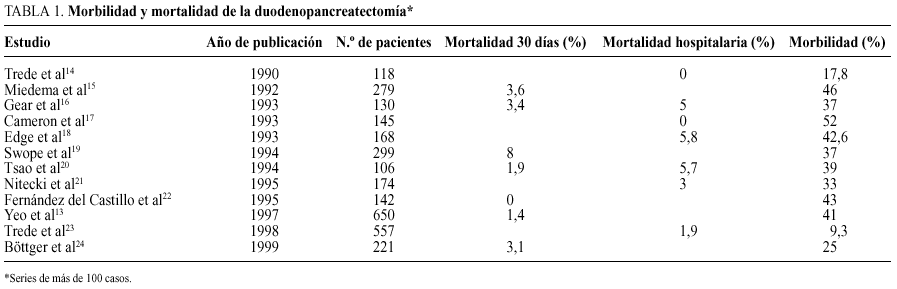
En la última década se ha producido un significativo descenso de la mortalidad operatoria de la duodenopancreatectomía cefálica. Craighead y Lien11, en 1958, observaban una mortalidad del 51 y del 61% en la pancreatectomía total. Gudjonsson12, en 1987, en una revisión de la bibliografía de 1980-1987, hallaba una mortalidad del 16%. En 1997, Yeo et al13 presentan una mortalidad del 1,4%, en una serie de 650 duodenopancreatectomías cefálicas realizadas entre 1990 y 1996. En la actualidad, la mortalidad de la duodenopancreatectomía, en la mayoría de centros con una amplia experiencia en la técnica14-24, no supera el 3% (tabla 1), habiéndose publicado series extensas sin mortalidad14,17,22. Este descenso en la mortalidad operatoria es multifactorial13,25: cirujanos con mayor experiencia, capaces de realizar la intervención en menos tiempo y con menor pérdida de sangre, mejores cuidados pre y postoperatorios, mejor técnica anestésica y soporte nutricional adecuado.
En intervenciones complejas, como es la cirugía exerética del páncreas, existe una estrecha relación entre el volumen de intervenciones realizadas por un hospital y la mortalidad operatoria26-28. Existe una relación inversamente proporcional entre mortalidad operatoria y volumen de intervenciones, que puede ser hasta seis veces superior en los hospitales con un bajo volumen27. Probablemente, como sugiere el grupo del Johns Hopkins28, en la reducción de la mortalidad tiene mayor importancia la experiencia adquirida por todos los grupos médicos implicados en el tratamiento de estos pacientes que el número de intervenciones realizadas por un cirujano en particular.
Complicaciones
En contraste con la reducción que se ha producido en la mortalidad operatoria, la morbilidad de la duodenopancreatectomía continúa siendo muy elevada13,29, y se han comunicado cifras de hasta un 52% (tabla 1). La frecuencia real de las complicaciones es, sin embargo, difícil de establecer ya que no existe uniformidad ni en la relación del tipo de complicaciones ni incluso en la definición de las mismas. Por otro lado, mientras en unas series se indica el número de complicaciones, en otras se indica el número de pacientes con complicaciones. Las complicaciones pueden clasificarse como complicaciones generales, o no quirúrgicas, derivadas del sistema cardiovascular, respiratorio o renal, y complicaciones directamente relacionadas con la técnica quirúrgica. Las causas más frecuentes de morbilidad relacionada con la técnica son: vaciamiento gástrico retrasado, fístula pancreática, fístula biliar, fístula gastrointestinal, absceso intraabdominal, hemorragia, pancreatitis y úlcera marginal. La incidencia de complicaciones generales30,31, en la cirugía exerética del páncreas, oscila entre un 9 y un 17%, y la de complicaciones relacionadas con la técnica2,15,23,32 entre un 25 y un 35%, que obligan a la reintervención2,15 en un 4-9% de los casos. Una técnica quirúrgica cuidadosa puede evitar muchas de las complicaciones relacionadas con la técnica; sin embargo, la mejor forma de prevención es la no aplicación de las técnicas quirúrgicas exeréticas de manera innecesaria.
Retraso del vaciamiento gástrico
El retraso del vaciamiento gástrico (RVG) es la principal causa de morbilidad, y la mayor causa de prolongación de la estancia hospitalaria, tras la duodenopancreatectomía cefálica. Presentan RVG un 20-50% de los casos2. La variabilidad en la incidencia se debe en parte a la ausencia de una definición uniforme. El RVG podría definirse, de acuerdo con la mayoría de autores, como la incapacidad para tolerar la ingesta oral durante más de 10 días, después de la intervención, por lo que debe mantenerse la descompresión gástrica. Inicialmente se consideró que su frecuencia era mucho más elevada tras la duodenopancreatectomía cefálica con preservación pilórica (DPPP) que tras el Whipple clásico33. Warshaw y Torchiana33 observaron un notable retraso en la instauración de la dieta oral plena en la DPPP en comparación con el Whipple: 16 frente a 9,8 días, y aconsejaron, en consecuencia, la realización sistemática de una gastrostomía en la DPPP. Sin embargo, diversas series posteriores32,34,35 han puesto de manifiesto que tanto la incidencia como la duración del RVG son similares en la DPPP y en el Whipple clásico36.
La etiología del RVG, tras la duodenopancreatectomía, es desconocida y probablemente multifactorial; se han propuesto para explicarlo distintos mecanismos fisiopatológicos: a) atonía gástrica debido a la resección del marcapaso duodenal y disrupción de las conexiones neuronales gastroduodenales; b) reducción de la concentración de motilina circulante37,38; c) lesión isquémica de la musculatura antropilórica; d) disritmia gástrica secundaria a dehiscencia de la anastomosis pancreaticoyeyunal, pancreatitis o absceso intraabdominal39; e) torsión o angulación transitoria del tracto digestivo reconstruido40, y f) nutrición enteral continua, que al mantener constantemente elevados los valores de colecistocinina, retrasa el vaciamiento gástrico44.
La integridad neurovascular del área antropiloroduodenal es importante para asegurar un correcto vaciamiento gástrico; para ello, es necesario respetar la arteria gástrica derecha y la arteria supraduodenal. Braasch et al42 han llamado la atención sobre la importancia que la preservación de la arteria supraduodenal tiene para acortar el período de descompresión gástrica. Por otro lado, nuestro grupo43 ha observado que la frecuencia de RVG tras la DPPP es menor en los pacientes con pancreatitis crónica que en los pacientes con tumores malignos, en los que la linfadenectomía del ligamento hepatoduodenal dificulta la preservación de la arteria supraduodenal.
Otra de las hipótesis propuestas para explicar el RVG sería la reducción de los valores circulantes de motilina tras la duodenopancreatectomía37. La motilina, hormona producida fundamentalmente por las células enterocromafines del duodeno y la parte proximal del intestino delgado, tiene un papel importante en la motilidad gástrica. Yeo et al44, en un estudio prospectivo y aleatorizado, han demostrado que la utilización de eritromicina, un agonista de la motilina44, reduce en un 37% la incidencia de RVG tras duodenopancreatectomía. El estudio isotópico demostraba, de forma significativa, una reducción de la retención
de líquidos a los 30 min y un mejor vaciamiento de los sólidos44.
La existencia de complicaciones intraabdominales es la causa más importante de RVG en una reciente publicación, en la que se analizan 200 duodenopancreatectomías cefálicas consecutivas35.
El tratamiento del RVG es, fundamentalmente, de sostén: mantenimiento de la descompresión gástrica, mediante sonda nasogástrica o gastrostomía, asociado al soporte nutricional parenteral o enteral. Si se utiliza esta última será preferible la forma cíclica, dado que esta modalidad acelera el retorno a la dieta normal41. Los procinéticos, como la metoclopropamida y el betanecol, se han utilizado en estudios no controlados46.
Fístula pancreática
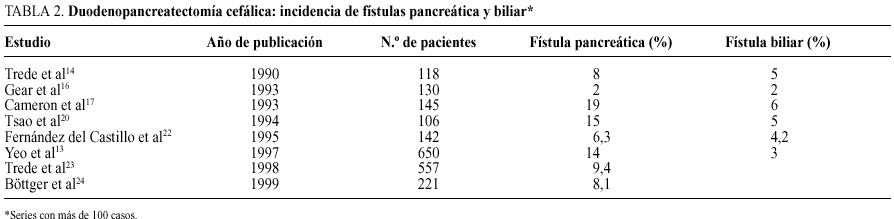
La fístula pancreática (FP) es la segunda causa de morbilidad y la principal de mortalidad, después de la duodenopancreatectomía. La aparición de una FP es un consecuencia del fracaso en la cicatrización de la anastomosis pancreaticoentérica. La FP se puede definir como la salida de 50 ml o más, al día, de un líquido rico en amilasas, a través de los drenajes peripancreá ticos, más allá del séptimo día postoperatorio, o la demostración radiológica de la disrupción de la anastomosis pancreática. La incidencia de FP tras la duodenopancreatectomía oscila, en la mayoría de series48,49, entre un 8 y un 15%, con una mortalidad asociada30,47-50 de hasta un 40% (tabla 2).
La incidencia de FP se ha relacionado con la modalidad de tratamiento del remanente pancreático, la lesión motivo de la intervención, las características del páncreas y la experiencia y capacidad técnica del cirujano (tabla 3).
Para tratar el remanente pancreático se han utilizado diversas técnicas: ligadura del conducto de Wirsung, pancreaticoyeyunostomía, con diferentes modificaciones, y pancreaticogastrostomía.
La ligadura del conducto de Wirsung se ha abandonado por su altísima incidencia de FP (50-100% de los casos)47,51.
La oclusión del conducto de Wirsung, mediante la inyección de diversos polímeros sintéticos, aunque es una técnica efectiva y segura, con una baja incidencia de FP, tiene como inconveniente que implica la pérdida de la función exocrina52.
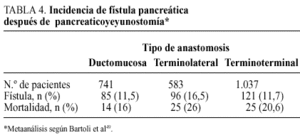
La pancreaticoyeyunostomía es la técnica más utilizada para tratar el remanente pancreático. La continuidad entre el remanente pancreático y el intestino puede establecerse mediante diferentes modalidades anastomóticas: pancreaticoyeyunostomía terminoterminal, pancreaticoyeyunostomía terminolateral, y pan creaticoyeyunostomía terminolateral con anastomosis ducto mucosa. Bartoli et al49, en un metaanálisis, constatan una mayor incidencia de FP tras la anastomosis terminolateral (16,5%), que tras la anastomosis terminoterminal (11,7%) o la terminolateral con anastomosis ductomucosa (11,5%), correspondiendo a esta última técnica la menor morbilidad (tabla 4). Grace et al53, en un estudio retrospectivo, hallan una incidencia de FP del 14% en la pancreaticoyeyunostomía terminolateral, con anastomosis ductomucosa y de un 13% en la pancreaticoyeyunostomía terminoterminal con invaginación (tipo dunking). En los casos en los que se colocó un drenaje en el conducto de Wirsung la incidencia de FP fue menor, de un 11 frente a un 30% en los casos sin drenaje ductal53. Fumovics et al54, en un estudio prospectivo, no aleatorizado, constataron en la pancreaticoyeyunostomía terminolateral un incidencia de FP del 12%, con una mortalidad del 15%, frente a un 9 y un 6,5%, respectivamente, en la pancreaticoyeyunostomía terminoterminal. Nagakave et al55, en un reciente estudio comparativo, de las tres modalidades de pancreaticoyeyunostomía, hallan una incidencia de FP del 0% en la pancreaticoyeyunostomía terminolateral con anastomosis ductomucosa, del 18% en la pancreaticoyeyunostomía terminoterminal con invaginación y del 28% en la pancreaticoyeyunostomía terminolateral sin sección de la seromuscular y aposición del conducto de Wirsung a la pared yeyunal, mediante un tubo tutor.
Con el fin de disminuir la incidencia de FP de la pancreaticoye yunostomía se han propuesto diferentes alternativas. Se han utilizado, además del drenaje externo del conducto de Wirsung53,56, el sellado de la pancreaticoyeyunostomía con fibrina57 y la pancreaticoyeyunostomía realizada con un asa en Y de Roux aislada58,59. Esta última técnica no disminuye, sin embargo, ni la gravedad ni la incidencia de FP. Ninguna de estas alternativas han sido estudiadas de forma prospectiva y aleatorizada en humanos.
La tutorización de la anastomosis pancreaticoyeyunal, mediante la colocación de un fino tubo de drenaje en el conducto de Wirsung, ha sido recomendada por numerosos investigadores. El drenaje se introduce unos 3 cm en el conducto pancreático y se fija con un punto de sutura al páncreas; con el objeto de minimizar el riesgo de extracción inadvertida del mismo, el drenaje se mantiene de 2 a 3 semanas. Aunque algún autor59 no ha observado ventajas con la utilización del drenaje del conducto de Wirsung y llama la atención sobre potenciales riesgos, la mayoría22,32,53,60,61 constata una disminución de la incidencia de FP. Roder et al61, en un reciente estudio prospectivo, no alea-
torizado, constatan una reducción significativa de la incidencia de FP con la utilización de drenaje del conducto pancreático del 6,8 frente a un 29,3% sin drenaje. Estos datos, que corroboran los de Grace et al53, sugieren que el drenaje del conducto de Wirsung tiene un efecto favorable sobre la cicatrización de la pancreaticoyeyunostomía. Por otro lado, tanto los estudios clínicos22 como experimentales60 demuestran que la utilización del drenaje pancreático aumenta, de forma clara, la persistencia de la anastomosis enteropancreática permeable.
Además de la modalidad de pancreaticoyeyunostomía, el tipo de lesión, las características del páncreas, el tamaño del conducto pancreático y la experiencia del cirujano son factores que influyen en el riesgo de FP (tabla 3). Durante la intervención quirúrgica debe efectuarse un estudio minucioso de las características morfológicas de la glándula pancreática. En nuestra experiencia, los pacientes con un conducto de Wirsung fino o de calibre normal tienen una mayor tendencia a presentar FP que los pacientes con dilatación ductal. También influye en la incidencia de FP la consistencia del páncreas y debe ser tenida en cuenta a la hora de decidir el tipo de pancreaticoyeyunostomía62. En los pacientes con un conducto dilatado (> 6 mm) y una glándula de consistencia firme, la pancreaticoyeyunostomía terminolateral con anastomosis ductomucosa es la técnica de elección. Sin embargo, cuando el conducto es de pequeño calibre o la glándula es blanda, la pancreaticoyeyunostomía terminoterminal, tipo dunking, es preferible. Este tipo de anastomosis requiere la liberación completa de 2-3 cm del extremo pancreático.
Marcus et al63 hallan una incidencia de fístula pancreática del 36% en los pacientes con un páncreas pequeño, frágil y blando, sin dilatación ductal, frente a un 2% en los páncreas fibróticos. En la serie del Johns Hopkins61 los factores predictores del riesgo de FP fueron un número bajo de intervenciones por cirujano y resecciones por lesiones ampulares y duodenales. En la serie de la Universidad de Amsterdam50 las lesiones ampulares y un Wirsung con un diámetro inferior a 2 mm se asociaron a una mayor incidencia de FP. En la serie del MD Anderson de la Universidad de Texas64 la reoperación fue el factor que se asoció con mayor incidencia de FP tras duodenopancreatectomía.
La pancreaticogastrostomía parece, por su facilidad y baja incidencia de FP, una alternativa atractiva a la pancreaticoyeyunostomía. Mason65 en una reciente revisión de la bibliografía, que recoge 733 casos de pancreaticogastrostomía, halla una incidencia de FP de un 4%. Sin embargo, Yeo et al66, en un estudio prospectivo y aleatorizado en el que se comparan la pancreticoyeyunostomía y la pancreaticogastrostomía, hallan con ambas técnicas una incidencia similar de FP, del 11,1 y del 12,3%, respectivamente. Estos datos no apoyan, pues, la hipótesis de que la pancreaticogastrostomía es una técnica más segura y con menor incidencia de FP. Por otro lado, Green et al67 en un excelente estudio experimental, prospectivo y aleatorizado realizado en perros en el que comparan la pancreaticogastrostomía, la pancreaticoyeyunostomía terminolateral y la pancreaticoyeyunostomía terminolateral con anastomosis ductomucosa, observaron una superioridad de esta última en cuanto a permeabilidad y función sobre las otras dos técnicas. La extrapolación, no obstante, de estos datos al ser humano es difícil. En la actualidad no contamos con datos convicentes que apoyen la elección de la pancreaticogastrostomía como técnica de elección.
El efecto de la manipulación farmacológica de la secreción pancreática, mediante la utilización de somatostatina o su análogo, el octreótrido, sobre la incidencia de FP tras resección pancreática es controvertido. Klempe et al68, en 1979, comunicaron una reducción de las complicaciones de la duodenopancreatectomía con la administración de somatostatina. Tres estudios multicéntricos69-71, posteriores, sugieren que la utilización de octreótrido reduce la incidencia de complicaciones y FP tras la duodenopancreatectomía. Sin embargo Lowy et al72, en un reciente estudio prospectivo y aleatorizado, no observaron diferencias en la incidencia de FP tras resecciones pancreáticas por enfermedades malignas, entre los pacientes que recibieron octreótido y los que no la recibieron.
Un 80% aproximadamente, de las FP cerrarán con tratamiento conservador73. Es esencial un buen drenaje de la fístula, por lo que debe asegurarse la permeabilidad de los tubos de drenaje. Es, asimismo, primordial el reposo intestinal con el fin de reducir la secreción exocrina pancreática a sus valores basales favoreciendo así el cierre de la FP. La nutrición parenteral total (NPT) en estos pacientes es fundamental, puesto que muchas FP requieren reposo intestinal prolongado.
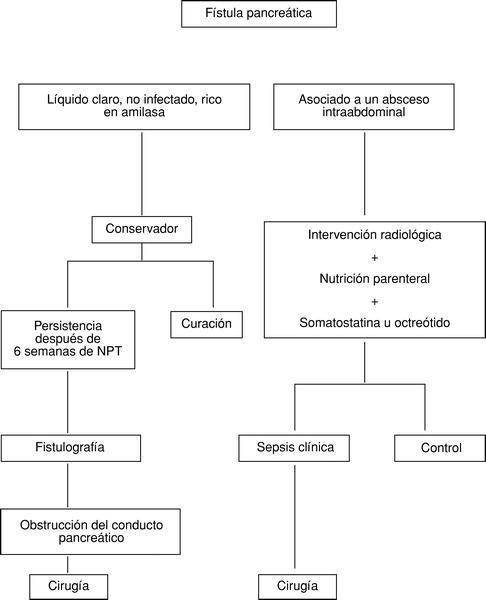
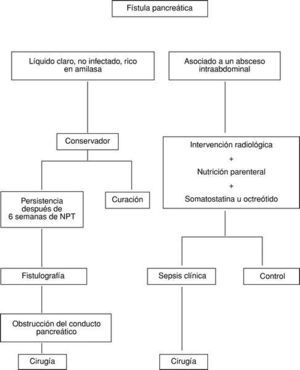
El tratamiento quirúrgico será necesario en pacientes en los que el drenaje percutáneo de un absceso abdominal fracasa o en presencia de una fístula biliar y pancreática con manifestaciones clínicas de sepsis. El reconocimiento de una dehiscencia pancreática incontrolada con sepsis intraabdominal debe ser precoz, realizándose una rápida evaluación de otros potenciales focos sépticos (fig. 1). El tratamiento quirúrgico está, asimismo, indicado en pacientes en los que tras 6 semanas de tratamiento conservador no se produce el cierre de la FP; debe sospecharse una obstrucción del conducto pancreático que se investigará mediante fistulografía (tabla 5 y fig. 1).
En los pacientes que requieren tratamiento quirúrgico hay diversas opciones: drenaje del área peripancreática, desconexión de la anastomosis pancreaticoyeyunal combinada con una oclusión del conducto pancreático y resección del remanente pancreático.
En la serie de la Clínica Mayo74, en 11 pacientes (6%) de 479 duodenopancreatectomías practicadas se completó la pancreatectomía por FP en 10 casos con una mortalidad del 64%. En la serie de Mannheim75, en 17 (3,7%) de 458 duodenopancreatectomías se completó la pancreatectomía por complicaciones postoperatorias con una mortalidad del 24%. En una reciente publicación50, en pacientes 29 (11%) de 269 duodenopancreatectomías se realizó tratamiento quirúrgico por FP, en 21 casos se efectuó un procedimiento de drenaje, con una mortalidad del 38%, y en 8 casos se completó la pancreatectomía con una mortalidad del 0%. Según estos datos, no es aconsejable el simple procedimiento de drenaje y la mejor opción es, siempre que las condiciones locales lo permitan, la desconexión de la anastomosis pancreaticoyeyunal con oclusión del conducto pancreático del páncreas remanente con inyección de polímeros (prolamina).
Fístula biliar
La fístula biliar (FB) tras la duodenopancreatectomía es una complicación infrecuente (3-4%), en comparación con la FP13,22,30. Esta complicación puede producirse por una inadecuada realización de la anastomosis o como consecuencia de una devascularización de la vía biliar78. La irrigación arterial de la vía biliar procede fundamentalmente de ramas de la arteria pancreaticoduodenal superior y, en menor medida, de ramas procedentes de la arteria hepática derecha. La ligadura de la arteria gastroduodenal, durante la duodenopancreatectomía, hace que la vascularización de la vía biliar proceda exclusivamente de las ramas de la arteria hepática derecha. Su lesión implicaría la isquemia de la vía biliar residual y la dehiscencia de la anastomosis bilioentérica76,77.
Cuando la FB es pequeña, un drenaje adecuado de la misma y el mantenimiento del estado nutricional son suficientes para que se produzca el cierre espontáneo. En los casos de FB con débito alto será necesario reconstruir la anastomosis biliar, que
se tutorizará con drenaje transanastomótico de ambos hepáticos.
En los casos con vía biliar no dilatada para prevenir la FB es aconsejable dejar un drenaje de Kehr transanastomótico.
Fístula gastrointestinal
En pocas publicaciones se hace referencia a esta complicación, que en la serie de Braasch et al78 era de un 2%.
Dependiendo de las condiciones del paciente y de las condiciones locales, cuando sea necesario el tratamiento quirúrgico, se optará por la resección y reconstrucción de la anastomosis o por la resutura de la dehiscencia, colocando una yeyunostomía tipo Witzel para descompresión de la zona79.
Absceso intraabdominal
Los abscesos intraabdominales tras la duodenopancreatectomía se asocian habitualmente a dehiscencias anastomóticas, especialmente de la pancreaticoyeyunostomía, presente en un 50% de los casos46. Su incidencia en la extensa experiencia de Yeo et al13 es de un 5%. Una vez localizados los abscesos mediante ecografía o TAC, el tratamiento de elección es el drenaje percutáneo. En los casos en los que, por las características o localización, el drenaje percutáneo no es posible o fracasa, deberá realizarse el drenaje quirúrgico. En los casos en los que en el acto quirúrgico se descubre una dehiscencia de la pancreaticoyeyunostomía deberá, contemplarse completar la pancreatectomía46.
Hemorragia
La hemorragia intraabdominal o gastrointestinal se presenta en aproximadamente un 5-16% de los pacientes sometidos a una duodenopancreatectomía23,30,80,81, con una mortalidad asociada de hasta un 80%.
Esta complicación puede estar relacionada con un problema técnico, deslizamiento de una ligadura o hemorragia de la línea de sutura. En ambos casos la hemorragia se presenta precozmente en el período postoperatorio. Con mayor frecuencia se presentan hemorragias tardías en el contexto de una FP con infección intraabdominal como consecuencia de una erosión arterial. La hemorragia puede verse adicionalmente agravada por los trastornos de coagulación inducidos por una ictericia de larga evolución82. El diagnóstico clínico se hará por la salida de sangre por los drenajes, hematemesis o melenas, inestabilidad hemodinámica y descenso del hematócrito.
Ocasionalmente, una hemorragia centinela puede ser el indicador de una inminente hemorragia cataclísmica83.
La endoscopia debe ser el primer método de exploración, y resulta útil en las hemorragias por úlcera o de la línea de sutura, ya que en ambas situaciones es posible utilizar métodos endoscópicos de hemostasia. Cuando la hemorragia se presenta en el contexto de un cuadro séptico, hay que sospechar la existencia de una fístula pancreática o entérica. En estos casos debe llevarse a cabo la reintervención de forma inmediata para cohibir la hemorragia. Deben explorarse cuidadosamente el lecho pancreático y las anastomosis para localizar el origen de la hemorragia.
Pancreatitis
La pancreatitis postoperatoria del páncreas residual es una complicación infrecuente tras la cirugía pancreática, cuya incidencia oscila entre un 2 y un 5%13,30. La pancreatitis puede presentar diversos grados de gravedad, desde la pancreatitis edematosa a la necrosante. El diagnóstico se establece sobre la base de una elevación de la amilasa sérica y en los líquidos obtenidos a través de los drenajes abdominales.
El tratamiento dependerá de la gravedad del proceso en las pancreatitis leves y moderadas, la NPT; el reemplazo de líquidos, la cobertura antibiótica y la analgesia serán suficientes para controlar el cuadro. En las pancreatitis graves será necesario completar la pancreatectomía.
Úlcera marginal
Las úlceras de la boca anastomótica y del yeyuno eran una complicación relativamente frecuente tras el Whipple clásico y la pancreatectomía total. Cesant y Van Herdeen84 observaron una incidencia de úlcera de la boca anastomótica de un 6%, tras la operación de Whipple y de un 18% después de la pancreatectomía total. Scott et al85 observaron una frecuencia global de úlcera marginal de un 18%, con una incidencia del 0% en los pacientes a los que se les añadió vagotomía, y de un 50% en los no vagotomizados. Braasch et al42 constataron una menor incidencia de úlcera marginal con la introducción de la duodenopancreatectomía con preservación pilórica. Sin embargo, estudios comparativos posteriores86, entre esta técnica y la operación clásica de Whipple, no hallaron diferencias en la incidencia de úlcera marginal que se sitúa alrededor del 5%. La úlcera puede hacer su aparición entre uno y varios años después de la intervención, el diagnóstico se confirma mediante endoscopia87.
Habitualmente, responde al tratamiento con bloqueadores de los receptores H2 u omeprazol. No obstante, la antrectomía, con o sin vagotomía, puede ser necesaria en algún paciente refractario al tratamiento médico.
Para prevenir la aparición de la úlcera marginal se ha propuesto la administración de bajas dosis de bloqueadores de los receptores H2 y acortar la distancia entre las anastomosis pancreática, biliar y gástrica, para que ésta esté bañada por las secreciones alcalinas de forma apropiada88.
Correspondencia: Dr. L. Fernández-Cr