Introducción
El cáncer de páncreas es, junto con el cáncer de esófago, el tumor digestivo de peor pronóstico y cuyo tratamiento quirúrgico mayor morbilidad y mortalidad acarrea1. Los avances sucedidos en las últimas décadas han permitido reducir de forma sustancial esta morbimortalidad, además de mejorar la supervivencia. Sin embargo, viejos y equivocados conceptos permanecen aún fuertemente arraigados y son fuente de errores en el tratamiento de estos pacientes, con un importante impacto en términos de morbimortalidad.
El objetivo del presente artículo es intentar valorar algunos errores de concepto, a la vez que describir los errores de tratamiento que de los anteriores pudieran derivarse.
Errores de concepto
El nihilismo terapéutico
Un concepto muy extendido en la comunidad médica es considerar que, debido a los malos resultados obtenidos en términos de supervivencia a largo plazo2-4 y a la alta morbimortalidad que la resección quirúrgica implica5,6, es mejor adoptar una política nihilista "de no hacer nada" que intentar la resección. Hacia 1970, y según una mortalidad posresección del 20-30%, se concluye que el bypass es la opción terapéutica preferida en el tratamiento del cáncer de páncreas7,8. Más aun, en una revisión colectiva de finales de los ochenta se llegó a afirmar que la resección pancreática no es coste-efectiva, dado que la supervivencia a los 5 años era del 0,4%, con una mortalidad operatoria del 16%9. Estos malos resultados, junto con los avances en la endoscopia biliar, favorecieron que se considerara el bypass como la opción ideal incluso para tumores potencialmente resecables10.
En la actualidad, el tratamiento de elección del cáncer de páncreas es la resección quirúrgica, con cifras de mortalidad a los 30 días inferiores al 5%, y tasas de supervivencia a los 5 años del 20%, que en grupos seleccionados (tumores < 2 cm con ganglios negativos) pueden alcanzar hasta el 40%11. Sin embargo, un buen número de cirujanos y gastroenterólogos todavía trata a este tipo de pacientes desde el más absoluto nihilismo terapéutico basado en un completo desconocimiento de los avances acontecidos en los últimos 15 años.
La no centralización
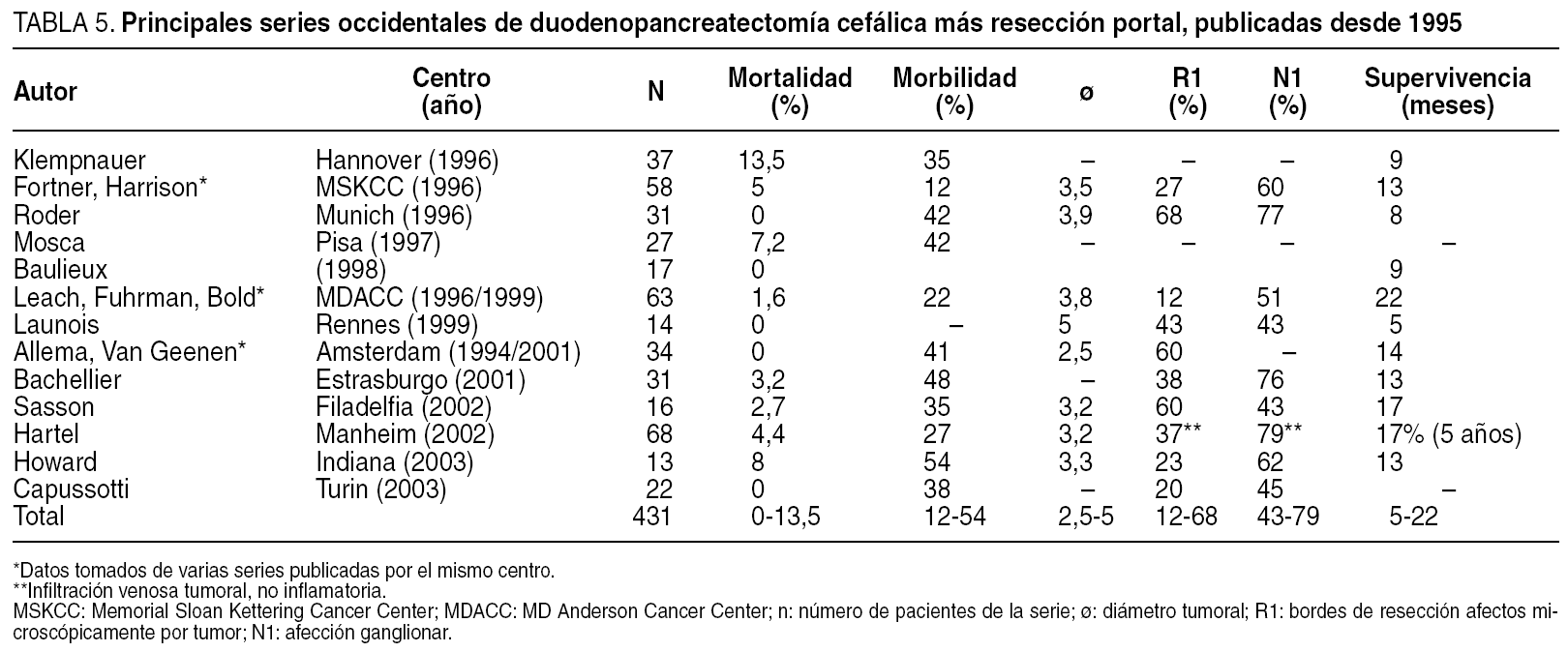
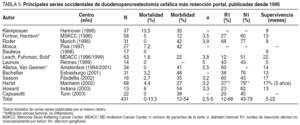
Desde la publicación, hace ya 25 años, del artículo seminal de Luft et al12, en el que se demostraba la correlación existente entre la experiencia quirúrgica y los resultados, muchos han sido los estudios que han venido a reforzar este concepto, que además es válido para prácticamente todas las intervenciones quirúrgicas mayores13. En el campo de la cirugía pancreática, diversas son las publicaciones que han estudiado este hecho (tabla 1), y se ha observado en todas ellas una gran correlación entre el volumen de procedimientos y los resultados, tanto en términos de mortalidad como de morbilidad14-18. Así, en centros de alto volumen, las tasas de mortalidad tras la resección pancreática oscilan entre el 0 y el 6%, frente a unas tasas del 6-27% en centros de bajo volumen (tabla 1). En España19, un reciente estudio20 concluye que en centros de alto volumen (> 11 resecciones/año) existe una tendencia a una menor mortalidad, con una reducción de la probabilidad de morir cercana al 48%.
A la luz de los datos expuestos, pocos pueden argumentar en contra del fenómeno de la centralización y sus beneficios14-18, aunque persisten diversas controversias. Así, podría argumentarse que es más importante el volumen de pacientes tratado por un determinado cirujano que por su unidad y/o su hospital. En nuestra opinión, las relaciones volumen/hospital y volumen/cirujano están íntimamente asociadas, y en la mayoría de los estudios el factor cirujano no es un factor pronóstico independiente11,18,21, lo que contrasta con la observación de que en otras enfermedades, como el cáncer de colon, el cirujano es un factor pronóstico clave. En la cirugía pancreática, la complicación más importante y determinante de mortalidad es la fístula pancreática, cuya incidencia depende de la experiencia del cirujano21. ¿Cómo podemos conciliar ambos hechos? En nuestra opinión, la mortalidad dependiente de las complicaciones de la cirugía pancreática, y en especial las fístulas, sólo puede reducirse en caso de existir cuidados especializados de 24 h que impliquen un diagnóstico y un tratamiento temprano y agresivo de estas complicaciones, y esto sólo puede ser ofrecido en el seno de unidades multidisciplinarias14 normalmente adscritas a grandes centros hospitalarios. La mejora de resultados que la centralización supone genera un círculo muy positivo: a mejores resultados, mayor volumen de pacientes ("sesgo de selección"), al ser atraídos más pacientes procedentes de otros centros, lo que implica mayor experiencia, no sólo quirúrgica, sino de toda la unidad, y con ella mejores resultados ("la práctica hace la perfección")15,16-19.
Los datos de la bibliografía avalan que estos pacientes deben ser tratados, sea cual sea el tratamiento empleado, en unidades especializadas, normalmente adscritas a grandes hospitales, porque ofrecen, tras la resección, las menores tasas de morbimortalidad, una menor estancia hospitalaria y, por ello, un menor coste y una mayor supervivencia15-19. Debe señalarse que, aunque con los datos previos podría pensarse que la centralización y la especialización sólo aportan ventajas en caso de cirugía de resección, recientes estudios demuestran que también la cirugía paliativa se beneficia de su práctica en hospitales de alto volumen18.
Errores de tratamiento
La historia clínica
Es posible identificar22, al menos, 4 conceptos clínicos muy extendidos, pero que a la vez son claramente erróneos: a) que el cáncer de páncreas se asocia a una ictericia indolora, cuando en realidad la mayoría de los pacientes refieren dolor o molestias epigástricas; b) que una pancreatitis aguda no puede estar causada por un tumor pancreático, lo que puede significar un retraso en el diagnóstico de casi 9 meses; c) que el dolor abdominal irradiado a la espalda es típico de tumores corporocaudales avanzados, cuando en realidad puede estar causado por tumores de cualquier localización, por obstrucción ductal, en caso de los tumores cefálicos, como por los de cuerpo y cola tras una invasión perineural, y d) que la paniculitis es característica de la pancreatitis aguda o crónica, cuando puede acompañar a algunos tumores, como el de células acinares23.
La historia clínica posee un valor incalculable a la hora del diagnóstico diferencial entre una neoplasia quística y un seudoquiste24. Los seudoquistes aparecen tras un episodio obvio de pancreatitis aguda o traumatismo, o en el seno de una pancreatitis crónica, mientras que los tumores quísticos no poseen antecedentes de interés, son más frecuentes en mujeres y poseen síntomas inespecíficos de largo tiempo de evolución, o bien son asintomáticos. La confusión y el error aparecen en caso de neoplasias intraductales papilares mucinosas, lesiones quísticas que típicamente se manifiestan como pancreatitis agudas o cuando la tumoración quística se descubre tras el estudio de una pancreatitis aguda, que es consecuencia y no causa de la lesión. A pesar de todo, se calcula que un tercio de los tumores quísticos es etiquetado erróneamente de seudoquiste y que hasta un 10% de éstos son tratados mediante quistoenterostomías24,25.
Drenaje biliar preoperatorio. ¿Sistemático o electivo?
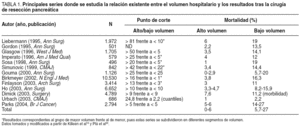
La bilirrubina sérica preoperatoria se ha identificado como uno de los factores pronósticos más importantes en el tratamiento quirúrgico de las ictericias malignas, por lo que muchos cirujanos consideran imprescindible el empleo sistemático del drenaje biliar preoperatorio (DBP)26. Esta actitud tiene su origen en 2 artículos clave publicados a principios de los años ochenta, que argumentaban que con el uso sistemático del DBP disminuían las tasas de morbimortalidad postoperatoria y se evitaban las complicaciones relacionadas con la colostasis prolongada27,28.
A finales de los años noventa, 2 publicaciones seminales, una procedente del Memorial Sloan Kettering Cancer Canter29 y otra del Anderson Cancer Center30 argumentaban justamente lo contrario.
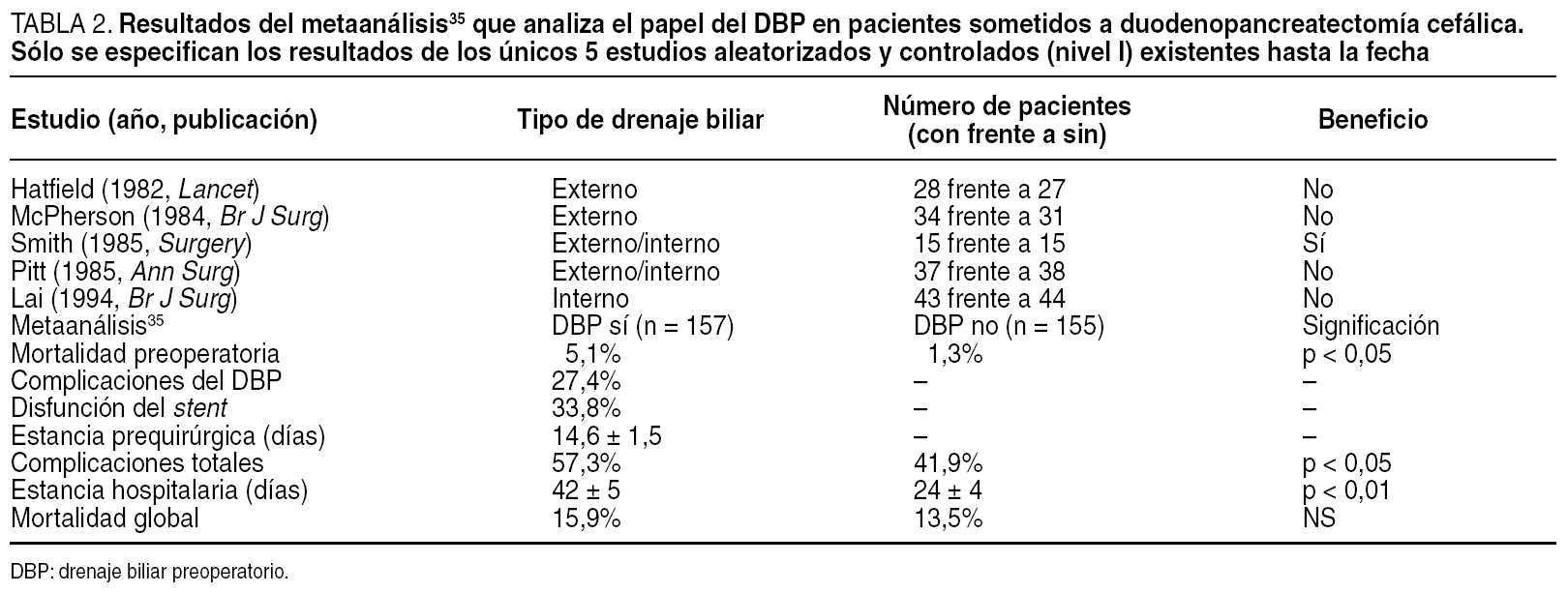
Según sus autores, el empleo sistemático del DBP no debía recomendarse por diferentes razones20,30: no disminuía la mortalidad postoperatoria; aumentaba la morbilidad, a expensas fundamentalmente de complicaciones infecciosas31; dificultaba, por la reacción inflamatoria provocada, la valoración intraoperatoria de la resecabilidad tumoral y la propia técnica quirúrgica en sí32,33, y finalmente, favorecía tanto la exfoliación como la implantación tumoral en el trayecto del drenaje o en otras zonas cruentas, por lo que se desaconsejaba su uso en caso de lesiones potencialmente resecables, al comprometerse su potencial curabilidad32-34. Los resultados de un reciente metaanálisis35, con los datos proporcionados por los únicos cinco estudios de nivel I publicados hasta la fecha y expuestos en la tabla 2, argumentan también en contra del uso sistemático del DBP, pues su empleo no sólo no logra ningún beneficio, sino que incrementa la tasa de complicaciones y la estancia hospitalaria.
En nuestra opinión, el DBP sólo estaría indicado en las siguientes situaciones31-36: a) en pacientes sometidos a colangiopancreatografía retrógrada endoscópica (CPRE), debido al elevado riesgo de colangitis, o en aquellos con complicaciones infecciosas de la vía biliar ya establecidas; b) en pacientes con valores de bilirrubina > 15-20 mg/dl, por el riesgo de insuficiencia renal, y c) en aquellos en que la dilación temporal de la cirugía sea inevitable. En el resto de circunstancias creemos que los riesgos son muy superiores a los beneficios esperados.
Inoperabilidad, irresecabilidad y sentido común
Tal y como se ha comentado, las series más recientes muestran una reducción cada vez mayor tanto en las tasas de mortalidad como en las de morbilidad tras la resección pancreática37. Sin embargo, de estos últimos estudios también se desprende que las causas de muerte han variado notablemente. Así, hace unos años estas dependían casi exclusivamente de complicaciones locales, normalmente en relación con fístulas pancreáticas o hemorragias intra o postoperatorias. En la actualidad, las causas de mortalidad son mayoritariamente sistémicas, dependientes más de la comorbilidad asociada preoperatoria que del desarrollo de complicaciones quirúrgicas38. Este es un hecho clave, pues convierte la evaluación preoperatoria de estos pacientes en un factor determinante a la hora de valorar su operabilidad. El tipo de pacientes que estamos considerando tiende a ser de edad avanzada (más del 80%, > 60 años) con frecuentes comorbilidades asociadas, como la enfermedad pulmonar obstructiva o la diabetes, que incrementan notablemente el riesgo quirúrgico37,39.
La edad no es un factor que contraindique la cirugía per se40,41, aunque algunos encuentran, especialmente en pacientes > 70 años, un riesgo muy aumentado40,42.
Con independencia de la edad, la valoración preoperatoria debe incluir una completa y exhaustiva evaluación pulmonar, cardiológica y vascular. Será el sentido común el que, apoyado en los datos ofrecidos por una correcta evaluación preoperatoria, decida la operabilidad de estos pacientes40.
Un error que se comete con cierta frecuencia es considerar a muchos pacientes como susceptibles de resecar cuando las pruebas de imagen muestran tumores claramente irresecables. Esta actitud puede deberse, probablemente, a la creencia de que las tasas de resultados erróneos proporcionados por las técnicas de imagen son altas y, tal vez, a un mal entendido prurito profesional, según el que se intenta operar y resecar aquello que claramente no lo es, con lo que se generan falsas expectativas, tanto para el paciente y su familia, como para el propio cirujano. Los avances técnicos sucedidos en el campo de la radiología permiten documentar la resecabilidad tumoral en casi el 100% de los casos22,40,43. La tomografía computarizada (TC) helicoidal con contraste intravenoso en secciones finas (< 2-3 mm) se ha convertido en la prueba de elección al proporcionar de forma precisa la relación entre el tumor, las venas mesentérica superior y porta, así como la arteria mesentérica superior y el tronco celíaco y sus ramas. Además, otras técnicas, como la resonancia magnética (RM), la ecoendoscopia (EE), la CRPE, etc., ayudan, aún más si cabe, a una correcta y precisa valoración de la resecabilidad tumoral22,40,43. Un aspecto básico que se debe tener en cuenta es que la determinación de la resecabilidad la debe efectuar un radiólogo y un cirujano expertos, sobre la base de una TC helicoidal de alta calidad. Esto nos lleva, de nuevo, a considerar que esta valoración se hará mucho mejor en el seno de unidades especializadas multidisciplinarias40. Cualquier conclusión tomada por cirujanos y/o radiólogos inexpertos o basada en pruebas de imagen deficitarias será errónea y dará lugar a que pacientes potencialmente resecables no sean operados o a que otros claramente irresecables sean intervenidos. Cada cirujano o radiólogo debe analizar la sensibilidad y la especificidad que estas pruebas poseen en su propio centro, pues los datos proporcionados por otros centros no poseen valor alguno si la experiencia y los resultados son diferentes. En cualquier caso, si existe la más mínima duda respecto a la resecabilidad tumoral en un paciente sin contraindicaciones formales para la cirugía, la laparotomía debe ser la norma.
¿Debemos operar sin un diagnóstico anatomopatológico preoperatorio?
Para muchos médicos, es obligatorio obtener un diagnóstico histopatológico de malignidad antes de efectuar ningún tipo de tratamiento en un paciente con una masa pancreática, normalmente mediante el empleo de la punción-aspiración con aguja fina (PAAF). En nuestra opinión, esta actitud es errónea, pues la PAAF posee una escasa sensibilidad (50-70%) y un alto porcentaje de falsos negativos (15%), que puede ser aún mayor en caso de tumores de pequeño tamaño, precisamente los tumores mejor abordables quirúrgicamente44,45. Además, la PAAF posee una significativa morbimortalidad dependiente del desarrollo de complicaciones, como pancreatitis agudas, hemorragias, etc.44,45. El desarrollo que en los últimos años ha tenido la EE y, con ella, la posibilidad de tomar muestras sin las potenciales complicaciones de la PAAF, y con una mejor sensibilidad, ha reavivado el interés por el diagnóstico patológico preoperatorio46. A pesar de ello, un diagnóstico histopatológico preoperatorio sigue siendo innecesario, porque la mortalidad posresección pancreática ha disminuido de forma espectacular en los últimos años; porque una biopsia negativa no excluye el cáncer, y porque la resección es el tratamiento de elección para otras entidades no malignas como la pancreatitis crónica47.
En nuestra opinión, la biopsia percutánea preoperatoria no posee ningún papel en la evaluación de un paciente sin contraindicaciones para la cirugía con una masa pancreática potencialmente resecable. Su empleo debe quedar restringido a pacientes de alto riesgo quirúrgico o en aquellos considerados irresecables de forma preoperatoria, en los que se planea la instauración de un tratamiento paliativo. También se debería indicar en pacientes incluidos en protocolos quimioterápicos neoadyuvantes y en los pacientes cuya forma de presentación clínica y datos de imagen nos hagan sospechar la presencia de otras formas tumorales diferentes al adenocarcinoma (p. ej., linfoma)44-47.
Por lo que respecta a la biopsia intraoperatoria47, ésta debe efectuarse sólo en 2 situaciones: tumores irresecables, con el fin de obtener un diagnóstico patológico definitivo para aplicar tratamientos adyuvantes paliativos, y cada vez que se efectúa una resección pancreática, para asegurarnos márgenes de resección libres de enfermedad; la biopsia se debe efectuar tanto en el borde de la sección pancreática como en la zona biliar distal47.
¿Estadificación laparoscópica?
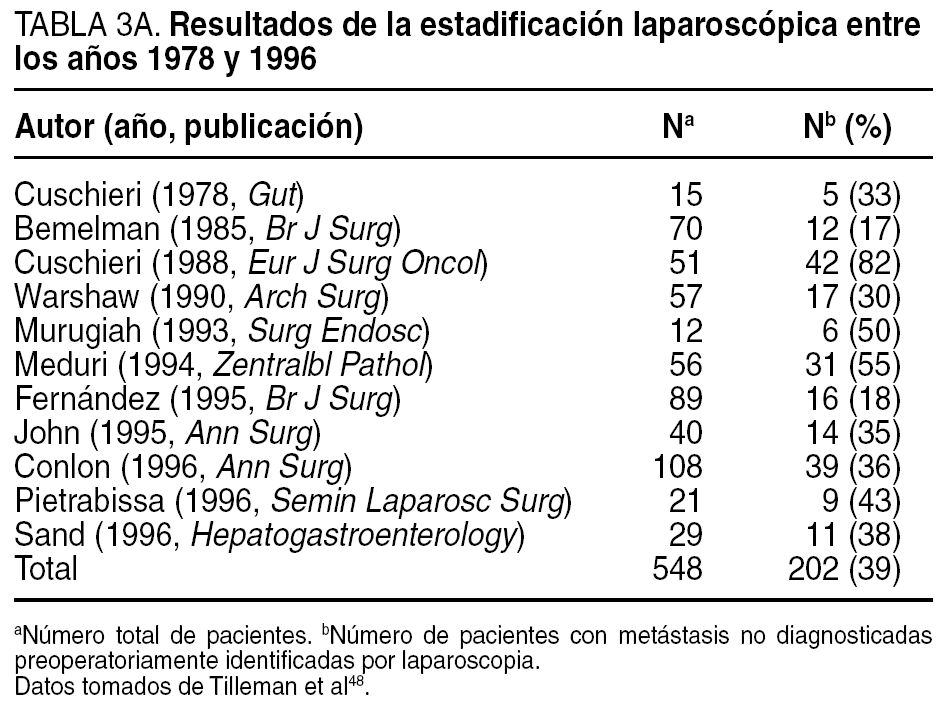
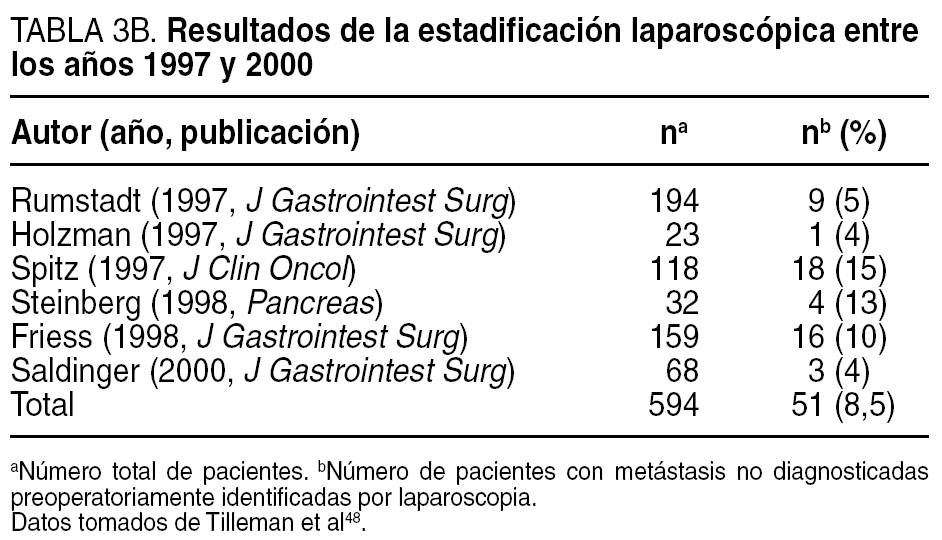
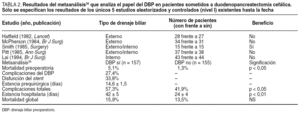
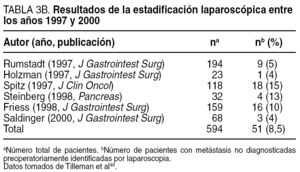
El desarrollo que en los últimos años ha experimentado la laparoscopia, junto con el hecho de que entre un 20 y un 40% de los pacientes presenta implantes peritoneales o metástasis hepáticas en el momento de la cirugía, hizo a muchos considerar su empleo sistemático en todos los pacientes con cáncer de páncreas, y en particular en el subgrupo de pacientes con tumores de cuerpo/cola23,48,49, a fin de evitar una laparotomía innecesaria. Su empleo se justificaba en los resultados proporcionados por múltiples estudios (tabla 3A) que revelaban una capacidad para detectar metástasis no identificadas preoperatoriamente en el 39% (18-82%) de los casos. En los últimos años, la capacidad de diagnóstico y estadificación preoperatoria ha mejorado de forma extraordinaria, en particular tras la introducción de la TC helicoidal, hasta el punto de alcanzar sensibilidades y especificidades cercanas al 100%. Este hecho se ha visto reflejado en una disminución muy notable en el rendimiento de la estadificación laparoscópica. Así, los más recientes estudios comunican tasas de metástasis no detectadas de tan sólo un 5% (tabla 3B). A este hecho se debe sumar la escasa capacidad de la laparoscopia para estadificar localmente el tumor y determinar la resecabilidad local, que es inferior a la de la vía abierta.
Finalmente, cabe comentar que el beneficio que el empleo de la estadificación laparoscópica posee, en términos de reducción de tasas de laparotomías innecesarias, es en la actualidad muy reducido (< 10%), dado el papel que la paliación quirúrgica desempeña, tal y como se comprobará posteriormente en estos pacientes. Todo esto hace que el valor de la estadificación laparoscópica en el tratamiento del cáncer de páncreas sea mínimo.
Cualquier paciente apto para cirugía, con una expectativa de vida prolongada, y en el que existan dudas respecto a su resecabilidad, debe ser laparotomizado y estadificado de forma precisa. Si el paciente no puede ser resecado, entonces se paliará quirúrgicamente. El empleo de la laparoscopia como técnica de estadificación podría recomendarse tan sólo en pacientes muy seleccionados (tumores corporocaudales o cefálicos con ø > 3 cm y valores de Ca 19,9 > 1.000 U/ml50), con un riesgo elevado de padecer una enfermedad diseminada, sobre todo si se esperan buenos resultados tras una paliación no operatoria.
¿Paliación quirúrgica o no operatoria?
Otro error que se comete con frecuencia consiste en adoptar de forma sistemática una política paliativa quirúrgica en pacientes en quienes se podría haber aplicado paliación de forma efectiva no operatoria23, o al revés, paliar de forma no operatoria a pacientes que se habrían beneficiado claramente de una paliación quirúrgica. La fuente de este error se encuentra en el desconocimiento de las ventajas e indicaciones de cada una de las técnicas de paliación. La paliación quirúrgica, comparada con la no operatoria (endoscópica o percutánea), presenta resultados a largo plazo mucho mejores con menor incidencia de colangitis, ictericia recurrente (3%) y obstrucción digestiva (4%); además, permite la colecistectomía, con lo que se evita el desarrollo posterior de colecistitis agudas, y permite, en el mismo acto operatorio, la derivación digestiva, caso de estar indicada (véase más adelante). El único handicap de esta técnica es su mayor morbimortalidad temprana, que puede incluso alcanzar el 30%23. El empleo de este tipo de paliación en pacientes con mal estado general se asocia a tasas de morbilidad del 20% y de mortalidad del 30%23. Sin embargo, en centros especializados, su mortalidad ronda el 3%, lo que enfatiza de nuevo el papel de la especialización y la adecuada selección de candidatos a la hora de obtener buenos resultados.
La paliación no quirúrgica, preferentemente mediante métodos endoscópicos, está indicada en todos los pacientes en que se demuestre, de forma preoperatoria, la presencia de masas irresecables localmente avanzadas, metástasis a distancia o diseminación tumoral intraperitoneal, y en los pacientes que se consideren inoperables por su condición médica. La paliación quirúrgica debería emplearse en caso de irresecabilidad demostrada intraoperatoriamente y cuando se trate a pacientes con buen estado general y escaso riesgo quirúrgico, cuya expectativa de vida es prolongada23.
Bypass digestivo. ¿Sistemático o electivo?
Una actitud muy extendida, pero a nuestro juicio errónea, es el empleo sistemático del bypass digestivo, una gastroyeyunostomía, junto con la derivación biliar a la hora de la paliación quirúrgica. Los defensores de esta actitud argumentan que, si bien la incidencia de obstrucción digestiva en el momento de la cirugía es escasa, aproximadamente un 15-30% de los pacientes la desarrollará en un plazo medio de 8 meses51, además de que con su empleo no parece incrementarse la morbimortalidad operatoria. En nuestra opinión, el empleo del bypass digestivo debe ser selectivo y no sistemático. Un análisis detallado de los estudios publicados revela que la morbilidad del doble bypass es superior a la de la derivación biliar simple debido a la alta incidencia de hemorragias digestivas y al vaciamiento gástrico retardado existente. Por otra parte, se observa que los datos están sesgados, pues los estudios publicados proceden de centros especializados que incluyen una elevada proporción de pacientes con tumores del proceso uncinado y tumores asociados con una alta incidencia de obstrucción digestiva. Finalmente, hay que comentar que no todas las series publicadas comunican tasas tan elevadas de obstrucción digestiva. Así, se publican cifras que rondan el 10%, mucho más cercanas a la realidad, dada la frecuente existencia de síntomas funcionales y no mecánicos52. Por tanto, y según lo expuesto, el empleo del bypass digestivo sólo debería efectuarse de forma selectiva en pacientes con síntomas de obstrucción digestiva o en aquellos en los que ésta sea inminente52.
Resección quirúrgica. Cuando más es igual a menos
La adopción de una política quirúrgica "radical"53-55, esto es, ser lo más agresivos posibles desde el punto de vista de la resección que se va a efectuar no ha proporcionado los beneficios que se esperaban. Basándose en este concepto "radical", diversas son las modificaciones técnicas descritas.
La primera operación diseñada bajo estas premisas fue la pancreatectomía regional de Fortner56. Esta intervención consistía en la resección tumoral junto con la resección y la reconstrucción del eje venoso portal y de la arteria hepática y/o mesentérica superior más linfadenectomía retroperitoneal en bloque. Los resultados de esta intervención quedan resumidos en la experiencia publicada por el propio Fortner et al57 y Sindelar58, del National Cancer Institute: elevada morbimortalidad, muy superior a la de la cirugía estándar, sin observarse beneficio alguno en tasas de recidiva local, metástasis o supervivencia.
El empleo de la pancreatectomía total, para así conseguir una mejor linfadenectomía, evitar el riesgo de la muticentricidad tumoral y obviar una anastomosis de alto riesgo, no sólo no mejora las tasas de supervivencia, sino que se asocia a una mayor morbilidad postoperatoria y a una grave insuficiencia pancreática exo y endocrina. Creemos que su empleo debe quedar restringido a los casos en los que exista afección tumoral en el muñón de sección pancreático23.
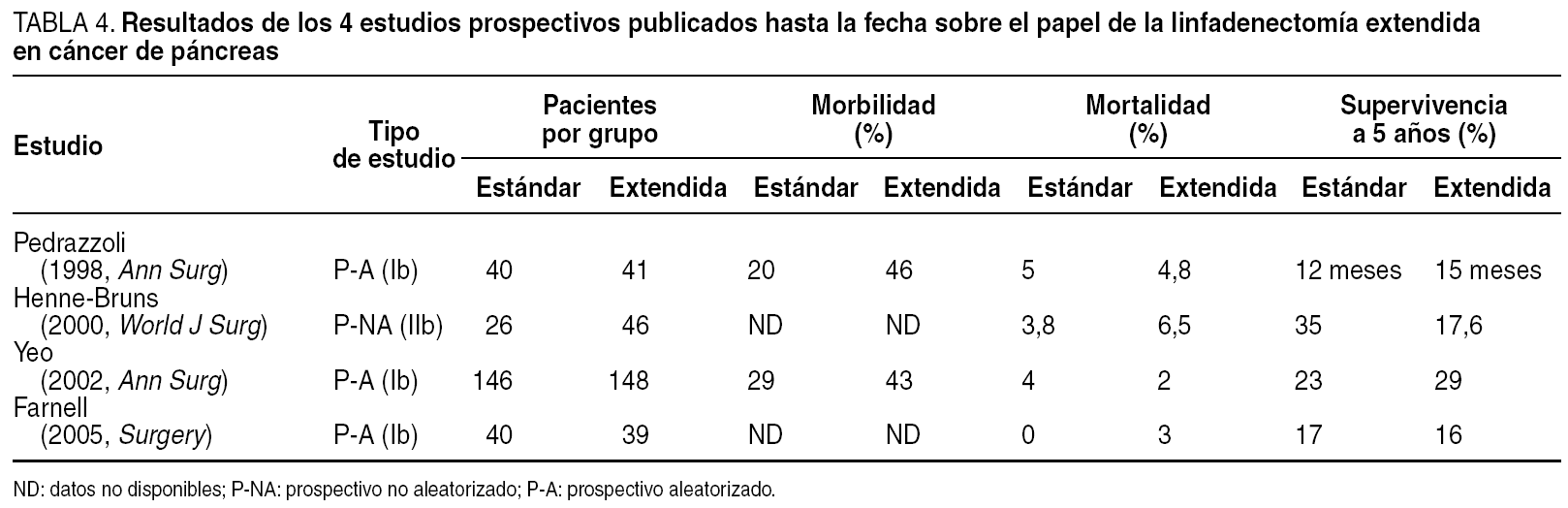
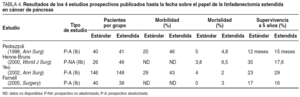
El empleo de la pancreatectomía radical o extendida, al añadir a la resección clásica una extensa linfadenectomía retroperitoneal, no ha logrado mejora alguna en las tasas de supervivencia, y sí un incremento en las de morbilidad59,60. Cuatro son los estudios que, con carácter prospectivo, se han publicado hasta la fecha (tabla 4), y en ninguno de ellos se ha demostrado beneficio alguno en términos de supervivencia60. Más aún, en un interesante estudio estadístico, el grupo del Anderson Cancer Center61 ha probado matemáticamente esta ausencia de beneficio calculando que sólo el 0,3% de los pacientes se beneficiarían de una linfadenectomía extendida. En este momento, los datos disponibles sugieren que las metástasis linfáticas son un marcador de enfermedad sistémica y que es improbable que su resección mejore la supervivencia de estos pacientes.
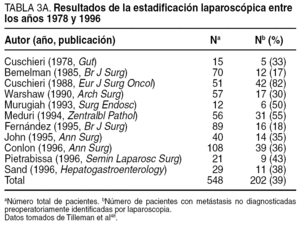
Finalmente, el empleo de resecciones vasculares debe considerarse, a nuestro juicio, como un logro técnico con escaso valor oncológico. Los últimos y más recientes estudios prueban que este tipo de resecciones pueden efectuarse con una morbilidad y una mortalidad mínimas, pero con un beneficio, en el mejor de los casos, dudoso.
Los defensores de las resecciones vasculares argumentan que ésta es la única forma de conseguir, en pacientes seleccionados, resecciones R0, y por ello mejorar su supervivencia. El análisis de las principales series de resección portal publicadas en occidente (tabla 5) que, como se observa, incluyen a un muy escaso número de pacientes, revela que este tipo de cirugía puede llevarse a cabo con una morbimortalidad similar a la de las resecciones estándar, aunque con un mayor tiempo operatorio, mayores requerimientos transfusionales y una estancia hospitalaria más prolongada. Se trata de tumores biológicamente muy agresivos, con tasas de afección ganglionar que oscilan entre el 42 y el 77% con invasión neural en más del 50% de los casos y una mayor indiferenciación histológica. Más aún, las tasas de márgenes quirúrgicos positivos (R1/R2) tras la resección pueden alcanzar hasta el 68% de los casos. Consideramos este último hecho como clave, pues la supervivencia de los pacientes en los que la resección ha sido paliativa no es mejor que la observada en pacientes con tumores localmente avanzados sometidos a radio y quimioterapia paliativa. Finalmente, cabe señalar que muchos autores consideran la invasión de la pared portal como un factor pronóstico per se relacionado con la presencia de micrometástasis. Por tanto, creemos que la invasión portal es el resultado de una mayor agresividad biológica tumoral más que un simple problema anatómico, por lo que este tipo de cirugía debe de considerarse un alarde técnico de mínimo valor oncológico. La resección portal sólo debería emplearse en centros especializados y en pacientes muy seleccionados, en los que exista una alta probabilidad de conseguir márgenes de resección negativos.
En conclusión, debemos considerar que estas técnicas "radicales" comportan una serie de riesgos quirúrgicos difícilmente asumibles fuera del seno de unidades especializadas, más aún si consideramos la escasa si alguna ganancia que en términos de supervivencia suponen. Eso sí, proporcionan una mayor satisfacción personal al cirujano al demostrarse que puede llevarse a cabo una mayor agresividad quirúrgica, al menos en centros de excelencia, sin un aumento de la morbimortalidad, pero sin incremento de la supervivencia23,55,59.
El postoperatorio inmediato también forma parte de la cirugía
La resección pancreática, y en especial la duodenopancreatectomía cefálica, posee unas tasas de complicaciones muy altas, que contrastan fuertemente con las mínimas tasas de mortalidad publicadas. Este hecho debe atribuirse a una mejor selección preoperatoria de los pacientes, a una mejora muy notable en la técnica quirúrgica y, sobre todo, a una mejora en los cuidados intensivos postoperatorios, donde desempeña un papel primordial la identificación temprana y un tratamiento agresivo de potenciales complicaciones37-40. Este último punto es clave: es un error considerar que no debemos tratar de forma agresiva a estos pacientes porque, de todas formas, su pronóstico es pésimo. En nuestra opinión, una de las claves del éxito del tratamiento quirúrgico actual del cáncer de páncreas radica en una estrecha vigilancia de la evolución postoperatoria de estos pacientes62, vigilancia que debe de reunir 2 condiciones: en primer lugar, que sea de 24 h, lo que enfatiza aún más si cabe el papel de las unidades especializadas multidisciplinarias, y en segundo lugar, que la toma final de las decisiones no dependa en exclusiva del mismo cirujano que ha operado al paciente. Al igual que ocurre en la evaluación de las lesiones iatrogénicas de la vía biliar, la objetividad aportada por cirujanos no directamente involucrados con el paciente es clave.
Incidentaloma pancreático intraoperatorio. ¿Qué hacer?
Aunque infrecuente, es posible descubrir de forma ocasional masas pancreáticas en el curso de una cirugía efectuada por otro motivo. En estos casos, consideramos un error tanto la resección como la toma de biopsias45,47. En estos pacientes se debe finalizar la intervención para la que fueron programados y, posteriormente, proceder a la evaluación de la masa pancreática. La resección no es recomendable porque ni el cirujano ni el paciente están preparados para afrontarla, y porque se desconoce la filiación histológica del tumor, y por ello si realmente la resección está indicada. Por otra parte, la toma de biopsias también la consideramos de escaso beneficio63. Un resultado negativo no excluye la malignidad y el daño infligido puede dificultar la evaluación de la masa mediante técnicas de imagen en el postoperatorio. Además, y con el objetivo de lograr el diagnóstico histopatológico más fiable posible, el cirujano con frecuencia intenta movilizar la masa, lo que hace más difícilmente interpretables las pruebas de imagen y más dificultosa una segunda laparotomía, en caso de que esta sea necesaria.
Correspondencia: Dr. J.A. Fernández.
Servicio de Cirugía General y Digestiva I. 3.a planta.
Hospital Universitario Virgen de la Arrixaca.
El Palmar, s/n. 301120 Murcia. España.
Correo electrónico: jumanjico@yahoo.com
Manuscrito recibido el 17-1-2005 y aceptado el 18-1-2006.