Introducción
No cabe ninguna duda de que la obesidad es en estos momentos una nueva epidemia. Más de 250 millones de personas la padecen en todo el mundo, y en España la prevalencia general de obesidad en la población adulta de 25 a 64 años se estima en un 15,5% de los que el 0,3% de los varones y el 0,9% de las mujeres presentan una obesidad mórbida (índice de masa corporal [IMC] > 40)1. En este grupo de pacientes está internacionalmente admitido que el único tratamiento efectivo es la cirugía, y también se puede operar a los pacientes con obesidad de grado II o premórbida (IMC entre 35 y 39) que presenten comorbilidades mayores, fundamentalmente metabólicas y/o cardiovasculares2.
Sin embargo, y aunque los resultados obtenidos son muy esperanzadores, la gran diversidad de modificaciones en los tres grupos principales de técnicas quirúrgicas (restrictivas, hipoabsortivas y mixtas) demuestra que no hay un adecuado fundamento fisiopatológico que permita diseñar la que se podría considerar más adecuada. Y ello muy probablemente se debe, por una parte, a las dificultades impuestas por la compleja etiopatogenia de la enfermedad y, por otra, a que los escasos modelos experimentales existentes, revisados recientemente por Sabench et al3, se han centrado más en el desarrollo y la resolución de problemas de técnica quirúrgica que en el análisis de los mecanismos fisiopatológicos (cerebrales, intestinales, tisulares y endocrinológicos) implicados en la pérdida de peso, en el mantenimiento del peso perdido o en la recuperación ponderal4.
En 1979, Scopinaro et al5 describieron en el perro la derivación biliopancreática; 20 años más tarde hay una importante experiencia clínica que demuestra que se trata de la técnica más efectiva para obtener una adecuada y mantenida pérdida de peso6. Sin embargo, la técnica presentaba un importante número de complicaciones, especialmente metabólicas, por lo que en 1989, previo estudio experimental en cerdos7, modificamos la técnica en un intento de reducir la principal secuela, la hipoproteinemia, alargando el canal alimentario. Por otra parte, Scopinaro también realizó diferentes modificaciones que finalmente le han llevado a proponer el último modelo, el "ad hoc stomach ad hoc alimentary limb"8, en el que también alargando el canal alimentario le permite obtener resultados prácticamente similares a los nuestros. Sin embargo, frente a la cada vez mayor preponderancia clínica de ambas técnicas, destaca el escaso conocimiento que tenemos sobre los factores que causan su mecanismo de acción a corto y largo plazo, motivo por el que diseñamos la realización del modelo en un animal de experimentación bien conocido en la investigación de la obesidad, la rata. En este trabajo comunicamos los aspectos técnicos del modelo y los primeros resultados de la historia natural de supervivencia y de las modificaciones ponderales que produce la intervención.
Material y metodo
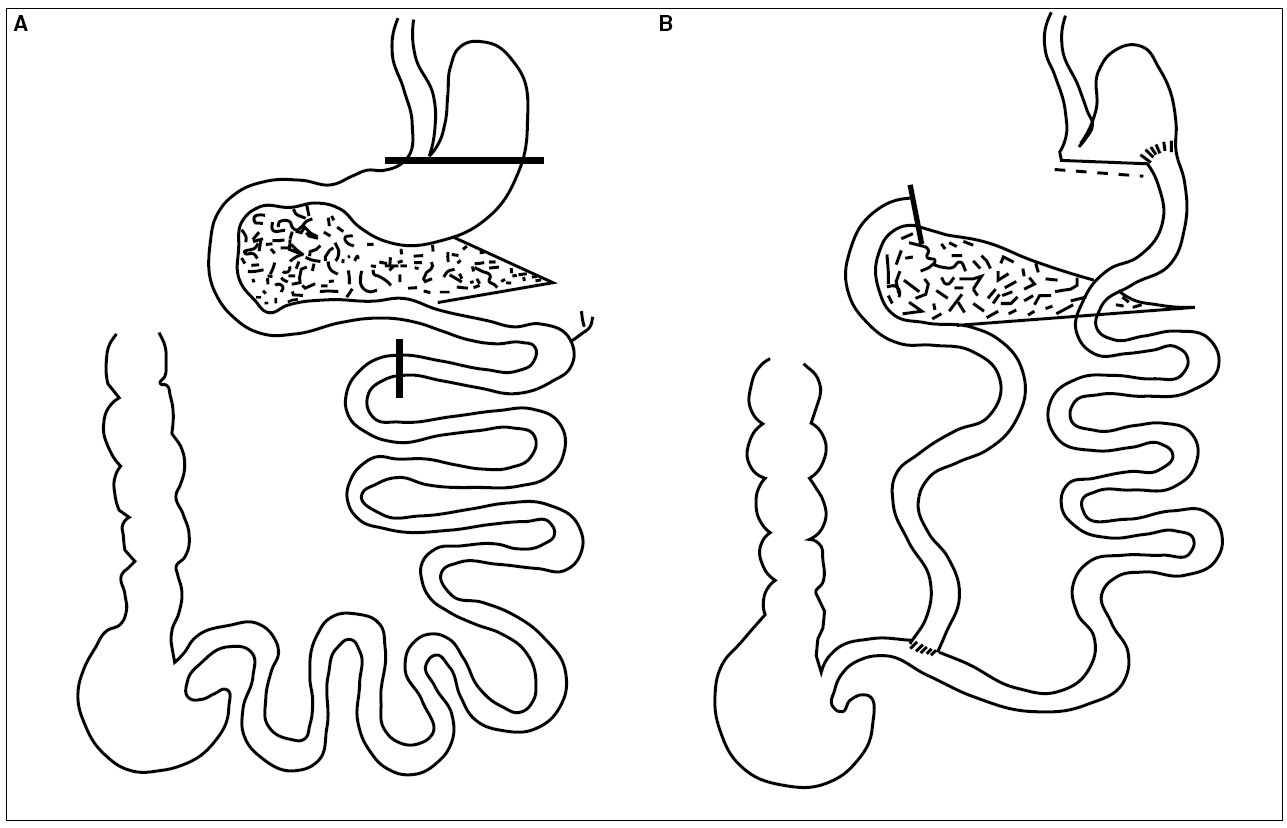
Siguiendo las normas éticas vigentes en el Departamento de Bioquímica y Biología Molecular de la Facultad de Medicina de la Universidad Complutense de Madrid, se estudia un grupo control (6 animales) y otro experimental (10 animales) de ratas machos de la cepa Wistar con un peso inicial mayor de 300 g. Previa separación de los animales en cajas individuales y ayuno de 24 horas previas a la cirugía son intervenidos con anestesia inhalatoria con una mezcla de 3 partes de halotano y 8 de oxígeno a través de una laparotomía media. Se realiza una sección del yeyuno proximal a 5 cm del ángulo de Treitz anastomosándose primero el cabo proximal al íleon terminal a 5 cm de la válvula ileocecal terminolateralmente con una sutura de puntos sueltos con seda 000000 (6/0). Tras liberar las adherencias laxas del estómago al hígado se procede a realizar una gastrectomía subcardial, previa liberación y hemostasia de los vasos gastroepiploicos, con sección gástrica mediante un disparo de Endo Ghia 30 de 3,5 mm (Multifire Auto Suture, Tyco Healthcare Spain SL) y sección duodenal subpilórica cerrando el cabo duodenal con un hemoclip Premium Surgiclip, L-13-O (Auto Suture, Tyco Healthcare Spain SL). Anastomosis del cabo distal del yeyuno al estómago a nivel del ángulo formado por la línea de sección gástrica y la curvatura mayor con puntos sueltos de seda 000000 (6/0). De esta forma se crea un canal biliopancreático que comprende el duodeno y los 5 cm proximales del yeyuno, un canal común de 5 cm de íleon terminal y un canal alimentario largo que comprende la casi totalidad del intestino delgado (fig. 1); la intervención es el reflejo de la utilizada en el humano9.
Fig. 1. A: esquema del intestino normal de la rata. Se indican las líneas de sección: gastrectomía subcardial, sección pospilórica y sección yeyunal a 5 cm del ángulo de Treitz. B: esquema de la derivación biliopancreática: gastroyeyunostomía a nivel de la unión de la línea de sección gástrica con la curvatura mayor. Cierre del muñón duodenal con una grapa. Yeyunoileostomía terminolateral a 5 cm de la válvula ileocecal.
Tras la intervención los animales se mantienen aislados durante 7 días con dieta exclusiva de agua con glucosa al 10%, adicionada de enrofloxacina (Baytril) (25 mg/kg) y meloxicam (Metacam) (1 mg/kg). A partir de la semana se alimentan ad limitum con una dieta estandar no suplementada de proteínas, minerales o vitaminas.
Se deja que todos los animales evolucionen espontáneamente y se los pesa semanalmente hasta la muerte espontánea o el sacrificio mediante decapitación antes de los 3 meses de la intervención al observarse claros signos de malnutrición (apatía, pérdida de movilidad, caída de pelo, hemorragias periorificiales), excepto un animal que progresivamente ganó peso. Las modificaciones ponderales se expresan como porcentaje de peso ganado o perdido y la media ± desviación estándar. El estudio estadístico se realiza mediante la prueba de la t para muestras independientes o apareadas.
Resultados
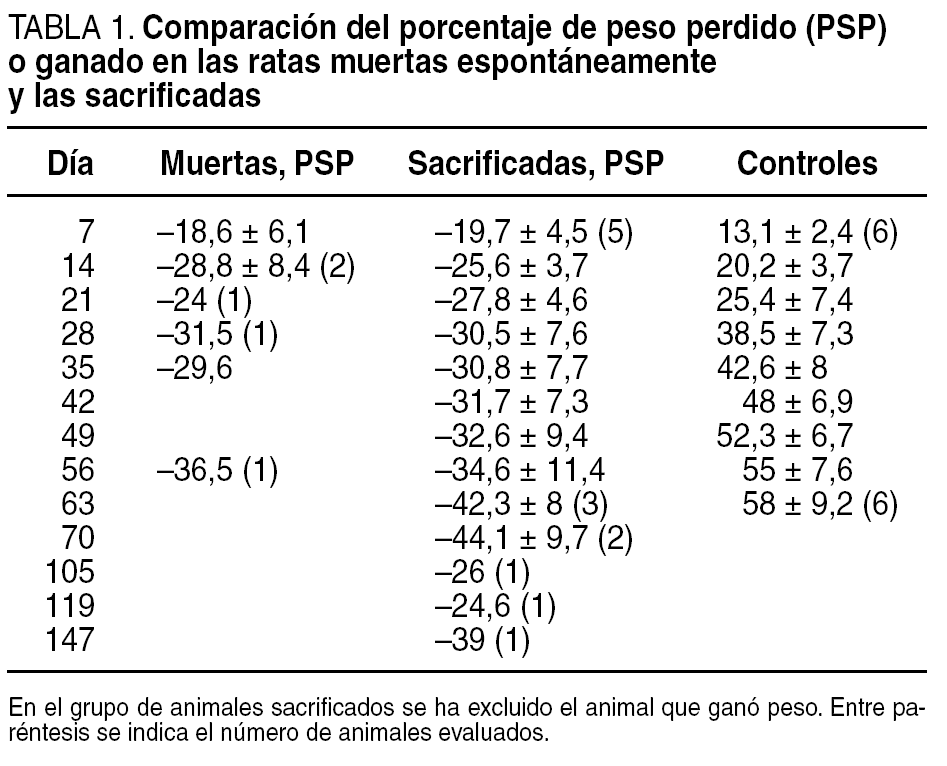
El peso inicial de los animales control se ha cifrado en 263,9 ± 15,8 (rango, 236,6-284,6) g y el de la serie experimental en 438,2 ± 90,4 (rango, 320-586) g. Los animales control ganan peso progresivamente desde un 13,1 ± 2,4% al séptimo día hasta el 58,2 ± 9,2% en el día 63 del sacrificio. De los animales sometidos a derivación biliopancreática (DBP), 5 (50%) fallecen espontáneamente a los 25 ± 17,5 (rango, 14-56) días, con pérdidas ponderales estadísticamente no significativas con respecto a los animales que sobrevivieron (29,5 ± 5,6% en los fallecidos y 38,9 ± 14,2% en los supervivientes; p = 0,192). De los 5 animales que sobrevivieron, 4 (80%) perdieron peso progresivamente y alcanzaron el máximo de pérdida ponderal entre los días 63 (42,3 ± 8%) y 70 (44,1 ± 9,7%); 1 (20%) animal del grupo superviviente pierde peso hasta el día 35 (44%), a partir de ese momento comienza a ganar peso hasta alcanzar un 7% el día 147, en que se lo sacrificó. Los valores ponderales se resumen en la tabla 1.
Las heces de todos los animales eran líquidas o pastosas durante los primeros 15-20 días, y posteriormente se normalizaron.
Discusión
Desde la introducción de la DBP por Scopinaro en 1979, ha quedado claramente demostrado que es la técnica más efectiva para perder peso y mantener dicha pérdida a largo plazo de las que dispone el arsenal quirúrgico para el tratamiento de la obesidad mórbida, y comparte con otras basadas en la realización de una Y de Roux un porcentaje muy similar de complicaciones10. Sin embargo, los mecanismos que controlan su forma de actuar son muy poco conocidos, quizá como consecuencia, al igual que sucede con otras técnicas, de la carencia de modelos experimentales. Por ello, y tras confirmar en el humano la validez de la modificación que realizamos desde 19899,11, nos planteamos la necesidad de disponer de un modelo similar en un animal que permitiera profundizar en el conocimiento fisiopatológico de la nueva situación funcional así creada. Si bien inicialmente trabajamos en el mini-pig con el fin de aclarar algunos aspectos técnicos7, se hizo evidente las limitaciones de manipulación de los animales grandes, motivo por el que finalmente seleccionamos la rata. Este animal, aunque dificulta o limita los aspectos de técnica quirúrgica, ofrece claras ventajas, como un manejo más fácil, la posibilidad de disponer de resultados en cortos períodos, disponer de un amplio arsenal de técnicas de laboratorio para determinar los distintos factores implicados en la regulación del apetito y el metabolismo o disponer de animales específicos manipulados genéticamente para estudiar aspectos concretos.
Una vez solventados los problemas técnicos podemos aceptar que el modelo de DBP en la rata es técnicamente viable, relativamente fácil con una mínima experiencia en microcirugía y biológicamente factible, con una baja mortalidad inducida por la intervención si se mantienen unos principios fundamentales de asepsia, cobertura antibiótica, analgesia y alimentación en el postoperatorio inmediato. Además, comparado con otros modelos como el mitad-mitad sección del intestino delgado a la mitad de su longitud, comunicado por Evrard et al12, nuestro modelo ofrece una mayor supervivencia espontánea que la obtenida por esos autores, quienes han comunicado que de un grupo de 30 animales los 10 supervivientes fallecieron entre los días 40 y 62 del postoperatorio.
Hay que destacar que los animales que fallecieron espontáneamente no mostraron claras diferencias ponderales respecto a los que sobrevivieron, por lo que la causa de muerte no parece relacionarse con la cantidad de peso perdido ni con las características de las heces, similares en ambos grupos. De hecho, las características de las heces no parece que marquen, al menos durante las primeras 3 semanas, la posterior evolución de los animales.
El análisis de la historia ponderal de los animales intervenidos aporta resultados sumamente interesantes, pues se asemejan mucho a los resultados obtenidos en humanos. A corto plazo (20-35 días) la mitad de los animales operados fallecen con signos indicativos de malnutrición severa (caída de pelo, hemorragias oculares) lo cual es previsible si se tiene en cuenta que, en este período de máxima restricción de ingesta, la dieta no es suplementada en proteínas como, obligatoria y regularmente, se realiza en el humano. En la otra mitad de los animales que sobreviven a este primer período se produce una progresiva pérdida de peso hasta los 70 días, seguida de una estabilización o lenta pérdida ponderal hasta el momento de su sacrificio. Sin embargo, ha sido muy revelador observar que algunos animales (el 20% en este experimento) recuperan el peso perdido e inician una curva ponderal de lenta recuperación de peso. Esta ganancia ponderal en algunos animales se asemeja a los resultados obtenidos en humanos en los que, con técnicas hipoabsortivas, ya se había indicado esta posibilidad13,14. Específicamente con la DBP, alrededor de un 25% de los pacientes ganan una cantidad variable de peso11, cifra muy semejante a la obtenida en este grupo de animales.
Independientemente de las innumerables posibilidades de estudio que ofrece el modelo en los mecanismos que controlan el apetito, la saciedad o la regulación metabólica, estos primeros resultados en nuestro modelo ponen en evidencia la importancia de la investigación del mecanismo de adaptación intestinal, como ya lo propusieron Levi et al15 o Evrard et al12,16, y su potencial regulación para intentar controlar la evolución de los pacientes operados con técnicas hipoabsortivas, pues parece que, como en el humano, se delimitan claramente 2 poblaciones de animales, los que mantendrán el peso perdido y los que lo ganarán nuevamente, cuyas características, posiblemente genéticas, habrá que analizar.
En resumen, y a pesar de la simplicidad de los objetivos de este primer experimento, podemos concluir que hemos desarrollado un modelo de DBP en la rata técnicamente factible, que reproduce resultados muy similares a los obtenidos en humanos, al menos desde el punto de vista ponderal, y que, debido a la buena supervivencia de gran parte de los animales, permite abrir una larga línea de investigación sobre los mecanismos neuroendocrinos y metabólicos de control del apetito y peso, sobre los fundamentos fisiopatológicos que controlan el mecanismo de acción de la intervención, así como sobre los fenómenos de adaptación intestinal que pueden condicionar el éxito o el fracaso de la intervención en un grupo de pacientes que pueden estar sometidos a una respuesta genética diferente.
Agradecimientos
A Dña. Soledad del Río y a la Empresa Conidien por la ayuda prestada pata la realización de este trabajo.
Trabajo subvencionado por una Beca de Investigación de la Fundación Mutua Madrileña.
Correspondencia: Dr. A. Larrad Jiménez.
Rafael Bergamín, 12, ático C, escalera izquierda. 28043 Madrid. España.
Correo electrónico: LARRAD@inicia.es
Manuscrito recibido el 18-6-2007 y aceptado el 6-11-2007.