El trasplante simultáneo de páncreas-riñón se encuentra indicado para pacientes con diabetes tipo 1 y enfermedad renal terminal. Los resultados son excelentes aunque el número de procedimientos parece ser un factor que afecta a la supervivencia de paciente e injerto estando en relación con la morbilidad quirúrgica, derivada de complicaciones pancreáticas. el objetivo del estudio es describir el desarrollo de un nuevo programa y exponer los resultados en un centro con un volumen bajo de trasplantes.
MétodosAnalizamos 53 trasplantes simultáneos de páncreas-riñón, en un período de 7 años (2009-2016), con una mediana de seguimiento de 39 meses.
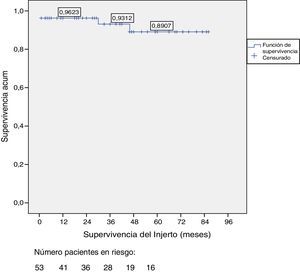
ResultadosDos pacientes han fallecido, uno tras parada cardíaca en postoperatorio y otro tras accidente de tráfico complicado con una neumonía. Entre los 51 pacientes vivos se han perdido 2 injertos, uno por un rechazo crónico tras cuatro años del trasplante y otro por trombosis arterial a los 20 días del mismo, motivo, este último, de la única trasplantectomía realizada. En diez pacientes se han realizado una o más reintervenciones: pancreatitis (n=3), oclusión intestinal (n=4), trombosis arterial (n=1), fístula con peritonitis (n=1) y hemoperitoneo (n=1). La supervivencia del paciente y del injerto a 1, 3, y 5 años fue del 98, 95 y 95% y del 96, 93 y 89%, respectivamente.
ConclusionesLos resultados muestran que un nuevo programa de trasplante pancreático puede conseguir resultados similares a los de grupos con mayor volumen y experiencia. Una adecuada selección de donantes y receptores, una técnica homogénea y el aprendizaje con grupos expertos garantizan estos resultados.
Simultaneous kidney-pancreas transplantation for patients with type 1 diabetes and end-stage chronic renal disease is widely performed. However, the rate of surgical morbidity from pancreatic complications remains high. The aim of this study was to describe the development and results of a new program, from the point of view of the pancreatic surgeon.
MethodsWe analyzed 53 simultaneous kidney-pancreas transplantations performed over a period of seven years (2009-2016), with a median follow up of 39 months (range: 1-86 months).
ResultsOut of the total of this series, two patients died: one patient because of cardiac arrest immediately after surgery; and another patient due to traffic accident, complicated by pneumonia. Among the 51 living patients, two grafts were lost: one due to chronic rejection four years after transplantation; and the other due to arterial thrombosis 20 days after transplantation (the only case requiring transplantectomy). In ten patients, one or more re-operations were necessary due to the following: graft pancreatitis (n=4), small intestinal obstruction (n=4), arterial thrombosis (n=1), fistula (n=1) and hemoperitoneum (n=1). Overall patient and graft survival rates after 1, 3 and 5 years were 98, 95 and 95% and 96, 93 and 89%, respectively.
ConclusionsThis study has shown that the results of a new pancreas transplant program, which relies on the previous experience of other groups, do not demonstrate a learning curve. Adequate surgeon education and training, as well as the proper use of standardized techniques, should ensure optimal results.
Desde el primer trasplante realizado en 1966 el trasplante de páncreas ha evolucionado progresivamente mejorando tanto los aspectos técnicos, derivación venosa sistémica y derivación entérica de la secreción exocrina, como la inmunosupresión, lo que finalmente se refleja en las mejoras en la supervivencia del paciente y del injerto1,2.
Algunos autores refieren que uno de los múltiples factores que pueden afectar a la supervivencia es el número de procedimientos que se realizan al año, lo que sería un marcador subrogado de la experiencia y calidad global del centro3,4. En esta línea, algunos equipos han publicado resultados desalentadores relacionados con problemas quirúrgicos en las primeras etapas, es decir, durante el teórico periodo de aprendizaje5,6. Por ello, consideramos de interés presentar nuestros resultados dado que se dan las dos circunstancias, ser un centro de bajo volumen y encontrarse en su etapa inicial.
En España, el profesor Fernández-Cruz inició el primer programa de trasplante pancreático en 19837; desde entonces, múltiples programas se han establecido en diferentes instituciones. En el año 2016 permanecían activos 11 programas de trasplante de adultos que realizaron un total de 70 trasplantes.
En este estudio recogemos la experiencia del programa de trasplante pancreático del Hospital Clínico Universitario de Salamanca a lo largo de 7 años. En este periodo se han realizado un total de 53 trasplantes todos ellos simultáneos de páncreas – riñón (SPK).
Describimos los resultados obtenidos con relación a la supervivencia del paciente y del injerto pancreático con el objetivo de evaluar si dichos resultados son equiparables a centros con mayor volumen de trasplantes y más experiencia.
MétodosEstudio observacional retrospectivo sobre base de datos prospectiva y auditada por el Ministerio de Sanidad y Consumo, que incluye todos los trasplantes efectuados (n: 53) durante el periodo de estudio (marzo 2009 – mayo 2016).
Donantes. Para la selección de donantes se siguieron los criterios establecidos en el Documento de Consenso de 1995 por la Organización Nacional de Trasplantes8.
Receptores. Para el estudio y selección de receptores también se siguieron las recomendaciones del Documento de Consenso de la Organización Nacional de Trasplantes8. El área geográfica asignada al grupo de Salamanca es la Comunidad de Castilla y León con 2.400.000 habitantes y desde el año 2012 la Comunidad de Extremadura con 1.099.000 habitantes. Desde enero de 2014 estamos acreditados como Centro de Referencia Nacional.
A todos se les realizó un estudio de SPECT preoperatorio seguido de coronariografia. En tres pacientes fue necesaria la colocación de stents coronarios pretrasplante.
El estudio de los ejes vasculares aortoilíacos se realizó mediante angio-TAC.
Todos los trasplantes fueron simultáneos de páncreas – riñón..
El estudio fue aprobado por el Comité de Ética del Hospital Universitario de Salamanca.
Procedimiento quirúrgicoEl equipo. Está formado por 4 cirujanos con dedicación especial y amplia experiencia en cirugía hepática y pancreática. El cirujano sénior cuenta asimismo con experiencia en trasplante hepático. Recibió formación específica en trasplante de páncreas en la Universidad de Wisconsin-Madison (Wisconsin, EE. UU.) con el Profesor Sollinger y con el Profesor Padillo en el Hospital Reina Sofía de Córdoba.
Operación en el donante. El equipo realiza la extracción del páncreas y del hígado mediante disección in situ de los pedículos vasculares y extracción aislada de los órganos. La perfusión se realizó en los primeros 23 casos con solución de Wisconsin (Viaspan, Bristol-Myers Squibb, Madrid, España) posteriormente con Celsior (Genzyme SL, Madrid, España). La mediana de duración del procedimiento fue de 180 min (r: 140 – 240 min).
Preparación del injerto. La técnica quirúrgica utilizada reproduce fielmente los fundamentos publicados previamente por nuestro equipo9. El trabajo de banco ocupa una mediana de 150 min (r: 110–220 min).
Técnica en el receptor. Se realiza derivación venosa sistémica y drenaje entérico y queremos resaltar dos detalles técnicos que consideramos de interés. En primer lugar, tras la anastomosis portocava colocamos un clamp en la vena porta lo que permite retirar el situado en cava, restaurando así el retorno venoso. Esto permite evaluar la estanqueidad de la anastomosis venosa, reparándola si es preciso. Igualmente, tras la anastomosis arterial colocamos un clamp en el injerto arterial y retiramos el situado en la arteria ilíaca para liberar la circulación del miembro inferior derecho y revisar la anastomosis.
En segundo lugar, durante el inicio de la reperfusión abrimos la vena mesentérica inferior del injerto, la cual hemos controlado previamente en el banco con una ligadura larga, y dejamos fluir unos 200ml de la sangre del receptor. (Aportación personal del Dr. Padillo Ruiz, no publicado previamente).
Esta maniobra, no solo intenta lavar el injerto, sino evitar la hiperpresión y posible daño endotelial y tisular en un órgano de bajo flujo como es el páncreas.
El drenaje entérico se realiza mediante anastomosis manual biplano del duodeno a un asa de intestino a 60cm del ángulo de Treitz. La mediana del procedimiento es de 155 min (r: 130 - 180 min) y la mediana del tiempo de isquemia fría ha sido de 11 h (r: 6-14 h). No administramos anticoagulación sistémica intravenosa en ningún caso.
Postoperatorio. La profilaxis antitrombótica se realizó mediante la administración de 300mg de ácido acetilsalicílico en el preoperatorio y posteriormente dosis permanente de 100mg/día. Así mismo y hasta el alta, se añadió a dosis profilácticas, heparina de bajo peso molecular.
La monitorización postoperatoria incluye analíticas diarias de sangre, orina y del líquido de los drenajes, en estos últimos se determina amilasa, bilirrubina y en caso de sospecha de infección intraabdominal cultivo y antibiograma; ecografía abdominal y determinación de flujos vasculares. La evolución clínica determina la realización de otras pruebas complementarias.
La sospecha de fístula: pancreática, anastomótica o de los extremos del duodeno, o la presencia de una pancreatitis del injerto se establece ante la existencia de dolor abdominal, fiebre, leucocitosis, aumento de las cifras de amilasas en los drenajes, con o sin presencia de bilirrubina e hiperamilasemia. La confirmación se realiza ante los hallazgos radiológicos de líquido libre intraabdominal, colecciones alrededor del injerto, o la presencia de edema y zonas de necrosis en el mismo.
Ante la sospecha clínica de trombosis arterial o venosa: dolor en la zona del implante, hiperglucemia y aumento brusco de las necesidades de insulina, se solicita de forma urgente un ecodopler seguido, según hallazgos, de angiorresonancia y arteriografía.
No se han realizado estudios para el diagnóstico de posibles trombosis parciales asintomáticas.
Inmunosupresión y seguimiento. La inducción se ha realizado con timoglobulina (1,5mg/kg/día durante 5 días) y el mantenimiento de la terapia inmunosupresora estuvo basado en tacrolimus, micofenolato mofetil, y prednisolona.
Los pacientes, tras el alta, acuden con frecuencia decreciente a la consulta de nefrología, endocrinología y cirugía. Los datos relativos a inmunosupresión, supervivencia del paciente y del injerto son remitidos al registro nacional con sede en la ONT cada 6 meses.
Hemos excluido del presente estudio los datos relativos a complicaciones médicas o urológicas. En el grupo presentado no hemos precisado de biopsia del injerto pancreático.
Se considera función completa del injerto la no necesidad de dieta, insulina ni ningún otro tipo de hipoglucemiantes para mantener glucemias y cifras de hemoglobina glicosilada en la normalidad. A efectos estadísticos la muerte con injerto funcionante se considera pérdida del injerto.
La media de seguimiento de los pacientes fue de 40 meses (mediana: 39), la fecha establecida para el análisis de datos de supervivencia se estableció en el 30 de mayo de 2016.
Análisis estadísticoLa media, mediana, rango, desviación estándar y el intervalo de todas las variables continuas fueron calculadas usando el paquete software SPSS (SPSS 20.0 Inc., Chicago, IL EE. UU.); las frecuencias se informan para variables dicotómicas. Las curvas de supervivencia de pacientes y de injerto fueron calculadas por el método de Kaplan-Meier.
ResultadosDonantes: el grupo estuvo formado por 32 hombres y 21 mujeres con una mediana de edad de 34 años (r: 17-52). Las causas más frecuentes de fallecimiento fueron el accidente cerebrovascular agudo con 30 casos, seguido del traumatismo craneoencefálico con 18 y 5 fallecimientos de diferentes causas. El índice de masa corporal (IMC) de los donantes osciló entre 19 y 28.
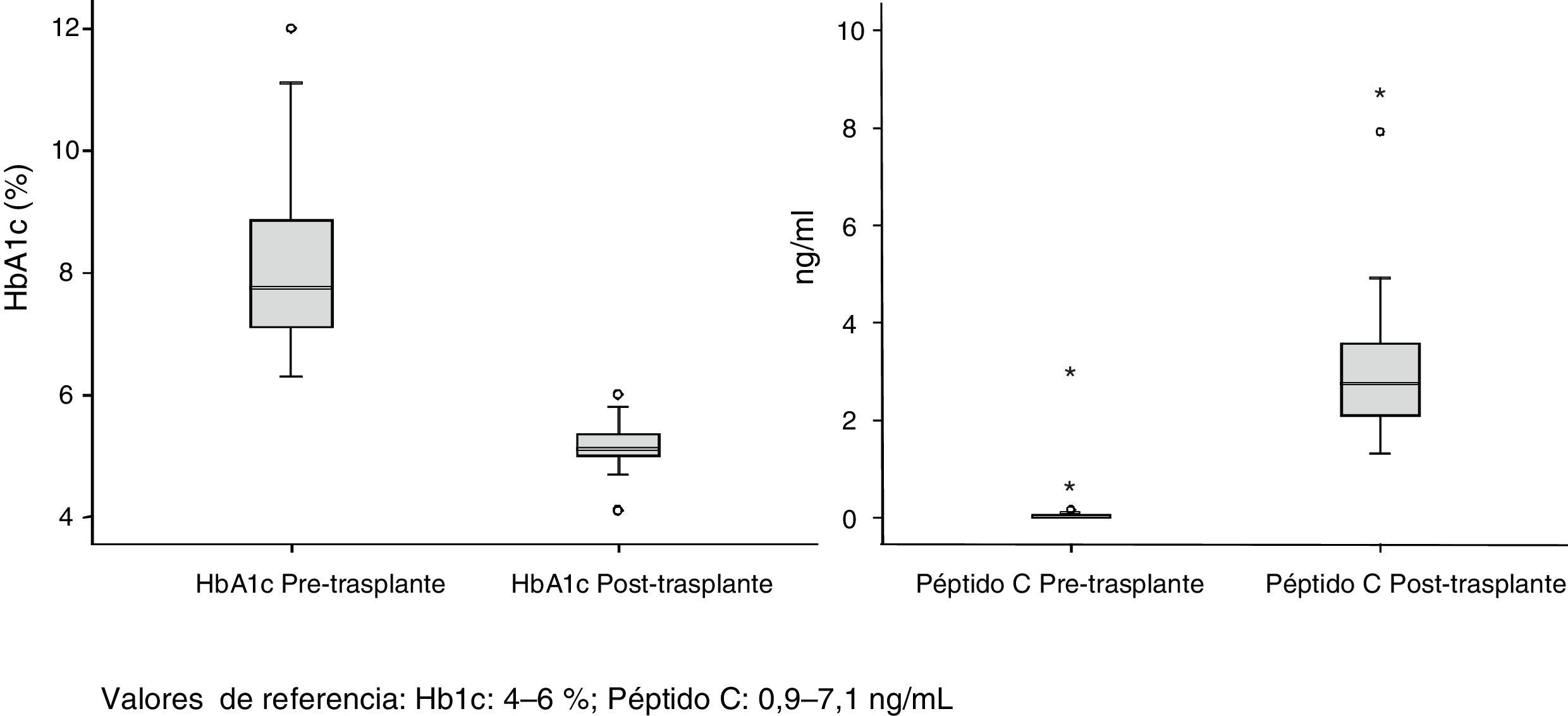
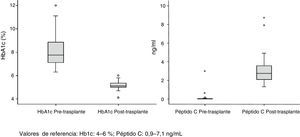
Del total de 53 receptores (40 hombres y 13 mujeres) 32 se encontraban en hemodiálisis, 17 en diálisis peritoneal y 4 en prediálisis. El tiempo medio de tratamiento sustitutivo renal fue de 48 meses. La mediana de edad de los receptores en el momento del trasplante fue de 40 años (r: 31-52) y el IMC de 23. Todos los pacientes analizados presentaron diabetes mellitus tipo 1 (DMT1), salvo un caso que mostró diabetes tipo Maturity Onset Diabetes of the Young «Mody». El seguimiento medio de la DMT1 fue de 25 años con un nivel preoperatorio medio de HbA1c de 8%. La mediana de tiempo en lista de espera fue de 71 días (r: 2-310 días).
La mediana de estancia hospitalaria durante el trasplante fue de 16 días (r: 9-49).
Diez pacientes (19%) precisaron una o mas reintervenciones. Se diagnosticó pancreatitis del injerto en 3 casos. Uno de estos pacientes presentó una necrosis infectada de la grasa peripancreática más que del propio parénquima que se trató mediante laparotomía, lavado, desbridamiento y drenaje. En otro caso, se produjo una auténtica pancreatitis necrohemorrágica segmentaria, con mantenimiento de la glucemia, que obligó a dos reintervenciones para desbridamiento y lavado y permitió la supervivencia del paciente y del injerto que sigue funcionando a día de hoy. El último reintervenido presentaba una pancreatitis edematosa con colecciones peripancreáticas que se resolvió con lavado y drenaje.
Obstrucción de intestino delgado por adherencias en 4 pacientes que se resolvieron mediante laparotomía y liberación de adherencias.
Un paciente fue reintervenido por sangrado peritoneal procedente de una colateral del injerto ilíaco usado en la reconstrucción arterial, se trató mediante laparotomía urgente y hemostasia. Un paciente presentó trombosis arterial del injerto a los 20 días del trasplante con pérdida de la función e infección añadida que obligó a trasplantectomía inmediata.
Por último, un paciente fue reoperado en 3 ocasiones por peritonitis secundaria a fístula de la anastomosis intestinal, resuelta inicialmente con laparotomía, lavado, drenaje y finalmente mediante transformación de la anastomosis duodeno-yeyunal laterolateral, en una Y de Roux.
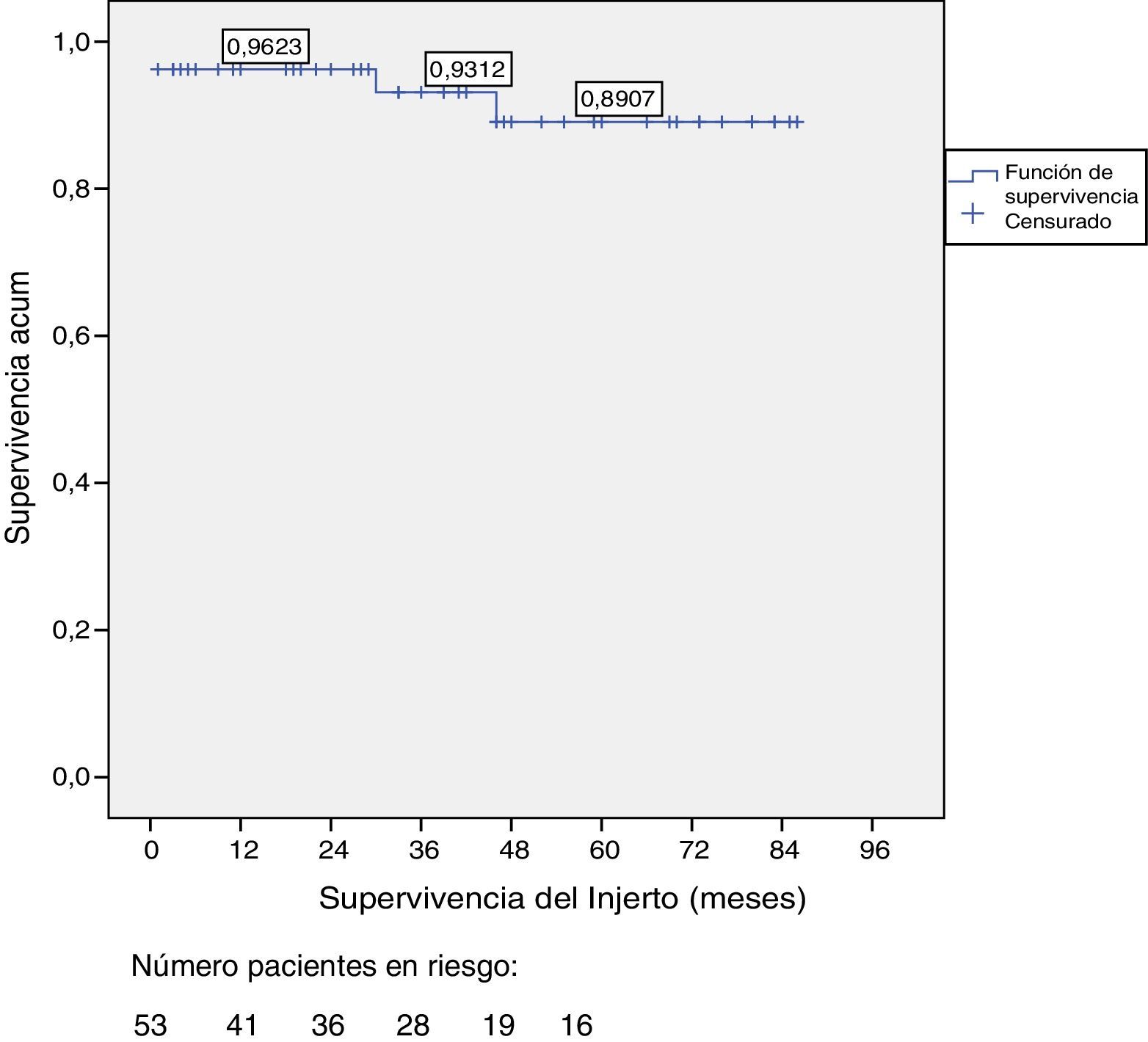
Supervivencia del paciente y del injertoAl final del estudio (mayo 2016) de los 53 pacientes trasplantados, permanecían vivos 51, de los cuales, 49 conservan una función pancreática completa. La mediana de seguimiento global es de 39 meses.
La supervivencia del paciente fue del 98, 95 y 95% a uno, 3 y 5, con dos fallecimientos, uno producido en el postoperatorio inmediato por parada cardiaca y otro, a los 30 meses del trasplante, a causa de un accidente de tráfico que provocó una neumonía, causa última del éxitus.
La supervivencia del injerto a uno, 3 y 5 años fue del 96, 93 y 89%, respectivamente (fig. 1). La causa de pérdida del injerto pancreático fue, en dos casos por la muerte del paciente con injerto funcionante, en las otras dos ocasiones por una trombosis arterial, ya comentada, y por un rechazo crónico a los 4 años del trasplante. La figura 2 muestra el cambio producido en la concentración de hemoglobina glicosilada pre- y postrasplante, así como el comportamiento del péptido C.
DiscusiónLa puesta en marcha de un programa de trasplante pancreático es, en ocasiones, de una tremenda complejidad para los cirujanos de trasplante. Debemos superar las reticencias de los nefrólogos acostumbrados al trasplante renal aislado, del cual tienen una larga experiencia; por el contrario, la introducción del trasplante de páncreas les provoca ciertas dudas generadas por la alta tasa de reintervenciones secundarias a complicaciones del injerto pancreático que fueron descritas hace unas décadas.
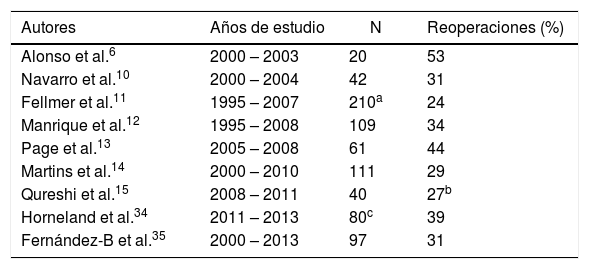
De hecho, aún hoy en día observamos series con tasas de reintervenciones, derivadas del trasplante pancreático, de entre 20 al 53% (tabla 1) e incluso algunos centros han reportado tasas del 83% durante su periodo inicial5.
Tasa de reoperaciones en diferentes series de trasplantes simultáneos de páncreas-riñón con drenaje entérico
| Autores | Años de estudio | N | Reoperaciones (%) |
|---|---|---|---|
| Alonso et al.6 | 2000 – 2003 | 20 | 53 |
| Navarro et al.10 | 2000 – 2004 | 42 | 31 |
| Fellmer et al.11 | 1995 – 2007 | 210a | 24 |
| Manrique et al.12 | 1995 – 2008 | 109 | 34 |
| Page et al.13 | 2005 – 2008 | 61 | 44 |
| Martins et al.14 | 2000 – 2010 | 111 | 29 |
| Qureshi et al.15 | 2008 – 2011 | 40 | 27b |
| Horneland et al.34 | 2011 – 2013 | 80c | 39 |
| Fernández-B et al.35 | 2000 – 2013 | 97 | 31 |
Los datos del último registro internacional referido a la pérdida del injerto en los primeros 90 días postrasplante presentan un descenso progresivo, mostrando para los pacientes con SPK trasplantados antes de septiembre de 2015 una tasa del 6%16.
El cirujano que pretende desarrollar un programa de trasplante pancreático, debe por tanto enfrentarse a la realidad de un trasplante que tiene una morbilidad quirúrgica importante, derivada fundamentalmente del implante de un órgano con secreción exocrina, cuando realmente solo se necesita la función endocrina. Si sumamos a lo anterior, la esperanza que depositan los pacientes y la propia sociedad, nos encontramos con que el desarrollo inicial de cualquier programa de trasplantes se convierte en un reto para el equipo quirúrgico, más allá de las razones técnicas. Por eso la implicación y complicidad de todos los especialistas y del conjunto del hospital es un pilar fundamental.
La formación del equipo quirúrgico y la presencia del cirujano sénior en todas las fases del trasplante, puede contribuir no solo a la estandarización de la técnica sino a una disminución de las complicaciones como muy bien reflejaron Sollinger et al.17.
Algunos autores proclaman que el volumen del centro también desempeña un papel en los resultados. Con respecto a esta afirmación, Mandal et al.3 han mostrado que los centros de bajo volumen de trasplante de páncreas (<10 trasplantes/año) tienen peores resultados en la supervivencia del injerto comparado con los de medio (10-20 trasplantes/año) o alto volumen (>21 trasplantes/año).
Por otra parte, Alhamad et al.18 en un estudio publicado recientemente confirma, que los grupos con menor volumen (1-6 trasplantes/año) tienen peor supervivencia del injerto pancreático que aquellos de volumen medio (7-13) o alto (14-34).
En su análisis encuentra algo que no consigue explicar y es que aparecen una serie de grupos con bajo volumen cuyos resultados, en relación con la supervivencia del injerto, son superiores a los centros con mayor volumen. Ante estos hallazgos considera que son necesarios nuevos estudios que sirvan para identificar los factores que determinan unos resultados excelentes y que son independientes del número de trasplantes realizados.
Efectivamente, nuestro centro realiza un número pequeño de trasplantes (5-9/año) y los resultados aquí expuestos son alentadores e incluso mejoran, en relación con la supervivencia y número de reintervenciones, a centros con mayor volumen, probablemente debido a la introducción de los regímenes actuales de inmunosupresión, los cambios actuales de la técnica quirúrgica, la selección de donantes y receptores, así como al hecho, no menor, de que se trata de una serie reciente.
Un análisis de las complicaciones quirúrgicas habituales muestra que la tasa de trombosis venosa se sitúa alrededor del 5%19, pero cuando analizamos las series de grupos recientes, similares al nuestro, con SKP realizados en la última década, tenemos unas tasas del 10-20%20–23. Incluso centros con gran volumen de trasplantes24 refieren una incidencia de trombosis venosa superior al 9% en trasplantes realizados desde el año 2008. Las posibles razones para explicar la ausencia de casos de trombosis venosa tras 53 trasplantes pueden ser: no usar una extensión de vena porta, abrir la cava extirpando un óvalo de la misma, extrema minuciosidad en la anastomosis evitando dar puntos sueltos complementarios una vez finalizada, una adecuada selección de donantes y receptores y lo reciente de la serie. Así mismo, pensamos que evitar la brusca reperfusión mediante el lavado del injerto podría ser un factor de prevención de daño vascular. No obstante, nuestra serie es corta, por ello se debe analizar este dato con cautela.
La hemorragia intraabdominal sigue siendo una de las causas más frecuentes de reintervención aunque en franca disminución en los últimos años con cifras entre el 5 al 11%12,14,25,26. En nuestra serie solo hay un caso y hemos seguido la práctica habitual en el grupo de Wisconsin de no heparinización tras la reperfusión, creemos que no heparinizar no aumenta el riesgo de trombosis y por el contrario disminuye la posibilidad de hemorragia, este hecho y una técnica depurada en el banco y en el implante permiten evitar esta complicación.
La pancreatitis del injerto, en sus diferentes grados, es una complicación quirúrgica frecuente11 y obliga en numerosas ocasiones a la reintervención. En la literatura esta complicación es difícil de evaluar debido a la falta de uniformidad en la definición de pancreatitis, manifestadas en algunos casos solamente por la aparición de amilasa en el drenaje y que probablemente no deberían incluirse, dado que no tienen relevancia clínica y no serían diagnosticadas si el paciente no tuviera un drenaje en el postoperatorio.
La pancreatitis grave es consecuencia generalmente de: procesos infecciosos, inmunológicos (rechazo) o secundaria a problemas técnicos como la trombosis del injerto. Sus complicaciones: infección, fístulas, abscesos y necrosis son las que llevan en última instancia a la pérdida del injerto. Se consideran como desencadenantes múltiples factores asociados con el donante, la extracción, el síndrome de isquemia reperfusión y la estructura del propio páncreas.
Quisiéramos destacar que en uno de nuestros pacientes la reintervención mostró una necrosis de la grasa que rodea al páncreas e incluso lo infiltra, lo que denominamos como peripancreatitis del injerto. Esto pudo ser debido a la obesidad del donante y a una preparación insuficiente del injerto en el banco, lo que conlleva una inadecuada perfusión con necrosis de las zonas grasas residuales. A partir de ese momento decidimos ser muy estrictos en aceptar donantes obesos (IMC>30) o aquellos en los que, durante la extracción, se observe una extensa infiltración grasa del páncreas.
La derivación entérica, realizada en todos los pacientes del estudio, no parece que tenga influencia en la tasa de fallos técnicos, a pesar de que numerosas publicaciones advierten que dicha técnica no influye en la supervivencia del injerto pero sí provoca un mayor porcentaje de problemas técnicos1,17.
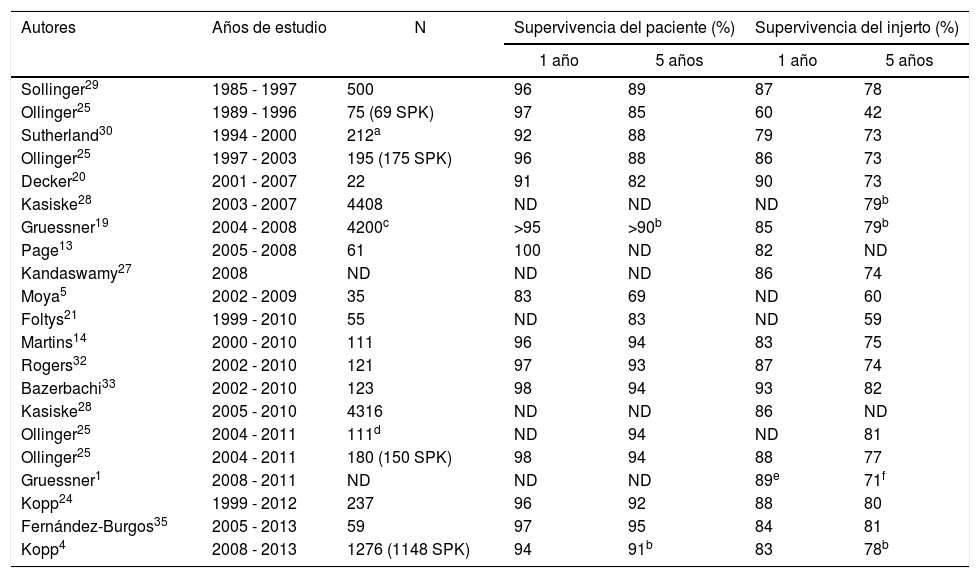
Supervivencia del pacienteLa supervivencia de los pacientes trasplantados de páncreas-riñón se mantiene prácticamente estable en las últimas décadas siendo mayor del 90% al año y 85% a los 5 años. Las series históricas de grandes grupos o del registro internacional (International Páncreas Transplant Registry) referidos a los años 80 y 90 muestran tasas de supervivencias entre 92 y 96% al año y del 85 al 88% a los 5 años (tabla 2). Los estudios publicados a partir del año 2000 muestran, tanto en series monocentro como en el análisis del International Páncreas Transplant Registry, supervivencias superiores al 95 y 89% a uno y 5 años, respectivamente16.
Supervivencia de paciente e injerto en diferentes series, a uno y 5 años, en trasplante simultáneo de páncreas-riñón
| Autores | Años de estudio | N | Supervivencia del paciente (%) | Supervivencia del injerto (%) | ||
|---|---|---|---|---|---|---|
| 1 año | 5 años | 1 año | 5 años | |||
| Sollinger29 | 1985 - 1997 | 500 | 96 | 89 | 87 | 78 |
| Ollinger25 | 1989 - 1996 | 75 (69 SPK) | 97 | 85 | 60 | 42 |
| Sutherland30 | 1994 - 2000 | 212a | 92 | 88 | 79 | 73 |
| Ollinger25 | 1997 - 2003 | 195 (175 SPK) | 96 | 88 | 86 | 73 |
| Decker20 | 2001 - 2007 | 22 | 91 | 82 | 90 | 73 |
| Kasiske28 | 2003 - 2007 | 4408 | ND | ND | ND | 79b |
| Gruessner19 | 2004 - 2008 | 4200c | >95 | >90b | 85 | 79b |
| Page13 | 2005 - 2008 | 61 | 100 | ND | 82 | ND |
| Kandaswamy27 | 2008 | ND | ND | ND | 86 | 74 |
| Moya5 | 2002 - 2009 | 35 | 83 | 69 | ND | 60 |
| Foltys21 | 1999 - 2010 | 55 | ND | 83 | ND | 59 |
| Martins14 | 2000 - 2010 | 111 | 96 | 94 | 83 | 75 |
| Rogers32 | 2002 - 2010 | 121 | 97 | 93 | 87 | 74 |
| Bazerbachi33 | 2002 - 2010 | 123 | 98 | 94 | 93 | 82 |
| Kasiske28 | 2005 - 2010 | 4316 | ND | ND | 86 | ND |
| Ollinger25 | 2004 - 2011 | 111d | ND | 94 | ND | 81 |
| Ollinger25 | 2004 - 2011 | 180 (150 SPK) | 98 | 94 | 88 | 77 |
| Gruessner1 | 2008 - 2011 | ND | ND | ND | 89e | 71f |
| Kopp24 | 1999 - 2012 | 237 | 96 | 92 | 88 | 80 |
| Fernández-Burgos35 | 2005 - 2013 | 59 | 97 | 95 | 84 | 81 |
| Kopp4 | 2008 - 2013 | 1276 (1148 SPK) | 94 | 91b | 83 | 78b |
ND: no datos.
Nuestros resultados, supervivencia del 95% a los 5 años, son muy satisfactorios y están en concordancia con los de grandes centros de trasplante25. En este aspecto, no parece que la posible inexperiencia o el número de procedimientos sea una causa que pueda afectar a la supervivencia. Esto contrasta con el análisis de series de grupos emergentes, similares al del presente estudio, con trasplantes realizados posteriormente al año 2000 o incluso 2005, con drenaje intestinal y en la modalidad SPK que refieren una mortalidad superior al 10% en el primer año asociada a complicaciones quirúrgicas5,21,22.
Supervivencia del injertoEl informe del registro publicado en 201527 muestra que la supervivencia media del injerto al año es del 86%, concordante con el trabajo publicado por Kasiske et al.28 en el que analizan 4.316 SPK entre 2005 a 2010 con una supervivencia del injerto del 86% al año. No obstante, tal y como se plasma en el informe del último registro, debemos tomar con cautela la supervivencia del injerto al no existir uniformidad entre todos los grupos en la definición de fallo del injerto16.
En el presente trabajo, los pacientes analizados son diabéticos tipo 1 con enfermedad renal terminal en los que se realizó SPK. En la actualidad tenemos una supervivencia del injerto del 96, 93 y 89% a uno, 3 y 5 años, respectivamente. Las series publicadas con pacientes trasplantados en los años 80 y 90 mostraban supervivencias del injerto entre el 60% (n=75; 69 SPK)25 hasta el 87% (n=500 SPK)29 tras un año de seguimiento. Sutherland et al. refieren en 212 SPK realizados entre 1994-2000 una supervivencia del injerto del 79 y 73% a uno y 5 años, respectivamente30.
Sin embargo, en la última década se aprecia un aumento significativo de la supervivencia fundamentado en mejoras técnicas y cambios en la inmunosupresión. Así, Ollinger et al.25 analizan una serie de 175 SPK alcanzando supervivencias del 86 y 73% tras uno y 5 años de seguimiento, respectivamente. Martins et al. en una serie de 111 SPK, reportan una supervivencia del 94 y 81% a uno y cinco años de seguimiento14.
En las series de pacientes trasplantados a partir del año 2000 se objetiva en general un aumento en la supervivencia del injerto pancreático, esto se confirma en los diferentes análisis del registro, por ejemplo, en el estudio presentado en enero de 2015 y referido a los pacientes trasplantados en el año 2008 se describe una supervivencia a uno y 5 años del 86% y 74%, respectivamente27. Gruessner et al.19 con una serie de 4.200 SPK realizados entre 2004-2008 y Kasiske et al.28 analizando 4.316 SPK presentan datos similares a uno y 5 años con un 86 y 80% respectivamente.
Series similares a la nuestra, compuestas por pacientes trasplantados en la variedad de SPK, con derivación entérica y realizados desde el año 2000 muestran supervivencias del injerto del 80 al 90% al año y del 70-80% a los 5 años14,20. No obstante, algunos grupos presentan cifras de supervivencia ligeramente inferiores (60%) debido fundamentalmente a problemas técnicos5,21 (tabla 2).
La mayoría de los injertos se pierden en el postoperatorio inmediato y en los 3 primeros meses postrasplante16,27, siendo los problemas técnicos y el rechazo las causas más frecuentes31. El registro muestra que la tasa de pérdidas del injerto pancreático en SPK en los primeros 90 días del trasplante es del 10% en los pacientes trasplantados entre los años 2007-2008, desciende al 7% en 2010 y alcanza cifras de un 6% en los trasplantados en 2014-201516.
En conclusión, el número de procedimientos anuales y la posible inexperiencia, no parecen haber tenido una influencia negativa en nuestros resultados. Una adecuada formación, la estandarización de la técnica, la homogeneidad del grupo y de los criterios de selección de candidatos y receptores son algunos factores a tener en cuenta. El desarrollo de herramientas de evaluación de los resultados podría aportar información sobre los factores que determinan la variabilidad entre grupos.
A la vista de nuestra experiencia inicial consideramos, que con los conocimientos actuales y basados en las experiencias previas de otros grupos, el desarrollo de un programa de trasplante de páncreas es seguro y ofrece unos excelentes resultados a los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.