Introducción
La disfagia orofaríngea es un síntoma que se refiere a la dificultad o incomodidad para formar y/o mover el bolo alimenticio desde la boca al esófago. La disfagia puede originarse por alteraciones estructurales que dificulten la progresión del bolo, como los tumores esofágicos y otorrinolaríngeos, los osteofitos cervicales y las estenosis esofágicas por anillos, posquirúrgicas o posradioterápicas1,2. La mayoría de nuestros hospitales están perfectamente equipados para diagnosticar y tratar estas causas estructurales de disfagia orofaríngea. Sin embargo, la disfagia orofaríngea es con frecuencia mucho mayor un trastorno funcional de la motilidad orofaríngea que afecta a la propulsión del bolo, la reconfiguración orofaríngea durante la deglución o a la apertura del esfínter esofágico superior (EES), y frecuentemente tiene relación con enfermedades neurológicas y envejecimiento2-4.
El objetivo de esta revisión es establecer un conjunto de recomendaciones clínicas de interés para el cirujano digestivo, con el objetivo de facilitar el diagnóstico y el tratamiento de los pacientes con disfagia orofaríngea de tipo funcional: a) conocer la prevalencia y los grupos de riesgo; b) describir su fisiopatología; c) los métodos de diagnóstico y de estudio funcional; d) las complicaciones específicas de la disfagia orofaríngea; e) las posibilidades de tratamiento médico, y f) las indicaciones del tratamiento quirúrgico. En la mayoría de nuestros hospitales hay una gran discrepancia entre los elevados morbilidad, mortalidad y costes sanitarios ocasionados por las complicaciones de la disfagia orofaríngea funcional y la escasez de los recursos materiales y humanos dedicados a esta patología. El diagnóstico y el tratamiento de la disfagia orofaríngea funcional requiere una aproximación multidisciplinaria. El equipo multidisciplinario de disfagia debe incluir diversos perfiles profesionales: enfermeras, logopedas, dietistas, gastroenterólogos, otorrinolaringólogos, radiólogos, rehabilitadores, geriatras y neurólogos, y la participación del cirujano digestivo. Los objetivos de este equipo son: a) la identificación precoz de los pacientes con disfagia; b) el diagnóstico de las enfermedades asociadas a la disfagia que tienen un tratamiento específico y la exclusión de los tumores orofaríngeos y del reflujo gastroesofágico y sus complicaciones; c) la identificación de las alteraciones biomecánicas orofaríngeas que causan la disfagia funcional en cada paciente, y d) la selección de las estrategias terapéuticas para cada paciente o la indicación de una vía no oral de alimentación con base en los hallazgos objetivos y reproducibles2,5 (fig. 1).
Fig. 1. Algoritmo diagnóstico y terapéutico para los pacientes con disfagia orofaríngea. Adaptado de Moreno et al1 y Clavé et al2. EES: esfínter esofágico superior; MECV-V: método de exploración clínica de la disfagia volumen-viscosidad.
Epidemiología
La prevalencia de alteraciones de deglución en pacientes con enfermedades neurológicas y asociadas al envejecimiento es extraordinariamente elevada y muy poco conocida. La disfagia orofaríngea funcional afecta a más del 30% de los pacientes que han sufrido un accidente cerebrovascular (ACV), su prevalencia en la enfermedad de Parkinson es de un 52-82%; es el síntoma inicial del 60% de los pacientes con esclerosis lateral amiotrófica (ELA); afecta al 40% de los pacientes con miastenia gravis; el 44% de los pacientes con esclerosis múltiple; hasta el 84% de los pacientes con Alzheimer, y a más del 60% de los pacientes ancianos institucionalizados. La disfagia orofaríngea afecta hasta al 80% de los pacientes que han recibido tratamiento quirúrgico o radioterápico por tumores de orofaríngeos, laríngeos y del área maxilofacial6-9. Por el contrario, la prevalencia de alteraciones de la apertura del esfínter superior como causa de disfagia orofaríngea es baja. Menos del 5% de los pacientes referidos a una unidad terciaria para estudio de disfagia orofaríngea funcional presentan alteraciones de la apertura del EES10. Las enfermedades que más frecuentemente causan las alteraciones de apertura del EES son la enfermedad de Parkinson, diversas lesiones medulares y los trastornos del EES asociados al divertículo de Zenker10.
Fisiología
Disfagia orofaríngea funcional
La etiología de la disfagia orofaríngea funcional se debe a dos grandes grupos de alteraciones: a) las alteraciones del reflejo deglutorio, y b) las alteraciones de apertura del EES.
Alteraciones del reflejo deglutorio
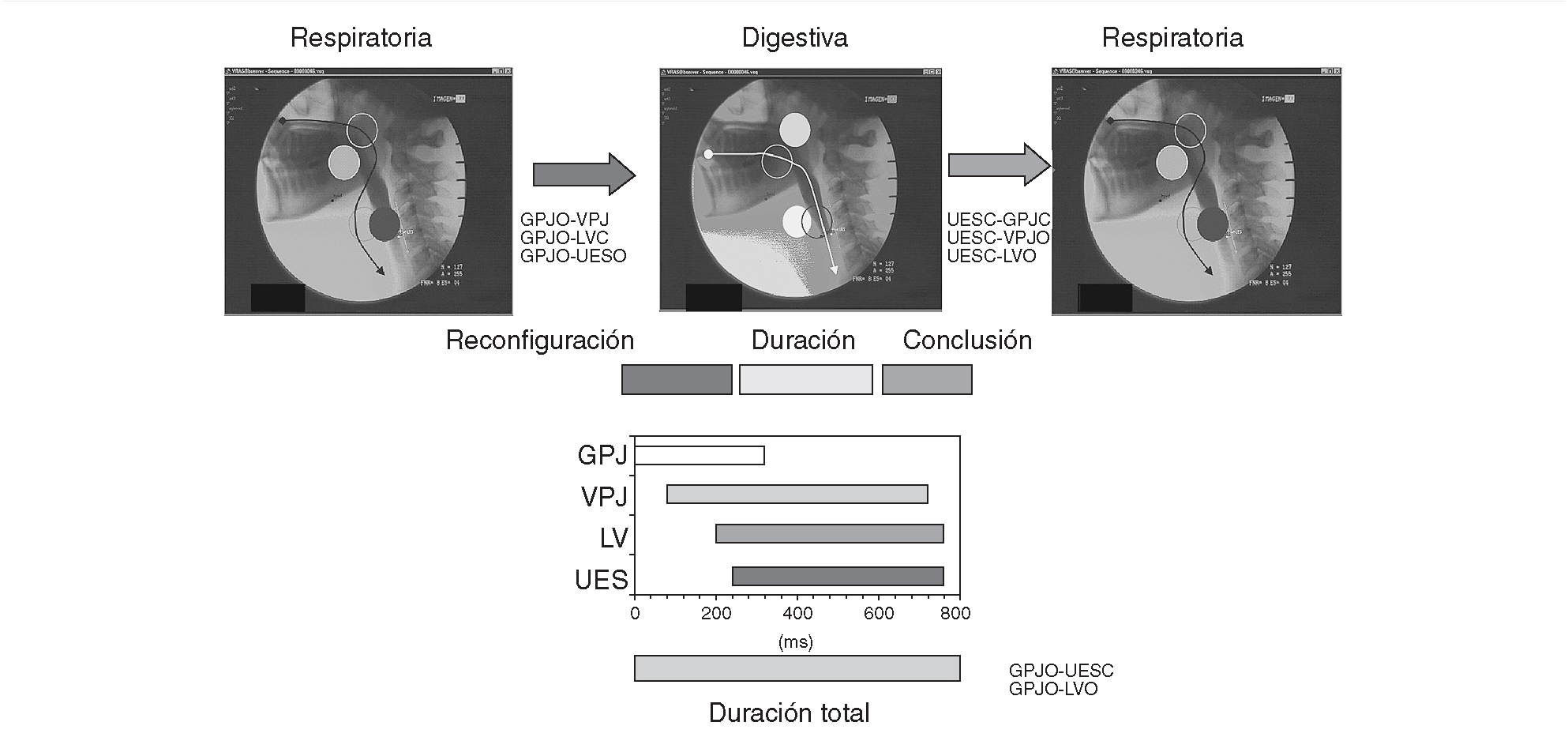
El reflejo deglutorio (mejor denominado con los términos respuesta motora orofaríngea) incluye tres grupos de acontecimientos: a) la reordenación temporal de las estructuras orofaríngeas desde una configuración de vía respiratoria en reposo hasta una disposición de vía digestiva durante la deglución; b) la transferencia del bolo alimenticio desde la boca al esófago, y c) la posterior recuperación de la configuración respiratoria6. La adaptación orofaríngea durante la deglución está mediada por la apertura y el cierre de cuatro importantes válvulas: el sello entre el paladar blando y la lengua (sello glosopalatino, GPJ), el cierre de la nasofaringe mediante el ascenso del paladar blando (sello velofaríngeo, VPJ), el vestíbulo laríngeo (LV) cerrado mediante el descenso de la epiglotis y la apertura del EES. El funcionamiento y la coordinación de estas válvulas puede medirse de forma muy precisa durante los estudios videofluoroscópicos (fig. 2). Los individuos jóvenes y sanos presentan una respuesta motora orofaríngea de duración muy breve (el período entre la apertura del GPJ y la apertura del LV es inferior a 740 ms), un rápido cierre del vestíbulo laríngeo (en menos de 160 ms) y una rápida apertura del esfínter esofágico superior (en menos de 220 ms)11. Por el contrario, la duración de la respuesta motora orofaríngea está muy alargada en los pacientes con disfagia neurogénica y en los pacientes ancianos3,4,11. Estos dos grupos de pacientes presentan un severo retraso en la fase de reconfiguración de la vía respiratoria hacia una vía digestiva. La prolongación de los intervalos hasta el cierre del vestíbulo laríngeo (LVC) y la apertura del EES (UESO) son las principales anomalías deglutorias que en estos pacientes conducen al desarrollo de aspiraciones y penetraciones (fig. 3)11,12. En pacientes neurológicos estos intervalos pueden requerir hasta el doble de tiempo que en individuos jóvenes y sanos11,12.
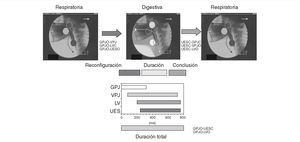
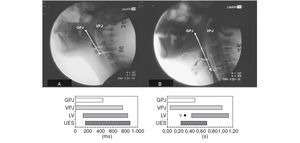
Fig. 2. Respuesta motora orofaríngea. Dinámica de los cuatro grandes esfínteres (sellos) orofaríngeos durante las tres fases de la respuesta motora orofaríngea (fase de reconfiguración, fase de duración o mantenimiento y fase de conclusión). Cronograma de la respuesta motora orofaríngea en un individuo sano. GPJ: sello glosopalatino; LV: vestíbulo laríngeo; UESC: esfínter esofágico superior cerrado; UESO: esfínter esofágico superior abierto; VPJ: sello velopalatino.
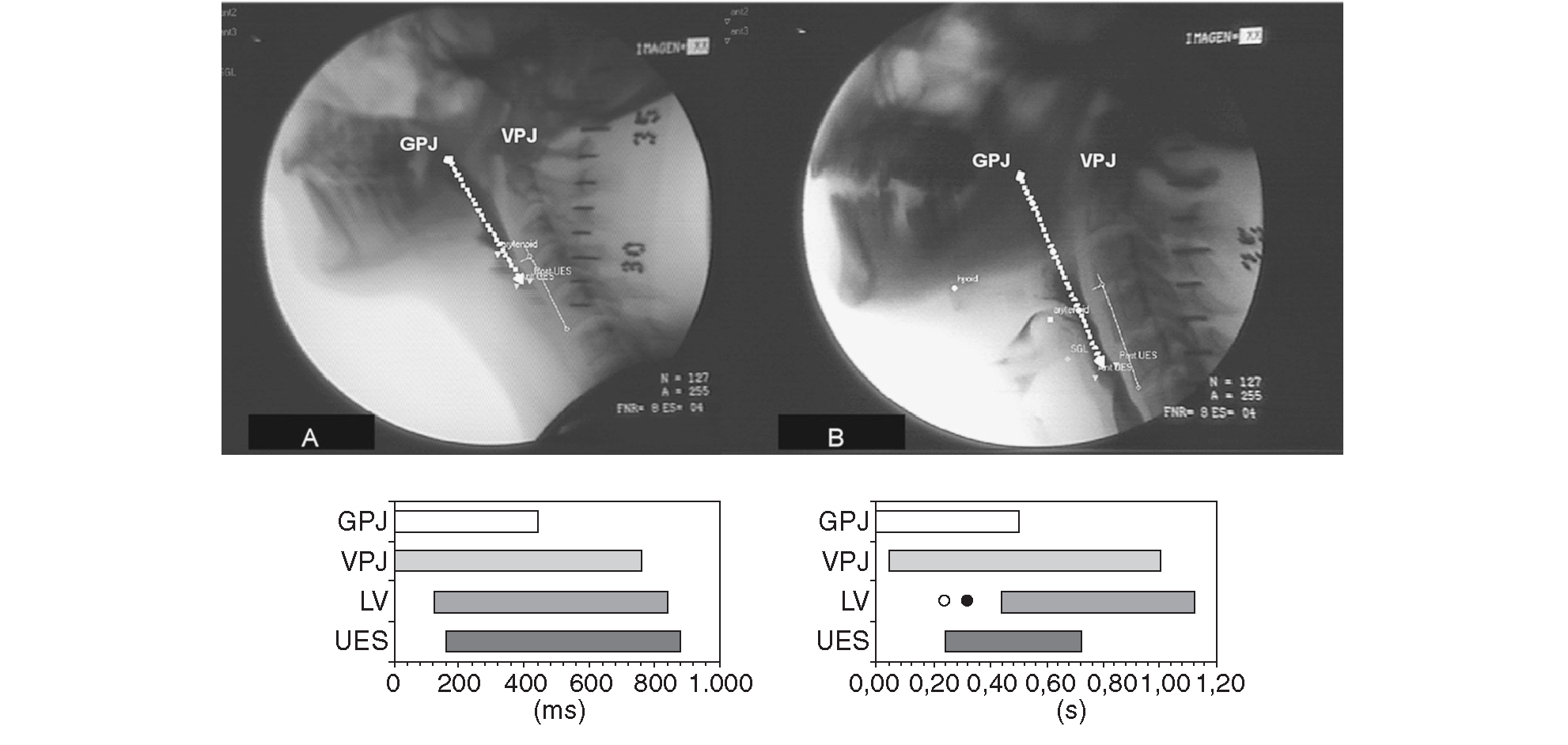
Fig. 3. Configuración temporal de la respuesta motora orofaríngea durante la ingesta de un bolo de 5 ml de viscosidad líquida en un individuo sano (A) y en un paciente con disfagia neurógena que presenta una aspiración (B). El paciente tiene un incremento en la duración total de la respuesta orofaríngea y un retardo en el cierre del vestíbulo laríngeo y de la apertura del esfínter superior. El punto blanco indica el momento de la penetración de contraste en el vestíbulo laríngeo y el punto negro indica el paso al árbol traqueobronquial (aspiración). Adaptado de Cook et al6. GPJ: sello glosopalatino; LV; vestíbulo laríngeo; VPJ: sello velopalatino; UES: esfínter esofágico superior.
La transferencia del bolo de la boca y la faringe al esófago es principalmente por la pulsión de la lengua contra el paladar duro, que proporciona la fuerza necesaria para propulsar el bolo por el EES con una mínima resistencia13,14. La función de los músculos constrictores faríngeos es el aclaramiento faríngeo y la limpieza de los residuos del bolo que quedan adheridos a las paredes de la hipofaringe y los senos piriformes15. Nuestro grupo ha desarrollado un método de evaluación de la fuerzas de propulsión de la lengua mediante la medida de la velocidad (en cm/s) y energía cinética del bolo en milijoules antes de su entrada en el esfínter esofágico superior. Los individuos jóvenes y sanos presentan altas velocidades (> 35 cm/s) y fuertes fuerzas de propulsión lingual (> 0,33 mJ). Por el contrario, los pacientes neurológicos presentan una baja velocidad del bolo durante su tránsito faríngeo (< 22 cm/s) y unas fuerzas de propulsión muy débiles (< 0,20 mJ). La baja intensidad de la propulsión lingual causa residuo deglutorio oral y faríngeo6. Los ancianos con disfagia orofaríngea presentan también intensas alteraciones de las fuerzas de propulsión lingual (< 0,14 mJ) y velocidad de tránsito faríngeo incluso más lenta (< 10 cm/s)3.
Alteraciones de la apertura del esfínter esofágico superior
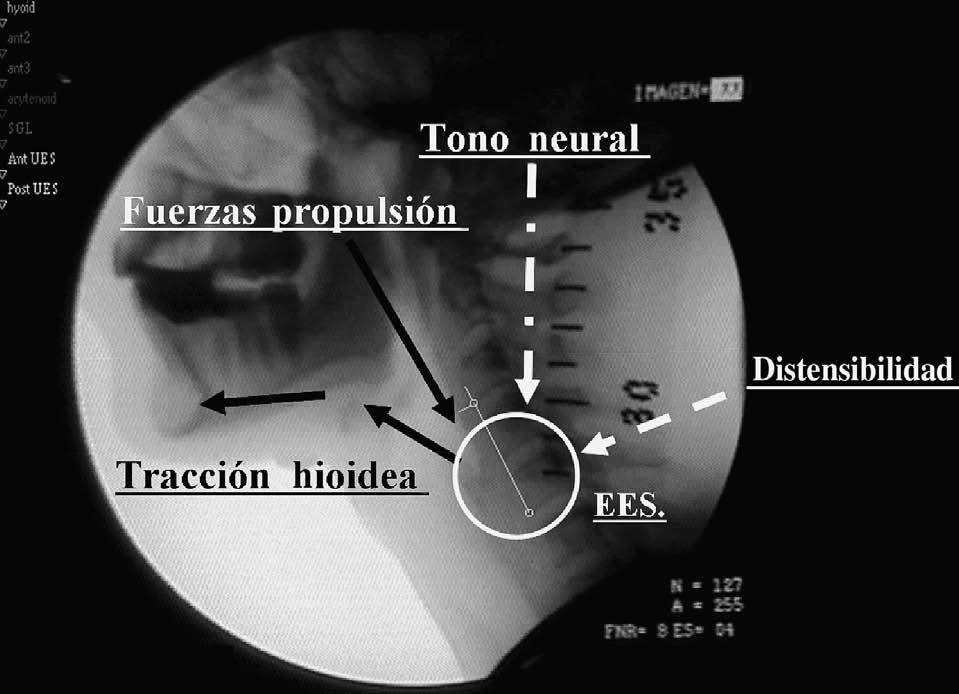
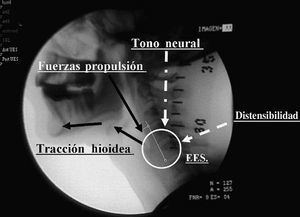
Los cuatro principales mecanismos que facilitan la apertura del EES son: a) la interrupción del tono vagal sobre el músculo cricofaríngeo, lo que permite la desaparición de la contracción muscular que lo mantiene cerrado; b) la tracción sobre la cara anterior del esfínter causada por la contracción de la musculatura que se inserta en el hueso hioides; c) la pulsión sobre el esfínter ejercida por la energía cinética del bolo, causada a su vez por la contracción lingual, y d) la distensibilidad del esfínter que permite su relajación completa, con bajas presiones residuales y escasa resistencia durante el paso del bolo (fig. 4)16. La integridad neuromuscular de la respuesta motora orofaríngea se puede estudiar mediante videofluoroscopia, así como la amplitud y extensión del movimiento hioideo, la magnitud de la apertura del esfínter esofágico superior y la propulsión del bolo. La relajación, la presión residual y la distensibilidad del EES se pueden evaluar mediante manometría faringoesofágica10,13. Es importante destacar que el concepto anatómico (radiológico o videofluoroscópico) de apertura del EES no se corresponde estrictamente con el concepto fisiológico (manométrico) de relajación neuromuscular del esfínter. Existe la posibilidad de que en fases iniciales de diversas enfermedades que reducen la relajación del EES se mantenga la apertura mediante un incremento de la presión intrabolo10. Los grandes grupos de enfermedades que contribuyen a una apertura incompleta del EES son: a) la incapacidad de interrumpir el tono vagal que mantiene cerrado el EES debido a enfermedades del SNC o asociado a la rigidez extrapiramidal de la enfermedad de Parkinson; b) la debilidad de la contracción de la musculatura hioidea y/o de la propulsión lingual asociada a enfermedades neurológicas, neurodegenerativas o a la sarcopenia del envejecimiento, y c) la fibrosis del EES asociada al divertículo de Zenker que, aunque permite la relajación neuromuscular, impide su correcta distensión durante el paso del bolo, con el consiguiente aumento de su resistencia10.
Fig. 4. Representación gráfica del balance de fuerzas que participan en la apertura del esfínter esofágico superior (EES). La apertura del EES se produce por: a) la desaparición del tono neural de origen central que a través del nervio vago mantiene cerrado el EES; b) la tracción originada por la contracción de la musculatura hioidea sobre la cara anterior del esfínter; c) las fuerzas de propulsión del bolo, y d) la distensibilidad del esfínter, que define la resistencia al paso del bolo.
Disfagia orofaríngea asociada a lesiones del nervio recurrente laríngeo
El nervio recurrente laríngeo se encarga de la inervación motriz de toda la musculatura intrínseca de la laringe, excepto del músculo cricotiroideo. Su lesión provoca una parálisis de la cuerda vocal correspondiente, que queda casi siempre en posición paramedial e impide cerrar la glotis17. La clínica inicial consiste en disfonía y disfagia orofaríngea con aspiraciones. La mayoría de estas parálisis tienden a compensarse en unos meses, con una mejoría progresiva de la clínica18,19. La lesión del nervio recurrente o la del nervio laríngeo superior no siempre se identifica claramente. Estudios clínicos en pacientes intervenidos mediante tiroidectomía subtotal bilateral demuestran un incremento significativo en la presencia de síntomas "menores" de disfagia, cambios en la voz y sensación de opresión faríngea en el postoperatorio tardío20. En la cirugía cervical, además de la lesión del nervio recurrente puede producirse una lesión de todo el nervio vago unilateral (se afectan completamente el recurrente y los nervios laríngeos superiores). Debido a la falta de sensibilidad faringolaríngea y a la parálisis del paladar y los músculos constrictores, en estos casos los problemas de aspiraciones se agravan. La falta de inervación vagal en el esófago cervical también puede dar lugar a dismotilidad. La clínica incluye los síntomas de una parálisis del recurrente laringeo, pero con mucha más aspiración, que aquí se convierte en un síntoma predominante. Además, el paciente puede desarrollar una voz hipernasal, regurgitación nasal y retención en el seno piriforme ipsolateral a la lesión. En estos casos la compensación espontánea puede ocurrir, pero es mucho menos frecuente. Por último en determinadas afecciones (p. ej., tumores de base del cráneo) además de la parálisis de la laringe se asocian parálisis de otros pares craneales (típicamente IX, XI y XII). Estos pacientes presentan una gran prevalencia de aspiraciones21.
Disfagia tras radioterapia o quimioterapia en neoplasias de cabeza y cuello
Los tratamientos con radioterapia o con quimiorradioterapia de las neoplasias de cabeza y cuello producen diferentes alteraciones que pueden causar disfagia orofaríngea, tanto aguda como crónica. Hasta un 40% de estos pacientes pueden requerir una sonda nasogástrica o una gastrostomía, más o menos transitoria. La base de la disfagia es multifactorial: hiposialia, mucositis, fibrosis, edema, disminución de la sensibilidad en el tracto digestivo superior y depresión del reflejo tusígeno, entre otros22. Los pacientes pueden presentar una clínica insidiosa, dado que la aspiración puede pasar inadvertida, que se inicie con un neumonía aspirativa o un cuadro clínico más claro, con predominio de la dificultad deglutoria asociada a aspiraciones. Después de la radioquimioterapia y en especial en pacientes que no reciben alimentación por vía oral durante un período prolongado, son muy frecuentes las estenosis de la faringe con sinequias que cierran las vallécula y los senos piriformes. La radioquimioterapia produce también disminución de la propulsión lingual y dificulta y enlentece la respuesta motora orofaríngea23.
Disfagia tras laringectomía
Debido a diferentes tipos de cáncer que afectan a la laringe, se realizan cirugías que extirpan una parte o toda la laringe, dejando en muchos casos problemas de disfagia residual. Aunque todas las cirugías de la laringe pueden dejar secuelas de este tipo, las tres más importantes son: a) laringectomía supraglótica, en la que se reseca la laringe por encima de las cuerdas vocales, que se conservan24; b) la laringectomía supracricoidea, en la que se reseca, además de la supraglotis, la porción membranosa de ambas cuerdas vocales25, y c) la laringectomía total con resección total de la laringe y desconexión entre la vía respiratoria y la digestiva, con lo que se evita las aspiraciones. Sin embargo, estos pacientes presentan un grado variable de disfagia fundamentalmente por las alteraciones del esfínter cricofaríngeo26.
Diagnóstico de la disfagia orofaríngea
El objetivo del programa de diagnóstico de la disfagia orofaríngea funcional es evaluar las dos características que definen la deglución: eficacia de la deglución o capacidad de que el paciente ingiera la totalidad de las calorías y el agua que necesita para estar bien nutrido e hidratado, y seguridad de la deglución o capacidad de que la ingestión del agua y las calorías necesarias sin que se produzcan complicaciones respiratorias. Para evaluar estas dos características de la deglución disponemos de dos grupos de métodos de diagnóstico: los métodos clínicos como la historia clínica específica y la exploración clínica de la deglución mediante el método volumen-viscosidad, y la exploración de la deglución mediante exploraciones complementarias específicas, como la videofluoroscopia y la manometría faringoesofágica2,13.
Métodos clínicos: historia clínica y exploración clínica de la deglución
El programa de diagnóstico de la disfagia orofaríngea se inicia con los métodos clínicos (fig. 1). El objetivo es determinar si los síntomas del paciente corresponden a una disfagia orofaríngea, decidir si el paciente va a requerir exploraciones complementarias e identificar las posibles complicaciones nutricionales y respiratorias.
Historia clínica
La disfagia a sólidos indica que hay un problema obstructivo, mientras que la disfagia a líquidos señala a una disfagia funcional. La regurgitación nasal, la necesidad de múltiples degluciones para un bolo pequeño (fraccionamiento) y una historia de infecciones respiratorias repetitivas también orientan a una disfagia neurógena. Los atragantamientos, la tos o la voz húmeda indican una aspiración, aunque en pacientes neurológicos, hasta el 40% de las aspiraciones son asintomáticas y no se acompañan de tos6,11,27. La sensación de residuo en la faringe orienta a una hipomotilidad faríngea, frecuente en enfermedades neurodegenerativas. El aumento del tiempo en cada comida y la pérdida de peso reciente indican una disminución de la eficacia de la deglución y la posibilidad de desnutrición. La severidad clínica de la disfagia puede cuantificarse mediante la aplicación de escalas analógicas visuales a una batería de síntomas clínicos28.
Exploración clínica. Método volumen-viscosidad
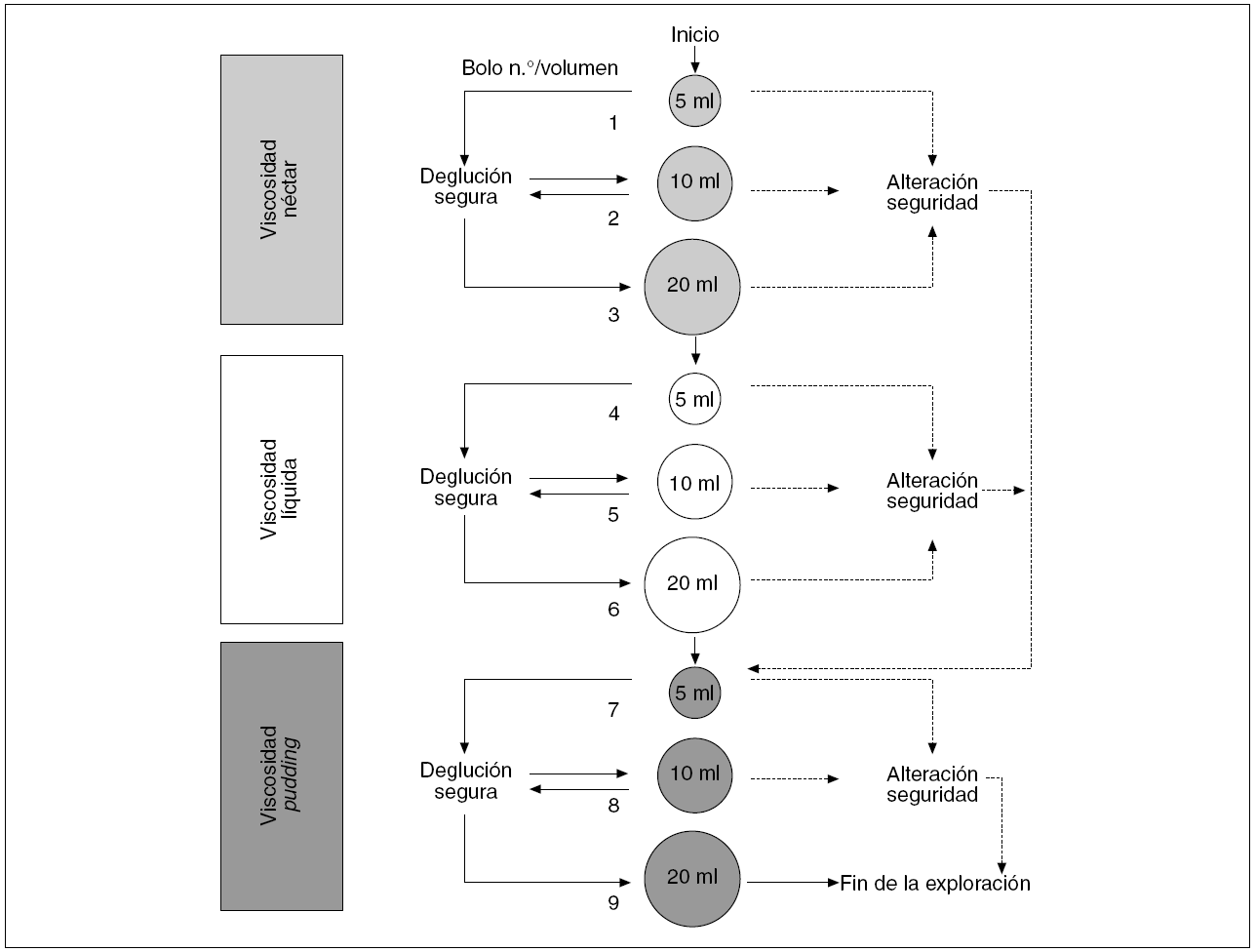
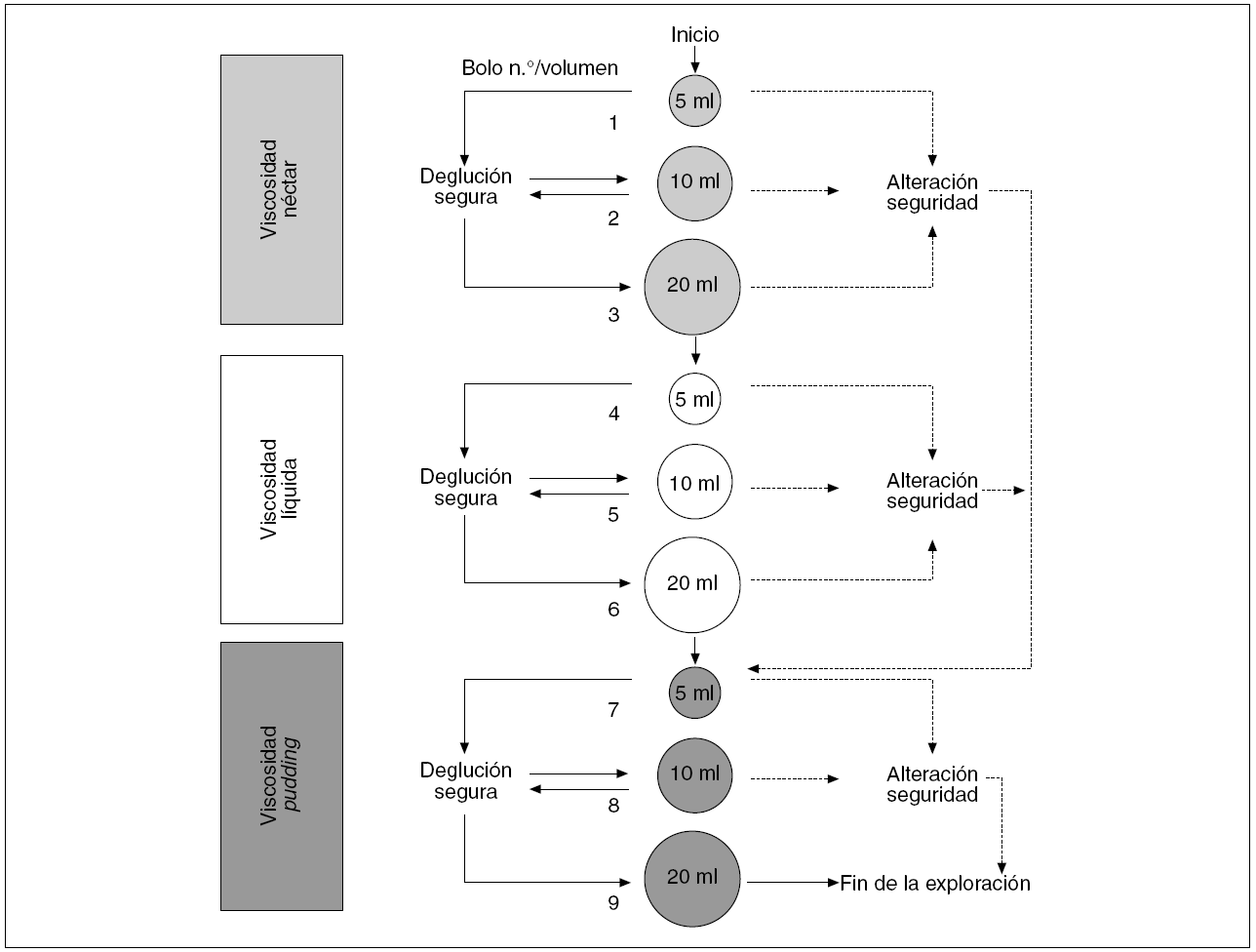
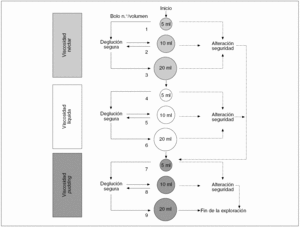
La exploración clínica de la deglución a la cabecera del paciente se realiza administrando al paciente bolos de viscosidad y volumen diferentes y observando sus reacciones. Diversos autores han desarrollado métodos basados en administrar al paciente diversos sorbos de agua (test del agua) y observar si presenta signos de aspiración para seleccionar a los pacientes que requerirán exploraciones complementarias29. Nuestro grupo ha desarrollado un método de exploración clínica mediante bolos en una gama de volúmenes de 5 a 20 ml y viscosidad líquida, néctar y pudding, al que se ha denominado método de exploración clínica volumen-viscosidad (MECV-V)2,5. Esta técnica de criba nos permite identificar a los pacientes con disfagia orofaríngea y seleccionar a los pacientes que se debe estudiar mediante videofluoroscopia. En manos de personal adecuadamente entrenado, la sensibilidad diagnóstica del MECV-V para las alteraciones de la seguridad y la eficacia de la deglución son del 88,1 y el 89,8%, respectivamente. Además de identificar a los pacientes con disfagia, el método MECV-V identifica adecuadamente a los pacientes con alteraciones de la seguridad de la deglución a los que es necesario restringir la viscosidad líquida y ofrece datos acerca del tipo de bolo (volumen y viscosidad) más adecuado para cada paciente (fig. 5). Es importante recalcar que un paciente en el que se sospeche especialmente una alteración de seguridad de la deglución debe ser estudiado mediante videofluoroscopia5.
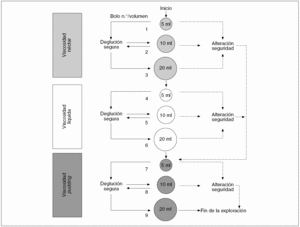
Fig. 5. Algoritmo del método de exploración clínica volumen-viscosidad (MECV-V). El MECV-V es una prueba clínica de esfuerzo deglutorio. El criterio general de aplicación es que el riesgo de aspiración en pacientes con disfagia orofaríngea aumenta al disminuir la viscosidad de los fluidos que se administran al paciente y al incrementar el volumen del bolo. Por lo tanto, no se debe exponer a un paciente a un bolo de viscosidad inferior o volumen superior (para la misma viscosidad) que aquel con que ya haya presentado signos de aspiración. El método utiliza tres series de bolos de 5, 10 y 20 ml y de viscosidad néctar, líquida y pudding; la exploración se inicia por la viscosidad media y un volumen bajo para proteger al paciente y la exploración progresa mediante la administración de bolos de creciente dificultad hasta que el paciente presenta signos de aspiración. Si el paciente presenta desaturación de oxígeno o signos clínicos de alteración de la seguridad, se interrumpe la serie y se pasa a una serie de viscosidad superior.
Exploraciones complementarias
La manometría faringoesofágica y la videofluoroscopia son métodos complementarios para el estudio de la fisiopatología y la selección del tratamiento de los pacientes con disfagia orofaríngea y las alteraciones de apertura del EES2,11,13: la videofluoroscopia permite identificar los signos de seguridad y eficacia de la deglución, cuantificar los acontecimientos temporales de la respuesta motora orofaríngea y establecer los mecanismos de aspiración, medir el movimiento hioideo y la apertura del esfínter esofágico superior y las fuerzas de propulsión del bolo1,30, y la manometría permite evaluar la distensibilidad del esfínter esofágico superior, la presión hipofaríngea y el mecanismo de apertura incompleta del esfínter13.
Videofluoroscopia
La videofluoroscopia (VFS) es una técnica radiológica dinámica que consiste en la obtención de una secuencia en perfil lateral y anteroposterior de la ingestión de diferentes volúmenes y viscosidades (líquido, néctar y pudding) de un contraste hidrosoluble2,30. Actualmente se considera esta técnica como el estándar para el estudio de la disfagia orofaríngea, ya que permite estudiar la respuesta motora orofaríngea e identificar los signos videofluoroscópicos4,6. Un 45-90% de los ancianos y los adultos con enfermedades neurológicas presentan alteraciones de la eficacia de la deglución que pueden dar lugar a desnutrición, y 2 de cada 3 de estos pacientes presentan alteraciones de la seguridad que pueden dar lugar a aspiraciones4,11. La VFS permite identificar entre 1/3 y 1/4 pacientes que van a presentar aspiraciones silentes no diagnosticables clínicamente y, por tanto, van a estar en un riesgo elevadísimo de una neumonía4,11. Los objetivos de la videofluoroscopia son evaluar la seguridad y la eficacia de la deglución, caracterizar las alteraciones de la deglución en términos de signos videofluoroscópicos, evaluar la eficacia de los tratamientos y cuantificar el reflejo deglutorio2,4:
Signos videofluoroscópicos de la fase oral. Los principales signos de alteraciones de la eficacia de la fase oral son la apraxia y la disminución del control y de la propulsión lingual del bolo. Muchos pacientes presentan apraxia deglutoria (dificultad, retraso o imposibilidad en iniciar la fase oral) después de un ACV. Este síntoma también se observa en pacientes con Alzheimer y en pacientes con una disminución de la sensibilidad oral2,30. Las alteraciones del control lingual (imposibilidad de formar el bolo) o de su propulsión causan un residuo oral o en la vallécula cuando la alteración es de la base de la lengua. El principal signo acerca de la seguridad de la fase oral es la insuficiencia del sello palatogloso (lengua-paladar blando), disfunción muy grave que origina la caída del bolo a la hipofaringe antes del disparo del patrón motor deglutorio faríngeo y mientras la vía respiratoria está todavía abierta, lo que origina una aspiración predeglutoria.
Signos videofluoroscópicos de la fase faríngea. Los principales signos videofluoroscópicos de la eficacia de la fase faríngea son el residuo hipofaríngeo y las alteraciones de apertura del EES. Un residuo hipofaríngeo simétrico en ambos senos piriformes se debe a una contracción faríngea débil, muy frecuente en los pacientes con enfermedades neurodegenerativas, y predispone a la aspiración posdeglutoria2,30. Los pacientes con ACV pueden presentar un residuo unilateral como consecuencia de una parálisis faríngea unilateral. Los signos videofluoroscópicos de la seguridad de la fase faríngea son la lentitud o la discoordinación del patrón motor deglutorio faríngeo y las penetraciones y/o aspiraciones. Se denomina penetración la entrada de contraste en el vestíbulo laríngeo sin rebasar las cuerdas vocales. Si se produce una aspiración, el contraste atraviesa las cuerdas y pasa al árbol traqueobronquial (fig. 3)11,12. La posibilidad de digitalización y análisis cuantitativo de las imágenes de la videofuoroscopia permite en la actualidad una medida precisa del patrón motor orofaríngeo en los pacientes con disfagia (fig. 2). Nuestro grupo ha observado que la lentitud en el cierre del vestíbulo laríngeo y la lentitud en la apertura del EES como la que se observa en la figura 3 son los parámetros más relacionados con la posibilidad de una aspiración11,12. Por otro lado, en nuestros estudios la existencia de residuos orofaríngeos se correlaciona estrechamente con la fuerza de propulsión lingual que determina la velocidad y la energía cinética del bolo11.
Manometría faringoesofágica
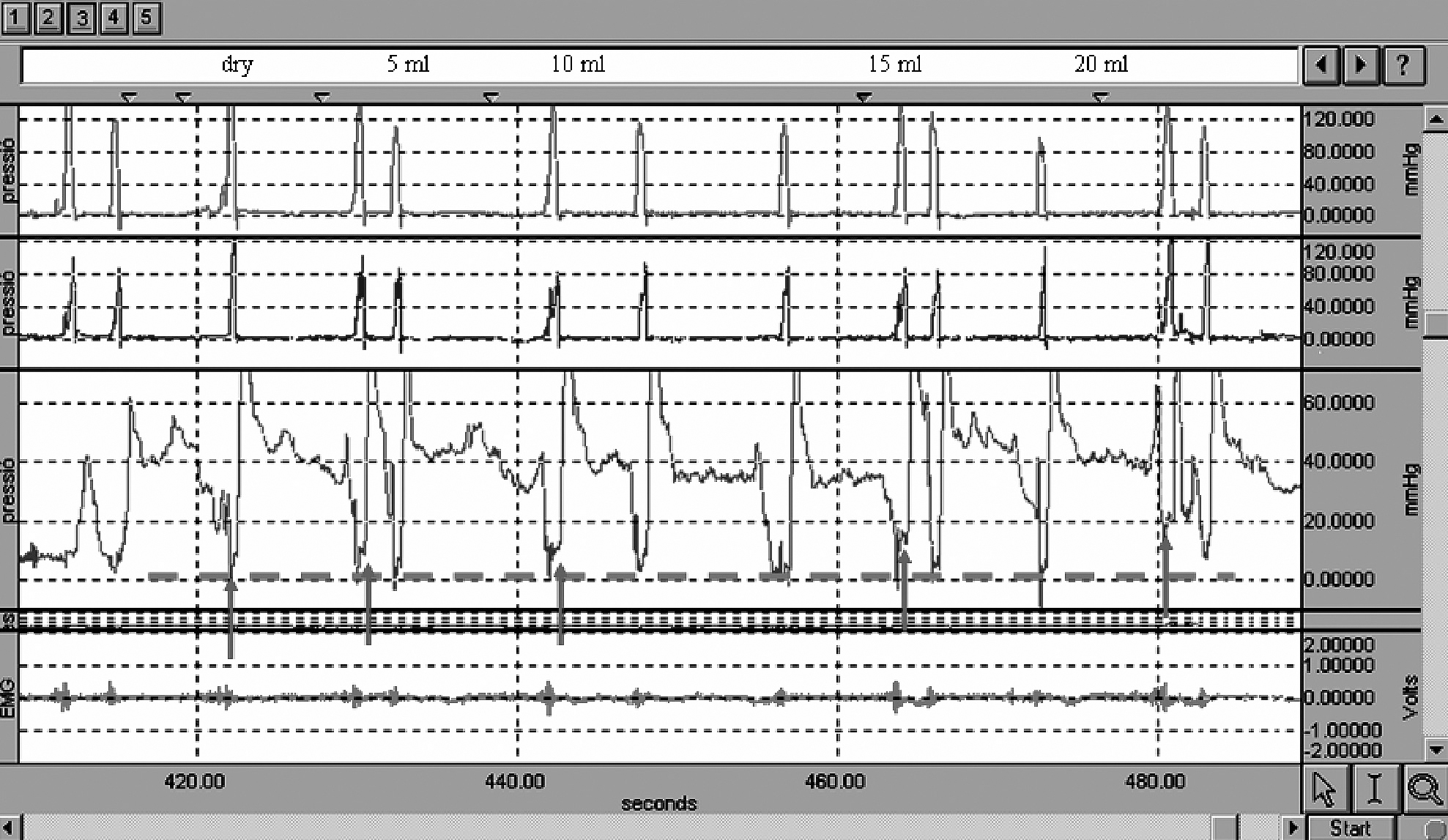
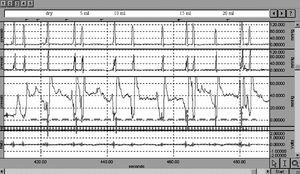
La manometría faringoesofágica es la técnica de elección para el estudio de los mecanismos de apertura del EES2. Requiere el uso de un manguito (DentSleeve) de 6 cm o de una sonda con 5 orificios de registro separados por 1 cm. El objetivo de ambos sistemas es "enfocar" adecuadamente el esfínter durante los movimientos deglutorios. Es de mucha ayuda un registro simultáneo de la actividad electromiográfica de superficie de la contracción de la musculatura hioidea (fig. 6). Algunos autores recomiendan realizar el estudio manométrico y el videofluoroscópico de forma simultánea (manofluoroscopia), aunque la presencia de la sonda de manometría altera la reconfiguración orofaríngea y el movimiento hioideo. Nuestro grupo realiza en primer lugar el estudio VFS y colocamos adecuadamente la sonda de manometría al final del estudio VFS para realizar secuencialmente el estudio manométrico utilizando los mismos volúmenes y viscosidades que en el estudio VFS2. La incapacidad de que el EES se relaje y la consecuente disminución de su distensibilidad ocasionan un incremento en la presión residual del esfínter y de la presión hipofaríngea a medida que se incrementa el volumen del bolo10,16 (fig. 6). De nuevo, es importante resaltar que a nivel del EES los términos "relajación" del EES y "apertura" del EES se refieren a conceptos diferentes. Relajación se refiere a un concepto fisiológico caracterizado por la desaparición del tono neuromuscular del EES y evaluable mediante la caída de presión del EES hasta niveles subatmosféricos. Algunos autores ya definen como anormal la relajación del EES si la presión residual no alcanza este nivel subatmosférico y/o la presión residual intrabolo supera los 10-15 mmHg31. Un hallazgo manométrico característico de esta reducción de la distensibilidad del EES es el progresivo y escalonado incremento de la presión residual a medida que se aumenta el volumen del bolo (fig. 6). En cambio, el término "apertura" se refiere a un concepto exclusivamente anatómico. Así, mediante la combinación de los hallazgos manométricos y de la VFS, podemos definir hasta tres patrones de alteración de la apertura del EES:
Fig. 6. Manometría faringoesofágica. Trazado representativo de la alteración de distensibilidad del esfínter superior en un paciente con divertículo de Zenker. Los dos canales superiores muestran la presión hipofaríngea; el tercer canal, la presión en el esfínter esofágico superior, y el cuarto, la señal electromiográfica de contracción de la musculatura hioidea. Las flechas indican el incremento en la presión residual del esfínter esofágico superior que se produce al incrementar el volumen del bolo como consecuencia de la relajación incompleta y la elevada resistencia del esfínter. La línea de puntos indica la presión atmosférica.
Disminución de la apertura del EES. Está causada por insuficiente propulsión del bolo, que se observa en hasta el 15% de los pacientes con enfermedades neurológicas o neurodegenerativas y está caracterizado por una respuesta motora orofaríngea lenta, un movimiento hioideo de tracción sobre el EES (ascenso y desplazamiento anterior) de poca amplitud, una débil propulsión del bolo y una relajación manométrica estrictamente normal10,11. Muchos de estos pacientes presentan además una alteración de la seguridad de la deglución en forma de penetraciones o aspiraciones.
Relajación neuromuscular incompleta del EES. Se observa en enfermedades neurológicas asociadas a espasticidad de origen neural como la enfermedad de Parkinson o el traumatismo craneoencefálico. El patrón está caracterizado por un severo retraso o incluso la ausencia de respuesta deglutoria, movimiento hioideo corto, propulsión débil del bolo y reducción o desaparición de la relajación neuromuscular y disminución en la distensibilidad del esfínter en la manometría2,3,10.
Alteración de la apertura del EES asociada al divertículo de Zenker o a barra del cricofaríngeo. La respuesta motriz orofaríngea es normal, el movimiento hioideo de tracción es amplio y adecuado, la propulsión del bolo es intensa y la distensibilidad del esfínter está intensamente reducida por la fibrosis y la presencia de tejido conectivo entre los haces musculares del esfínter2,10,31 (fig. 7).
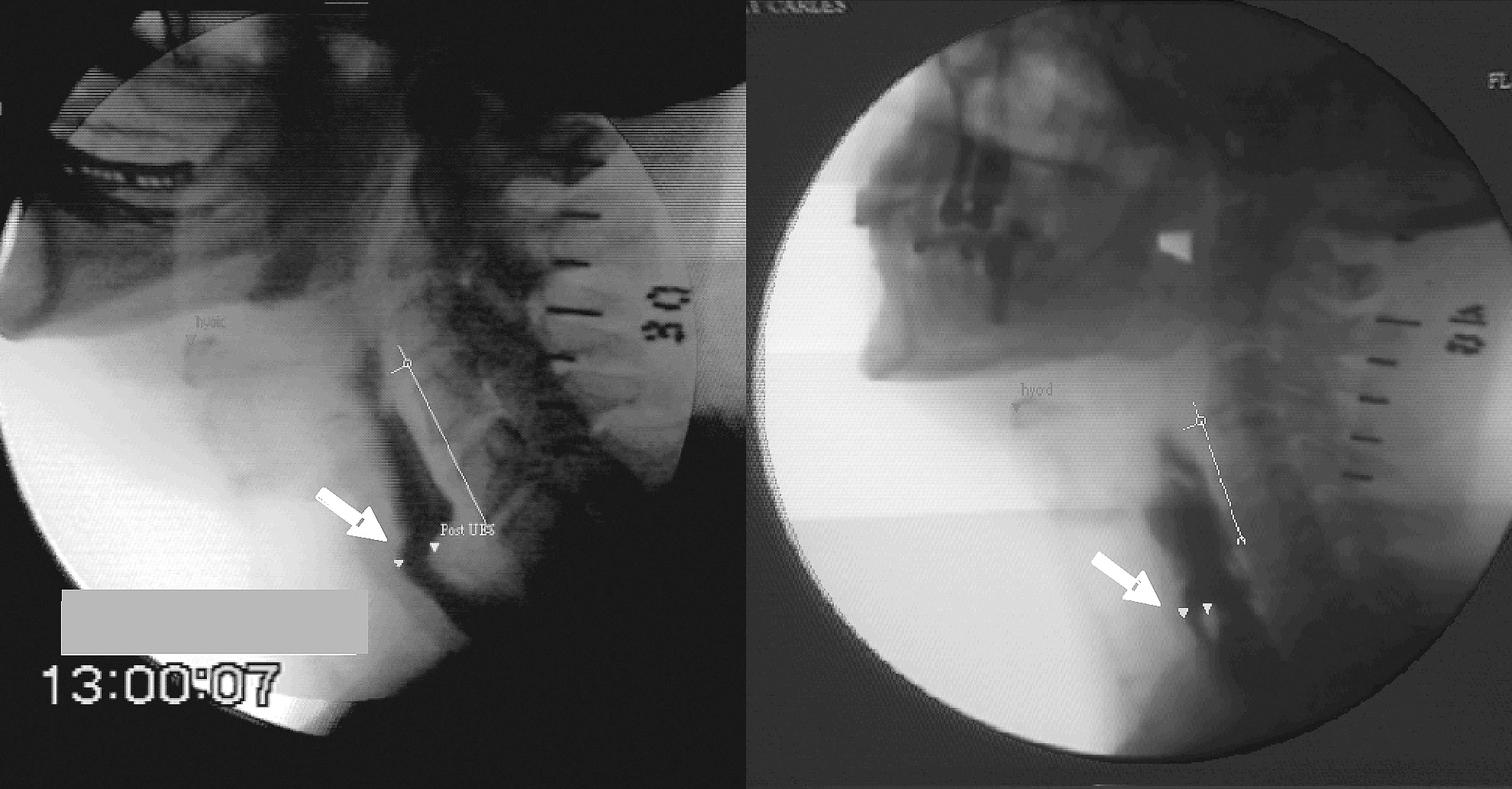
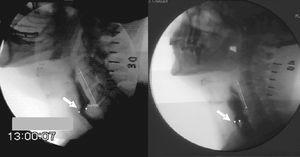
Fig. 7. Imágenes videofluoroscópicas representativas de las alteraciones de la apertura del esfínter esofágico superior que presentan los pacientes con divertículo de Zenker (derecha) y los pacientes con barras aisladas del cricofaríngeo (izquierda).
Complicaciones de la disfagia orofaríngea
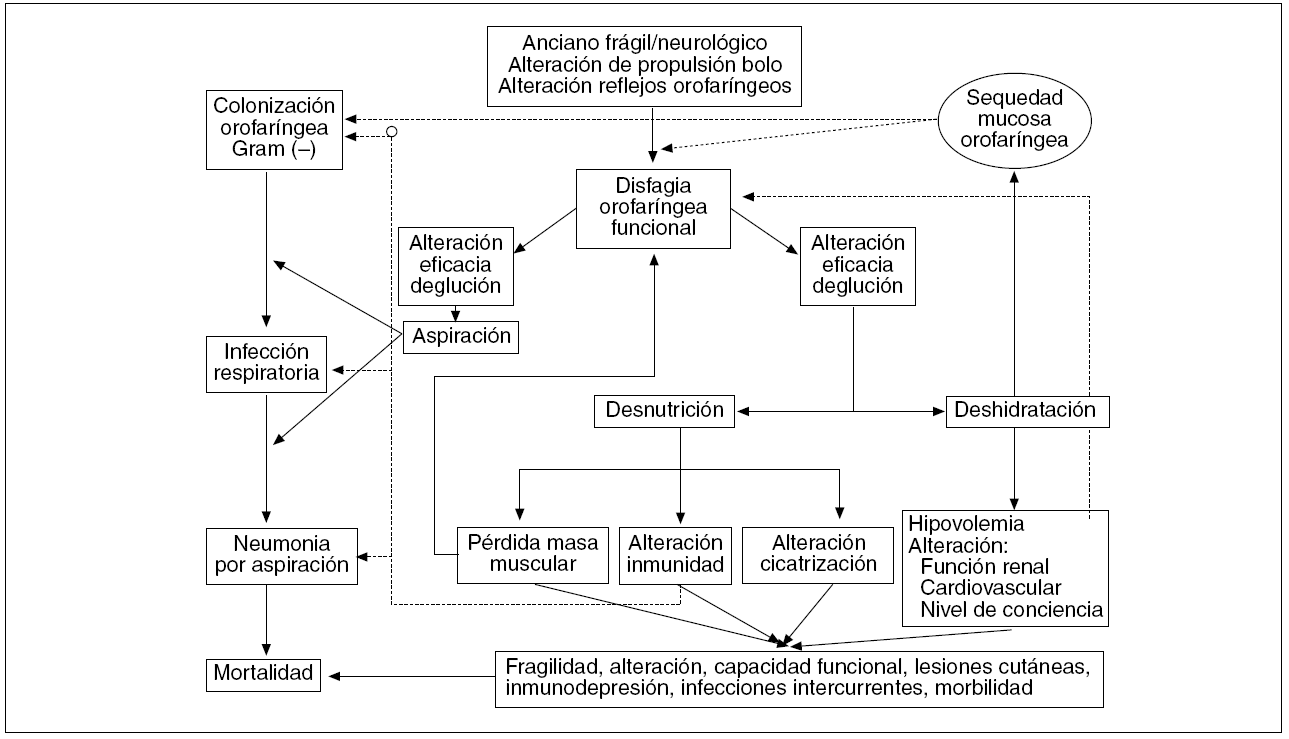
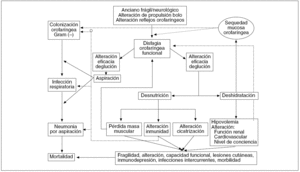
La disfagia orofaríngea puede variar desde una dificultad moderada hasta la total imposibilidad para la deglución y puede originar dos grupos de complicaciones de gran trascendencia clínica5-7. Si se produce una disminución de la eficacia de la deglución, el paciente se desnutre y/o se deshidrata. Si se produce una disminución de la seguridad de la deglución, se producirá un atragantamiento con obstrucción de la vía aérea o, más frecuentemente, una aspiración traqueobronquial3,6 (fig. 8). La prevalencia de desnutrición en los pacientes con disfagia orofaríngea funcional es muy elevada. En nuestra experiencia, hasta el 25% de los pacientes con disfagia neurógena presentan desnutrición identificada mediante el Subjective Global Asessment (SGA B o C)11 o el índice de masa corporal (IMC) o por una pérdida de peso superior al 10% desde la aparición del cuadro de disfagia11. Hasta un tercio de los pacientes ancianos con disfagia ingresados en nuestro hospital tuvieron desnutrición identificada mediante el Mini Nutritional Assessment (MNA). Hemos encontrado una profunda relación entre la disfagia y la desnutrición en estos colectivos de pacientes11. La desnutrición afecta de forma importante al compartimento magro, lo que empeorará todavía más la capacidad para deglutir, al disminuir la fuerza de los músculos deglutorios. Las complicaciones respiratorias suponen la principal causa de mortalidad de los pacientes con disfagia orofaríngea. Hasta el 50% de los pacientes neurológicos y pacientes ancianos presentan alteraciones de la seguridad de la deglución (penetraciones y aspiraciones) durante el estudio videofluoroscópico3,6,11. Una elevada proporción de estos pacientes tienen aspiraciones asintomáticas (no acompañadas de tos). Las aspiraciones orofaríngeas ocasionan frecuentes infecciones respiratorias, y hasta un 50% de los pacientes que aspiran desarrollan una neumonía por aspiración, con una mortalidad asociada de hasta el 50%6. La mayoría (> 80%) de las aspiraciones de los pacientes neurológicos y los ancianos se producen durante la fase faríngea del ciclo deglutorio y tienen relación con un enlentecimiento de la respuesta motora orofaríngea8,16,22,23. En Estados Unidos, entre 1992 y 1998 se produjo un incremento del 93,5% en las hospitalizaciones de ancianos con neumonías aspirativas, mientras que otras causas de neumonía se mantuvieron estables32. La neumonía aspirativa (NA) es la principal causa de muerte de los pacientes con disfagia tras un ACV después del alta hospitalaria, los pacientes con enfermedades neurodegenerativas y los pacientes ancianos frágiles5. En estos pacientes el material orofaríngeo está colonizado por gérmenes más patógenos que la flora orofaríngea habitual. Los más relacionados con la neumonía aspirativa son Haemophilus influenzae y Streptococcus pneumoniae, seguidos a distancia de enterobacterias (Klebsiella pneumoniae y Escherichia coli) y Pseudomonas aeruginosa; en cambio no parece, en estudios recientes, que los anaerobios tengan mucha implicación en la neumonía aspirativa. Los factores que permiten esta colonización orofaríngea son la edad, la mala higiene dental y oral, la desnutrición, el tabaquismo, la antibioterapia previa, la deshidratación, la disminución de la efectividad del sistema inmunitario, y llevar una sonda nasogástrica, cuyo biofilm en la capa externa favorece el crecimiento de gérmenes y la posibilidad de embolias sépticas a la cavidad orofaríngea, alterando el ecosistema orofaríngeo y aumentando la colonización de la vía respiratoria alta33.
Fig. 8. Fisiopatología de las complicaciones asociadas a la disfagia orofaríngea funcional. Modificado de Clavé et al3.
Tratamiento de la disfagia orofaríngea
La aplicación de programas de diagnóstico y tratamiento de la disfagia ororfaríngea ocasiona una importante reducción de la incidencia de neumonías por aspiración y mejora el estado nutricional3-9. El objetivo del tratamiento de la disfagia orofaríngea es el mantenimiento de la vía oral mientras sea posible mantener el estado nutricional y evitar las complicaciones respiratorias. Las estrategias de tratamiento de la disfagia orofaríngea se agrupan en cuatro grandes grupos: tratamiento rehabilitador (estrategias posturales, incremento sensorial, prácticas neuromusculares y maniobras específicas); modificación de las características del bolo: volumen y viscosidad; gastrostomía endoscópica percutánea, y procedimientos quirúrgicos sobre el esfínter velopalatino, el esfínter glótico o el esfinter esofágico superior. La mejor práctica clínica actual consiste en la selección del tratamiento de los pacientes con disfagia en función de la severidad de las alteraciones de eficacia y seguridad identificadas durante el estudio funcional: a) los pacientes con alteraciones discretas de la eficacia y una correcta seguridad pueden seguir una dieta libre; b) los pacientes con alteraciones moderadas requieren cambios destinados a disminuir el volumen e incrementar la viscosidad del bolo alimentario; c) los pacientes con alteraciones severas requieren además estrategias basadas en el aumento de la viscosidad y la introducción de técnicas del tipo postural, maniobras activas e incremento sensorial oral, y d) existe un grupo de pacientes con alteraciones tan graves que no es posible tratarlas mediante la aplicación de las técnicas de rehabilitación, en los que la vía oral no es posible y es necesario colocar una gastrostomía endoscópica percutánea3-9. En casos extremos en los que el paciente continúa aspirando secreciones orofaríngeas, se debe considerar una inyección de toxina botulínica a las glándulas salivales o, en última instancia, una separación laringotraqueal. La miotomía del cricofaríngeo debe restringirse a los pacientes con alteración de la apertura y relajación del EES asociados al divertículo de Zenker o en pacientes con el reflejo deglutorio preservado2,6.
Los pacientes con disfagia requieren estrategias dietéticas para concentrar sus requerimientos calóricos y proteínicos en el escaso volumen de comida que pueden ingerir. Una reciente resolución del Consejo de Europa sobre los cuidados nutricionales hospitalarios recomienda el desarrollo de guías para la identificación de la disfagia como origen de desnutrición, la homogeneización de las viscosidades y texturas necesarias, la monitorización de la ingesta caloricoproteínica y la disponibilidad de texturas y viscosidades apropiadas para cada tipo de paciente34. Estas recomendaciones están encaminadas a minimizar el impacto de la disfagia y de la desnutrición en la salud y la calidad de vida de los pacientes hospitalizados, y debe ser posible aplicarlas de forma extrahospitalaria una vez el paciente es dado de alta.
Tratamiento rehabilitador
Estrategias posturales. Permiten modificar las dimensiones de la orofaringe y de la vía que debe seguir el bolo. La flexión anterior del cuello permite proteger la vía respiratoria35; la flexión posterior facilita el drenaje gravitatorio faríngeo y mejora la velocidad de tránsito oral; la rotación de la cabeza hacia el lado faríngeo paralizado dirige la comida al lado sano, aumenta la eficacia del tránsito faríngeo y facilita la apertura del EES36; la deglución en decúbito lateral o supino protege de la aspiración de un residuo hipofaríngeo. El efecto de estas estrategias es modesto, ya que como mucho consiguen evitar las aspiraciones en el 25% de los pacientes en que se aplican6,35,36.
Estrategias de incremento sensorial oral. Son especialmente útiles en pacientes con apraxia o alteraciones de la sensibilidad oral (muy frecuente en pacientes ancianos). La mayoría de estrategias de incremento sensorial comprenden la estimulación mecánica de la lengua, modificaciones del bolo (volumen, temperatura y sabor) o la estimulación mecánica de los pilares faríngeos. Los sabores ácidos, como el del limón o la lima, o las sustancias frías (helado, hielo) desencadenan el mecanismo de la deglución y pueden reducir el número de aspiraciones37,38. La evidencia acerca de la eficacia de esta estrategia es baja y sólo un estudio ha conseguido demostrar una muy discreta disminución (un 5%) en el número de aspiraciones37.
Prácticas neuromusculares. Tienen como objetivo mejorar la fisiología de la deglución y el tono, la sensibilidad y la motricidad de las estructuras orales (labios, lengua) y la musculatura suprahioidea39. Una de estas prácticas, denominada maniobra de Shaker (un ejercicio isométrico-isotónico de flexión anterior del cuello para potenciar la musculatura suprahioidea de 6 semanas de duración), ha conseguido demostrar un cambio en la fisiología orofaríngea y un efecto terapéutico en los pacientes con disfagia. En concreto, la maniobra de Shaker origina un significativo incremento en la apertura anteroposterior del EES y del desplazamiento anterior de la laringe40. Además, los pacientes mostraron una significativa disminución en el residuo posdeglutorio y de las aspiraciones posdeglutorias28.
Maniobras deglutorias específicas. Están específicamente dirigidas a compensar alteraciones biomecánicas concretas, el paciente debe ser capaz de aprenderlas y realizarlas de forma automatizada39,41. Las más importantes son la deglución supraglótica (fig. 9), la supersupraglótica, la deglución de esfuerzo o forzada, la doble deglución y la maniobra de Mendelsohn. El efecto terapéutico de estas estrategias es moderado y su aplicación requiere de un paciente cognitivamente íntegro y colaborador y los efectos son evidenciables a medio y largo plazo.
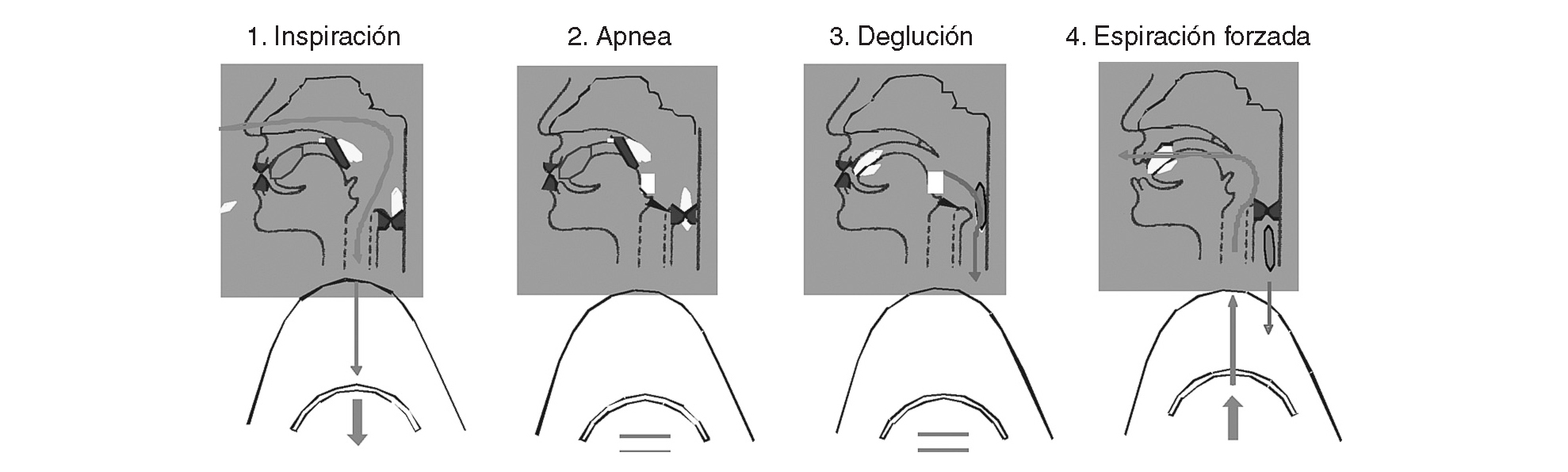
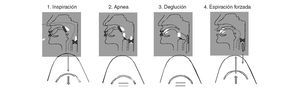
Fig. 9. Maniobra de deglución supraglótica. Fases de la maniobra dirigida a mejorar el cierre glótico e incrementar la protección de la vía respiratoria durante la deglución: 1. inspiración, 2. apnea y cierre de glotis, 3. deglución en apnea y 4. espiración forzada.
Electroestimulación. La estimulación eléctrica transcutánea o intramuscular de los músculos miliohioideos y tirohioideos es un tratamiento descrito recientemente que permite incrementar el ascenso hiodeo y laríngeo y mejorar la protección contra las aspiraciones42,43.
Cambios de volumen y viscosidad del bolo
Diversos grupos de expertos están de acuerdo en que la modificación de la textura de los líquidos es extremadamente importante para asegurarse de que los pacientes con disfagia orofaríngea funcional asociada al en-vejecimiento o a enfermedades neurológicas estén adecuadamente nutridos e hidratados y no tengan aspiraciones5,6. En pacientes con disfagia neurógena, la reducción del volumen del bolo y los incrementos de viscosidad causan un importante efecto terapéutico en los signos de eficacia y seguridad, con una importante mejoría en las penetraciones y aspiraciones11. La viscosidad es una propiedad física que se puede medir y se expresa en unidades del sistema internacional denominadas Pa.s. La prevalencia de penetraciones y aspiraciones es máxima con líquidos (20 mPa.s) y disminuye con bolos de viscosidad néctar (300 mPa.s) y pudding (4.000 mPa.s)11. El efecto terapéutico de los incrementos de viscosidad es muy intenso; la prevalencia de aspiraciones de bolos líquidos sobrepasa el 20% de los pacientes neurológicos y los ancianos y se reduce significativamente al 10,5% mediante viscosidad néctar y al 5,3% mediante viscosidad pudding3,11. Los cambios de volumen y viscosidad del bolo alimenticio constituyen una estrategia terapéutica muy valiosa, ya que se trata de un método de gran eficacia terapéutica que no fatiga, no requiere integridad cognitiva y no supone ningún aprendizaje, y la aplicación de la estrategia corre a cargo del cuidador11.
Gastrostomía endoscópica percutánea
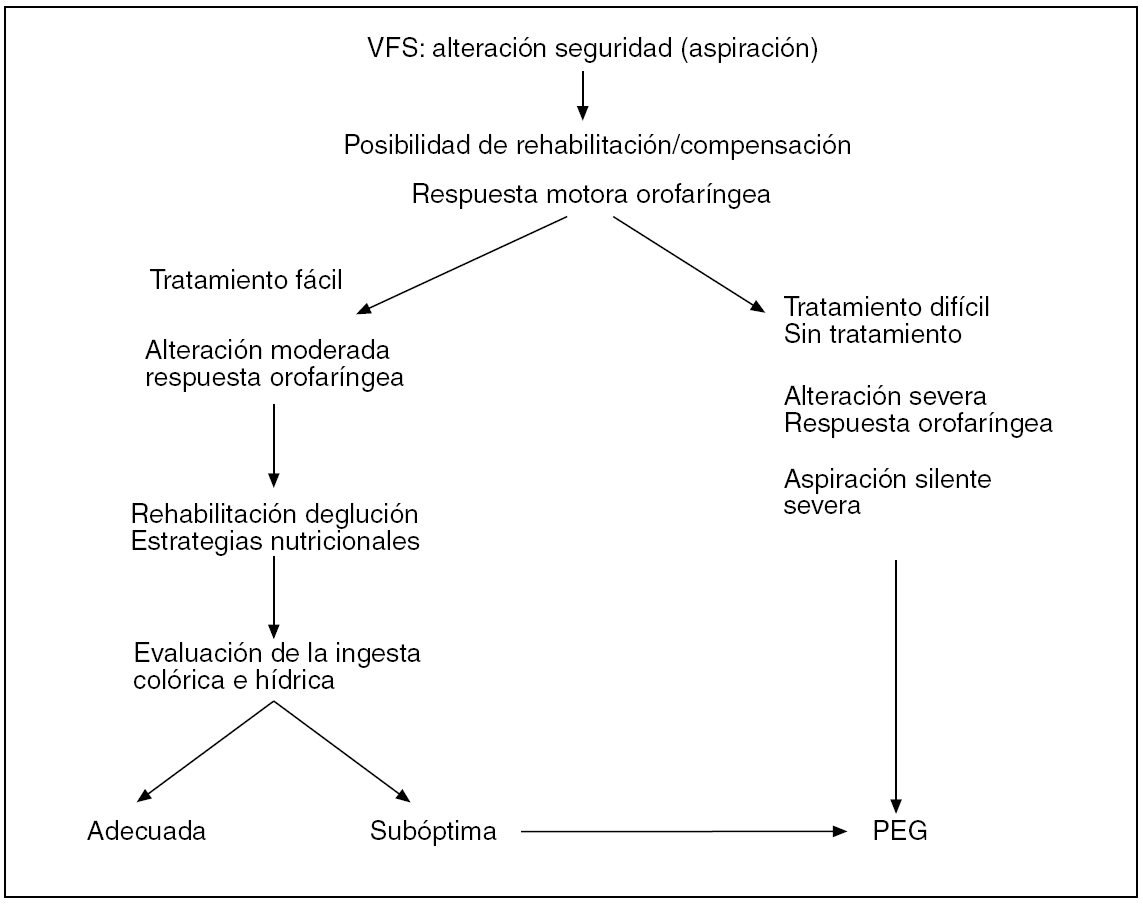
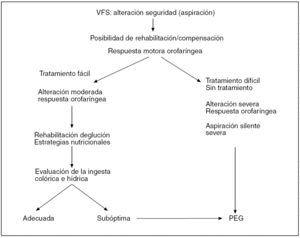
La gastrostomía endoscópica percutánea está indicada en pacientes con enfermedades crónicas o progresivas y una disminución de la eficacia y seguridad de la deglución que previsiblemente se prolongará más allá de 6-8 semanas siempre que la esperanza de vida sea de al menos 3 meses (fig. 10)5,44. La alimentación por sonda nasogástrica sólo está justificada en pacientes con disfagia aguda que puede evolucionar favorablemente a reutilizar la vía oral en un período inferior a 2 meses. Está totalmente desaconsejada la utilización de la sonda nasogástrica en pacientes con enfermedades crónicas o progresivas en los que va a evitarse la vía oral por un período superior a 2 meses45. En la mayoría de los pacientes que requieren una gastrostomía es posible y debe intentarse mantener una pequeña proporción de alimentación por la vía oral en condiciones de seguridad2,5. Las contraindicaciones absolutas de la gastrostomía endoscópica percutánea (GEP) son la imposibilidad de practicar una gastroscopia (estenosis esofágicas), la ascitis, el cáncer gástrico, las coagulopatías, el sangrado gástrico, la gastrectomía parcial o total, la infección de la pared abdominal y los trastornos severos de la motilidad intestinal. Se considera contraindicaciones relativas una voluminosa hernia de hiato, la cirugía gástrica no resectiva y la imposibilidad de transiluminación por obesidad, cifoescoliosis o transposición del colon. Las complicaciones leves más frecuentes de la GEP son la infección local del estoma, que suele resolverse con tratamiento local, y el sangrado, que suele ser autolimitado. Ocasionalmente (1-4%) puede haber complicaciones graves como infecciones abdominales, hemorragias, perforaciones y neumoperitoneo secundario a la extracción accidental y precoz de la sonda46,47.
Fig. 10. Algoritmo para la indicación de gastrostomía endoscópica percutánea (PEG) en pacientes con disfagia severa de causa crónica o progresiva. La selección del tratamiento se realiza en función de las alteraciones de la seguridad de la deglución identificadas durante el estudio videofluoroscópico. Modificado de Carrau et al49.
Tratamiento quirúrgico de la disfagia orofaríngea
El tratamiento quirúrgico de la disfagia orofaríngea está orientado principalmente a mejorar la eficiencia de los esfínteres que son necesarios para una deglución eficiente y segura. Éstos incluyen el EES, el esfínter velopalatino y el esfínter glótico48-53.
Pacientes con barra del cricofaríngeo. La selección de los pacientes para la miotomía del esfínter esofágico superior es difícil y de mayor importancia para la calidad de vida de los pacientes6. La miotomía está exclusivamente indicada en pacientes con disfagia orofaríngea que presenten: a) una alteración de la apertura del esfínter; b) junto con una disminución de la distensibilidad y un incremento de la resistencia al flujo, y c) propulsión lingual y faríngea adecuada. Los marcadores manométricos para la selección de estos pacientes son la pérdida del descenso de presión subatmosférica y el incremento en la presión intrabolo en el registro manométrico31. En estos pacientes la miotomía del cricofaríngeo suele realizarse a través de una incisión cervical izquierda a lo largo del borde anterior del músculo esternocleidomastoideo. La miotomía se inicia en el constrictor faríngeo inferior y se extiende hasta 5 cm distales. Es recomendable la toma de biopsias para estudio histológico, que suele ofrecer cambios de degeneración y fibrosis del tejido muscular. En los pacientes sin antecedentes neurológicos y reflejo deglutorio preservado, los resultados son positivos en dos tercios de los pacientes intervenidos31. En cambio, los resultados de la miotomía son mediocres cuando se aplican a pacientes con trastornos espásticos de la apertura del EES (Parkinson, TCE) y alteraciones de la respuesta motora orofaríngea6.
Pacientes con divertículo de Zenker. En 1878, Zenker y Ziemssen propusieron que la fisiopatología del divertículo faríngeo se debía a una herniación de la mucosa faríngea a través de una zona debilitada en la región posterior de la dehiscencia de Killian causada por un incremento de la presión hipofaríngeo54. Hasta 100 años después y gracias a estudios de Cook et al54 no se obtuvieron datos fisiológicos que confirmaran esta teoría y se determinara que esta presión se incrementaba como consecuencia de una alteración de la apertura, disminución de la distensibilidad del EES, y un incremento de la resistencia al flujo del bolo55. Estos pacientes no presentan ningún tipo de discoordinación entre la contracción faríngea y la relajación del EES31,54. El estudio histológico del EES de los pacientes con Zenker demuestra claramente la degeneración del tejido muscular estriado y su sustitución por tejido fibroadiposo mucho menos distensible. También se ha demostrado mediante estudios funcionales que en los pacientes con Zenker la miotomía del cricofaríngeo (incluso sin resección del divertículo) normaliza la presión hipofaríngea y la distensibilidad del EES; por lo tanto, es un elemento imprescindible en el tratamiento de estos pacientes54,55. Una reciente revisión de los resultados del tratamiento quirúrgico del Zenker indica que el tratamiento de elección de los divertículos pequeños (< 2 cm) es la miotomía exclusivamente; los divertículos de tamaño moderado pueden ser tratados mediante miotomía asociada a suspensión y los de tamaño grande, mediante miotomía asociada a resección del divertículo56. Los resultados clínicos y funcionales de la vía abierta en pacientes con Zenker son excelentes (> 96%) y la tasa de complicaciones, baja6,56. Más recientemente se ha descrito técnicas endoscópicas de división de la pared común entre el divertículo y la luz esofágica mediante electrocauterio o una sutura mecánica, no siempre posibles en divertículos de pequeño tamaño56.
Indicaciones de la inyección de toxina botulínica en el EES. La toxina botulínica tipo A deriva de la fermentación controlada de Clostridium botulinum y su inyección directa en el músculo cricofaríngeo permite conseguir la parálisis (relajación) y la deglución en pocos días57-59. Tiene como inconveniente que el efecto es gradualmente reversible, aunque es posible repetir las sesiones. Está indicada en pacientes con disfunción primaria del cricofaríngeo, cuando precisemos un efecto transitorio o en aquellos donde la miotomía sea de muy alto riesgo52. Con el paciente sedado se practica la endoscopia, se localiza la hipofaringe y el músculo cricofaríngeo y se inyecta la toxina con una aguja de esclerosis a nivel dorsomedial (50%) y el 25% a cada lado del músculo. Se suele administrar 50-100 U por sesión. La sesión suele durar unos 20 min, aproximadamente, y requiere un ingreso hospitalario corto.
Procedimientos quirúrgicos sobre el esfínter glótico y el esfínter velopalatino. Un esfinter glótico incompetente debido a una parálisis o debilidad neuromuscular puede ser tratado mediante la medializacion del pliegue vocal con métodos de inyección transendoscópica, transoral o percutánea o por medio de una laringoplastia48-51. El objetivo es mover el pliegue vocal paralizado a una posición donde el pliegue vocal contralateral pueda completar el cierre laríngeo. La medialización por inyección puede realizarse como un procedimiento ambulatorio en la mayoría de los pacientes y es aconsejable cuando la brecha glótica no es amplia y cuando el pronóstico del paciente es favorable51. La laringoplastia requiere una incisión cervical e implica la implantación de un material aloplástico como silicona, gore-tex o hidroxiapatita48-50. La laringoplastia tiene un resultado final más predecible que la inyección y es preferible cuando el déficit es permanente, cuando la brecha vocal es amplia o cuando hay una brecha de la glotis posterior. Los pacientes que con brecha glótica posterior pueden necesitar una cirugía de los aritenoides para aducirlos o medializarlos. Este procedimiento puede ser completado ampliando la incisión y el abordaje de la laringoplastia. En casos de aspiraciones que no responden a ninguno de los tratamientos mencionados, el paciente se puede beneficiar de una separación laringotraqueal52. La incontinencia de esfínter velopalatino, ya sea por defectos quirúrgicos o por déficit neuromusculares, puede dar lugar a regurgitación nasal y perdida de la presión producida por la propulsión lingual. Muchos de los pacientes con este problema van a beneficiarse de una prótesis que reemplace la pérdida de tejido o que empuje el paladar contra la pared faríngea posterior. La corrección quirúrgica está indicada cuando el paciente no tolera la prótesis, cuando no tiene suficientes dientes para retenerla o por preferencia personal. Un método quirúrgico relativamente sencillo es crear una sinequia del paladar a la pared posterior faríngea53. Esto mantiene el contacto velopalatino y restablece el esfínter en pacientes con déficit neurógenos, rehabilita la deglución y elimina la rinolalia.
Estudios realizados con el soporte de: Instituto de Salud Carlos III, Fondo de Investigación Sanitaria IF/063678-2, PI/051554;
Fundació de Gastroenterologia Dr. F. Vilardell; Fundació Salut del Consorci Sanitari del Maresme; filial del Maresme de la Acadèmia de Ciències Mèdiques de Catalunya i Balears, y Novartis Consumer Health, S.A.
Correspondencia: Dr. P. Clavé.
Unidad de Exploraciones Funcionales Digestivas. Servicio
de Cirugía General y Digestiva. Hospital de Mataró.
Ctra. Cirera, s/n. 08304 Mataró (Barcelona). España.
Correo electrónico: pclave@teleline.es
Manuscrito recibido el 20-3-2007 y aceptado el 28-3-2007.