Introducción
El cáncer de páncreas es una enfermedad frecuente en países desarrollados; es la cuarta causa de muerte por cáncer en Estados Unidos y la segunda causa de muerte por neoplasia digestiva después del cáncer colorrectal. Se diagnostican alrededor de 10 nuevos casos por cada 100.000 habitantes y año. Es un tumor de muy mal pronóstico y comportamiento muy agresivo con gran tendencia a diseminarse de forma precoz a ganglios linfáticos e hígado y afectación temprana de estructuras vecinas, fundamentalmente vasculares. La resección quirúrgica es el único tratamiento potencialmente curativo, pero sólo el 15-20% de los tumores son candidatos a ella por su presentación en estadios avanzados, y en estos casos se realiza un tratamiento paliativo. La supervivencia global se ha mantenido prácticamente constante durante los últimos 15 años, con cifras aproximadas del 20% al año y menos del 3% a los 5 años. La supervivencia a los 5 años en los casos en que se pudo hacer resección quirúrgica es del 25-30% en los pacientes que presentaron ganglios linfáticos negativos, y desciende hasta el 10% en los casos con ganglios afectados. A su vez, el tratamiento quirúrgico está gravado con una alta tasa de morbilidad y mortalidad: del 30-50% y el 0-15%, respectivamente. Por ello, es necesario seleccionar bien a los candidatos, evitando cirugías innecesarias en pacientes que no van a beneficiarse de ellas1.
Caso 1
Varón de 59 años, intervenido 3 años antes de cáncer de colon en estadio B1 de Dukes. Al mes de una revisión completa normal, comenzó con molestias epigástricas, que ceden con la ingesta, y melenas. En la exploración destacaba palidez mucocutánea, heces melénicas, hemoglobina de 9,5 g/dl y CEA de 7,29 ng/ml. En panendoscopia oral se observó, en bulbo duodenal, ulcus de 1 cm con vaso sangrante que se esclerosa, cediendo la hemorragia. A los 6 días recidivó la hemorragia, que se controla con nueva esclerosis, esta vez de una masa ulcerada, que en la biopsia se informó como carcinoma pobremente diferenciado. Durante el ingreso se observó aumento progresivo de las concentraciones de transaminasas y bilirrubina total, con aparición de ictericia mucocutánea. Mediante ecografía se observó dilatación de la vía biliar intrahepática y extrahepática y ecos heterogéneos en la cabeza pancreática. Una tomografía computarizada (TC) abdominal mostró una masa en cabeza pancreática de 7 cm con infiltración de pared de la segunda porción de duodeno y adenopatías mesentéricas y celíacas (fig. 1). A las 2 semanas el CEA era de 32,13 ng/ml, el CA 125 de 193,8 U/ml y el CA 19.9 de 7.865 U/ml. Mediante laparotomía se observó una gran masa en cabeza pancreática, ulcerada al duodeno, y abundantes adenopatías celíacas, mesentéricas y retroperitoneales. Se realizó duodenopancreatectomía cefálica paliativa, quedando adenopatías en territorio mesentérico y retroperitoneal. El diagnóstico anatomopatológico fue carcinoma adenoescamoso de páncreas perforado a duodeno. A los 5 meses de la cirugía el paciente continúa vivo y asintomático, sin haber presentado nuevos episodios de melenas.
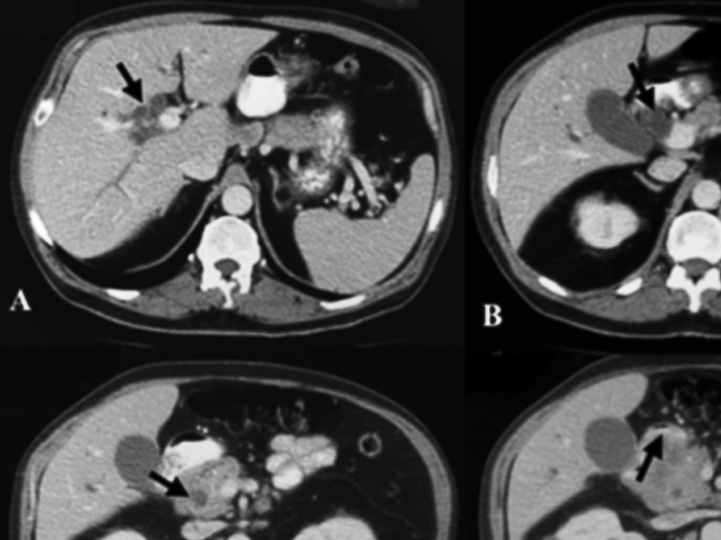
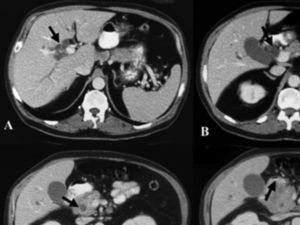
Fig. 1. Imágenes de tomografía computarizada del caso 1. A: vía biliar intrahepática dilatada. B: colédoco distal dilatado. C: disminución de calibre de colédoco, atrapado por el tumor. D: tumor que infiltra el duodeno.
Caso 2
Varón de 49 años con episodios esporádicos de dolor en el hipocondrio derecho. Destacan sus antecedentes familiares de padre, tío paterno y 2 primos fallecidos de cáncer de páncreas y 2 tías fallecidas de otros tumores digestivos. La TC y la resonancia magnética (RM) mostraron en la cabeza pancreática una lesión inferior de 1 cm (fig. 2). La ecoendoscopia identificó una lesión quística septada de 8 × 9 mm en proceso uncinado del páncreas, indicativo de cistoadenoma. Una punción-aspiración con aguja fina (PAAF) mostró abundante material mucoide y presencia de papilas con atipia celular. Con sospecha de tumor quístico mucinoso de páncreas en paciente con cáncer familiar, se indicó duodenopancreatectomía cefálica con preservación de píloro. La anatomía patológica mostró lesión quística con epitelio ductal con alguna proyección papilar sin atipias en pieza mal conservada, lo que planteaba el diagnóstico diferencial entre hiperplasia papilar ductal y cistoadenoma mucinoso. A los 5 meses de la cirugía el paciente se encuentra asintomático.
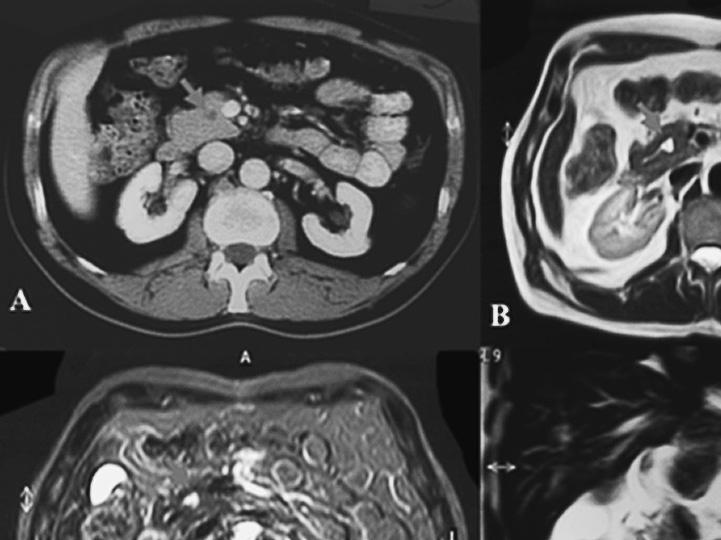
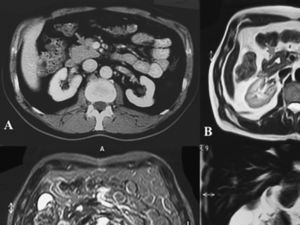
Fig. 2. Caso 2. A: imagen de la lesión mediante tomografía computarizada con contraste. B: imagen de resonancia magnética (RM) en T1. C: imagen de RM en T2. D: corte coronal de RM.
Discusión
El cáncer de páncreas es una causa poco frecuente de hemorragia digestiva alta. La mayoría de los casos se suelen presentar en forma de melenas o hematoquecia. Lee et al2 y Lin et al3 describen los dos únicos casos en la literatura de cáncer de páncreas cuya primera manifestación fue hematemesis. En ambos casos había una invasión directa del tumor sobre el duodeno. El caso descrito por Lin et al presentaba en la endoscopia una masa polipoide protruyendo a través de la mucosa duodenal. En nuestro caso 1, la primera endoscopia mostraba una imagen de ulcus duodenal sangrante y la segunda, una masa ulcerada protruyente.
En el caso 1 observamos una elevación de los marcadores tumorales CA 19.9, CEA y CA 125. El CA 19.9 es el marcador de elección para el cáncer de páncreas por ser el que presenta mayor sensibilidad y especificidad (el 85 y el 90%, respectivamente), y sus concentraciones séricas son directamente proporcionales a la masa tumoral; por tanto se hallan valores más elevados cuanto más avanzada se encuentre la enfermedad. El CEA se eleva únicamente en tumores grandes e irresecables, por lo que su utilidad es escasa, con una sensibilidad del 26%1. Ante revisión completa reciente normal del colon, la elevación del CEA, asociada a las concentraciones elevadas del CA 19.9, orientaba a tumor pancreático de gran tamaño.
Lee et al2 describen en su trabajo 8 casos de hemorragia digestiva alta como primera manifestación del carcinoma pancreático por afectación de duodeno, estómago y colon transverso, en los que sólo se planteó tratamiento paliativo ante la ausencia de tratamiento quirúrgico curativo, e incluso llegan a sugerir que una actitud inicial más agresiva con angiografía en sangrados no filiados habría podido evitar laparotomías innecesarias.
Se consideran criterios de irresecabilidad: la presencia de ascitis o metástasis peritoneales o hepáticas, la infiltración del retroperitoneo al realizar la maniobra de Kocher y metástasis ganglionares fuera del territorio de la linfadenectomía estándar. Un tumor de 5 cm o mayor es poco probable que sea resecable, y los casos de afectación linfática del territorio intercavo-aórtico deben ser valorados individualmente1. La infiltración de vasos mesentéricos superiores no es necesariamente un criterio de irresecabilidad, pero sí conlleva un peor pronóstico. Nuestro primer caso presentaba un tumor de 7 cm con infiltración duodenal y múltiples adenopatías en todos los territorios ganglionares, por lo que cumplía criterios de irresecabilidad. Se planteó la posibilidad de realizar una derivación biliodigestiva paliativa, que solucionaría la ictericia y una eventual obstrucción duodenal por el crecimiento del tumor, pero no solucionaría la hemorragia digestiva. Ante esta situación, sólo la extirpación del tumor podría solventar el problema, valorando que la morbimortalidad asociada a este procedimiento es muy elevada y que sus fines eran meramente paliativos.
Diversos factores genéticos pueden predisponer al cáncer de páncreas. Se estima que la agregación familiar está presente en el 10% de los pacientes con cáncer de páncreas4. El riesgo está también aumentado en pacientes con síndromes de cáncer familiar, como síndrome de Peutz-Jeghers, enfermedad de von Hippel-Lindau, síndrome de melanoma familiar atípico con molas múltiples, ataxia-telangiectasia, síndrome de Lynch tipo II y casos de pancreatitis crónica familiar5. Muchas combinaciones de mutaciones genéticas se encuentran en el cáncer de páncreas, de las cuales la activación del oncogén k-ras es la más frecuente, que se encuentra en más del 90% de los tumores pancreáticos. Alteraciones en el gen supresor p53 aparecen en el 60-70% de los casos de cáncer de páncreas. En neoplasias quísticas mucinosas la frecuencia de mutación de k-ras se correlaciona con el grado de displasia en el tumor6.
La agregación familiar de tumores pancreáticos permite el desarrollo de estrategias de identificación y tratamiento de lesiones precancerosas, así como la comprensión de la base genética en el desarrollo de estas neoplasias. El consejo genético permite la detección de alteraciones genéticas que impliquen aumento del riesgo de desarrollar un tumor pancreático en los individuos con antecedentes familiares importantes; las principales son las mutaciones en los genes BRCA2, STK11/LKB1, p16/CDKN2A y PRSS1. La presencia de una mutación en estos genes en pacientes con antecedentes familiares aconseja adoptar medidas conservadoras, como abandono del tabaco o modificaciones dietéticas, y en individuos seleccionados la realización de un cribado con TC y ecoendoscopia. En estos casos, cuando las pruebas de cribado detectan una lesión pancreática, estaría indicada la intervención quirúrgica, ya que la resección de lesiones precancerosas no invasivas significaría la curación del tumor antes de darle la oportunidad de diseminarse y metastatizar. Sin embargo, incluso con estos métodos se diagnostica a algunos pacientes ya en fase invasiva, pero el tumor suele ser aún pequeño y sin afectación ganglionar, lo que determina una mayor supervivencia tras la cirugía7.
Con el uso de técnicas de imagen avanzadas ha aumentado el número de lesiones quísticas pancreáticas asintomáticas identificadas, y supone un problema diferenciar lesiones benignas, como seudoquistes y cistoadenomas serosos, de lesiones malignas o mucinosas premalignas. Hace años se recomendaba resección quirúrgica de toda lesión quística en el páncreas, lo que hoy es inaceptable ante la batería de pruebas diagnósticas disponibles, aunque ninguna de ellas permite diferenciar con absoluta seguridad lesiones benignas de malignas. Se acepta que el cistoadenoma seroso es una lesión benigna que no maligniza; sin embargo, las lesiones quísticas que presentan células productoras de mucina (cistoadenoma mucinoso, cistoadenocarcinoma mucinoso y neoplasia mucinosa papilar intraductal) tienen potencial para transformación maligna8. Lim et al9 proponen un algoritmo en el que la TC es la primera prueba a realizar, y queda la RM relegada a un segundo lugar, al no aportar mayor información. Si mediante TC se observa lesión quística con efecto masa o evidencia radiológica de tumor mucinoso o maligno, estaría indicada la cirugía sin necesidad de realizar más pruebas. Si la TC evidencia dilatación del conducto de Wirsung, una colangiopancreatografía retrógrada endoscópica (CPRE) estaría indicada para descartar un tumor mucinoso papilar intraductal. En lesiones quísticas que no presentan estas características en la TC, estaría indicado realizar CPRE o ecoendoscopia acompañadas de PAAF para analizar el fluido del quiste. La presencia de células mucinosas, atipia celular o células tumorales en la PAAF obliga a la intervención quirúrgica10.
En nuestro caso 2, ante la presencia de una lesión quística en páncreas, indicativa de cistoadenoma mucinoso con presencia de atipias en el estudio citológico y antecedentes familiares de primer y segundo grado fallecidos de carcinoma de páncreas, la resección del tumor parece la opción adecuada a la vista del conocimiento de que disponemos en la actualidad sobre las lesiones quísticas mucinosas del páncreas.
Correspondencia: Dr. J. Ruiz-Tovar.
Servicio de Cirugía General y Digestiva. Hospital Universitario Ramón y Cajal.
Crta. Colmenar Viejo, km 9,100.
28034 Madrid. España.
Correo electrónico: jrtovar@wanadoo.es
Manuscrito recibido el 22-2-2006 y aceptado el 24-5-2006.