Introducción
El tratamiento de las colecciones abscesificadas intraabdominales ha cambiado de manera sustancial en las últimas 2 décadas. Clásicamente, la cirugía abierta ha desempeñado un papel relevante en la evacuación y curación de las colecciones infectadas abdominales. Diversas circunstancias han contribuido a que el médico intervencionista tome un especial protagonismo en esta parcela terapéutica. Entre estas circunstancias destacan los avances en las técnicas de imagen, como la tomografía computarizada y la ecografía, el diseño de pequeños materiales de acceso y drenaje poco traumáticos, y la tendencia y demanda generalizada de la mínima invasión, tanto por parte del paciente como del médico. Surge un nuevo quehacer médico que se imbrica en otras tareas que también se realizan con las manos, kheiros. En este caso, el trabajo se realiza con pequeñas y sofisticadas herramientas guiadas por medio de imagen. McFadzean et al1 publicaron por primera vez en 1953 el tratamiento de 14 abscesos piógenos de hígado mediante aspiración cerrada y antibióticos.
Desde este primer artículo se han realizado múltiples publicaciones en las que se han valorado los resultados y los beneficios de esta técnica percutánea2,3, de tal forma que en el momento actual pocos discuten que el drenaje percutáneo de los abscesos abdominales con guía de imagen es el tratamiento de elección de esta enfermedad4.
El éxito clínico obtenido con el drenaje percutáneo y la correcta antibioterapia es alto y, según la localización y el agente causal, alcanza el 80-90%5. No obstante, en algunos pacientes este tratamiento es ineficaz y es necesario recurrir a la cirugía abierta.
Entre las diversas causas de fracaso clínico en el drenaje de un absceso abdominal mediante catéter se han encontrado la viscosidad del material drenado (sangre o pus), que obstruye el catéter, y la tabicación o compartimentación del absceso5-7. Diversos autores han demostrado que, en estas circunstancias, los resultados pueden mejorar si se administran fibrinolíticos8,9.
Acción de los fibrinolíticos en la inflamación
El fibrinógeno es una proteína plasmática soluble con un peso molecular de 340.000 daltons constituida por 6 cadenas polipeptídicas. Su síntesis se realiza en el hígado entre 1 y 5 g/día, con una vida media de 100 h: la rotura de sus cadenas libera los fibrinopétidos A y B, y genera el monómero de fibrina.
El plasminógeno es una glucoproteína de cadena simple sintetizada en el hígado con un peso molecular de 93.000 daltons. Contiene un grupo aminoterminal con ácido glutámico (glu-plasminógeno) y un grupo carboxi-terminal con asparragina. El plasminógeno puede unirse específicamente a la fibrina por los lysine binding sites. El paso de glu-plasminógeno a lys-plasminógeno se realiza por la hidrólisis de los puentes peptídicos por la plasmina.
La plasmina es una serinproteasa capaz de digerir tanto el fibrinógeno como la fibrina. La plasmina es abundante en el organismo en forma de una proenzima o forma inactiva (plasminógeno). Los activadores del plasminógeno (estreptocinasa, uricinasa, activador tisular del plasminógeno prouricinasa) escinden el plasminógeno en 2 sitios y activan la acción proteasa de la plasmina10. De forma natural, el plasminógeno coprecipita con la fibrina y, de este modo, es incorporado a los depósitos de fibrina. Cuando la plasmina que está en los coágulos es activada, degrada la fibrina a fragmentos solubles (factores de degradación del fibrinógeno [PDF]) y disuelve el polímero de fibrina. Los polímeros de fibrina con enlaces cruzados son menos sensibles a la disolución de la plasmina. La regulación del sistema fibrinolítico y, principalmente, de la excesiva cantidad o acción de la plasmina es realizada sobre todo por la α2-antiplasmina, α2-macroglobulina y los inhibidores del activador del plasminógeno PAI-1 y PAI-210.
Se ha comprobado que en el espacio pleural hay actividad fibrinolítica y procoagulante. Ambas actividades están reguladas y se mantienen en equilibrio por una serie de factores, como la quimiotaxis celular, la permeabilidad vascular y la inmunomodulación, que se constituyen como factores procoagulantes, mientras que la activación del complemento, la liberación de enzimas proteolíticas, la estimulación de fibroblastos y los productores de activación de complemento se consideran factores fibrinolíticos. En ciertos derrames pleurales de carácter inflamatorio se produce un desequilibrio entre la actividad procoagulante y la fibrinolítica a favor de un aumento en la formación de cadenas de fibrina y una disminución de la fibrinólisis, con lo que la colección purulenta o inflamatoria se hace más viscosa y tiende a formar tabiques de fibrina. Estos mismos mecanismos deben ser ciertos para todos los procesos inflamatorios infecciosos contenidos en cavidades. No obstante, se deben constatar diferencias notables. Las colecciones inflamatorias metaneumónicas o empiematosas del espacio pleural están recubiertas de las capas pleurales con células mesoteliales. Raja y Casson11 demostraron, mediante cultivo puro de células mesoteliales in vitro, la presencia de actividad fibrinolítica y producción de t-PA en estos cultivos. Otros autores, como Idell et al12 y Philip-Joet et al13, corroboraron estos hallazgos tras estudiar PDF1, dímeros D (PAI-1) en derrames pleurales inflamatorios.
Son escasos los trabajos publicados en la bibliografía en los que se demuestre categóricamente una actividad procoagulante aumentada en los abscesos abdominales o en colecciones inflamatorias abdominales. Park et al14 demostraron en un modelo in vitro que el empleo de urocinasa reducía la viscosidad del material purulento en un 23% en comparación con el material purulento no tratado con este fármaco. Haaga y Weinstein6 y Lahorra et al8 reseñaron por primera vez las ventajas clínicas de la urocinasa para tratar abscesos abdominales. Lahorra et al8, en su estudio de 26 pacientes con absceso abdominal tratados con distintas dosis de urocinasa, demostraron que los abscesos abdominales contienen una elevada concentración de fibrina, que la urocinasa conserva sus propiedades enzimáticas en contacto con el material purulento escindiendo la fibrina y, finalmente, que la urocinasa administrada localmente no tiene efectos sistémicos sobre la coagulación.
El organismo se defiende ante la infección local atrayendo un flujo de células inflamatorias que liberan cininas. Estas sustancias aumentan la permeabilidad capilar, lo que permite el paso de proteínas tales como el fibrinógeno que se polimeriza en fibrina. Dicha fibrina rodea al foco infeccioso e impide su progresión y diseminación. Esta barrera biológica de contención, verdadero mecanismo de defensa, impide también la llegada de elementos sanguíneos encargados de la fagocitosis y de antibióticos, y tabica y compartimentaliza la colección purulenta a la vez que transforma al material purulento en una sustancia más viscosa. Estos hallazgos fueron demostrados por Hau et al15,16, que comprobaron que, en un modelo animal (120 ratas), las bacterias inyectadas en un coágulo de fibrina intraperitonealmente desarrollaban abscesos y las ratas no morían, pero disminuía la eficacia de los antibióticos sistémicos. Cuando se administraba heparina mejoraba la acción de los antibióticos al impedir la formación de trabéculas. Nakamoto et al17,18 demostraron en hámsters que la inyección de urocinasa en abscesos provocados por cuerpos extraños contaminados con bacterias mejoraba los resultados. Lahorra et al8 en su estudio en fase I, aunque no pudieron demostrar la presencia de plasminógeno y plasmina en el material purulento de los abscesos, hallaron concentraciones elevadas de PDF por encima de los valores normales, con significación estadística. Las concentraciones de fibrinógeno no se modificaron antes y después de la irrigación con urocinasa, mientras que el dímero D ascendió tras la administración de urocinasa, y sus concentraciones se redujeron hasta las normales tras cesar la irrigación.
Indicaciones del uso de fibrinolíticos
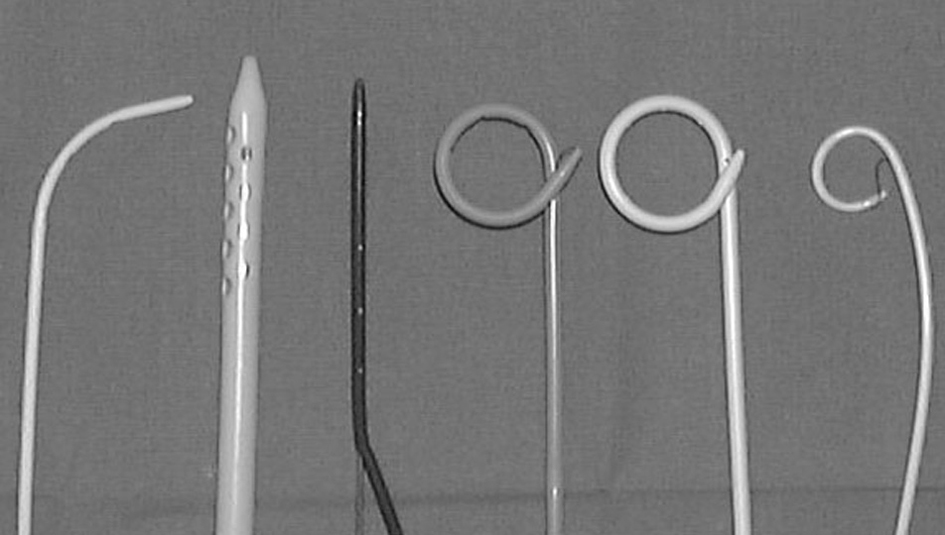
El drenaje mediante catéter es el tratamiento de elección de los abscesos abdominales. Diversas circunstancias han permitido el desarrollo de las técnicas percutáneas mínimamente invasivas, como los avances en los medios de imagen guía (ultrasonidos, tomografía computarizada [TC] y resonancia magnética [RM]), la mejora en los materiales (agujas, catéteres, etc.) (fig. 1) y la buena aceptación en la comunidad médica y en la sociedad.
Fig. 1. Diversos tipos de catéteres y diámetros (French) utilizados para drenaje de colecciones abdominales.
Los resultados clínicos obtenidos mediante el drenaje de catéteres oscilan entre el 60 y el 100% según la localización4-7. No obstante, algunos factores determinan los resultados clínicos, como el estado basal del paciente, el germen causal, la localización, la extensión y el tamaño, y la complejidad del absceso.
Las principales causas de fracaso en el drenaje de abscesos mediante catéter son: la septación o tabicación, la viscosidad aumentada del contenido y la presencia de sangre en el absceso19. En estos casos, a pesar de utilizar varios tubos de gran tamaño e irrigarlos de manera constante con suero, éstos se obstruyen por la fibrina y no son capaces de evacuar todas las cámaras.
Desde que, en 1988, Haaga20 sugirió el empleo de urocinasa en las colecciones abdominales, el uso de fibrinolíticos es una buena indicación para tratar abscesos complicados, septados o hematomas infectados en los que el uso tan sólo de catéteres no sería suficiente.
Contraindicaciones
Se aceptan como contraindicaciones para el uso de urocinasa en el tratamiento de los abscesos abdominales la alteración grave de la coagulación, el sangrado activo en la colección abscesificada, la sospecha de aneurisma o malformación vascular en la proximidad o en el lecho del absceso, el embarazo o la lactancia, la hemorragia activa en el sistema nervioso central y la hipersensibilidad a la urocinasa.
No obstante, la mayor parte de estas contraindicaciones son teóricas, ya que se ha comprobado que la urocinasa instilada en las cavidades abscesificadas no modifica ni altera la coagulación sistémica8,9. La estreptocinasa es una proteína extraña al organismo que puede producir reacciones febriles y anafilaxia, y puede inactivarse en algunas personas con títulos altos de anticuerpos antiestreptocócicos3,5. La urocinasa, al ser una enzima proteínica de origen humano, tiene menor antigenicidad; no obstante, aunque pocas, se han descrito algunas reacciones adversas a la urocinasa21.
Por la gran frecuencia de presencia de seudoaneurisma en las colecciones pancreáticas, aunque estén infectadas con comprobación bacteriológica, algunos autores8 las han excluido del tratamiento fibrinolítico.
La presencia de fístulas enterales activas no constituye en sí ninguna contraindicación, pero es posible que la aplicación de fibrinolíticos retrase el cierre de la fístula, por lo que se desaconseja su uso.
Tipos y dosis de fibrinolítico
Al igual que en la pleura21, el fibrinolítico de elección para la mayoría de los autores es la urocinasa8,9. Algunos autores han utilizado también con éxito la estreptocinasa, tanto en la pleura22 como en la cavidad abdominal. La estreptocinasa, más barata que la urocinasa, tiene el inconveniente de que puede inactivarse por el bloqueo antigénico y las reacciones adversas. Bouros et al22, en un estudio aleatorizado en el que compararon la estreptocinasa con la urocinasa en el tratamiento de derrames pleurales complicados y empiemas, demostraron las ventajas de la urocinasa sobre la estreptocinsasa.
No hay acuerdo ni bases científicas que establezcan una dosificación o unas pautas de administración de referencia del fibrinolítico. Vogelzang et al19 utilizaron con éxito 250.00 U de urocinasa en 250 ml de suero repartidas en 3 veces para tratar un hematoma abdominal infectado. Los mismos autores19 trataron a otro paciente con hematoma mediante irrigación con estreptocinasa en dosis de 50.000 U cada 8 h. Haaga20 utilizó diferentes dosis según el volumen del absceso en 3 administraciones al día durante 3 días. En abscesos de 1-3 cm utilizaron 12.500 U por irrigación, en los de 3-5 cm, 25.000 U, en los de 5-10 cm, 50.000 U y en los > 10 cm, 100.000 U. Todas las diferentes dosis se disolvieron en 10 ml de suero fisiológico.
Siguiendo las pautas y recomendaciones para el espacio pleural21 , por su simplicidad y comodidad, la dosis de urocinasa para todo tipo y tamaño de abscesos abdominales sería de 100.000 U 3 veces al día hasta su desaparición. Las dosis para la estreptocinasa serían de 250.000 U cada 4-8 h durante 1-3 días.
¿Cómo utilizar los fibrinolíticos?
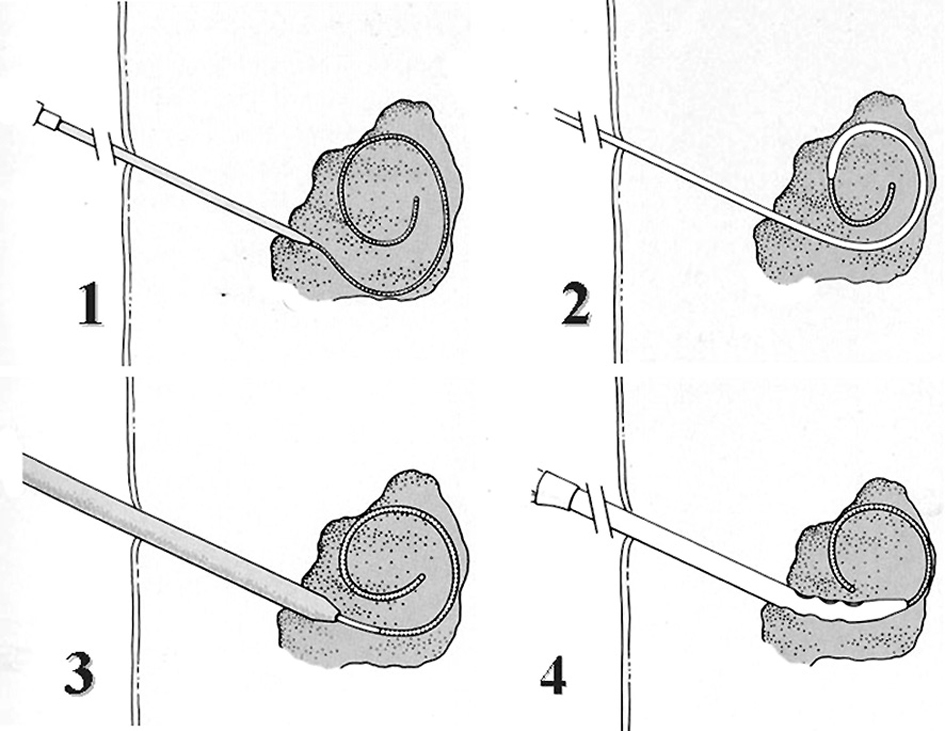
Se han descrito diversas maneras y pautas de aplicación de los fibrinolíticos. La punción de la colección se realiza con control guía ecográfica o de TC (fig. 2). Se obtienen muestras para estudio microbiológico (visión directa, cultivo y antibiograma), estudio bioquímico (pH, glucosa, lactado deshidrogenasa [LDH], amilasa y bilirrubina) y estudio hematológico (dímero D).
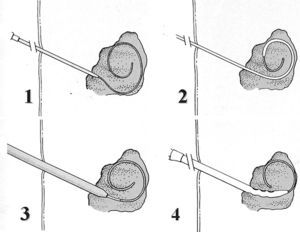
Fig. 2. Esquema de la técnica Sedlinger. Se aprecia en 1: entrada de guía en la cavidad abscesificada, 2: dilatación del orificio de entrada, 3: progresión del catéter sobre la cavidad, 4: alojamiento definitivo del catéter.
El dímero D determinado por inmunofluorescencia en nuestro medio es también la manera de controlar la eficacia de la urocinasa. Tras seleccionar la dosis de la sustancia fibrinolítica, se disuelve en 10 ml de suero salino y se administra a través del catéter. Éste permanecerá cerrado durante 15-30 min para mantenerlo abierto durante las 2 h siguientes. Esto se puede repetir hasta 3 veces al día, durante 3 o más días, hasta la resolución completa del proceso infeccioso.
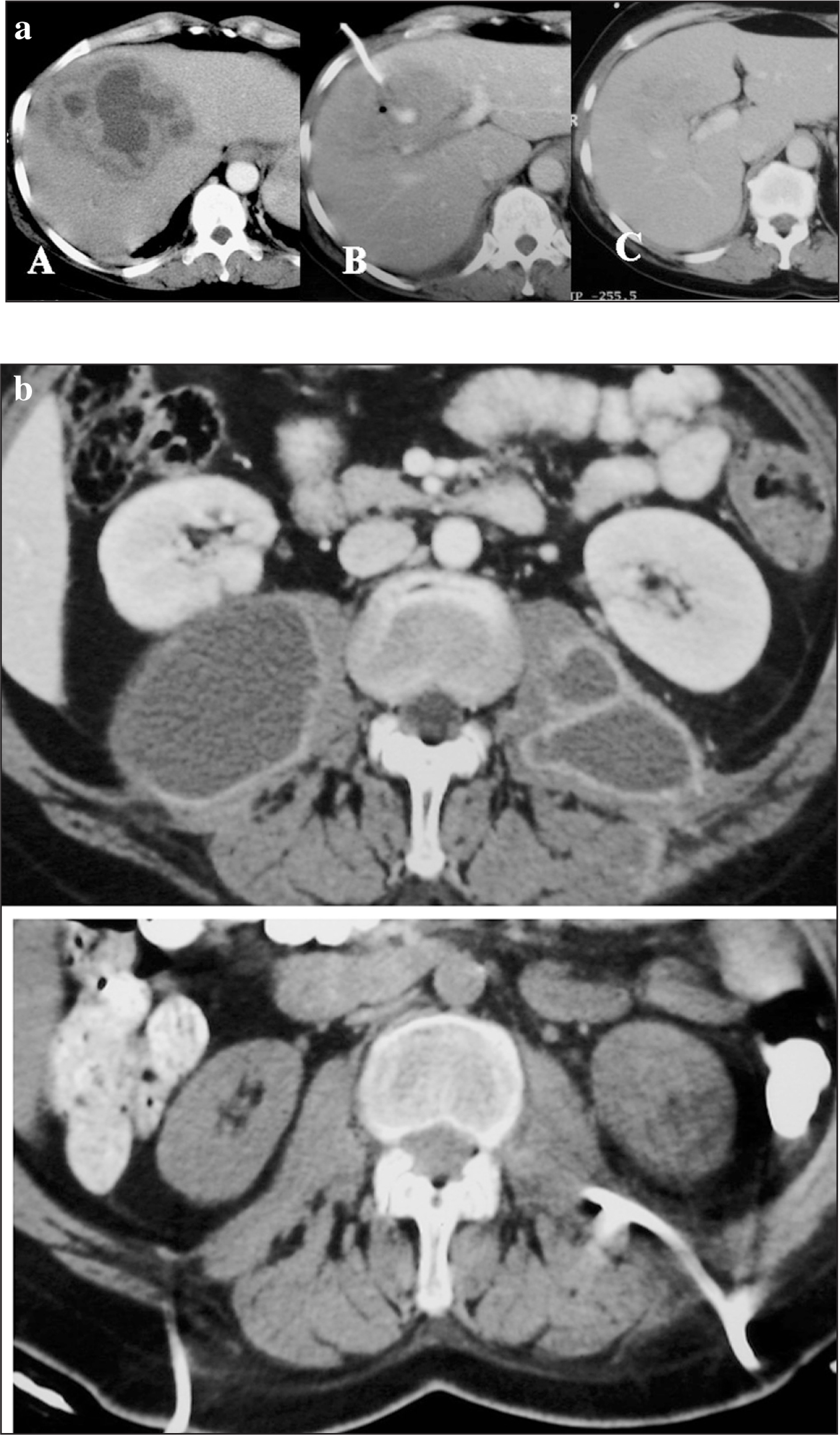
Se evalúa el resultado, definiendo como éxito la ausencia o mejoría franca de clínica infecciosa y la desaparición de la colección en los medios de imagen (TC, ecografía). El fracaso se define como la ausencia de mejoría clínica y la persistencia de colección en los medios de imagen que requiere medidas terapéuticas adicionales. Los criterios para retirar el catéter fueron la ausencia de colección y un débito < 10 ml. (fig. 3 a y b).
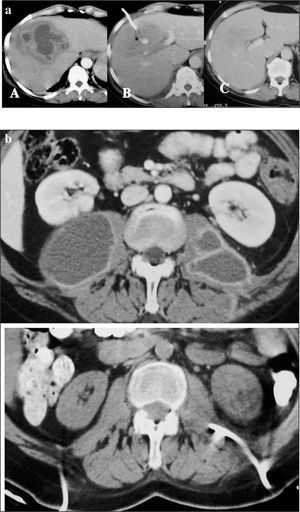
Fig. 3. a) Secuencia de tratamiento de un absceso amebiano hepático. A: tomografía computarizada (TC) de absceso loculado muy denso en el lóbulo derecho hepático. B: Tratamiento mediante catéter y urocinasa (se puede apreciar todavía el catéter en la colección). C: TC de control al mes. b) Absceso del psoas en paciente con antecedentes de clínica urinaria. Tras aislar Escherichia coli se drenó con 2 catéteres de 12 Fr y se administró urocinasa. Arriba: antes del tratamiento. Abajo: después del tratamiento con drenaje y fibrinolíticos.
Resultados
Son pocos los autores que han publicado sus resultados en la bibliografía médica19-22. La introducción del drenaje percutáneo en el manejo de los abscesos abdominales, hace ya más de 20 años, supuso un cambio sustancial en el tratamiento de esta enfermedad1. El éxito clínico comunicado excede el 80% y, según la localización, alcanza el 100% de los casos2. En la actualidad, el drenaje percutáneo mediante catéter es el tratamiento de elección en los abscesos abdominales23. Entre las causas más frecuente de fracaso, varios autores2-8,23 coinciden en señalar al aumento de la viscosidad del material purulento. Parece lógico que el lavado y la irrigación con sustancias que disminuyan esta viscosidad podría mejorar los ya buenos resultados y evitar fracasos.
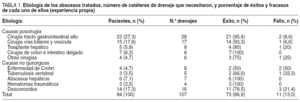
Haaga et al9 realizaron en el año 2000 un estudio aleatorizado en 42 pacientes con absceso abdominal. Con asignación aleatoria, en un grupo de 21 pacientes se realizó drenaje percutáneo irrigando el catéter con suero y urocinasa; en el otro grupo, también de 21 pacientes, el catéter se lavó e irrigó tan sólo con suero salino. A pesar de que en este estudio no se observaron diferencias significativas en cuanto al éxito/fracaso en ambos grupos (85%), sí se constató una reducción significativa de la estancia media hospitalaria y de los costes económicos en el grupo tratado con urocinasa. Nuestro grupo ha tratado a 84 pacientes con absceso abdominal mediante drenaje e infusión con urocinasa. El éxito clínico se alcanzó en 73 pacientes (86,9%) (tabla 1). De los fracasos clínicos, en 4 pacientes se implantaron nuevos catéteres y se prolongó el tratamiento con urocinasa, aunque estas medidas sólo fueron resolutivas en 1 caso. Los 3 restantes y 6 más necesitaron cirugía para su resolución. Uno murió en el curso de su enfermedad neoplásica. Estos porcentajes corraboran los hallazgos observados por Haaga et al9.
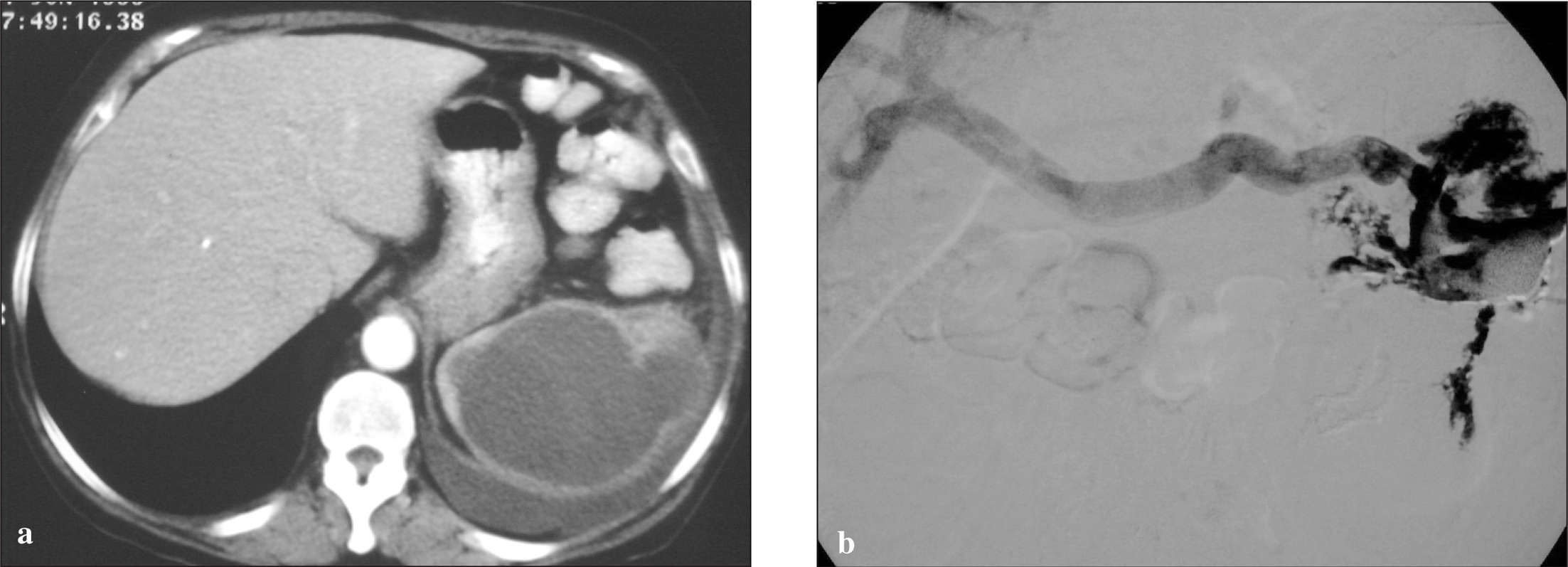
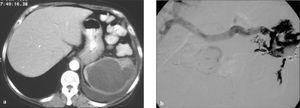
No se han descrito complicaciones con el uso de fibrinolíticos como tratamiento coadyuvante de colecciones abscesificadas abdominales; sin embargo, su utilización incorrecta podría producir hemorragias intraabsceso, sangrado de aneurismas, seudoaneurismas o malformaciones (fig. 4 a y b).
Fig. 4. Complicación postratamiento mediante drenaje con catéter y urocinasa. a) Tomografía computarizada de un paciente con fiebre y absceso en la celda esplénica postesplenectomía en una resección de carcinoma de ángulo esplénico. b) Cavitograma posdrenaje con catéter y urocinasa que muestra el relleno de la vena porta. La paciente no requirió tratamiento complementario y se mantuvo el drenaje cerrado durante 2 días. Se abrió y se mantuvo abierto sin fibrinolítico durante una semana y se retiró sin consecuencias.
Conclusiones
El drenaje percutáneo mediante catéter y con guía de imagen (ultrasonidos o TC) es el tratamiento actual de los abscesos abdominales. Cuando estos abscesos presentan dificultad para ser drenados debido a su viscosidad aumentada, a la presencia de sangre coagulada o a la aparición de septación, el uso de fibrinolíticos puede ayudar a su evacuación y a mejorar los resultados clínicos de una manera segura y relativamente económica, ya que disminuye la estancia media hospitalaria y las complicaciones.