En el marco de la cirugía metabólica, este estudio pretende valorar la transposición ileal como tratamiento quirúrgico de la obesidad mórbida relacionada con la diabetes mellitus no insulinodependiente gracias a la acción del péptido GLP-1, en relación con el bypass gástrico y la gastroplastia vertical. También determinar las concentraciones de grelina y su contribución a la pérdida de peso para cada técnica.
Material y métodosAnimales de experimentación del tipo Zucker Diabetic Fatty, ratas obesas y modelo de diabetes tipo 2. Tres grupos de 10 animales cada uno: a) transposición ileal; b) bypass gastroyeyunal, y c) gastroplastia vertical. Parámetros determinados: pérdida de peso, cambios en la ingesta, valores de glucemia, GLP-1, insulina y grelina en sangre de cada uno de los animales una semana antes de la intervención quirúrgica y a los 15 días de la cirugía.
ResultadosLa intervención que produce una mayor pérdida de peso es el bypass gastroyeyunal. Hay una disminución de la ingesta calórica significativa para los tres tipos de intervención. No se consigue corregir el estado de hiperglucemia intensa en los tres grupos, aunque en el grupo de la transposición se logra frenar el estado de cetosis. El aumento de GLP-1 es sólo significativo en la transposición ileal.
ConclusionesEn la respuesta metabólica a la cirugía no sólo se modifica una única hormona, sino que se establece un estado de regulación y contrarregulación como traducción de una determinada acción quirúrgica. Los animales obesos, cuyo exceso de peso es de causa exógena, pueden ser un buen modelo para otros estudios en esta dirección.
The continual advances in our knowledge of the pathogenesis and hormonal disorders of morbid obesity lead to new studies in experimental animals and the development of new technical options. The aim is to asses whether ileal transposition can be a good treatment of morbid obesity associated with diabetes mellitus due to the action of intestinal peptide Glp-1 (enteroglucagon) compared to gastric bypass and vertical gastroplasty (VGB).
Material and methodsTrial enviroment: experimental animals ZDF rats (Zucker Diabetic Fatty rats). Subjects of the study: three groups of 10 animals each one divided as: a) ileal tranposition; b) gastro-jejunal bypass; c) vertical gastroplasty. Parameters to determine: weight loss, levels of glycaemia, enteroglucagon, insulin and ghrelin in blood, one week before the operation as a baseline control, and 15 days after the surgical procedure.
ResultsGastrojejunal bypass produces the most significant weight loss. There is a significant decrease in intake in all groups. Hyperinsulinaemia and hyperglycaemia tend to decrease after surgery in all groups, but in ileal transposition there is better control of ketosis. After gastrojejunal bypass and ileal transposition, we observed an increase in GLP-1 levels but were only significant in ileal transposition.
ConclusionsIleal transposition produces a decrease in plasma glucose and better control of diabetes mellitus, which could benefit patients affected by morbid obesity and poor metabolic control. More studies are needed on other models of obesity. A model of exogenous and reversible obesity could be a good option to study the real benefits of the interventions.
La obesidad es una enfermedad multifactorial, en la que intervienen factores tanto genéticos como ambientales, y que influye decisivamente en la calidad y la esperanza de vida. En la obesidad mórbida (índice de masa corporal ⩾40) el exceso de peso se acompaña de trastornos metabólicos, hormonales e inflamatorios de difícil resolución, así como de importantes comorbilidades médicas, psicológicas, sociales y económicas. Son precisamente las comorbilidades, lo que determina en buena parte una reducción en la esperanza de vida1. Algunas comorbilidades conforman el llamado síndrome metabólico, entre las que destacan la resistencia a la insulina, la diabetes mellitus tipo 2, las enfermedades cardiovasculares, las dislipemias y la hipertensión arterial2–4.
Actualmente, la cirugía bariátrica es un pilar fundamental para el tratamiento de la obesidad mórbida y sus comorbilidades. Los mecanismos de control de la diabetes mellitus, en cuanto a la cirugía bariátrica, incluyen disminución de la ingesta y también mecanismos hormonales5. Estos mecanismos incluyen, entre otros, un aumento del péptido intestinal GLP-1 o enteroglucagón, sintetizado en el íleon terminal y que también aumenta después de las técnicas quirúrgicas con componente de hipoabsorción (bypass gástrico y derivación biliopancreática)6. Entre sus acciones, el GLP-1 inhibe la secreción de glucagón pancreático y disminuye la resistencia a la insulina7. Dentro de la cirugía de la obesidad contamos, de forma experimental, con la técnica de la transposición ileal8. La transposición ileal produce una pérdida de peso y un aumento del GLP-1. Esta técnica consiste en realizar una transposición de un segmento de íleon terminal a nivel del tramo digestivo superior de forma isoperistáltica9. La comida poco digerida en el tubo digestivo superior estimula la secreción de GLP-1, con lo cual, de forma indirecta, mejora el perfil glucémico10–12. Otro punto destacable es el papel que tiene la hormona gástrica grelina como reguladora del hambre y, por lo tanto, de la pérdida de peso13,14. La grelina es una hormona orexígena que produce un aumento de peso en humanos y en ratas, y que es particularmente baja en obesos15–17. Es un factor regulador de la ingesta en el sistema nervioso central (SNC), y estudios que relacionen las concentraciones de grelina y diferentes técnicas quirúrgicas bariátricas se han hecho ya imprescindibles dado que la grelina se sintetiza, en su mayor parte, en el fundus gástrico18,19.
Establecer un nexo entre la transposición ileal y el control metabólico de la obesidad hace que se nos plantee la necesidad de un trabajo experimental en animales y, en concreto, sobre ratas obesas y afectas de diabetes mellitus tipo 2 (Zucker Diabetic Fatty) y que serían el equivalente al síndrome metabólico en humanos20. El objetivo de este trabajo es determinar los cambios producidos después de una transposición ileal de la regulación hormonal de la ingesta mediante las concentraciones plasmáticas de grelina, GLP-1, glucemia, los cambios ponderales y la variación de la ingesta calórica. Su comparación con el bypass gastroyeyunal en Y de Roux, como actual estándar del tratamiento quirúrgico de la obesidad mórbida, y con la gastroplastia vertical nos permite analizar las diferencias entre técnicas con componente mixto hipoabsortivo/restrictivo y técnicas de carácter restrictivo puro.
Material y métodosAnimales: Zucker Diabetic Fatty (ZDF) machos de 13 semanas de edad. Charles River Laboratoires. Modelo de obesidad y diabetes mellitus tipo 221.
Grupos experimentales: tres grupos de 10 animales en cada uno, según la intervención quirúrgica. Grupo 1: gastroplastia vertical en banda (GVB) como técnica restrictiva; grupo 2: bypass gastroyeyunal en Y de Roux como técnica con componente hipoabsortivo/restrictivo mixto; grupo 3: transposición ileal.
Procedimiento: durante la segunda semana de estabulación previa a la cirugía, realizamos la primera extracción de sangre por punción en vena yugular externa (1,5ml) para determinar los parámetros de referencia: glucosa, GLP-1, grelina total e insulina. Peso del animal diario 10 días antes de la intervención. Control diario del volumen de ingesta (gramos de pienso).
El día de la intervención se pesa al animal y en ayunas de 8h se procede a la técnica asignada. Posteriormente a la intervención se administra dieta líquida durante 72h y seguidamente, pienso estándar y agua ad libitum. Determinaciones diarias del peso y la ingesta. Determinación de la glucemia a los 7 días por obtención sanguínea de la vena coccígea de la cola y su determinación mediante glucómetro Menarini® (mg/dl) en ayunas de 8h. A los 15 días de la intervención se obtienen nuevas muestras de sangre por vía yugular externa contralateral.
Las extracciones, el procesamiento y las intervenciones se han realizado en el laboratorio de cirugía experimental del departamento de cirugía de la facultad de medicina. Para determinar el GLP-1, se añadió un inhibidor de la dipeptidil dipeptidasa IV para evitar su rápida degradación. Determinación de grelina total, insulina y GLP-1 por radioimmunoanálisis (Linco®, kits específicos para rata).
Estabulación: estabulario de la Facultad de Medicina y Ciencias de la Salud de la Universidad Rovira y Virgili, siguiendo las normas de manipulación y manutención de animales (DOGC 2.073, 10-7-1995).
Tipo de pienso: de mantenimiento tipo AO4 de Panlab®; 3.173kcal/kg. Agua: clorada ad libitum. Dieta líquida: Resource 2.0® (2kcal/ml).
Anestesia y sacrificio: todas las intervenciones quirúrgicas y las extracciones de sangre se han realizado bajo anestesia general inducida por inyección intraperitoneal de Zoletil 20® (tiletamina y zolazepam) (20mg/kg) y atropina (0,01mg/kg). Después de la segunda extracción sanguínea, procedemos al sacrificio mediante sobredosis anestésica.
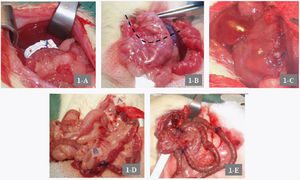
Intervenciones quirúrgicasGVB: laparotomía media de 4cm. Disección de la curvatura mayor. Ligadura de vasos cortos y vasos gastroepiploicos de la región del antro con seda 6/0. Se define la línea de transección gástrica colocando dos pinzas tipo «Bulldog». Cierre mediante una doble línea de sutura continua de fundus a antro con polipropileno de 5/0. Colocación y fijación de una banda de Goretex® de 15×40mm alrededor del reservorio gástrico.
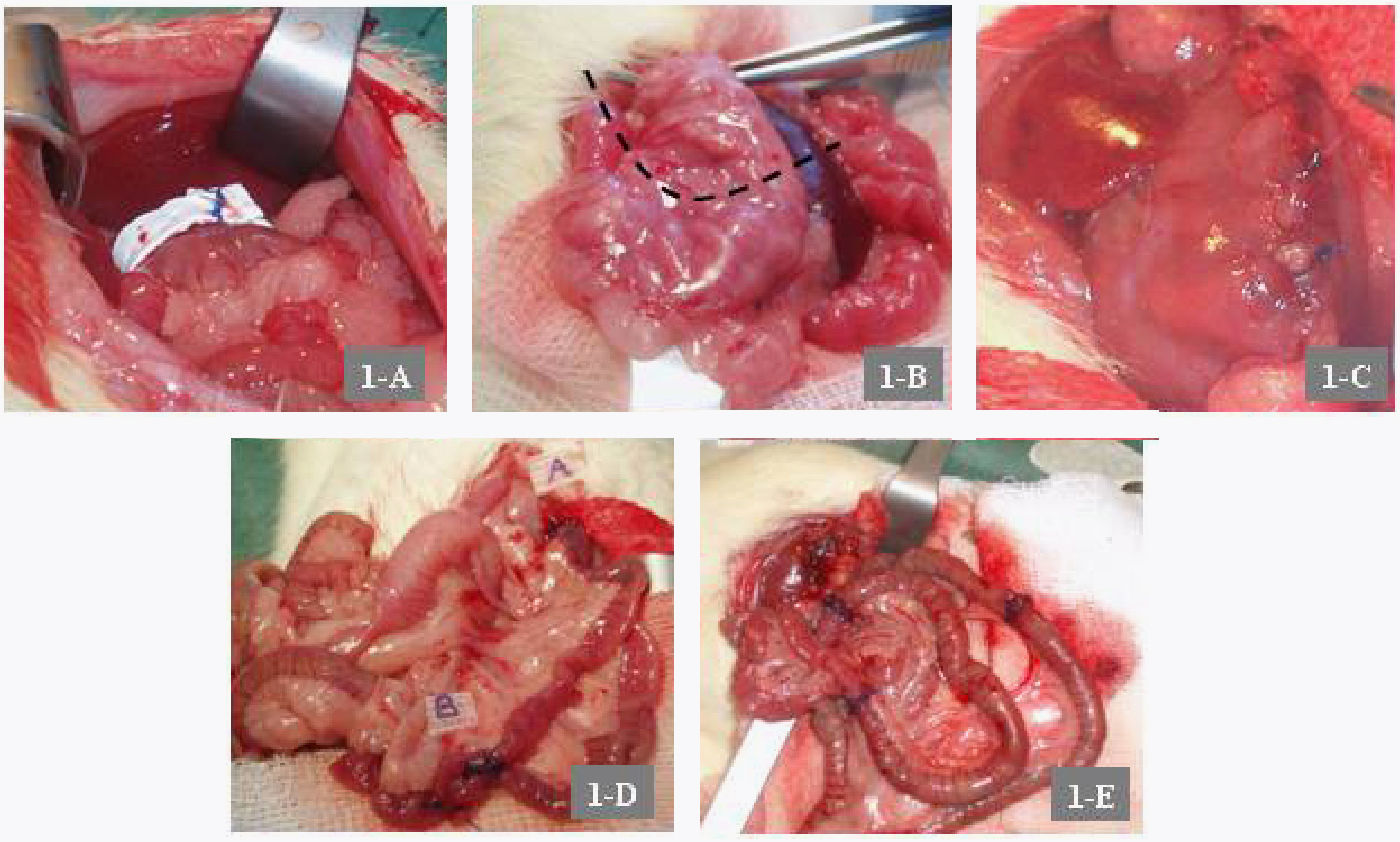
Bypass gastroyeyunal en Y de Roux: laparotomía media y sección transversal del estómago con cierre del muñón gástrico distal (fig. 1B y C). Sección yeyunal a 15cm del ligamento de Treitz; esta medida se corresponde con la descrita por los trabajos revisados en la literatura20. Anastomosis gastroyeyunal y anastomosis terminolateral yeyunoyeyunal con puntos sueltos de polipropileno 5/0. Asa en Y de Roux de 10cm (fig. 1D).
A: detalle de la GVB con banda de Goretex®. B: línea de la transección gástrica horizontal o transversal en el bypass gastroyeyunal en Y de Roux. C: detalle del muñón gástrico distal o inferior. D: anastomosis gastroyeyunal (A) y yeyunoyeyunal (B). E: transposición ileal con detalle de las anastomosis.
Transposición ileal: laparotomía media y localización del segmento ileal de 10cm de longitud a 10cm del íleon terminal. Ligadura de vasos del epiplón adyacente. Sección del segmento y su transposición yeyunal a 2cm distales al ligamento de Treitz en dirección peristáltica. Anastomosis terminoterminal (polipropileno 5/0) (fig. 1E).
Análisis estadísticoCálculo muestral: se han utilizado fórmulas correspondientes a la comparación de medias y el análisis de la variancia para cada una de las variables (Sample Power 2.0); la variable del peso fue la determinante. Para la comparación de medias en el mismo grupo o entre grupos, usamos la prueba de la t de Student-Fisher (para datos apareados y no apareados respectivamente). Análisis general mediante el programa estadístico SPSS-PC 13.1.
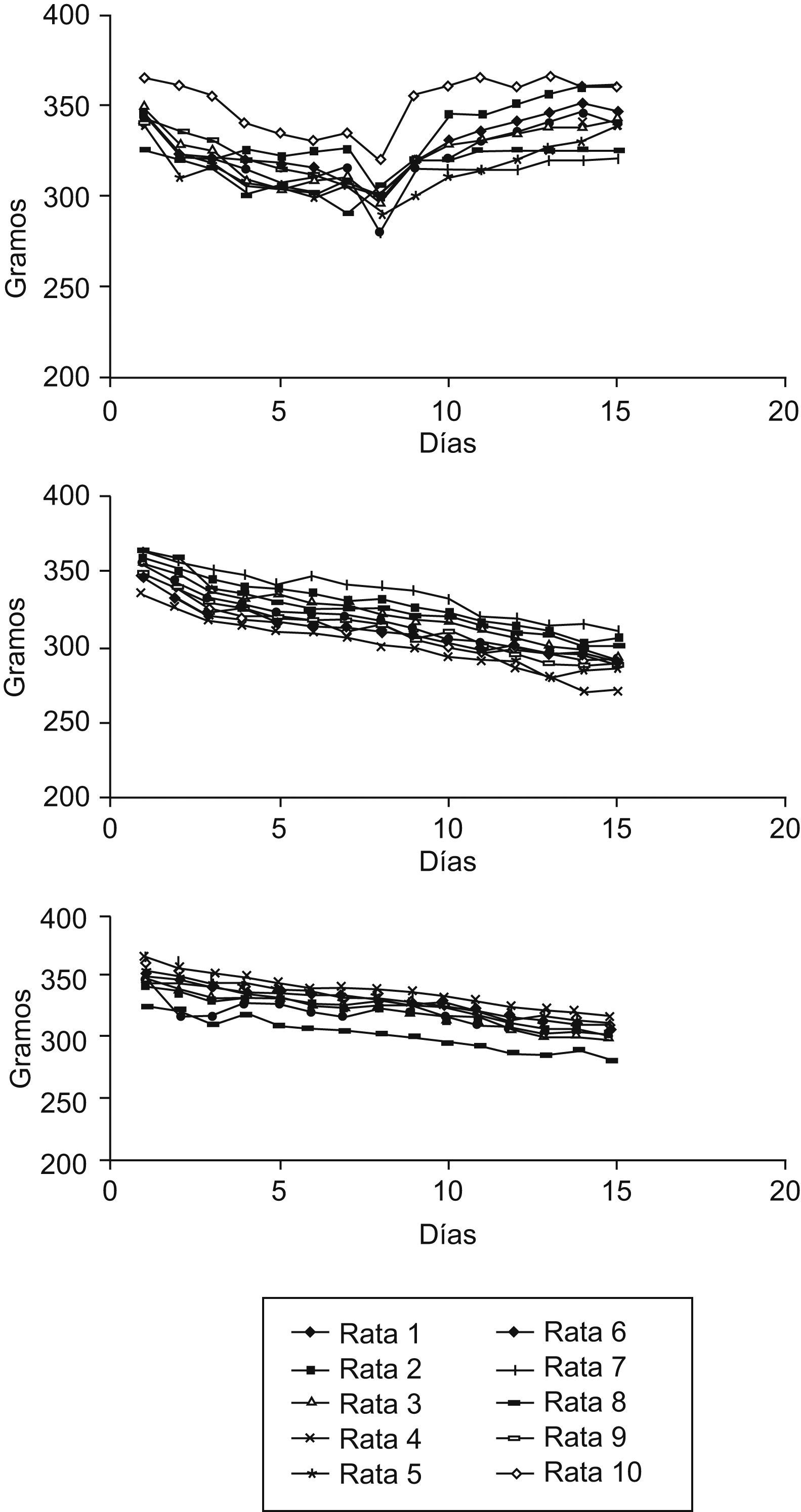
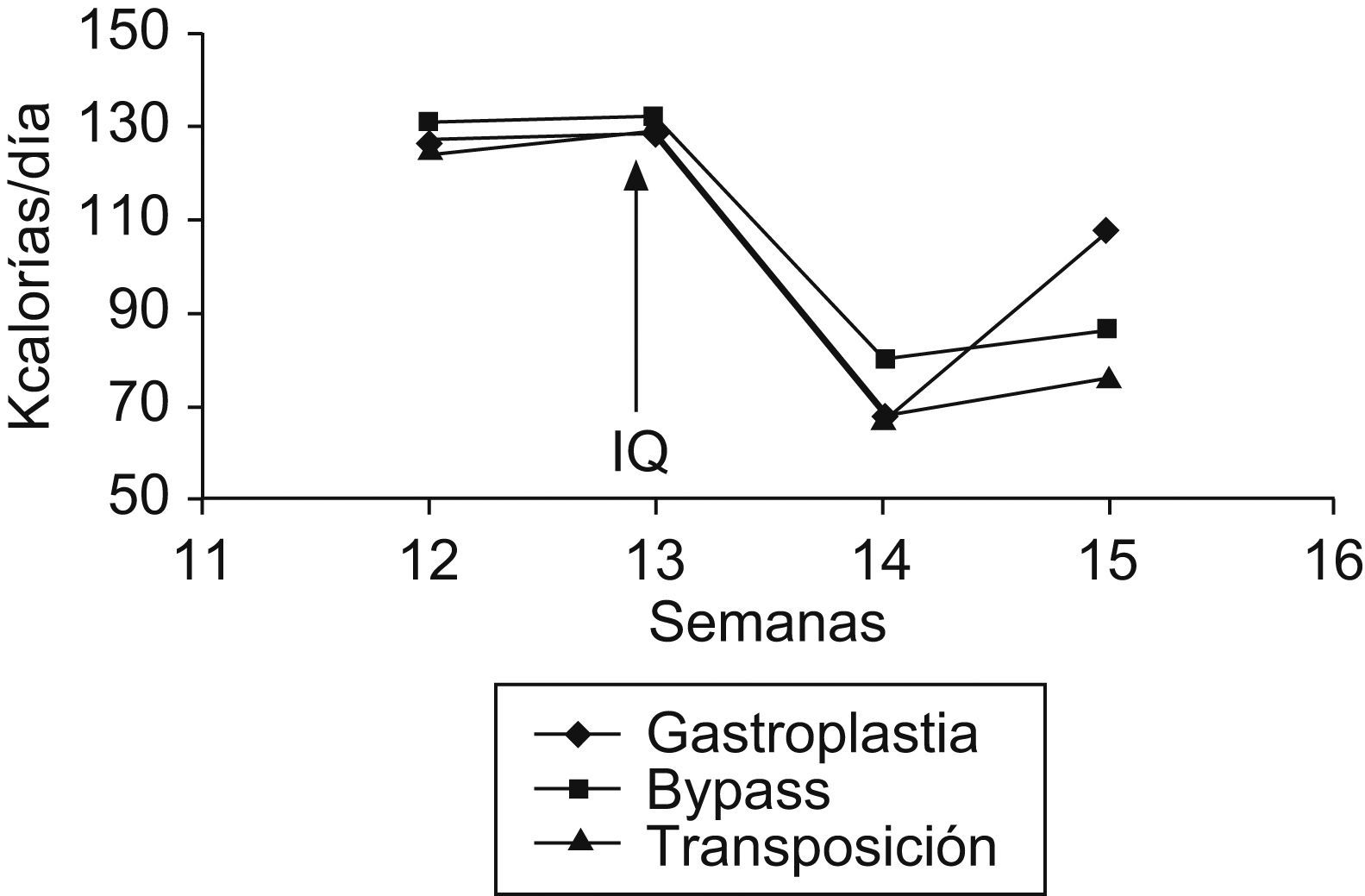
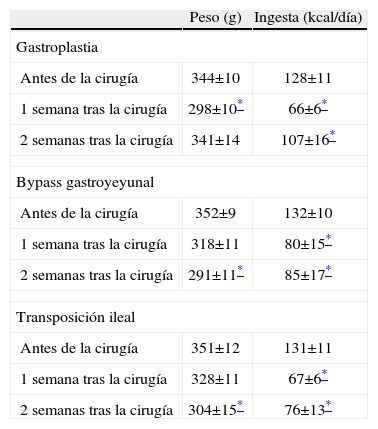
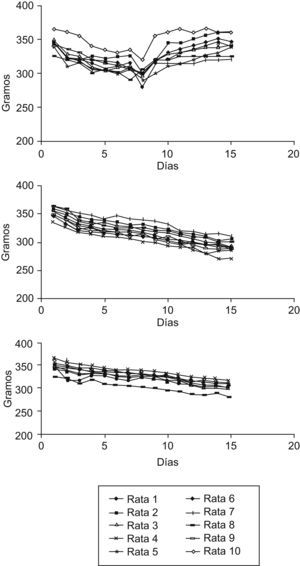
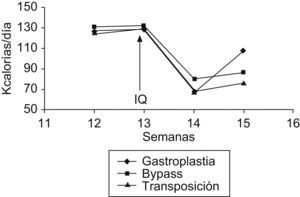
ResultadosCambios en el peso y la ingesta: en el grupo de la GVB, se observa una disminución de peso significativa durante la primera semana de la intervención, aunque los animales recuperan el peso inicial al final de la segunda semana. En los grupos del bypass gastroyeyunal y de la transposición ileal, en cambio, se observa una disminución significativa de la media de peso durante la primera semana y que se mantiene estable durante la segunda semana (p<0,001). En cuanto a la ingesta, en el grupo de la GVB se observa una disminución significativa después de la primera semana de la intervención, que se recupera durante la segunda semana, pero no alcanza los valores iniciales. Aun así, la disminución general de la ingesta al final de la segunda semana es estadísticamente significativa. En los grupos del bypass gastroyeyunal y de la transposición ileal, hay una disminución significativa de la ingesta después de la primera semana de la intervención, que se mantiene durante la segunda semana, también de forma significativa (p<0,001). Estos cambios quedan recogidos en la tabla 1. Las variaciones de peso e ingesta a lo largo del estudio quedan reflejadas en las figuras 2 y 3, respectivamente.
Variación del peso y la ingesta antes y después de la cirugía
| Peso (g) | Ingesta (kcal/día) | |
| Gastroplastia | ||
| Antes de la cirugía | 344±10 | 128±11 |
| 1 semana tras la cirugía | 298±10* | 66±6* |
| 2 semanas tras la cirugía | 341±14 | 107±16* |
| Bypass gastroyeyunal | ||
| Antes de la cirugía | 352±9 | 132±10 |
| 1 semana tras la cirugía | 318±11 | 80±15* |
| 2 semanas tras la cirugía | 291±11* | 85±17* |
| Transposición ileal | ||
| Antes de la cirugía | 351±12 | 131±11 |
| 1 semana tras la cirugía | 328±11 | 67±6* |
| 2 semanas tras la cirugía | 304±15* | 76±13* |
Los valores indican media±desviación estándar.
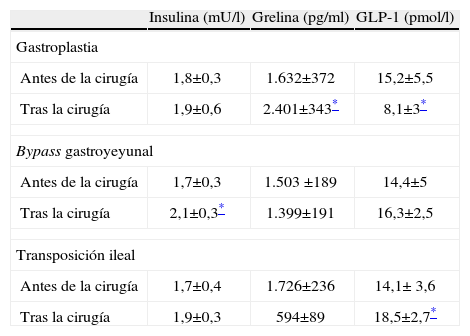
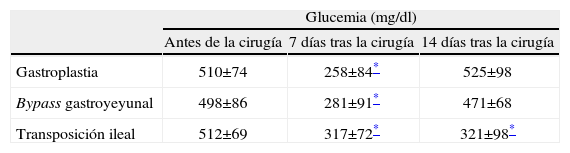
Cambios bioquímicos: en el grupo de la gastroplastia hay un aumento significativo de las concentraciones de grelina después de la intervención. En los otros dos grupos se observa una tendencia a la disminución de las concentraciones plasmáticas de grelina, pero sin cambios estadísticos objetivables. En cuanto a los valores de GLP-1, en el grupo de la gastroplastia, se observa una disminución significativa después de la intervención, en cambio, en el grupo del bypass gastroyeyunal hay una tendencia al aumento de las concentraciones de GLP-1, aunque no de forma significativa. En el grupo de la transposición ileal se produce un aumento de GLP-1 estadísticamente significativo. Respecto a las concentraciones de insulina, en los tres grupos de animales se produce un aumento, aunque sólo significativo en el grupo del bypass gastroyeyunal (tabla 2). Las cifras de glucosa en sangre sufren cambios significativos después de la primera semana, sin llegar a valores de normalidad, aunque luego se recuperan durante la segunda semana, y se mantiene el estado de hiperglucemia intensa (grupos 1 y 2). En el grupo de la transposición ileal estos cambios se mantienen durante la segunda semana tras la intervención (tabla 3).
Diferencias hormonales antes y después de la cirugía
| Insulina (mU/l) | Grelina (pg/ml) | GLP-1 (pmol/l) | |
| Gastroplastia | |||
| Antes de la cirugía | 1,8±0,3 | 1.632±372 | 15,2±5,5 |
| Tras la cirugía | 1,9±0,6 | 2.401±343* | 8,1±3* |
| Bypass gastroyeyunal | |||
| Antes de la cirugía | 1,7±0,3 | 1.503 ±189 | 14,4±5 |
| Tras la cirugía | 2,1±0,3* | 1.399±191 | 16,3±2,5 |
| Transposición ileal | |||
| Antes de la cirugía | 1,7±0,4 | 1.726±236 | 14,1± 3,6 |
| Tras la cirugía | 1,9±0,3 | 594±89 | 18,5±2,7* |
Los valores indican media±desviación estándar.
Cambios en los valores glucémicos antes y después de la cirugía
| Glucemia (mg/dl) | |||
| Antes de la cirugía | 7 días tras la cirugía | 14 días tras la cirugía | |
| Gastroplastia | 510±74 | 258±84* | 525±98 |
| Bypass gastroyeyunal | 498±86 | 281±91* | 471±68 |
| Transposición ileal | 512±69 | 317±72* | 321±98* |
Los valores indican media±desviación estándar.
Complicaciones posquirúrgicas: se objetivan principalmente durante la segunda semana tras la intervención. Destacan tres eventraciones en el grupo 1 (GVB); 2 animales presentaron cuadros de diarrea persistente durante la segunda semana tras el bypass gastroyeyunal.
Mortalidad: ocurrió durante las primeras 72h del curso postoperatorio. Bypass gastroyeyunal: 3 (23%) casos. Transposición ileal: 2 (16%) casos. El grupo de la gastroplastia no registró ninguna muerte.
DiscusiónEl procedimiento que produce mayor pérdida de peso es el bypass gastroyeyunal en Y de Roux, aunque la pérdida de peso producida por la transposición ileal es igualmente equiparable. La gastroplastia produce una pérdida de peso inicial significativa, que posteriormente se recupera, aunque no para los valores que le correspondería tener al animal para su edad. Teniendo en cuenta que las ratas aumentan de peso de forma inherente a su fisiología a lo largo de las semanas, el peso final de este grupo de animales se sitúa en el valor de su peso ideal según los parámetros antropométricos de las ratas ZDF controles proporcionados por los laboratorios Charles Rives® (semana 13, peso ideal de 320g, y semana 15, peso ideal de 344g).
Hay una disminución general de la ingesta calórica estadísticamente significativa para los tres grupos. Este modelo de animal tiene un comportamiento en la ingesta sustancialmente diferente del de otros tipos de animales. La ingesta calórica basal es aproximadamente un 50% superior al objetivado en ratas Sprague-Dawley o ratas Zucker. Aun estando ante una situación genéticamente predeterminada, induce a la atribución de este efecto la acción de la cirugía y la mejoría metabólica que de ella se deriva22. Otros estudios con ratas no obesas, pero con comportamiento de diabetes tipo 2 y a las que se practica una transposición ileal, no demuestran ningún efecto en la ingesta ni el peso, pero sí en el GLP-123. Esto demostraría la efectividad y la posibilidad de indicar la intervención en situaciones de obesidad relacionada con diabetes mellitus tipo 2.
El aumento significativo de las concentraciones de grelina después de una GVB, al igual que en otras técnicas restrictivas24, indica una tendencia a la normalización de sus valores y que puede estar mediatizado por una estimulación residual del fundus y/o por una posible producción extragástrica de grelina que intenta compensar una situación de pérdida de peso y de ingesta. En cambio, en los otros grupos las concentraciones plasmáticas de grelina no varían de forma significativa. Esta escasa variación en el grupo del bypass apoyaría la hipótesis de que la estimulación directa por el alimento en el fundus es la causa del aumento de grelina25; en este caso, buena parte del fundus queda excluido (figs. 1B y 3C) y, a pesar de una disminución de peso mayor que en el grupo de la gastroplastia, las cifras de grelina no se han modificado. La pérdida de peso por sí sola no es capaz de contrarrestar las concentraciones bajas de grelina que hay de base en una situación de obesidad. En el grupo de la transposición ileal, los valores de grelina tampoco han variado significativamente, al no haber actuado en este caso en el estómago.
En el grupo de la gastroplastia la disminución significativa de los valores de GLP-1 después de la intervención podría explicarse como una posible compensación ante una situación de disminución de la ingesta y el peso por su efecto anorexígeno reconocido26. No se consigue corregir el estado de hiperglucemia intensa en los grupos de la gastroplastia y el bypass gastroyeyunal. En el grupo de la transposición ileal, en cambio, se consigue disminuir de forma sostenida y significativa el valor de glucosa, aunque sin llegar a un estado normoglucémico27. Esto puede hacernos pensar que la contribución genética puede evitar alcanzar valores de normalidad en la glucosa plasmática.
El aumento de las concentraciones de insulina, al contrario de lo esperado, no refleja un empeoramiento de la resistencia a la insulina, sino una mejoría metabólica, ya que se trata de animales con unas reservas de insulina muy bajas debido a los elevados y persistentes grados de glucemia28. Este aumento puede indicar una posible recuperación en la producción de insulina. Otros estudios experimentales contrastan estos resultados ante diferentes modelos de obesidad, en donde los resultados son diferentes según su contribución genética22. En la clínica, podría evaluarse de alguna manera esta contribución genética, de forma preoperatoria, como una variable más a tener en cuenta, tal y como apunta algún estudio29.
Referente a las complicaciones posquirúrgicas, las muertes ocurridas (3 casos) han sido en el grupo del bypass y siempre dentro de las primeras 72h, sin hallazgos macroscópicos valorables en la necropsia. Posiblemente, este hecho sea debido a un fallo metabólico grave por hiperglucemia intensa ante una intervención que dura un 50% más de tiempo que las demás (100min del bypass frente a 60min de la transposición y 45min de la gastroplastia). Los casos de diarrea objetivados (2 casos) también pertenecen al grupo del bypass gastroyeyunal; este suceso era relativamente previsible ante una intervención de componente hipoabsortivo.
ConclusionesLa intervención que produce una mayor pérdida de peso es el bypass gastroyeyunal en Y de Roux. Se produce una disminución general de la ingesta calórica estadísticamente significativa para los tres tipos de intervención. No se consigue corregir el estado de hiperglucemia intensa en los tres grupos quirúrgicos, aunque en el grupo de la transposición se logra frenar el aumento a grados de cetosis. En los tres grupos hay una tendencia a aumentar las concentraciones de insulina plasmáticas que puede implicar una buena respuesta metabólica ante un grupo de animales con unas reservas pancreáticas de insulina muy pobres. Los cambios observados en la grelina plasmática pueden apuntar a una regulación conjunta por la pérdida de peso, la disminución de la ingesta y los cambios anatómicos que cada intervención quirúrgica implica. El aumento de GLP-1 se da en las técnicas en que hemos realizado un cambio de posición anatómica intestinal, lo que justifica la hiperestimulación con alimento poco digerido como el principal mecanismo de producción. Son necesarios más estudios en esta dirección, que valoren diferentes modelos animales de obesidad (no genéticos) y objetiven los cambios hormonales reales de los principales péptidos que regulan la ingesta.
FinanciaciónTrabajo subvencionado por el Instituto de Salud Carlos III. Fondo de Investigación Sanitaria.
PremiosPrimer premio a la comunicación oral en el 10.° Congreso de la Sociedad Española de Cirugía de la Obesidad. Barcelona, 23–25 de abril de 2008.