En los últimos 20 años los procedimientos de estadificación ganglionar en el cáncer de mama se han modificado. El objetivo de este estudio es describir la evolución de estos procedimientos en nuestro centro.
MétodosEstudio prospectivo observacional que incluye a las mujeres con cáncer de mama intervenidas entre el 2001 y el 2017. Se identificaron 4 grupos según el esquema terapéutico utilizado y 3 periodos a estudio definidos por las indicaciones de la linfadenectomía.
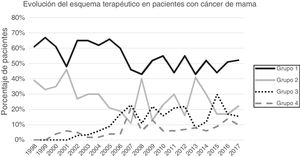
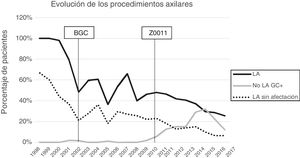
ResultadosMil trescientos diecinueve pacientes cumplieron los criterios de inclusión. La cirugía conservadora primaria fue el esquema terapéutico más frecuente (54,13%) y se realizaron 615 linfadenectomías axilares (46,62%) durante los 20 años estudiados. El porcentaje de linfadenectomías axilares disminuyó progresivamente en el tiempo, pasando del 91% en el primer periodo al 34% en el último periodo. Las linfadenectomías axilares fútiles descendieron al 6,6% en el último año. En la cirugía conservadora primaria no se realizó ninguna linfadenectomía axilar fútil los 2 últimos años.
ConclusiónLa introducción de la biopsia de ganglio centinela en 2001 y de los criterios ACOSOG Z0011 han modificado la indicación de la linfadenectomía axilar. Así, se han disminuido las linfadenectomías axilares sin afectación, evitando la morbilidad que asocia este procedimiento, especialmente linfedema. El estudio refleja el descenso progresivo de la indicación de la linfadenectomía en los diferentes grupos a estudio, similar a lo expuesto por otros autores. En diversos ensayos clínicos se ha descrito que estos cambios no han impactado negativamente en supervivencia.
In last 20 years, lymph node staging procedures in breast cancer have been modified. The objective of this study is to describe the evolution of these procedures at our hospital.
MethodsA prospective observational study that included women with breast cancer who were treated surgically between 2001 and 2017. Four groups were identified according to the therapeutic regimen and 3 study periods defined by the lymph node dissection.
Results1319 patients met the inclusion criteria. Primary conservative surgery was the most frequent therapy (54.13%), and 615 (46.62%) axillary lymph node dissections (ALND) were performed in the 20-year study period. The percentage of ALND decreased progressively over time, going from 91% in the first period to 34% in the last period. The futile ALND fell to 6.6% in the last year. In the primary conservative surgery, no futile ALND was performed in the last two years.
ConclusionThe introduction of sentinel lymph node biopsy and the ACOSOG Z0011 criteria have modified the indication for ALND. Thus, ALND without involvement have been reduced, thereby avoiding the associated morbidity. The study demonstrates the progressive decrease in the indication of lymphadenectomy in the different study groups, similar to reports by other authors. Several clinical trials have described that these changes have not negatively impacted survival.
El cáncer de mama es el tumor maligno más frecuente en la mujer. Su incidencia parece estar en aumento en los países desarrollados, en donde el riesgo de padecer un cáncer de mama a lo largo de la vida es del 12% (una de cada 8 mujeres)1,2. Es la primera causa de muerte por cáncer en la mujer a nivel mundial, sin embargo, el diagnóstico precoz y los avances en el tratamiento han disminuido la mortalidad por esta causa3.
En las últimas décadas el tratamiento del cáncer de mama ha evolucionado y exige una perspectiva multidisciplinar que proporcione un adecuado control sistémico de la enfermedad, un enfoque quirúrgico conservador y una mayor preocupación por la satisfacción y calidad de vida de estas mujeres. En este contexto, los procedimientos de estadificación y tratamiento axilar también se han modificado y la indicación sistemática de una linfadenectomía axilar (LA) ha sido sustituida por un procedimiento fácilmente reproducible y con menor morbilidad: la biopsia de ganglio centinela (BGC). Diversos ensayos clínicos han analizado la viabilidad de esta técnica para la estadificación ganglionar y describen una sensibilidad mayor del 88%, una especificidad del 100% y una tasa de falsos negativos (FN) inferior al 10%4–8.
Recientemente la publicación del ensayo clínico ACOSOG Z00119,10 demostró similar supervivencia global y libre de enfermedad en un grupo seleccionado de enfermas con afectación metastásica del ganglio centinela (GC) sin LA. Estos hallazgos han sido corroborados por otros estudios11–13 y han modificado la práctica clínica habitual, permitiendo la omisión del vaciamiento ganglionar en un gran número de enfermas con afectación metastásica de la axila.
El objetivo de este estudio es describir la evolución de los procedimientos de estadificación y tratamiento axilar en los últimos 20 años en nuestro centro y los principales factores que han generado estos cambios.
MétodosEstudio prospectivo observacional de las pacientes con un carcinoma infiltrante de mama intervenidas quirúrgicamente entre el 1 de enero de 1998 y el 31 de diciembre de 2017. Se excluyeron los varones, las pacientes diagnosticadas de un carcinoma in situ, recidivas en la misma mama o con metástasis a distancia al diagnóstico, así como aquellas sin estadificación axilar o con esquema de radioterapia o quimioterapia desconocido.
Análisis estadísticoSe realizó un análisis de la evolución de los procedimientos quirúrgicos para la estadificación ganglionar determinando el porcentaje anual de LA y de LA fútiles (LAF). Se utilizó el término LAF para aquellas LA en las que no se evidenció afectación metastásica de la grasa axilar. Para la recogida de datos y análisis estadístico se utilizó el programa IBM SPSS Statistics 22.0 y Microsoft Excel versión 16.0.
Se establecieron 4 grupos a estudio según el esquema de tratamiento utilizado: 1. cirugía primaria conservadora, 2. mastectomía primaria, 3. cirugía conservadora tras neoadyuvancia y 4. mastectomía tras neoadyuvancia. Se describen 3 periodos a estudio según el método de estadificación ganglionar utilizado. El periodo pre-BGC comprendido desde el inicio del estudio hasta la introducción de la BGC. En la cirugía primaria se utilizó la BGC desde mediados de 2001 y en 2005 en los grupos de tratamiento sistémico primario. El periodo BGC se extiende desde la introducción de la BGC hasta la aplicación de los criterios ACOSOG Z0011 en nuestro centro. A partir de 2012 en las pacientes con tratamiento sistémico primario se realizó la BGC una vez finalizada la quimioterapia. El último periodo (post-Z0011) se inicia con la introducción de los criterios Z0011 en febrero de 2010. Los criterios de IBCSG 23-01 y los ACOSOG Z0011 modificados (pacientes con cirugía conservadora tras neoadyuvancia) se introdujeron en marzo de 2012 y abril de 2013, respectivamente.
Método quirúrgico. La decisión del tipo de cirugía mamaria se consensuó en el comité multidisciplinar de la unidad siguiendo los criterios de resección oncológica válidos en cada periodo. Para el marcaje e identificación del GC se utilizó como trazador el tecnecio 99 y/o el azul patente. Se definió como GC aquel ganglio con un recuento isotópico 10 veces superior a la base y/o aquellos coloreados de azul o con un conducto linfático azulado.
Estudio patológico. El estudio de la LA se realizó con inclusión en parafina y posterior tinción con hematoxilina-eosina. A cada ganglio se le realizó un solo corte estudiando ambos lados. El estudio del GC inicialmente se realizó mediante corte por congelación y desde enero de 2011 con el método «One Step Nucleic Acid Amplification» − (OSNA), exceptuando los pacientes con tumores CK19 negativo y las mujeres tratadas con neoadyuvancia.
Tratamientos adyuvantes. La planificación del tratamiento adyuvante se realizó a partir del protocolo de la unidad para el manejo de pacientes con cáncer de mama, basado en las guías clínicas internacionales14,15 y los hallazgos inmunohistoquímicos realizados en el tejido tumoral. La irradiación de las cadenas ganglionares se llevó a cabo en enfermas con afectación ganglionar extracapsular y con más de 3 ganglios axilares afectados. El comité valoró individualmente aquellos casos con afectación de 1-3 ganglios para la irradiación.
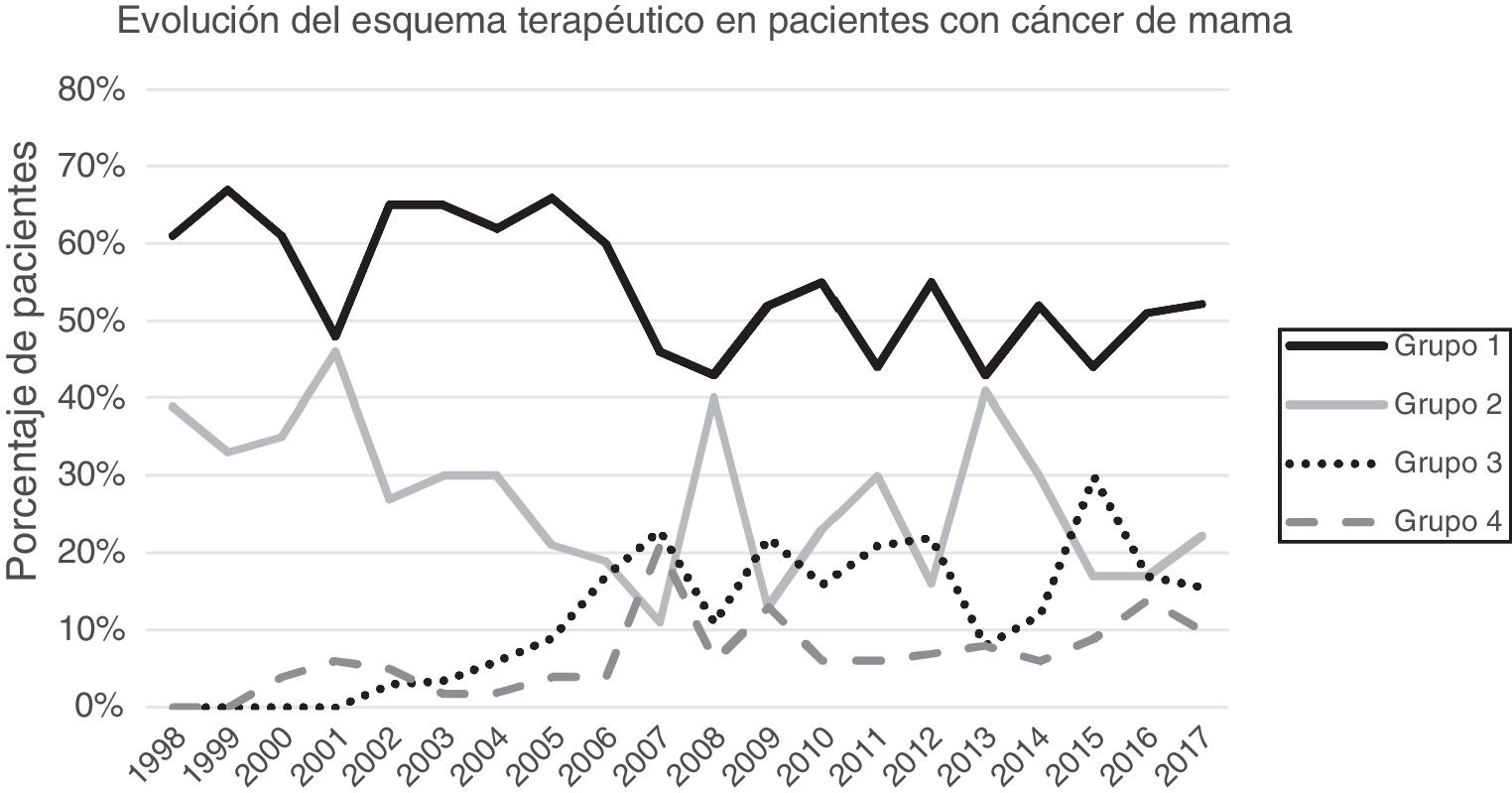
ResultadosUn total de 1.649 pacientes fueron intervenidos en el periodo a estudio de los cuales 1.319 cumplieron los criterios de inclusión y 313 fueron excluidos (169 patología benigna, 100 carcinoma in situ, 27 metástasis a distancia en el momento del diagnóstico, 25 phyllodes/sarcomas y 9 varones). La cirugía conservadora primaria fue el esquema terapéutico más frecuente (54,13%), seguido de la mastectomía primaria (25,62%). La cirugía después de tratamiento sistémico primario se incrementó progresivamente en el tiempo, representando el 26% de las intervenciones en 2017 (fig. 1).
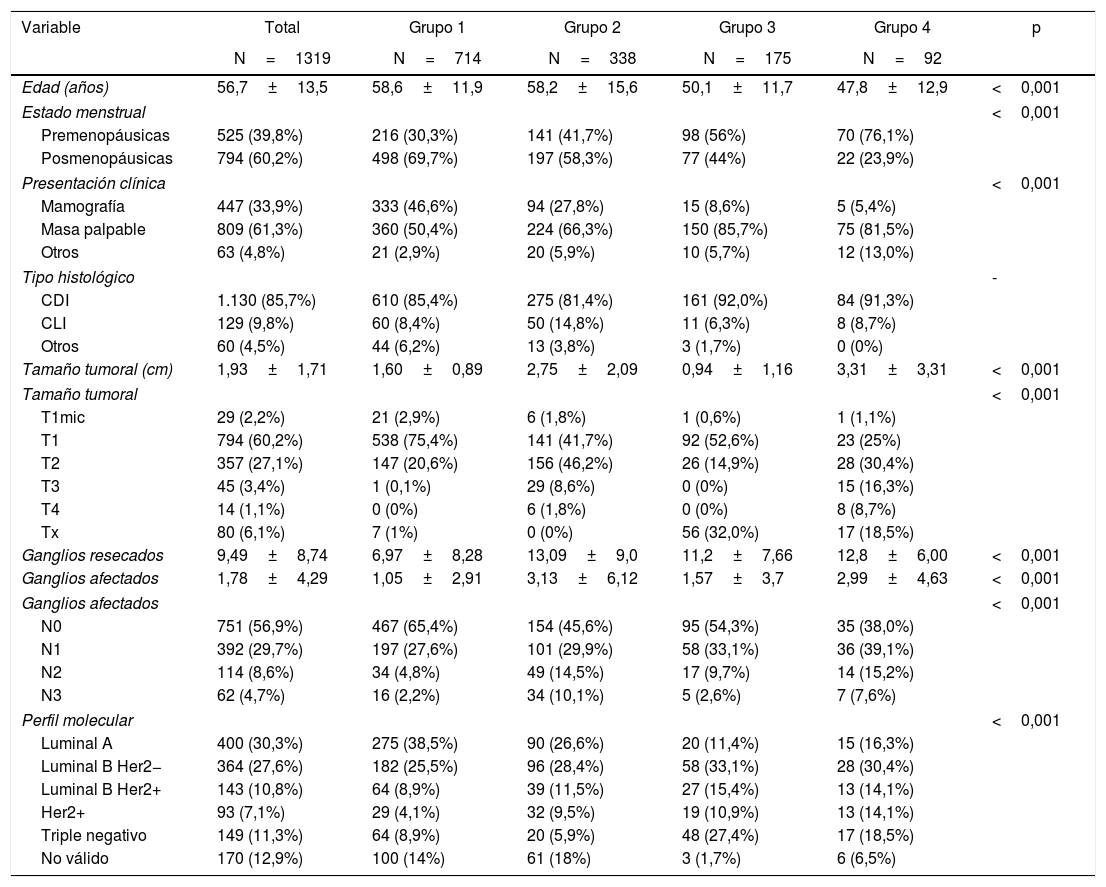
Características clinicopatológicas. La tabla 1 muestras las características clínicas y patológicas de las pacientes. La edad media de las pacientes fue de 56,7 años, siendo las mujeres con quimioterapia neoadyuvante significativamente más jóvenes. La forma de presentación más común en todos los grupos fue la masa palpable, representando más del 80% en los grupos con quimioterapia neoadyuvante. No se observaron diferencias en el tipo histológico según los grupos. En el grupo 1 el subtipo molecular más frecuente fue el luminal A (38,5%), a diferencia de los demás grupos donde predominó el subtipo luminal B Her2 negativo. En los grupos de cirugía conservadora se observan tamaños tumorales más pequeños (p<0,001) y en los grupos con quimioterapia neoadyuvante mayor porcentaje de afectación ganglionar (p<0,001).
Características clínicas y anatomopatológicas
| Variable | Total | Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | p |
|---|---|---|---|---|---|---|
| N=1319 | N=714 | N=338 | N=175 | N=92 | ||
| Edad (años) | 56,7±13,5 | 58,6±11,9 | 58,2±15,6 | 50,1±11,7 | 47,8±12,9 | <0,001 |
| Estado menstrual | <0,001 | |||||
| Premenopáusicas | 525 (39,8%) | 216 (30,3%) | 141 (41,7%) | 98 (56%) | 70 (76,1%) | |
| Posmenopáusicas | 794 (60,2%) | 498 (69,7%) | 197 (58,3%) | 77 (44%) | 22 (23,9%) | |
| Presentación clínica | <0,001 | |||||
| Mamografía | 447 (33,9%) | 333 (46,6%) | 94 (27,8%) | 15 (8,6%) | 5 (5,4%) | |
| Masa palpable | 809 (61,3%) | 360 (50,4%) | 224 (66,3%) | 150 (85,7%) | 75 (81,5%) | |
| Otros | 63 (4,8%) | 21 (2,9%) | 20 (5,9%) | 10 (5,7%) | 12 (13,0%) | |
| Tipo histológico | - | |||||
| CDI | 1.130 (85,7%) | 610 (85,4%) | 275 (81,4%) | 161 (92,0%) | 84 (91,3%) | |
| CLI | 129 (9,8%) | 60 (8,4%) | 50 (14,8%) | 11 (6,3%) | 8 (8,7%) | |
| Otros | 60 (4,5%) | 44 (6,2%) | 13 (3,8%) | 3 (1,7%) | 0 (0%) | |
| Tamaño tumoral (cm) | 1,93±1,71 | 1,60±0,89 | 2,75±2,09 | 0,94±1,16 | 3,31±3,31 | <0,001 |
| Tamaño tumoral | <0,001 | |||||
| T1mic | 29 (2,2%) | 21 (2,9%) | 6 (1,8%) | 1 (0,6%) | 1 (1,1%) | |
| T1 | 794 (60,2%) | 538 (75,4%) | 141 (41,7%) | 92 (52,6%) | 23 (25%) | |
| T2 | 357 (27,1%) | 147 (20,6%) | 156 (46,2%) | 26 (14,9%) | 28 (30,4%) | |
| T3 | 45 (3,4%) | 1 (0,1%) | 29 (8,6%) | 0 (0%) | 15 (16,3%) | |
| T4 | 14 (1,1%) | 0 (0%) | 6 (1,8%) | 0 (0%) | 8 (8,7%) | |
| Tx | 80 (6,1%) | 7 (1%) | 0 (0%) | 56 (32,0%) | 17 (18,5%) | |
| Ganglios resecados | 9,49±8,74 | 6,97±8,28 | 13,09±9,0 | 11,2±7,66 | 12,8±6,00 | <0,001 |
| Ganglios afectados | 1,78±4,29 | 1,05±2,91 | 3,13±6,12 | 1,57±3,7 | 2,99±4,63 | <0,001 |
| Ganglios afectados | <0,001 | |||||
| N0 | 751 (56,9%) | 467 (65,4%) | 154 (45,6%) | 95 (54,3%) | 35 (38,0%) | |
| N1 | 392 (29,7%) | 197 (27,6%) | 101 (29,9%) | 58 (33,1%) | 36 (39,1%) | |
| N2 | 114 (8,6%) | 34 (4,8%) | 49 (14,5%) | 17 (9,7%) | 14 (15,2%) | |
| N3 | 62 (4,7%) | 16 (2,2%) | 34 (10,1%) | 5 (2,6%) | 7 (7,6%) | |
| Perfil molecular | <0,001 | |||||
| Luminal A | 400 (30,3%) | 275 (38,5%) | 90 (26,6%) | 20 (11,4%) | 15 (16,3%) | |
| Luminal B Her2− | 364 (27,6%) | 182 (25,5%) | 96 (28,4%) | 58 (33,1%) | 28 (30,4%) | |
| Luminal B Her2+ | 143 (10,8%) | 64 (8,9%) | 39 (11,5%) | 27 (15,4%) | 13 (14,1%) | |
| Her2+ | 93 (7,1%) | 29 (4,1%) | 32 (9,5%) | 19 (10,9%) | 13 (14,1%) | |
| Triple negativo | 149 (11,3%) | 64 (8,9%) | 20 (5,9%) | 48 (27,4%) | 17 (18,5%) | |
| No válido | 170 (12,9%) | 100 (14%) | 61 (18%) | 3 (1,7%) | 6 (6,5%) | |
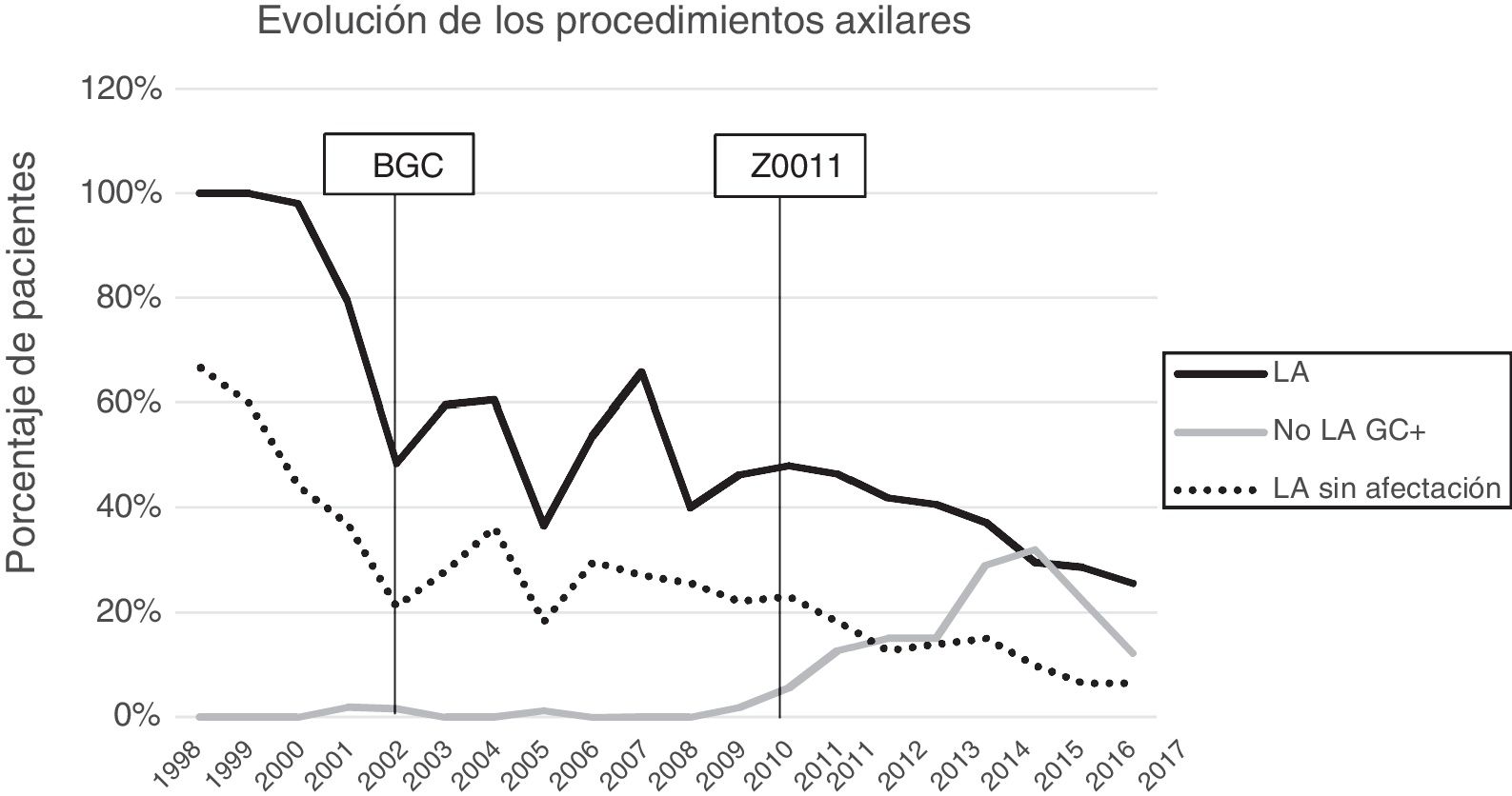
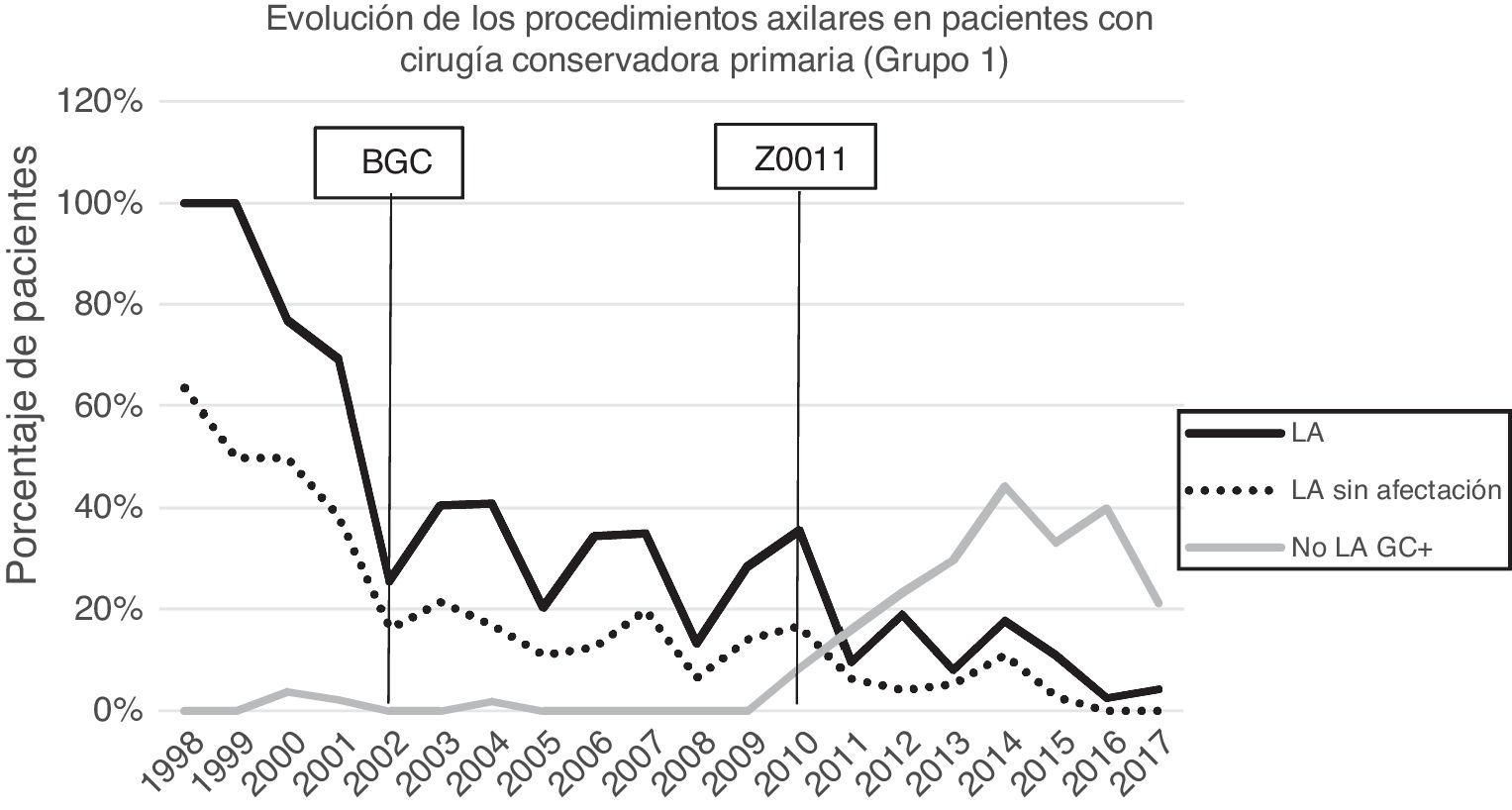
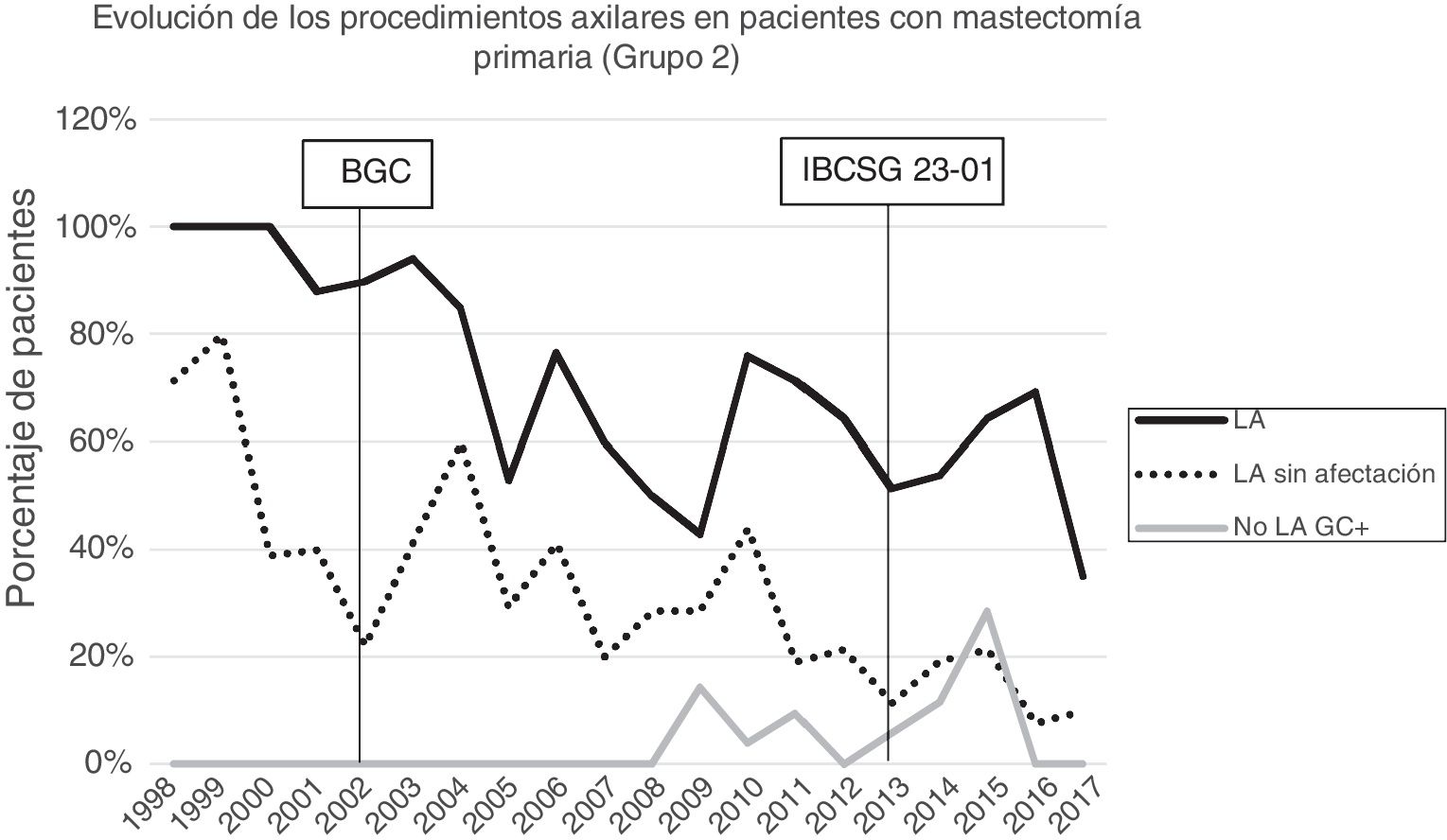
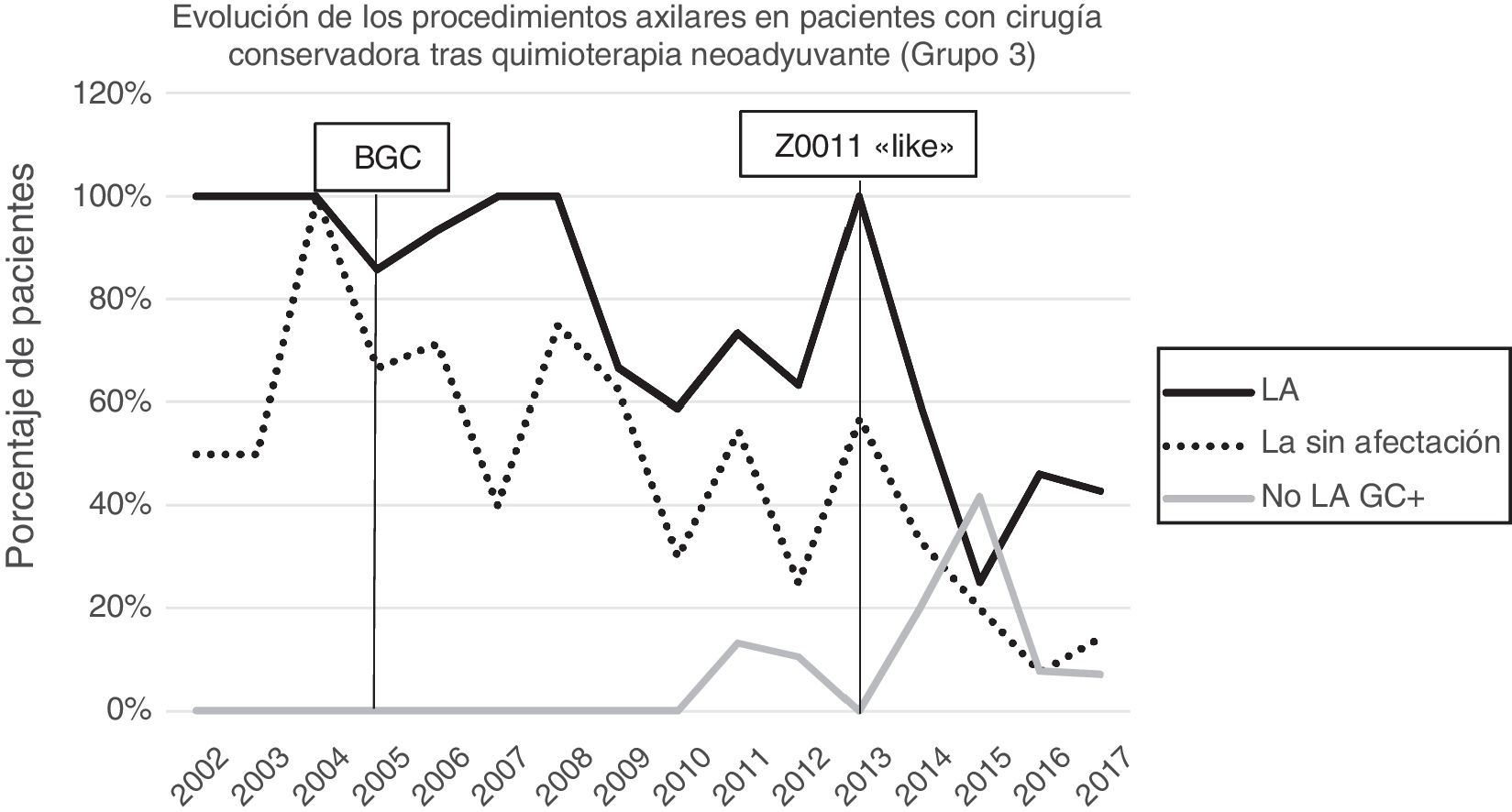
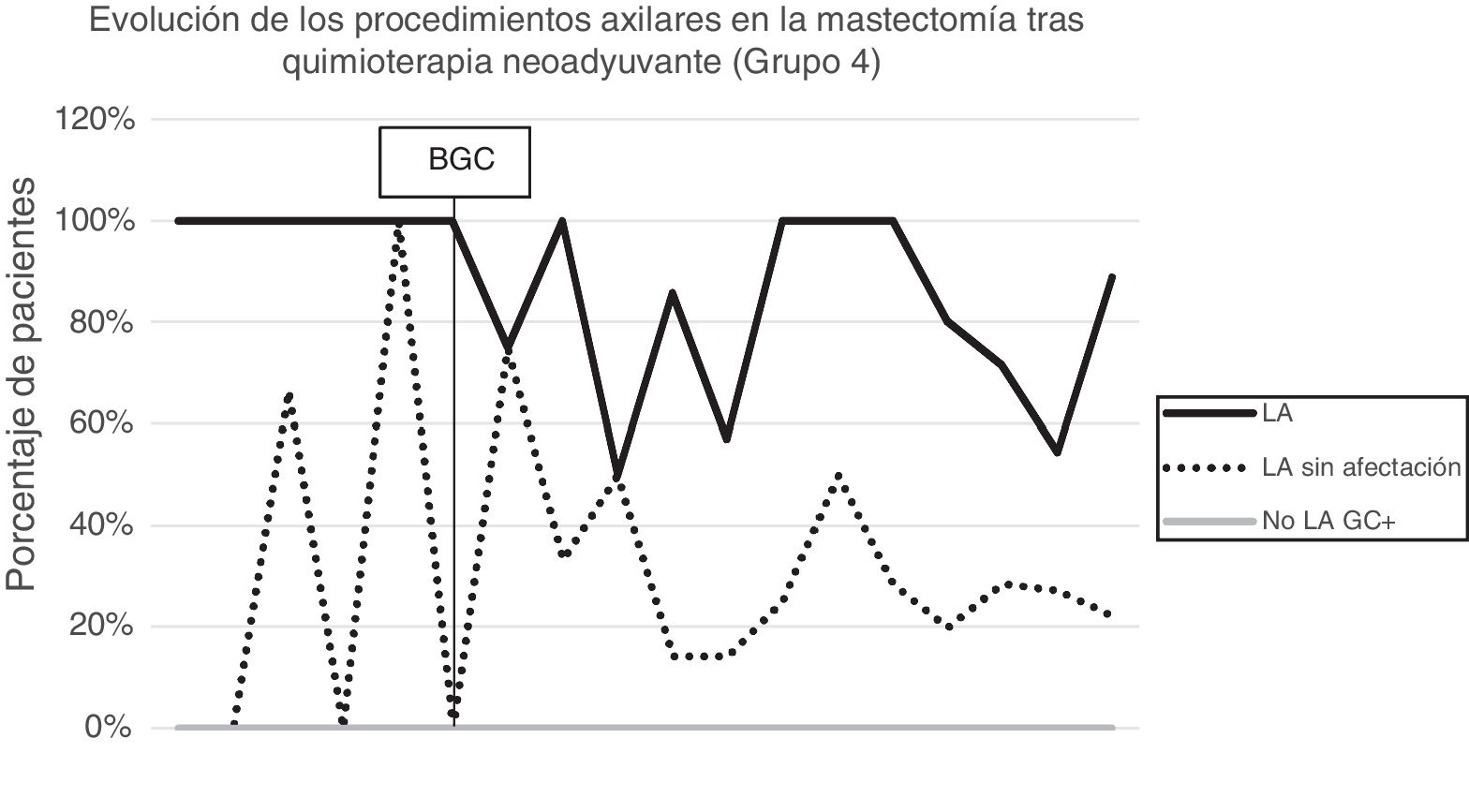
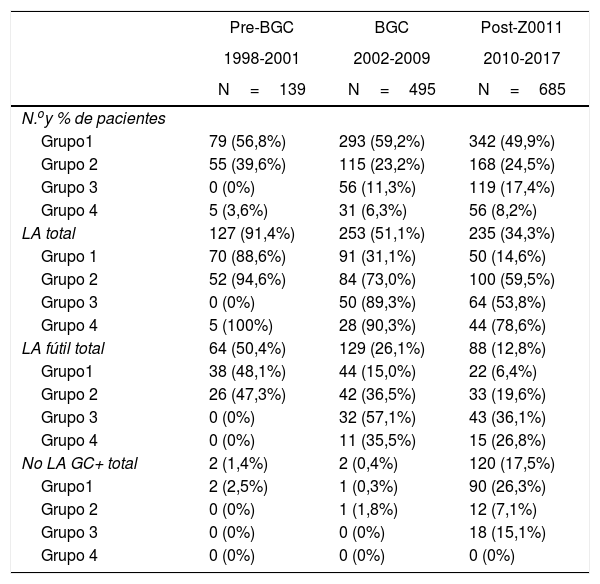
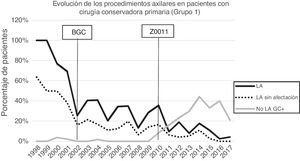
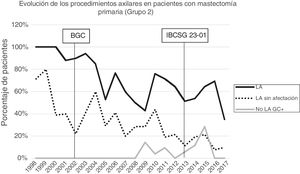
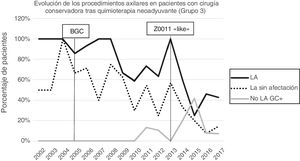
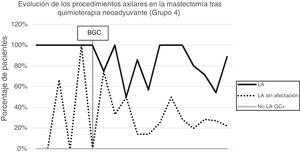
Linfadenectomía axilar. La tabla 2 muestra el número y porcentaje de LA y LAF en los 3 periodos. Un total de 615 LA (46,62%) se realizaron durante los 20 años a estudio con diferencias entre los grupos: un 29,55% en el grupo 1; un 69,8% en la mastectomía primaria; un 65,14% en el grupo 3 y un 83,7% en la mastectomía tras neoadyuvancia. El porcentaje de LA disminuyó progresivamente en el tiempo, pasando del 91% en el primer periodo al 34% después de la introducción de los criterios ACOSOG Z0011 (fig. 2). Dos factores marcaron el descenso de las LA. En primer lugar, la introducción de la BGC a mediados del año 2001 descendió un 50% las LA por año. El segundo factor fue la introducción de los criterios Z0011, lo que disminuyó las LA al 25,6% en 2017. En el grupo 1 se evidenció el mayor descenso en las LA realizadas (4% en 2017) (figs. 3, 4, 5 y 6).
Número y porcentaje de pacientes con linfadenectomía axilar por año
| Pre-BGC | BGC | Post-Z0011 | |
|---|---|---|---|
| 1998-2001 | 2002-2009 | 2010-2017 | |
| N=139 | N=495 | N=685 | |
| N.oy % de pacientes | |||
| Grupo1 | 79 (56,8%) | 293 (59,2%) | 342 (49,9%) |
| Grupo 2 | 55 (39,6%) | 115 (23,2%) | 168 (24,5%) |
| Grupo 3 | 0 (0%) | 56 (11,3%) | 119 (17,4%) |
| Grupo 4 | 5 (3,6%) | 31 (6,3%) | 56 (8,2%) |
| LA total | 127 (91,4%) | 253 (51,1%) | 235 (34,3%) |
| Grupo 1 | 70 (88,6%) | 91 (31,1%) | 50 (14,6%) |
| Grupo 2 | 52 (94,6%) | 84 (73,0%) | 100 (59,5%) |
| Grupo 3 | 0 (0%) | 50 (89,3%) | 64 (53,8%) |
| Grupo 4 | 5 (100%) | 28 (90,3%) | 44 (78,6%) |
| LA fútil total | 64 (50,4%) | 129 (26,1%) | 88 (12,8%) |
| Grupo1 | 38 (48,1%) | 44 (15,0%) | 22 (6,4%) |
| Grupo 2 | 26 (47,3%) | 42 (36,5%) | 33 (19,6%) |
| Grupo 3 | 0 (0%) | 32 (57,1%) | 43 (36,1%) |
| Grupo 4 | 0 (0%) | 11 (35,5%) | 15 (26,8%) |
| No LA GC+ total | 2 (1,4%) | 2 (0,4%) | 120 (17,5%) |
| Grupo1 | 2 (2,5%) | 1 (0,3%) | 90 (26,3%) |
| Grupo 2 | 0 (0%) | 1 (1,8%) | 12 (7,1%) |
| Grupo 3 | 0 (0%) | 0 (0%) | 18 (15,1%) |
| Grupo 4 | 0 (0%) | 0 (0%) | 0 (0%) |
BGC: biopsia de ganglio centinela; GC: ganglio centinela; LA: linfadenectomía axilar.
Linfadenectomía axilar fútil. El número de LAF se redujo de un 50% en el periodo inicial a un 12,8% en el último periodo. En 2017 se realizaron un 6,6% de LAF. Este descenso fue más evidente en el grupo 1, de hecho, en los 2 últimos años no se realizó ninguna LAF en este grupo. En los grupos 2 y 3 también se evidencia un descenso en la curva de las LAF llegando en 2017 al 10% y al 14,3% respectivamente (figs. 4 y 5). El grupo 4 presentó el mayor porcentaje de LAF (27,3%). En este grupo no se omiten LA con GC metastásico. La introducción de los criterios ACOSOG Z0011 produjo un ascenso de las LA omitidas con GC metastásico en todos los grupos, especialmente destacable en los grupos de cirugía conservadora (figs. 3 y 5).
DiscusiónEl tratamiento de las mujeres con cáncer de mama ha evolucionado durante las últimas 2 décadas, abandonándose la necesidad de una cirugía radical en la mayoría de las pacientes. Tres hechos han condicionado este cambio. En primer lugar, el paradigma de enfermedad sistémica propuesto por Fisher16,17, que minimiza la importancia del tratamiento locorregional. En segundo lugar, la introducción de la mamografía y los programas de detección precoz, que incrementaron el número de pacientes con enfermedad temprana en la mama18,19. Finalmente, la descripción de Perou et al.20 de los diferentes subtipos tumorales, que permite la elección de tratamientos específicos según las características biológicas del tumor.
No obstante, la afectación ganglionar continúa siendo el factor pronóstico más importante en el cáncer de mama y la estadificación ganglionar constituye un elemento imprescindible para la planificación del esquema terapéutico. Inicialmente, la estadificación ganglionar se realizó mediante exploración clínica. Sin embargo, el examen físico es poco sensible e inespecífico con tasas de FN por encima del 40%21,22. Por esto la LA pasó a ser el procedimiento de estadificación axilar estándar, capaz de proporcionar un adecuado control regional de la enfermedad. El dilema es que la LA tiene una alta morbilidad (linfedema y neuralgia) por lo que es necesario discriminar aquellas pacientes que se benefician, en términos de supervivencia, de este procedimiento. En ese contexto surge la BGC: una técnica accesible, fácilmente reproducible, con gran sensibilidad y especificidad y de menor morbilidad4–8. La introducción de la BGC en nuestro centro diferencia 2 periodos. En el primer periodo, correspondiente con la era halstediana, se realizó una LA a todas las mujeres con cáncer de mama, procurando más de un 50% de LAF. Estos datos son similares a los evidenciados por otros autores que describen más de un 60% de LA sin afectación metastásica. Así, Fisher et al.23 describen un 62% de pacientes con LA sin afectación ganglionar y Louis-Sylvestre et al.24 un 79%. De igual forma, Martelli et al.25 y Rudenstam et al.26 determinan afectación metastásica ganglionar en el 23% y en el 28% de las pacientes, respectivamente. Estos datos muestran un sobretratamiento de la axila en más de la mitad de las pacientes intervenidas de un cáncer de mama.
El segundo periodo se inicia en 2001 con la introducción de la BGC en nuestro centro, que redujo la indicación de la LA por debajo del 60% y las LAF al 21% en 2002. Este fenómeno fue particularmente evidente en las pacientes con una cirugía primaria conservadora (grupo 1). Sin embargo, la introducción progresiva de la BGC en los distintos grupos de tratamiento permitió una reducción de las LAF en todos los grupos. La BGC generó una problemática: la posibilidad de un FN. Para disminuir la tasa de FN se realiza un estudio exhaustivo del GC (cortes seriados, inmunohistoquímica o método OSNA). No obstante, el estudio detallado del GC incrementa el diagnóstico de pequeños focos tumorales que en la mayoría de las LA del periodo previo a la BGC pasarían desapercibidas27. La detección de estos focos tumorales incluso modificó la nomenclatura del TNM, donde se definen como células tumorales aisladas los nidos metastásicos menores de 0,2mm en su dimensión mayor o un recuento menor de 250 células en el estudio molecular. Las micrometástasis son depósitos tumorales entre 0,2mm y 2mm en su mayor dimensión o un recuento de 250-5.000 copias de células en el OSNA.
Diversos estudios28,29 describen que la incidencia de enfermedad axilar residual en pacientes con células tumorales aisladas y micrometástasis en el GC es menor del 11% y del 16%, respectivamente; y que la supervivencia de estas pacientes es similar a aquellas sin afectación ganglionar30–33. Adicionalmente, la mayoría de los autores refieren tan solo entre un 1,5% y un 6% de pacientes con más de 3 ganglios metastásicos (pN2) si el GC presentaba micrometástasis27–29. Esto implica que menos del 15% de las pacientes con micrometástasis presentará enfermedad residual en la axila y que alrededor de un 5% de las pacientes modificará su estadio ganglionar y quizás la indicación de sus tratamientos adyuvantes (radioterapia ganglionar)34,35. Tres ensayos clínicos9–13 estudian la repercusión de la omisión de la LA en pacientes con metástasis del GC. El primero de ellos, el ACOSOG Z00119,10, aleatoriza a LA u observación a mujeres con carcinoma infiltrante de mama menor de 5cm y afectación metastásica de hasta 2 GC, sometidas a cirugía conservadora y radioterapia. Después de un seguimiento de 5 y 10 años9,10 no se evidencian diferencias estadísticamente significativas en las recaídas locorregionales, supervivencia libre de enfermedad ni supervivencia global, a pesar de un 27% de enfermedad axilar residual detectado en el grupo sometido a una LA. Posteriormente, los ensayos de Galimberti et al.11,12 y de Solá et al.13 demuestran resultados similares al ACOSOG Z0011 en pacientes con afectación micrometastásica de la axila. Los hallazgos de estos 3 ensayos clínicos (ACOSOG Z0011, IBCSG 23-01 y ATTRM) modificaron el algoritmo para el tratamiento axilar en las guías clínicas a nivel mundial14,15.
En nuestro estudio, la aplicación de los criterios ACOSOG Z0011 marca el inicio del tercer periodo. En este se reducen las LA a un 34% y las LAF a menos de un 6,6% de las pacientes intervenidas en el 2017. Esto fue particularmente evidente en el grupo con cirugía conservadora primaria en quienes no se realizó ninguna LAF en los 2 últimos años. En las pacientes con una cirugía conservadora tras quimioterapia neoadyuvante la reducción de las LA y LAF fue tardía, debido a 2 hechos. En primer lugar, realizar la BGC después de la quimioterapia a partir del año 2012, que permitió rescatar a las pacientes con respuesta ganglionar a la quimioterapia sistémica. En segundo lugar, y en menor medida, a la omisión de la LA en pacientes con micrometástasis del GC en los 4 últimos años. La seguridad de la observación sin una LA en este grupo de pacientes no ha sido valorada y en la literatura no existe evidencia que apoye nuestra estrategia terapéutica. Estos resultados en este periodo son semejantes a los expuestos en la literatura. Caretta-Weyer et al.36 calcularon una posible reducción del 38% de las LA en la población que cumple los criterios Z0011. Caudle et al.37 analizan el impacto de los criterios del Z0011 un año después de la implementación de los mismo y evidencian una disminución de las LA con GC metastásico del 85% al 24%. Joyce et al.38 realizaron un estudio similar y determinaron una reducción del 27% de las LA. De igual forma, en una publicación previa de nuestro centro39 se rescataron de la LA al 58% de las pacientes con cirugía primaria conservadora y GC metastásico.
En conclusión, nuestro estudio refleja los cambios que se han producido en las últimas 2 décadas en los procedimientos de estadificación y tratamiento axilar en el cáncer de mama. La evolución en el tratamiento del cáncer de mama ha disminuido la indicación de la LA, reduciendo así el número de LAF. Las mujeres con una cirugía primaria conservadora obtienen el mayor beneficio ya que en la actualidad no se realizan LAF en este grupo. Actualmente están en curso diversos ensayos clínicos40–49 que contribuirán a tomar decisiones sobre la indicación de una LA en distintos escenarios. El vaciamiento ganglionar debe limitarse a las mujeres que se beneficien de ella en términos de supervivencia global, reduciendo así la morbilidad asociada a esta técnica (linfedema, neuralgia, parestesias…).
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNo existe conflicto de intereses.