El objetivo principal de este estudio es analizar la eficacia del marcaje ganglionar combinado (clip y biopsia de ganglio centinela (BGC)) para la estadificación axilar en pacientes con tratamiento sistémico primario (TSP) y cáncer de mama con ganglios positivos confirmados patológicamente en el momento del diagnóstico. El objetivo secundario es determinar el impacto del marcaje ganglionar en la supresión de la linfadenectomía axilar (LA) en el grupo a estudio.
MétodosEstudio prospectivo en el que se realizó la estadificación ganglionar mediante la localización con alambre metálico (arpón) de los ganglios afectados y una BGC con doble trazador. Todas las pacientes sin afectación metastásica del ganglio centinela (GC) o del ganglio marcado con clip/alambre no realizaron una LA. El comité multidisciplinar acordó el tratamiento axilar de las pacientes con afectación ganglionar.
ResultadosOchenta y un pacientes cumplieron los criterios de inclusión. Identificamos y extirpamos el ganglio marcado con clip/alambre en 80 de 81 pacientes (98,8%), y la BGC se realizó con éxito en el 88,9% de los pacientes. El GC y el nódulo marcado con arpón coincidieron en el 78,9% de las pacientes. El 76,2% de las pacientes no se sometieron a LA.
ConclusionesEl marcaje axilar combinado (clip y BGC) en pacientes con ganglios metastásicos al diagnóstico y TSP ofrece una alta tasa de identificación (98,8%) y una alta correlación entre el ganglio marcado con arpón y el GC (78,8%). Este procedimiento ha permitido la supresión de la LA en el 76,2% de las pacientes incluidas en el estudio.
The main objective of this study is to analyze the efficacy of combined axillary marking (lymph node clipping and sentinel lymph node biopsy (SLNB)) for axillary staging in patients with primary systemic treatment (PST) and pathologically confirmed node-positive breast cancer at diagnosis. The secondary objective is to determine the impact of lymph node marking in the suppression of axillary lymph node dissection (ALND) in the study group.
MethodsWe conducted a prospective study in which lymph node staging was performed using wire localization of positive lymph nodes and a SLNB with dual tracer. All patients who presented no metastatic involvement of the sentinel lymph node (SLN) or clip/wire-marked lymph node were spared an ALND. The multidisciplinary committee agreed on axillary treatment for patients with lymph node involvement.
ResultsEighty one patients met the inclusion criteria. We identified and extirpated the clip/wire-marked node in 80 of 81 patients (98.8%), with SLNB performed successfully in 88,9% of patients. The SLN and wire-marked node matched in 78.9% of patients; 76.2% of patients did not undergo ALND.
ConclusionsThe combined axillary marking (clip and SLNB) in patients with metastatic lymph node at diagnosis and PST offers a high identification rate (98.8%%) and a high correlation between the wire-marked lymph node and the SLN (78.9%%). This procedure has enabled the suppression of ALND in 76.2% of patients.
La biopsia de ganglio centinela (BGC) es el procedimiento de elección para la estadificación axilar en pacientes con cáncer de mama y cirugía primaria, ya que diversos estudios han demostrado que la supervivencia global (SG) y libre de enfermedad (SLE) es similar en pacientes con BGC y linfadenectomía axilar (LA) cuando el ganglio centinela (GC) es negativo1,2. Posteriormente, los estudios ACOSOG-Z00113 y AMAROS4 demostraron que la supresión de la LA en pacientes con afectación del GC ofrecía una supervivencia similar a la LA mediante la irradiación completa de la mama y/o axila. Por el contrario, tras tratamiento sistémico primario (TSP) la LA ha sido la técnica de elección en pacientes con afectación ganglionar al diagnóstico o metástasis del GC tras TSP.
Actualmente existe controversia sobre la técnica idónea para la estadificación axilar tras TSP en mujeres con afectación ganglionar al diagnóstico. Diversos grupos5,6 proponen evaluar la respuesta ganglionar tras TSP para evitar la LA en las pacientes con respuesta patológica completa (RPC). En los últimos años se ha propuesto una nueva técnica de estadificación denominada disección axilar dirigida (TAD)7 para disminuir la indicación de LA en este grupo de pacientes.
El objetivo principal de este estudio es analizar la eficacia del marcaje ganglionar combinado (clip y BGC) para la estadificación axilar en pacientes con TSP y cáncer de mama con afectación metastásica ganglionar en el momento del diagnóstico. El objetivo secundario es determinar el impacto del marcaje ganglionar en la supresión de la LA en el grupo a estudio.
MetodologíaEstudio prospectivo no randomizado de la unidad de mama de nuestro centro entre mayo de 2016 y enero de 2022. En el estudio se incluyen a las mujeres mayores de 18 años con cáncer de mama (todos los tipos histológicos y subtipos tumorales, excepto los sarcomas) y afectación de ganglios axilares al diagnóstico (N1) que recibieron TSP por indicación del comité multidisciplinar, basado en las guías clínicas internacionales8-10. Se excluyeron aquellas pacientes con metástasis a distancia al diagnóstico (M1), progresión clínica o radiológica de la enfermedad durante el TSP, cuatro o más ganglios sospechosos de malignidad al diagnóstico y aquellas pacientes que decidieron no participar en el estudio (tabla 1). El estudio fue aprobado por el Comité Autonómico de Ética de la Investigación (Código Promotor: SENTINA 00-14; Código de Registro: 2014/140).
Criterios de inclusión y exclusión
| Criterios de Inclusión | Criterios de Exclusión |
|---|---|
| MujeresEdad mayor de 18 añosCarcinoma infiltrante de mama (todos los tipos histológicos, except sarcomas)Todos los subtipos tumorales (por IHQ)Afectación ganglionar al diagnóstico (cN1)Indicación de terapia sistémica primariaAceptar participar en el estudioConfirmación patológica de afectación ganglionar (BAG)Marcaje del ganglio biopsiado | VaronesMenores de 18 añosSarcomas de mamaNo afectación ganglionar al diagnóstico (cN0)Afectación de más de 4 ganglios al diagnóstico (cN2-3)Metástasis a distancia al diagnósticoProgresión durante la terapia sistémica primariaNegativa para participar en el estudioFalta de confirmación histológica de metástasis ganglionarNo marcaje del ganglio biopsiado |
Se realizó una ecografía axilar para estadificación ganglionar previa al TSP. Cada ganglio linfático se clasificó en base a las características morfológicas de la cortical y el hilio ganglionar utilizando la clasificación de Bedi et al.11 y aquellos ganglios que mostraban una categoría Bedi 4-6 se biopsiaron y marcaron con un clip. En las pacientes con más de 1 ganglio sospechoso se llevó a cabo la biopsia y marcaje de aquel ganglio con mayor índice de sospecha de afectación metastásica. Una vez finalizada la TSP, mediante ecografía, se procedió al marcaje con una guía metálica (arpón) del ganglio marcado con un clip durante el diagnóstico. Asimismo, se realizó el marcaje isotópico del GC con tecnecio-99 en la región periareolar. En caso de no evidenciarse captación por el radioisótopo, se complementó el marcaje del GC con azul patente. Todas las pacientes realizaron una resonancia magnética de mama previa al inicio de la TSP y otra al finalizar dicho tratamiento para conocer el grado de respuesta en la mama y en la axila.
Terapia sistémica primariaTodas las pacientes incluidas en el estudio se sometieron a TSP de acuerdo con las guías clínicas correspondientes a cada período9,10. Todas las pacientes fueron tratadas con cuatro ciclos de adriamicina y ciclofosfamida, y 12 ciclos de paclitaxel. La secuencia de estas terapias fue decisión del oncólogo médico. Todas las mujeres que fueron positivas para el receptor HER2 fueron tratadas con anticuerpos monoclonales (trastuzumab con o sin pertuzumab).
Método quirúrgicoTodas las pacientes incluidas en el estudio fueron intervenidas tras haber completado el esquema de quimioterapia neoadyuvante seleccionado. El día de la intervención se realizó la extirpación del ganglio marcado con el clip/arpón. Una vez extirpado este ganglio se comprobó si presentaba carga isotópica y/o coloración con azul patente. Se confirmó la presencia del clip en el ganglio marcado a través de una radiografía de la muestra. Finalmente se llevó a cabo una exploración axilar complementaria para comprobar la existencia de otros GC marcados con radioisótopo/colorante. Se definió como GC aquel con un recuento de isótopos diez veces mayor que el basal y/o los teñidos con azul patente o con el conducto linfático azul. Definimos como ganglio no centinela a aquellos sospechosos a la palpación, aquellos que no mostraron colorante azul, ganglios sin actividad del radiotrazador. En el informe de la cirugía se especificó si el GC coincidía con el ganglio marcado con clip.
En las pacientes sometidas a una mastectomía se realizó un estudio intraoperatorio de los ganglios extirpados mediante el método OSNA. En caso de afectación macrometastásica del ganglio, se procedía a una LA en el mismo acto quirúrgico. En las pacientes intervenidas mediante cirugía conservadora se realizó el estudio diferido de los ganglios. Si este estudio mostraba afectación metastásica del ganglio, el caso era discutido en el comité multidisciplinar de mama para valorar la indicación de una LA. El comité multidisciplinar está formado por oncólogos médicos, oncólogos radioterapeutas, cirujanos de mama, radiólogos de mama y anatomopatólogo. Se valoraron las características individuales de cada paciente (número de ganglios afectados, biología del tumor, respuesta a TSP en la mama, morbilidades asociadas etc.). Aquellas mujeres con alguna característica favorable como: RPC en mama, extirpación de más de un ganglio y uno de ellos sin enfermedad, y/o micrometástasis del ganglio, el comité consensuó omitir la LA. En las pacientes con LA se extirparon en los niveles I y II de Berg, y solo se extirpó el nivel III en aquellas pacientes con afectación macroscópica de dicho nivel. Se indicó radioterapia de cadenas ganglionares en aquellos casos en los que el comité recomendó la supresión de la LA.
Se definió como micrometástasis aquellas inclusiones tumorales entre 0,2 y 2 mm, equivalente en el método OSNA a un número de copias entre 250 y 5.000. Las macrometástasis son aquellas metástasis > 2 mm o más de 5.000 copias por OSNA. Finalmente, las células tumorales aisladas son metástasis menores de 0,2 mm y se corresponden con < 250 copias por OSNA.
Indicación y planificación del tratamiento radioterápicoTodas las pacientes con cirugía conservadora incluidas en el estudio recibieron radioterapia de la mama entre la cuarta y la sexta semana después de la cirugía. La irradiación mamaria se realizó mediante campos tangenciales a dosis de 50 Gy en 25 fracciones de 2 Gy, 5 veces por semana. En caso de realizar una sobreimpresión del lecho tumoral se aplicaron dosis entre ocho a 10 Gy adicionales, repartidos en cuatro o cinco sesiones. En todas las mujeres con una mastectomía se indicó radioterapia de la pared torácica en dosis de 45-50 Gy en 25 fracciones de 1,8-2 Gy/día en la pared torácica. Las pacientes con indicación de radioterapia de cadenas ganglionares recibieron dosis de 50 Gy en 25 sesiones, con una profundidad de 3 cm.
Método estadísticoEmpleamos IBP SPSS Statistics versión 22 (IBM Corporation, Armonk, NY, E.E. U.U.) para la recopilación de datos y análisis. Las variables cuantitativas se enumeran con su media y desviación estándar y las variables cualitativas se enumeran con sus proporciones. Las diferencias entre las variables cualitativas se hallarán mediante el test exacto de Fisher o test de χ2. El estudio de SG se realizó a través de curvas de Kaplan-Meier.
ResultadosEl grupo a estudio está formado por 81 pacientes con carcinoma infiltrante de mama y afectación metastásica de la axila al diagnóstico tratadas con TSP. El subtipo tumoral más frecuente fue el Luminal B Her2 negativo (32,1%) seguido del Luminal B Her2 positivo (27,2%).
Características de la serie. La media del tamaño inicial del tumor fue de 3,6 cm (±1,5) y la media del tamaño final 0,7 cm (± 1,1) (tabla 2). Un 76,6% de las pacientes preservaron la mama (tumorectomía 66,7% y oncoplastia 9,9%) (tabla 3). El 85,7% de las pacientes con una RPC en la mama presentaron también una RPC en la axila (ypN0). Por el contrario, solo un 34% de las pacientes con respuesta parcial en la mama negativizaron la enfermedad ganglionar. La respuesta axilar fue estadísticamente superior en los tumores con sobreexpresión Her2 y respuesta en la mama. Así, el 91,7% de los tumores Her2 puros y el 90,9% de los Luminal B Her2 positivos con RPC en la mama, negativizaron la axila (p = 0,001). En dos pacientes con tumores Luminal B Her2 negativo que no respondieron al TSP presentaban enfermedad axilar residual.
Características clinicopatológicas de las pacientes
| Pacientesn = 81 | |
|---|---|
| Edad (años) | |
| Media | 53,3 (± 11,5) |
| Rango | 26-81 |
| Subtipo tumoral | |
| Luminal A | 2 (2,5%) |
| Luminal B Her2- | 26 (32,1%) |
| Luminal B Her2 + | 22 (27,2%) |
| Her2 + | 13 (16,0%) |
| Triple Negativo | 18 (22,2%) |
| Marcaje del GC | |
| Tecnecio | 41 (50,6%) |
| Azul Patente | 5 (6,2%) |
| Azul + Tecnecio | 35 (43,2%) |
| Tamaño tumoral inicial (cm) | |
| Media | 3,6 (± 1,5) |
| Rango | 1,2 – 8,4 |
| Tamaño tumoral inicial (cTNM) | |
| T1c | 9 (11,1%) |
| T2 | 57 (70,4%) |
| T3 | 15 (18,5%) |
| Tamaño tumoral final (cm) | |
| Media | 0,7 (± 1,1) |
| Rango | 0 – 6 |
| Resultados quirúrgicos | Pacientesn = 81 |
|---|---|
| Tipo de cirugía mamaria | |
| Tumorectomía | 54 (66,7%) |
| Oncoplastia | 8 (9,9%) |
| Mastectomía | 19 (23,5%) |
| RPC en mama | 35 (43,2%) |
| RPC en mama según subtipo tumoral | |
| Luminal A | 0/2 (0%) |
| Luminal B Her2- | 5/26 (19,2%) |
| Luminal B Her2 + | 11/22 (50%) |
| Her2 + | 12/18 (66,7%) |
| Triple negativo | 7/13 (53,8%) |
| GC Extirpados | 2,6 (± 1,5) |
| Pacientes con afectación axilar tras quimioterapia | 36 (44,4%) |
| Linfadenectomía Axilar | 19 (23,5%) |
| Ganglios extirpados en la linfadenectomía | 12,6 (± 5,9) |
| 3-27 | |
| Tipo de afectación axilar | |
| ypN0 | 45 (55,6%) |
| ypN1mi | 14 (17,3%) |
| ypN1 | 22 (27,2%) |
| RPC en el GC/ganglio marcado | |
| Luminal A | 0/2 (0,0%) |
| Luminal B Her2- | 6/26 (23,1%) |
| Luminal B Her2 + | 15/22 (68,2%) |
| Her2 + | 15/18 (83,3%) |
| Triple negativo | 9/18 (69,2%) |
| Respuesta axilar según respuesta en mama (completa o parcial) | |
| Luminal A | 0/0 (0,0%) |
| Luminal B Her2- | 3/5 (60,0%) |
| Luminal B Her2 + | 10/11 (90,9%) |
| Her2 + | 11/12 (91,7%) |
| Triple negativo | 6/7 (85,7%) |
GC: ganglio centinela; RPC: respuesta patológica completa.
Identificación y concordancia del marcaje axilar
| PacientesN 81 | |
|---|---|
| Identificación del clip y colocación de arpón | 81 (100%) |
| Extirpación de ganglio marcado con arpón | 80 (98,8%) |
| Biopsia de ganglio centinela | 72 (88,9%) |
| Concordancia entre ganglio marcado con clip y ganglio centinela | 56/71 (78,9%) |
| Capacidad del ganglio marcado de detectar afectación axilar | 32/36 (88,9%) |
Tratamiento axilar. El 85,2% (69) de las pacientes incluidas en el estudio presentaban afectación metastásica de un solo ganglio; cuatro mujeres (4,9%) presentaban dos ganglios sospechosos de afectación metastásicos y ocho pacientes (9,9%) tres ganglios. El clip de marcaje axilar se detectó mediante ecografía en todas las pacientes del grupo a estudio, lo que permitió la colocación del arpón en todas las enfermas (tabla 4). El ganglio marcado con clip/arpón se extirpó en 80 de las 81 pacientes (98,8%), mientras que el marcaje con isótopo/colorante identificó el GC en 72 pacientes (88,9%). Este GC coincidió con el ganglio marcado con clip en 56 pacientes (78,9%).
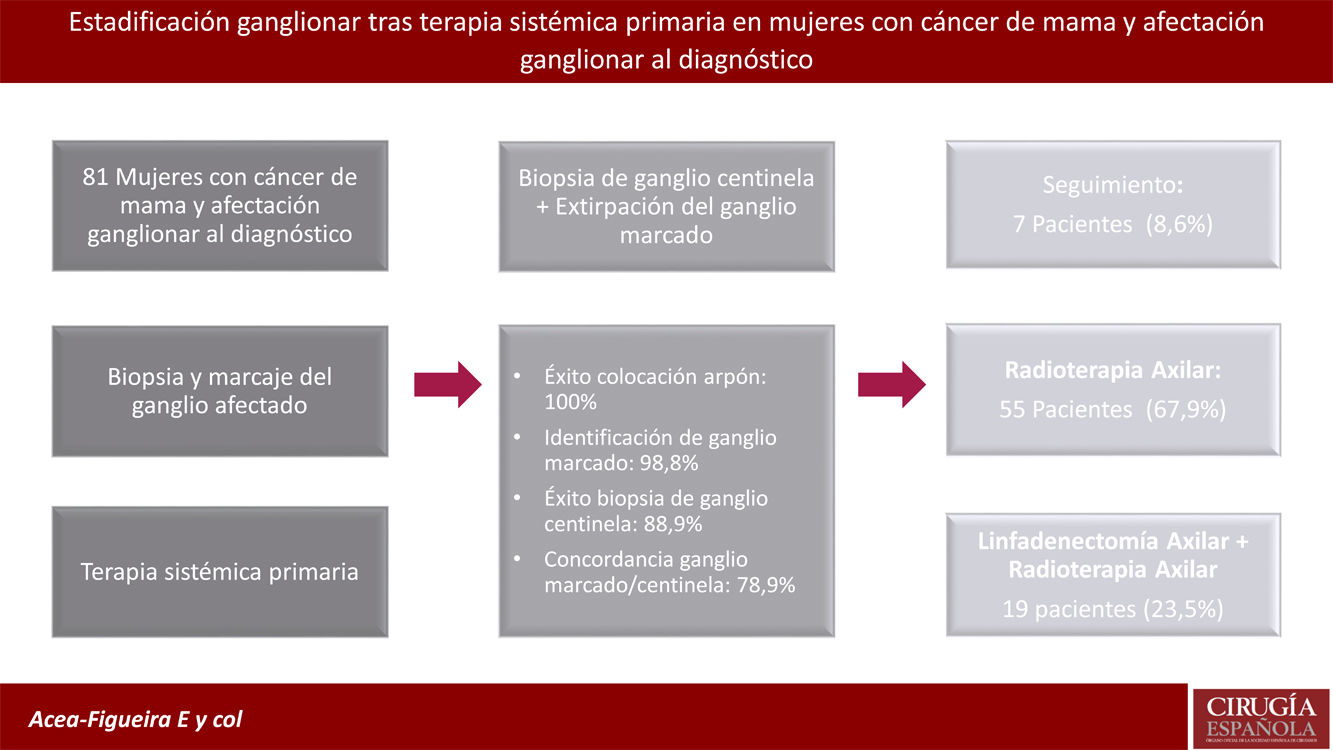
Un total de 45 pacientes (55,6%) presentaron una respuesta completa en la axila tras el TSP. Con estos resultados patológicos el comité de mama recomendó realizar una LA en 18 pacientes (23,5%) (fig. 1):
ypN0. En el 97,8% de las pacientes con respuesta axilar (44 de 45 mujeres), no se realizó una LA. Una de las 45 pacientes sin afectación del ganglio marcado, fue sometida a una LA axilar, ya que no se detectó GC y la axila impresionaba macroscópicamente afectada. Siete de estas pacientes sin LA (8,6%), tampoco recibieron radioterapia axilar (fig. 1).
ypN1. En el 50% de las pacientes con persistencia de afectación metastásica del ganglio no se realizó una LA. Un 66,7% de estas pacientes (12 de 18) presentaba afectación micrometastásica del ganglio y todas recibieron radioterapia axilar. Cinco de las 6 pacientes con macrometástasis (83,3%), sin LA axilar, tenían otros ganglios centinelas sin enfermedad.
Eventos oncológicos. El tiempo medio de seguimiento fue de 24,2 ± 16 meses (Rango: 1,3-68,5) y durante el mismo no se detectaron recaídas axilares. Una paciente con LA y radioterapia ganglionar falleció a los 47 meses de la intervención por progresión metastásica de su cáncer de mama, determinando una SG a los 48 meses de 88,9% (IC 95%: 78,4-99,4%) (fig. 2).
DiscusiónLa cirugía axilar en mujeres con cáncer de mama ha sufrido una desescalada en los últimos años. Sin embargo, la cirugía axilar tras TSP no ha presentado una reducción similar en su intensidad, debido a la ausencia de estudios prospectivos que evalúen a estas mujeres. Este estudio analiza la eficacia del marcaje con clip del ganglio afectado tras TSP. Esta eficacia depende del método empleado para el marcaje y por ello diversos estudios han evaluado estos métodos. Donker et al.12 llevaron a cabo el marcaje de los ganglios axilares mediante semillas de yodo radiactivo-125 (procedimiento MARI) obteniendo una tasa de identificación del 97% y una tasa de FN del 7%. Caudle et al.7 aplicaron el método TAD para evaluar la respuesta de los ganglios axilares metastásicos a la TSP. La tasa de identificación obtenida por este grupo fue del 95%, con una tasa de FN del 2%. Por contra, cuando se realizó únicamente la extracción del ganglio marcado o del GC la tasa de FN fue 4,2 y 10,1%, respectivamente. Boughey et al.13 demostraron en el estudio ACOSOG Z1071 que la colocación de un clip en el ganglio afectado durante el diagnóstico de la enfermedad junto con la BGC es un método adecuado para disminuir la tasa de FN. Esta tasa disminuyó del 19,9 al 6,8% en pacientes con BGC y marcaje selectivo del ganglio biopsiado, respectivamente. El estudio retrospectivo de Simons et al.14 utilizó semillas de yodo radiactivo para la identificación del ganglio biopsiado tras TSP en combinación con la BCG, obteniendo una tasa de identificación del 92,8% y una tasa de FN del 2 al 4% combinando ambos procedimientos. Posteriormente, Hellingman et al.15 propusieron una modificación del procedimiento MARI mediante la inyección de albúmina macroagregada marcada con tecnecio-99m en los ganglios marcados con clip y su posterior extracción durante la cirugía, logrando una tasa de identificación del 87%. Recientemente el estudio de Martínez et al.16 evaluó la seguridad y eficacia de las semillas magnéticas como método de estadificación axilar, obteniendo una tasa de identificación del 100% y una reducción en la tasa de FN del 21,4 al 5,9% cuando se combinó la BGC y la extracción del ganglio marcado. El estudio de Siso et al.17 utilizó la ecografía para la identificación del ganglio marcado con clip logrando una tasa de identificación de 95,4% y una tasa de FN de 4,1%. Por su parte, Gurleyik et al.18 lograron una tasa de identificación del 98,4% mediante la localización del ganglio marcado con ecografía tras TSP. Los estudios de Park et al.19 y Patel et al.20 analizaron la eficacia del tatuaje del ganglio linfático con carbón vegetal y tinta negra, respectivamente, obteniendo una tasa de FN de 20,0% y 13,3%. En nuestro estudio, el clip se detectó en el 100% de las pacientes. El marcaje con arpón permitió la identificación del ganglio marcado en 80 de 81 pacientes (98,8%) y el marcaje con isótopo/colorante permitió la identificación del GC en 72 pacientes (88,9%). Otros autores han empleado una metodología similar a la de nuestro estudio mediante el uso de una guía metálica. Plecha et al.21 y Hartmann et al.22, obtuvieron resultados dispares. Por un lado, el estudio realizado por Plecha et al.21 obtuvo una tasa de éxito para el procedimiento del 97,3%, afirmando que la localización de los ganglios axilares metastásicos guiada por arpón se trata de una técnica precisa y que mejora la tasa de FN y de extracción quirúrgica. Por el contrario, el estudio de Hartmann et al.22 obtuvo una tasa de identificación del 70,8%, afirmando que esta técnica no es adecuada para la práctica clínica habitual. Estas discrepancias podrían ser debidas a las diferencias de experiencia de los cirujanos/radiólogos participantes en el estudio. En nuestra opinión, este procedimiento de estadificación es un método eficaz y fácilmente reproducible, ya que emplea la misma metodología que la utilizada para las lesiones no palpables de mama, lo que lo hace un método extrapolable a la mayoría de las unidades de mama. Además, no precisa inversión y no conlleva los riesgos de seguridad radiológica asumidos en otras técnicas.
El segundo objetivo del estudio fue determinar la disminución de LA según el tipo de respuesta patológica tras TSP en el ganglio biopsiado. En nuestra experiencia los perfiles tumorales con mayor incidencia de RPC fueron los tumores Her2 positivo y triple negativo, con respuestas del 91,7 y 85,7%, respectivamente. Resultados similares fueron obtenidos en los estudios de Samiei et al.23 y Gurleyik et al.18, y en todos ellos las tasas de cirugía conservadora de mama fueron significativamente más altas en los tumores Her2 positivo y triple negativo. Estos resultados nos plantean la posibilidad de una desescalada en la cirugía axilar en pacientes con RPC en el ganglio marcado de manera similar a la planificación que se lleva a cabo en la mama tras una RPC. Este planteamiento estaría sustentado por dos hechos. El primero, se relaciona con el uso de la radioterapia mamaria y axilar en este grupo de mujeres con afectación ganglionar al diagnóstico, que garantiza la seguridad oncológica tras la conservación de la mama y de los ganglios axilares. En segundo lugar, algunos estudios como el de Fayanju et al.24 demuestran que el grupo de pacientes con RPC ganglionar poseen un pronóstico comparable a las pacientes con ganglios clínicamente negativos al diagnóstico.
En nuestro estudio un total de 56 pacientes (78,9%) presentaron una concordancia entre ambos marcajes, una incidencia similar a la obtenida en otros estudios (75,9-77%)7,13,17. Esta elevada concordancia entre el ganglio marcado y el GC plantea la hipótesis de que ambos son el mismo ganglio, lo cual estaría alineado con la definición de GC como aquel con mayor probabilidad de metástasis25. En estas pacientes la propia enfermedad habrá marcado su GC, lo que podría plantear la supresión de la BGC en estas pacientes. Por el contrario, otros estudios han demostrado tasas menores de concordancia, con valores entre 35,7 y 65%16,22,26. También en este estudio, un 21,1% de pacientes no presentó concordancia entre el ganglio marcado y el GC. Estas discrepancias pueden ser debidas al bloqueo linfático y, menos probable, a un error en el marcaje del ganglio biopsiado. Por ello consideramos que es de gran importancia la selección de las pacientes para la estadificación ganglionar tras TSP, que en el caso de nuestro estudio se ha centrado en mujeres con afectación limitada de la axila (N1).
En nuestra experiencia, en 61 pacientes (76,3%) se suprimió la LA, siendo el grupo con RPC ganglionar las pacientes más beneficiadas. No obstante, en un 50% de las pacientes con persistencia de afectación metastásica del ganglio, a pesar de la recomendación de las guías clínicas, se indicó la supresión de la LA tras ser valoradas individualmente en el comité de tumores y ser incluidas en este estudio prospectivo. Un estudio realizado por Nijnatten et al.27 compara la SLE y la SG entre pacientes con cáncer de mama y ganglios positivos al diagnóstico en base a su respuesta a la quimioterapia neodayuvante. Los resultados de este estudio concluyen que no hay diferencias significativas entre las pacientes con RPC axilar (ypN0) y las pacientes con células tumorales aisladas (ypN0itc) o micrometástasis (ypN1mi). Por el contrario, las macrometástasis axilares residuales (ypN1) se asociaron a un pronóstico menos favorable. El estudio multicéntrico realizado por Cabıoğlu et al.28 mostró resultados similares, afirmando que la LA podría evitarse en pacientes con RPC de mama y/o ganglios tras quimioterapia neoadyuvante y en el caso de cT1-2 o baja carga tumoral (micrometástasis o células tumorales aisladas) residual ganglionar en subtipos luminales, siempre que se proporcione radioterapia axilar. En contraposición, los estudios realizados por Wong et al.29 y Fisher et al.30 defienden que la enfermedad residual de baja carga después de la quimioterapia neoadyuvante se relaciona con unas tasas de SLE y SG menores en comparación con aquellas con ganglios negativos. Estas discrepancias hacen necesarios estudios prospectivos que evalúen el impacto de la LA y radioterapia axilar en la evolución a medio y largo plazo de las pacientes con macrometástasis tras TSP. En nuestro estudio no se han registrado recaídas axilares durante el seguimiento en las pacientes sin LA y tratadas con radioterapia axila, pero precisamos un mayor seguimiento para evaluar la seguridad oncológica de esta desescalada quirúrgica, especialmente en aquellas mujeres con macrometástasis tras TSP.
Nuestro estudio presenta varias limitaciones. La ausencia de LA en un grupo significativo de las pacientes nos impide conocer la tasa de FN de la serie. Una segunda limitación es el escaso tiempo de seguimiento (seguimiento medio de 24 meses), que nos impide realizar una correcta valoración de la seguridad oncológica y el impacto en SG del procedimiento a medio plazo, especialmente en aquellas pacientes con supresión de la LA.
En conclusión, nuestro estudio demuestra que el marcaje axilar combinado (clip en el ganglio biopsiado y BGC) presenta una alta tasa de eficacia para la estadificación ganglionar (98,8%). Un 78,9% de estos ganglios marcados coinciden con el GC. Las pacientes con tumores Her2 y triple negativo presentan una alta tasa de RPC (91,7 y 85,7%, respectivamente) y por ello constituyen un grupo con una especial indicación para este procedimiento. En nuestro estudio, en un 76,25% de mujeres se suprimió la LA axilar y por ello consideramos que se justifica el esfuerzo empleado en el marcaje y extracción del ganglio biopsiado.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.