La indicación de trasplante hepático (TH) en el tumor de Klatskin (TK) no está establecida debido a la discrepancia en los resultados de las series publicadas.
ObjetivoPresentar los resultados del TH en pacientes con TK irresecable no diseminado y compararlos con los obtenidos en los pacientes no resecados y con resección del tumor.
Pacientes y métodoHemos tratado 75 pacientes con TK. La edad media fue de 62±11 años (rango: 38–88) y 50 fueron varones (66%). Veinte pacientes se consideraron inoperables. Se realizó resección del tumor (RT) en 29 de los 55 pacientes operados, TH en 11 casos (en tumores irresecables no diseminados) y tratamiento paliativo en los 15 pacientes con TK irresecables diseminados.
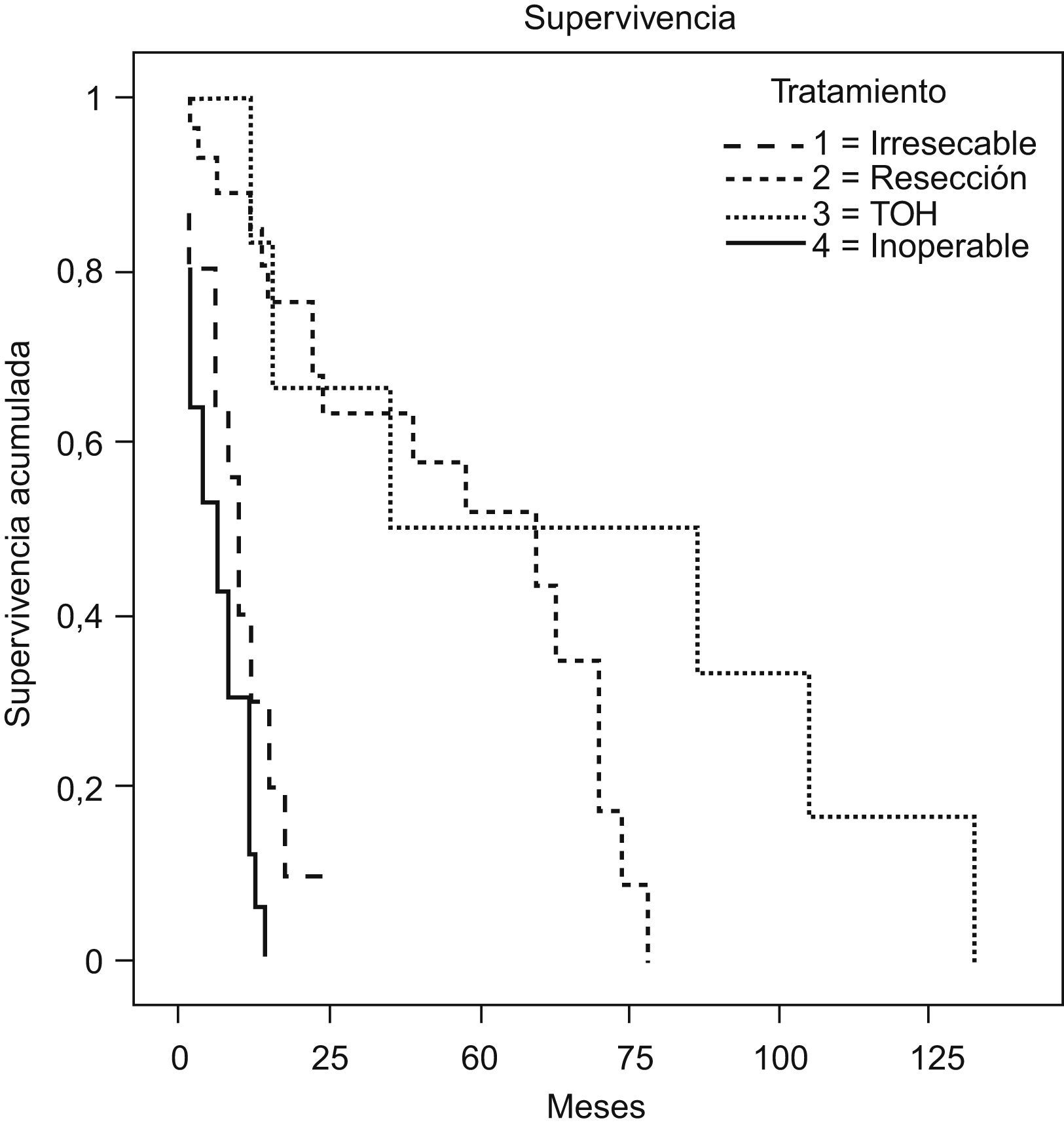
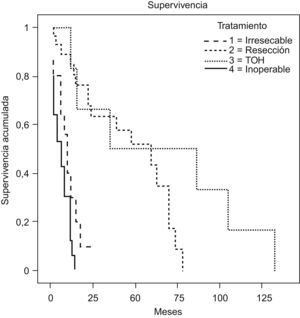
ResultadosEn el grupo TH no hubo mortalidad postoperatoria (primer mes) y presentaron una supervivencia a 1, 3 y 5 años del 95, el 59 y el 36% con una supervivencia libre de enfermedad (SLE) del 75, el 40 y el 20%. Los pacientes con RT presentaron una supervivencia del 80, el 52 y el 38%, con una SLE del 65, el 35 y el 19%, sin diferencias respecto al grupo TH. Los pacientes con tumor irresecable que quedaron con tratamientos paliativos presentaron una supervivencia inferior a la de los pacientes con tumores irresecables que recibieron TH (p<0,001).
ConclusionesEn pacientes con TK irresecable no diseminado, el TH consigue una supervivencia similar a la obtenida en los casos resecables con la resección hepática R0, y mejora claramente la esperanza de vida de estos pacientes con tratamientos paliativos.
There are no established indications for Liver transplant (LT) in patients with a Klatskin tumour (KT) due to the differences in the published results.
ObjectiveTo report on our patients who have non-disseminated unresectable KT and who were given a LT, and to compare results with those of patients who have had tumour resection and those who have not.
Patients and methodWe have treated 75 patients diagnosed with KT. The mean age was 62±11 years (range: 38–88 years) and 50 were males (66%). Twenty patients were inoperable. Of the 55 patients who underwent surgery: tumour resection (TR) was performed in 29 cases; there was no tumour dissemination in 11 unresectable cases and therefore these patients were added to the LT waiting list and the remaining 15 unresectable cases had tumour dissemination and remained on palliative treatment.
ResultsIn the LT group there was no postoperative mortality (during the first month) and the survival rate was 95%, 59% and 36% with a disease-free survival of 75%, 40% and 20%; whereas the patients given RT had a survival rate of 80%, 52% and 38% at 1, 3 and 5 years, with a disease-free survival of 65%, 35% and 19%, without any differences compared to the LT group. Patients with unresectable tumour left on palliative therapy had a lower survival than the unresectable who underwent LT (p<0.001).
ConclusionsIn patients with non-disseminated unresectable KT, LT has a similar survival to that obtained in cases with resectable R0 liver resection. LT improves the survival rate achieved using palliative treatment in patients with non-disseminated unresectable KT.
El tratamiento más aceptado para el colangiocarcinoma hiliar (tumor de Klatskin) (TK) es la resección hepática R0, que consigue una supervivencia a 5 años de entre el 20 y el 45%1–16. En pacientes inoperables, la supervivencia es nula a 5 años, y en pacientes cuyo tumor es irresecable sin estar diseminado (debido a la extensión del tumor hacia los radicales biliares intrahepáticos de forma bilateral), el pronóstico es similar al de los pacientes inoperables. En estos casos, algunos autores proponen el trasplante hepático (TH)17–26, aunque algunos grupos lo consideran contraindicado debido a la escasez de órganos. En estos mismos pacientes, en 1993, el grupo de la Mayo Clinic inicia un protocolo con quimiorradioterapia previa al TH con buenos resultados a 5 años27–31.
Nuestro objetivo es presentar los resultados obtenidos en nuestros pacientes con TK, que en el curso de la laparotomía se juzgaron irresecables por infiltración de la vía biliar intrahepática, en ausencia de enfermedad extrahepática, que posteriormente recibieron TH. Los resultados de este grupo de pacientes se comparan con los obtenidos en los pacientes que pudieron resecarse sin TH y con los de los pacientes que no se resecaron, bien por ser inoperables o por existir diseminación de la enfermedad en la laparotomía.
Pacientes y métodoDesde mayo de 1988 (fecha de inicio de nuestro programa de TH) hasta octubre de 2008 hemos tratado 75 pacientes con el diagnóstico de TK. La edad media fue de 62±11 años (rango: 38–88 años) y 50 fueron varones (66%). En 69 pacientes la clínica fue secundaria a la colestasis y la bilirrubina total (BT) fue de 14±11mg/dl (rango: 5–44); en 6 casos (8%) no existió ictericia y se detectó en la analítica una colestasis disociada.
En 11 pacientes (14%) existió una insuficiencia renal con creatinina superior a 3. En todos los pacientes se realizó ecografía y TC hepática trifásica, en busca de dilatación de radicales biliares intrahepáticos, de masa tumoral en hilio hepático, de metástasis hepáticas, de adenopatías en hilio hepático o retroperitoneales y de invasión portal o arterial. Desde 1998 realizamos sistemáticamente colangio-RMN (50 pacientes). En 63 pacientes (84%), todos con BT superior a 10ng/ml, se realizó una colangiografía transparietohepática colocando un drenaje biliar externo intrahepático supratumoral con el fin de no manipular el tumor. Cuando consideramos al paciente inoperable32, dejamos un tutor interno-externo o una prótesis transtumoral definitiva.
Para determinar la localización del tumor utilizamos la clasificación de Bismuth-Corlette33: 5 casos tipo i (6,6%), 4 casos tipo ii (5,3%), 22 casos tipo iii (29,3%) y 44 casos tipo iv (58,6%). Para la estadificación definitiva del tumor utilizamos la clasificación TNM de la UICC34.
Veinte pacientes se consideraron inoperables (criterios de inoperabilidad en la tabla 1). Se realizó resección del tumor (RT) en 29 de los 55 pacientes a los que se les practicó intervención quirúrgica, 11 fueron irresecables sin diseminación del tumor, por lo que se incluyeron en lista de espera para TH, y 15 pacientes irresecables con diseminación tumoral quedaron con tratamiento paliativo (tabla 1).
Criterios de inoperabilidad (n=20) y de irresecabilidad (n=15) en el tumor de Klatskin
| Inoperables (20 pacientes) | |
| Edad avanzada y taras orgánicas del paciente | 8 casos |
| Fallo multiorgánico | 4 casos |
| Metástasis a distancia | 4 casos |
| Hemorragia digestiva alta¿ | 1 caso |
| Complicaciones del drenaje radiológico¿¿ | 2 casos |
| Rechazo de tratamiento por paciente | 1 caso |
| Irresecables (15 pacientes). Consideración de enfermedad localmente avanzada por parte del cirujano | |
| Invasión arterial y portal | 4 casos |
| Invasión ganglionar retroperitoneal y mesentérica | 5 casos |
| Metástasis hepáticas bilaterales | 3 casos |
| Carcinomatosis peritoneal | 3 casos |
El grupo de pacientes en los que no se resecó el tumor está constituido por 35 pacientes (20 inoperables y 15 irresecables), y el grupo donde el tumor pudo resecarse está constituido por 40 pacientes: 29 con RT y 11 con TH.
Método estadístico. Se calcularon las tasas y curvas de supervivencia mediante el método de Kaplan-Meier y el test log-rank. Los datos de supervivencia de cada grupo se resumen mediante sus tasas de supervivencia a 1, 3 y 5 años con sus intervalos de confianza del 95%. Los posibles factores pronósticos de supervivencia se evaluaron con el modelo de regresión por riesgo proporcional de Cox. Presentamos los resultados de los factores pronósticos de supervivencia, seleccionados con la razón de riesgo de cada categoría (odds ratio) y su intervalo de confianza del 95%; se consideró estadísticamente significativa una p<0,05.
ResultadosPacientes sin resección tumoral (n=35)En los casos inoperables (n=20), la vida media fue de 6±2 meses (rango: 1–14 meses). En el primer mes de ingreso fallecieron 7 pacientes (35%) por complicaciones y los 13 pacientes restantes fallecieron por enfermedad neoplásica avanzada. Ningún paciente recibió quimiorradioterapia. En los casos considerados irresecables (n=15) la vida media fue de 9±2 meses (rango: 1–30 meses); fallecieron 2 pacientes tras la cirugía debido a fallo multiorgánico. Cinco pacientes recibieron quimioterapia (gemcitabina), de los que sólo 2 pacientes vivieron durante 16 y 30 meses.
Pacientes con resección del tumor (n=40)Grupo TH (n=11). A todos se les había realizado una laparotomía con intento de resección, y el cirujano consideró que no podía conseguir la resección R0 por la extensión biliar intrahepática. En ningún caso se detectó diseminación del tumor. El tiempo medio de espera fue de 2 meses (rango: 1–4 meses), y dos pacientes recibieron quimioterapia con gemcitabina durante la espera. La técnica consistió en la resección en bloque de toda la vía biliar principal hasta su entrada al páncreas, resección distal al tumor de la vena porta y de la arteria hepática. Se realizó linfadenectomía amplia del hilio hepático y la arteria hepática. En todos los casos, las biopsias intraoperatorias del extremo distal del colédoco y de los ganglios del hilio hepático fueron negativas. En ningún caso existió invasión de la vena cava inferior, por lo que en 2 pacientes se realizó técnica clásica y en los 9 pacientes restantes se realizó la técnica de piggy-back. La reconstrucción biliar se realizó mediante hepaticoyeyunostomía en Y de Roux. Dos pacientes presentaron invasión ganglionar positiva (N1) en la anatomía patológica definitiva (tabla 2). Ningún paciente recibió quimioterapia ni radioterapia postoperatoria. No hubo mortalidad postoperatoria (primer mes). La resección R0 se consiguió en todos los casos. La vida media fue de 60±17 meses (rango: 12–122 meses), y fallecieron 7 pacientes en el seguimiento, todos por enfermedad tumoral: 5 por recidiva abdominal del tumor (a los 12, 16, 19, 43 y 46 meses), uno por metástasis pulmonares (a los 12 meses) y uno por un tumor de novo abdominal (tumor indiferenciado de origen linfomatoso a los 122 meses). Viven 4 pacientes durante 96, 72, 39 y 12 meses, respectivamente.
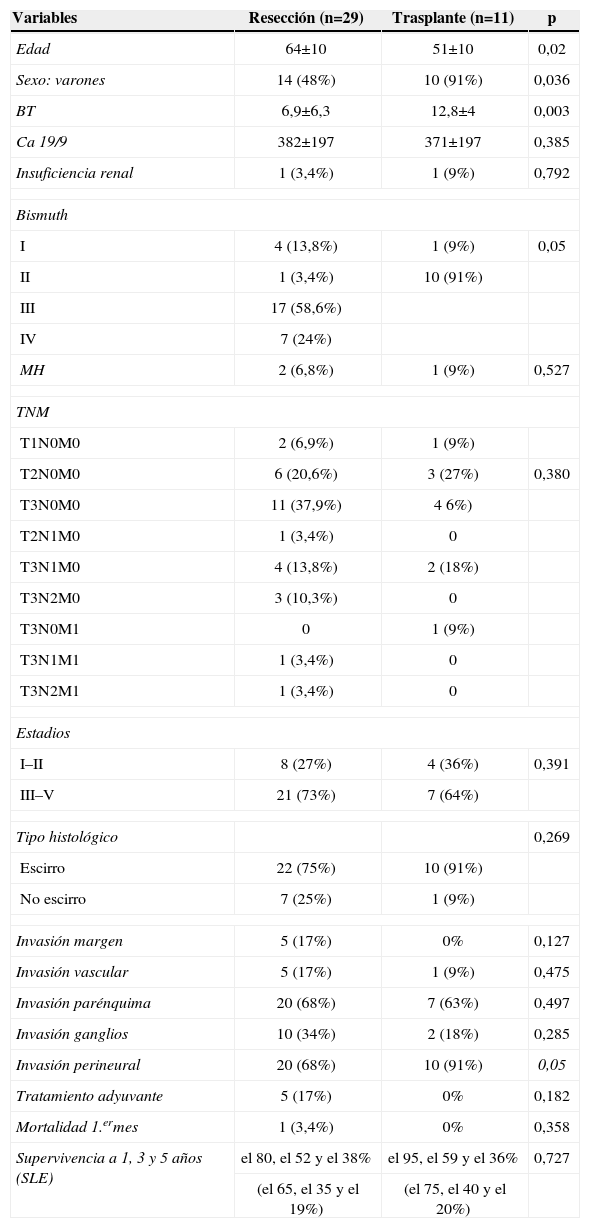
Características de los pacientes con resección del tumor y trasplante hepático
| Variables | Resección (n=29) | Trasplante (n=11) | p |
| Edad | 64±10 | 51±10 | 0,02 |
| Sexo: varones | 14 (48%) | 10 (91%) | 0,036 |
| BT | 6,9±6,3 | 12,8±4 | 0,003 |
| Ca 19/9 | 382±197 | 371±197 | 0,385 |
| Insuficiencia renal | 1 (3,4%) | 1 (9%) | 0,792 |
| Bismuth | |||
| I | 4 (13,8%) | 1 (9%) | 0,05 |
| II | 1 (3,4%) | 10 (91%) | |
| III | 17 (58,6%) | ||
| IV | 7 (24%) | ||
| MH | 2 (6,8%) | 1 (9%) | 0,527 |
| TNM | |||
| T1N0M0 | 2 (6,9%) | 1 (9%) | |
| T2N0M0 | 6 (20,6%) | 3 (27%) | 0,380 |
| T3N0M0 | 11 (37,9%) | 4 6%) | |
| T2N1M0 | 1 (3,4%) | 0 | |
| T3N1M0 | 4 (13,8%) | 2 (18%) | |
| T3N2M0 | 3 (10,3%) | 0 | |
| T3N0M1 | 0 | 1 (9%) | |
| T3N1M1 | 1 (3,4%) | 0 | |
| T3N2M1 | 1 (3,4%) | 0 | |
| Estadios | |||
| I–II | 8 (27%) | 4 (36%) | 0,391 |
| III–V | 21 (73%) | 7 (64%) | |
| Tipo histológico | 0,269 | ||
| Escirro | 22 (75%) | 10 (91%) | |
| No escirro | 7 (25%) | 1 (9%) | |
| Invasión margen | 5 (17%) | 0% | 0,127 |
| Invasión vascular | 5 (17%) | 1 (9%) | 0,475 |
| Invasión parénquima | 20 (68%) | 7 (63%) | 0,497 |
| Invasión ganglios | 10 (34%) | 2 (18%) | 0,285 |
| Invasión perineural | 20 (68%) | 10 (91%) | 0,05 |
| Tratamiento adyuvante | 5 (17%) | 0% | 0,182 |
| Mortalidad 1.ermes | 1 (3,4%) | 0% | 0,358 |
| Supervivencia a 1, 3 y 5 años (SLE) | el 80, el 52 y el 38% | el 95, el 59 y el 36% | 0,727 |
| (el 65, el 35 y el 19%) | (el 75, el 40 y el 20%) | ||
BT: bilirrubina total; MH: metástasis hepáticas; SLE: supervivencia libre de enfermedad.
Grupo RT (n=29). En 4 de ellos (13%) se realizó una resección local del tumor, todos Bismuth I, con resección completa de la vía biliar principal y hepaticoyeyunostomía en Y de Roux a los 2 hepáticos (tabla 2). En 25 casos (87%) se asoció hepatectomía con resección del caudado en todos los casos: izquierda en 18 casos, derecha en 4 casos y derecha ampliada en 3 casos. En todos los casos, la reconstrucción se realizó a 2 o 3 radicales biliares, todos ellos tutorizados. En todos los pacientes se asoció linfadenectomía del hilio hepático y tronco celíaco, y en 2 casos se asoció linfadenectomía retroperitoneal. Siete pacientes presentaron invasión ganglionar en hilio, 3 pacientes presentaron invasión ganglionar retroperitoneal y dos pacientes presentaron metástasis hepáticas en el lóbulo izquierdo que fue resecado (tabla 2). En 5 pacientes, con invasión de vena porta, se realizó resección de toda la circunferencia de la porta con anastomosis terminoterminal o resección parcial con plastia de ésta. Cinco pacientes recibieron quimioterapia postoperatoria (5-fluoruracilo) más radioterapia externa. La vida media fue de 49±8 meses (rango: 1–78 meses). Una paciente (3,4%) falleció a los 2 meses por sepsis biliar y fallo multiorgánico.
En el seguimiento, han fallecido por recidiva tumoral 13 pacientes (44%) (los 4 con resección local del tumor y 9 de los 25 pacientes restantes con resección hepática). Viven, por tanto, 16 pacientes, 2 con recidiva de la enfermedad en tratamiento actual con quimioterapia.
Comparaciones entre gruposEn el grupo TH, la edad media fue inferior (p<0,02), la BT fue superior (p<0,003) y el Bismuth IV fue más frecuente (p<0,05) que en el grupo RT (tabla 2).
Los pacientes inoperables (n=20) presentaron una supervivencia a 1 año del 27 y del 0% a los 2 años. Los pacientes irresecables diseminados que no recibieron TH (n=15) presentaron una supervivencia del 28% al año y del 12% a los 2 años, muy inferior a la obtenida por los pacientes irresecables que recibieron TH (p<0,001). Los pacientes con TH presentaron una supervivencia del 95, el 59 y el 36% con una supervivencia libre de enfermedad del 75, el 40 y el 20%, y los pacientes con RT (n=29) presentaron una supervivencia del 80, el 52 y el 38% a 1, 3 y 5 años, con una supervivencia libre de enfermedad del 65, el 35 y el 19%, sin diferencias estadísticas respecto al grupo TH (fig. 1).
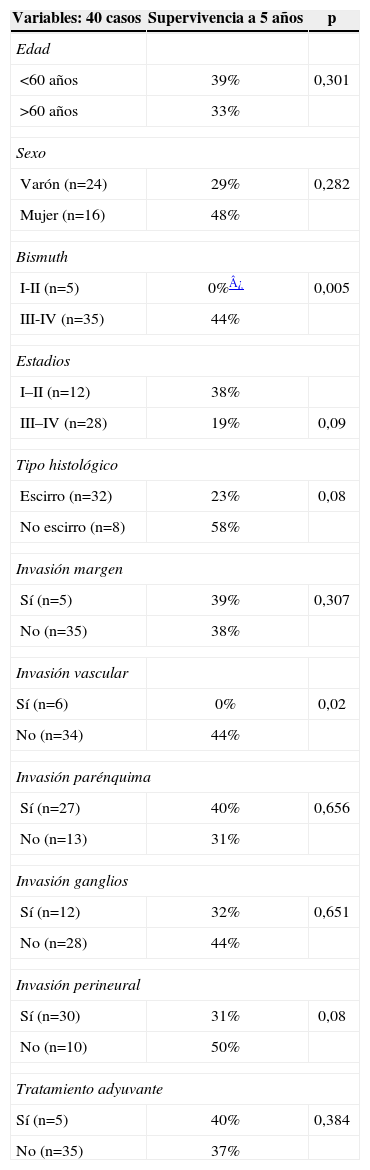
Factores pronósticos de supervivencia en pacientes resecados (n=40) (tabla 3)Los pacientes Bismuth I y II (p<0,005) y la invasión vascular (p<0,02) fueron factores de mal pronóstico de supervivencia (los Bismuth I-II, posiblemente relacionados con la realización de una resección local del tumor). Los estadios avanzados estuvieron cerca de la significación estadística de mal pronóstico, ya que presentaron peor supervivencia a 5 años que los precoces (el 19 versus el 38%), los tipos histológicos escirros (el 23 versus el 58%) y la invasión perineural (el 31 versus el 50%).
Análisis univariante de los factores de mal pronóstico de supervivencia en los pacientes con resección del tumor (resecados y trasplantados) (n=40)
| Variables: 40 casos | Supervivencia a 5 años | p |
| Edad | ||
| <60 años | 39% | 0,301 |
| >60 años | 33% | |
| Sexo | ||
| Varón (n=24) | 29% | 0,282 |
| Mujer (n=16) | 48% | |
| Bismuth | ||
| I-II (n=5) | 0%¿ | 0,005 |
| III-IV (n=35) | 44% | |
| Estadios | ||
| I–II (n=12) | 38% | |
| III–IV (n=28) | 19% | 0,09 |
| Tipo histológico | ||
| Escirro (n=32) | 23% | 0,08 |
| No escirro (n=8) | 58% | |
| Invasión margen | ||
| Sí (n=5) | 39% | 0,307 |
| No (n=35) | 38% | |
| Invasión vascular | ||
| Sí (n=6) | 0% | 0,02 |
| No (n=34) | 44% | |
| Invasión parénquima | ||
| Sí (n=27) | 40% | 0,656 |
| No (n=13) | 31% | |
| Invasión ganglios | ||
| Sí (n=12) | 32% | 0,651 |
| No (n=28) | 44% | |
| Invasión perineural | ||
| Sí (n=30) | 31% | 0,08 |
| No (n=10) | 50% | |
| Tratamiento adyuvante | ||
| Sí (n=5) | 40% | 0,384 |
| No (n=35) | 37% | |
La mayoría de los autores consideran el TH contraindicado en el TK debido a los malos resultados publicados, a pesar de conseguir una mayor resecabilidad18, que en nuestra serie35,36 fue del 100%, mientras que en la serie de Hidalgo et al37 fue del 75%. Algunos autores, al buscar una mayor resecabilidad R0, asocian al TH una DPC18, e incluso Starlz et al19,20 extienden la resección a órganos vecinos (cluster transplantation).
Los malos resultados se relacionan con una elevada recidiva tumoral, que ocurre entre el 56 y el 96% de los pacientes21–26,35–37, generalmente abdominal, que se relaciona con la inmunosupresión que favorece la diseminación de los restos tumorales que pudiesen quedar inadvertidos y con una mala selección de los pacientes, ya que el TH se indica en tumores que en principio se consideraron no diseminados pero que en el estudio histológico del explante existía invasión ganglionar, arterial, portal y diseminación peritoneal. Por tanto, en las series de TH en el TK, la supervivencia a 5 años oscila entre el 0 y el 38%21–26,35–37 y con mayor intensidad (cluster transplantation) no supera el 38%19,20.
A pesar de los malos resultados, se demostró que algunos pacientes con TH presentaron supervivencias prolongadas. Así, en la serie española35, con una mortalidad postoperatoria del 8,3%, recogimos 36 TH por TK con una supervivencia a 5 años del 30%. Sin embargo, en los estadios precoces (estadios i-ii) fue del 47%, mientras que en estadios iii-iv fue tan sólo del 15%, resultados similares a los obtenidos en este estudio. En un estudio similar, Kaiser et al38 (experiencia de Alemania) comunican 47 pacientes trasplantados por TK, con una mortalidad postoperatoria más elevada (20%), con una supervivencia del 22% a 5 años. Cuando los criterios de selección fueron más estrictos (desde 1998) la supervivencia de los 15 pacientes trasplantados fue del 48% a 5 años (p<0,014).
Algunas series comparan la resección con el TH sin neoadyuvancia. Hidalgo et al37 recogen 106 pacientes con TK, consiguieron la resección en 44 casos y realizaron TH en 12 casos. Entre resección y TH no existieron diferencias en cuanto a sexo, estadios precoces, tamaño tumoral, invasión ganglionar (7 del grupo TH fueron N1), grado de diferenciación, invasión perineural e invasión vascular. Tampoco hubo diferencias en cuanto a supervivencia a 5 años (el 28% con resección frente al 20% con TH). Al igual que en nuestra serie, los pacientes que recibieron TH fueron más jóvenes que los pacientes con resección (p<0,012). Fueron factores de mal pronóstico los estadios iii-iv, las resecciones R1-2, la presencia de invasión ganglionar, la presencia de metástasis hepáticas, los tumores indiferenciados y la invasión vascular. Del mismo modo, Iwatsuki et al39 y nosotros36 tampoco encontramos diferencias de supervivencia entre TH y la RT con resección hepática.
En la actualidad existen datos en la literatura médica que indican que el TK irresecable no diseminado es una buena indicación de TH. En 1993, la Mayo Clinic inicia un protocolo27–31 de tratamiento neoadyuvante con radioterapia externa, quimioterapia y radioterapia interna en colangiocarcinomas i y ii de la clasificación TNM, que fueron irresecables mediante una primera laparotomía. A los 2 meses de acabar la radioterapia se realiza una segunda laparotomía exploradora y, si el tumor está diseminado, se excluye al paciente del estudio. En 200830 comunican 148 pacientes, de los que 90 completaron la neoadyuvancia y el TH; de estos, 71 están vivos y 19 fallecieron (8 por recurrencia del tumor), 19 están en espera de TH y 39 no cumplieron neoadyuvancia por progresión de la enfermedad. La supervivencia a 5 años del grupo fue del 55% y la supervivencia de los trasplantados fue del 71%. Los buenos resultados de este protocolo se relacionan con varios factores: la radioterapia externa e interna (útil para controlar la invasión de la pared y la invasión perineural); la estricta selección de pacientes, ya que todos fueron estadios i–ii, a diferencia de otras series en las que los estadios iii-iv exceden el 40%; la mayoría fueron pacientes jóvenes, y, por último, el porcentaje importante de colangitis esclerosante primaria (CEP) (65%). El tratamiento neoadyuvante fue tan eficaz que en muchos pacientes no encuentran tumor en el hígado explantado (aunque la citología previa al TH había sido positiva). En su serie, fueron factores de mal pronóstico la edad >45 años, el Ca 19/9 >100, la realización de una colecistectomía previa, la existencia de tumor residual >2cm, la invasión perineural y el tiempo de espera >100 días; de ahí la importancia del TH de donante vivo y la aplicación de una puntuación adicional al sistema MELD. Este protocolo tiene el inconveniente de que se asocia a un mayor porcentaje de complicaciones vasculares tardías y a una mayor necesidad de utilización de injertos40, sobre todo cuando se emplea TH de donante vivo. Relacionan esta mayor dificultad con la fibrosis importante que encuentran durante el trasplante en relación con la radioterapia, aunque no afecta a la supervivencia del paciente ni del órgano.
Otros autores como Sudan et al41 y Wu et al42 han reproducido parcialmente estos resultados. Los últimos comunican 6 pacientes con CEP y colangiocarcinoma, con un protocolo de detección precoz similar al de los pacientes de la Mayo Clinic, que recibieron solo radioterapia neoadyuvante al TH con duodenopancreatectomía cefálica, de los que solo uno falleció de causa no tumoral y los 5 restantes están todos vivos más de 5 años.
En un estudio retrospectivo28, la supervivencia a 5 años en el grupo TH con neoadyuvancia fue del 82 frente al 21% en el grupo con RT sin neoadyuvancia. Sin embargo, los 2 grupos no fueron homogéneos, ya que en el grupo de TH28 la edad fue de 48 años frente a los 63 años del grupo RT y todos fueron estadios i-ii, mientras que en el grupo RT el 14% presentaba metástasis hepáticas, el 39% presentaba invasión vascular, el 25% presentaba ganglios positivos en hilio hepático y el 18% presentaba metástasis peritoneales. Además, en el grupo RT sólo realizaron un 38% de resecciones de caudado y el 58% de los pacientes trasplantados tenía un TK sobre una CEP frente al 8% de los pacientes resecados.
En conclusión, igual que otros autores43, consideramos que el TH, indicado en casos muy seleccionados (tumores irresecables por extensión biliar intrahepática y que no están diseminados, que hayan intervenido cirujanos con experiencia en cirugía hepática), consigue una supervivencia superior al tratamiento paliativo en los pacientes con TK irresecable no diseminado. Los protocolos de neoadyuvancia, la estadificación correcta, la prioridad en lista de espera de TH y el TH de donante vivo también pueden contribuir a la mejora de los resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.