Un número importante de pacientes con infección intraabdominal desarrollan estados avanzados de la infección y la mortalidad es todavía superior al 20%. El fracaso es multifactorial y se relaciona con el incremento de resistencias bacterianas, el tratamiento empírico inapropiado, la mayor comorbilidad de los pacientes y el mal control del foco de infección. Estas guías analizan cada uno de estos problemas y proponen medidas para evitar el fracaso, basadas en la major evidencia científica actual.
A significant number of patients with abdominal infection develop advanced stages of infection and mortality is still above 20%. Failure is multifactorial and is associated with an increase of bacterial resitance, inappropriate empirical treatment, a higher comorbidity of patients and poor source control of infection. These guidelines discuss each of these problems and propose measures to avoid the failure based on the best current scientific evidence.
A pesar de la mejora del conocimiento de la fisiopatología de la infección grave, de las pruebas diagnósticas, el tratamiento antibiótico, los cuidados perioperatorios y la técnica quirúrgica, todavía un porcentaje relevante de pacientes afectos de infección intraabdominal (IIA) desarrollan estadios avanzados de infección y precisan el ingreso en las Unidades de Cuidados Intensivos (UCI). En este contexto, la mortalidad es del 23%1, sobre todo en los pacientes de más edad, con mayor comorbilidad y aquellos diagnosticados en las fases más avanzadas de la infección.
En la década de 1990, asistimos al desarrollo y consolidación de nuevos antibióticos que mejoraron el pronóstico de los pacientes con IIA. En este sentido, la asociación de β-lactámicos con inhibidores de β-lactamasas como tazobactam, permitió recuperar el espectro de las ureidopenicilinas para el tratamiento de la infección mixta en el paciente grave. Sin embargo, el uso continuado de los β-lactámicos de amplio espectro ha favorecido el desarrollo de resistencias, dificultando la correcta adecuación del tratamiento antibiótico empírico y comprometiendo el pronóstico de los pacientes.
El presente manuscrito refleja la opinión contrastada de un conjunto de especialistas implicados en el tratamiento de los pacientes con IIA atendidos en los servicios de urgencias y en las salas de cirugía, y que precisan del tratamiento antibiótico y quirúrgico de forma precoz. Estas recomendaciones quieren resaltar que el éxito del tratamiento de la IIA es multifactorial, y que la mejor pauta antibiótica puede fracasar si el control del foco de la infección es deficiente o difícil de conseguir. Además, se enfatiza en el concepto de que el tratamiento antibiótico adecuado no sólo se refiere a su actividad frente a la flora causante de la IIA, sino también al inicio lo más precoz posible y a la dosificación adecuada. La elección del antibiótico debe tener en cuenta también el mejor perfil farmacocinético-farmacodinámico en función de la situación hemodinámica del paciente y la duración, con objeto de retardar la aparición de resistencias y no comprometer el tratamiento de futuros pacientes.
El profesional responsable de los pacientes afectos de IIA debe ser capaz de identificar la gravedad de la infección y, en función de los factores de riesgo del enfermo, elegir el mejor tratamiento posible. El uso excesivo de antibióticos en espectro y duración sin tener en cuenta estos preceptos, puede conducirnos a un modelo de atención poco sostenible en un entorno amenazado por la escasez en la investigación y en el de sarrollo de nuevos antimicrobianos necesarios para enfrentarse a la aparición de patógenos resistentes a los antimicrobianos actuales2.
El panel justifica la realización de las nuevas recomendaciones por la necesidad de elaborar un documento que, mediante una mayor comprensión del problema, ayude a la mejora del tratamiento global de la IIA y aporte credibilidad a los servicios asistenciales implicados en su gestión. Además, el documento quiere hacer entender el entorno de su aplicación, atendiendo a los diversos grados de gravedad y a los diferentes agentes implicados, para que se realice dentro del proceso asistencial y no se utilice sólo como un apunte ocasional.
Metodología del consensoEl panel del consenso ha considerado que el tratamiento antibiótico empírico del paciente con IIA, debe tener en cuenta los siguientes puntos:
- 1.
Definición de los diferentes tipos, ámbito y gravedad de la IIA.
- 2.
Definición de los factores de riesgo de mala evolución, que se han clasificado en:
- •
Inadecuación del tratamiento antibiótico empírico y factores de riesgo de IIA producida por patógenos resistentes al tratamiento antibiótico empírico.
- •
Factores relacionados con la presencia de co-morbilidad significativa asociada del paciente con IIA.
- •
Factores en relación con el control de foco deficiente.
- •
- 3.
Conceptos básicos de farmacodinamia y farmacocinética útiles en la adecuación del tratamiento antibiótico empírico de la IIA.
- 4.
Conceptos de precocidad, duración y rescate del tratamiento antibiótico.
El panel ha discutido los principales puntos en base a la evidencia disponible. En las situaciones en las que ha existido controversia, se ha realizado una votación prevalenciendo el criterio de la mayoría simple.
Tipos de infección intraabdominalEl término de IIA se refiere al proceso infeccioso que bien afecta a la pared de las vísceras huecas o progresa más allá de sus límites, alcanzando el compartimento peritoneal. En las presentes recomendaciones se prescinde del término IIA complicada y se evalúa la gravedad de la infección en función de la extensión de la misma, la repercusión sistémica y los factores de riesgo de fracaso terapéutico. Los principales tipos de IIA son la peritonitis y los abscesos intraabdominales.
La peritonitis primariaSe define como la infección peritoneal, generalmente monomicrobiana, en la que no se ha documentado una alteración macroscópicamente visible de la integridad del tracto gastrointestinal. La forma más frecuente es la peritonitis espontánea asociada a enfermedad hepática avanzada (ascitis infectada), seguida de la infección en pacientes tratados con diálisis peritoneal. Generalmente, la administración de antibióticos es suficiente para tratar este tipo de IIA. A pesar de que los pacientes que sufren cuadros, como la peritonitis estreptocócica, pueden ser diagnosticados gracias a la lapa-rotomía exploradora, las presentes recomendaciones no están dirigidas a clarificar el tratamiento antibiótico de esta entidad.
La peritonitis secundariaLa peritonitis debida a la perforación de una víscera hueca es el tipo de IIA que con mayor frecuencia atiende el cirujano. La flora causante es generalmente mixta (cocos grampositivos, enterobacterias y microorganismos anaerobios). En este tipo de IIA, además del tratamiento antibiótico empírico, se debe asociar a algún gesto (quirúrgico o mínimamente invasivo) para reducir y controlar el inóculo bacteriano (control del foco de la IIA).
La peritonitis terciariaSe define como la infección intraabdominal «posinfección» y suele afectar a pacientes sometidos a procedimientos quirúrgicos repetidos, ingresados en la UCI y en los que frecuentemente coexisten infecciones a distancia (infección respiratoria, sepsis por catéter y urinaria). Los patógenos causantes de la infección son típicamente nosocomiales predominando cocos grampositivos resistentes (Staphylococcus coagulasa-negativo y Enterococcus spp.), Candida spp. y bacilos gramnegativos no fermentadores. Sin embargo, este tipo de infección, gravada de una alta mortalidad, debe diferenciarse de la infección persistente y/o recurrente que se observa en el paciente tratado por IIA en el que el control del foco ha sido insuficiente o ha presentado fracaso terapéutico por inadecuación del tratamiento antibiótico empírico inicial.
Abscesos intraabdominalesLa disposición y dinámica de los fluidos del compartimento peritoneal persigue la eliminación y acantonamiento de la infección peritoneal diseminada. El reconocimiento de los patrones moleculares bacterianos por los receptores de los macrófagos peritoneales inicia el reclutamiento de leucocitos y monocitos en la cavidad peritoneal, favoreciendo la eliminación del inóculo bacteriano. La respuesta inflamatoria estimula la cascada de la coagulación y la formación de fibrina cuya misión es el secuestro y acantonamiento bacteriano, además de limitar la contaminación bacteriana. Teleológicamente, la formación de los abscesos intraabdominales representa la respuesta adecuada del huésped inmunocompetente, contrariamente a lo que ocurre en el paciente con peritonitis terciaria en la que la IIA está mal localizada.
Microbiología de la infección intraabdominal: comunitaria y nosocomialEn la IIA de origen comunitario predominan los bacilos gramnegativos, con Escherichia coli a la cabeza (25–30%), seguido a distancia de Klebsiella spp. y Pseudomonas aeruginosa (3–6%). Los microorganismos anaerobios, fundamentalmente del grupo Bacteroides fragilis ocupan el tercer lugar en orden de frecuencia de los cultivos microbiológicos (8,6–14,3%)3–5. Los cocos grampositivos también son relevantes en la IIA, destacando los Streptococcus spp. (16%), Staphylococcus spp. (5,2%) y en menor medida, Enterococcus spp. (4,7%), fundamentalmente Enterococcus faecalis.
En la IIA de inicio nosocomial, principalmente peritonitis y abscesos posoperatororios, E. coli sigue siendo la enterobacteria más frecuentemente implicada (22%)6 junto a Enterobacter spp. (12%)7. La frecuencia de aislamiento de B. fragilis (5,5%) es menor que en la IIA comunitaria y la presencia de Enterococcus spp. es más elevada (17%)6,7 incluyendo a Enterococcus faecium. La prevalencia de bacilos gramnegativos no fermentadores (P. aeruginosa) es sólo discretamente superior a la IIA comunitaria, sin embargo presenta un patrón de resistencias mayor8–10.
Tanto en la IIA comunitaria como nosocomial, la incidencia de cultivos peritoneales positivos para Staphylococcus aureus resistentes a la meticilina (SARM) y Enterococcus spp. resistente a la vancomicina, es por ahora anecdótica11.
Independientemente del origen de la IIA, es importante resaltar que uno de los factores determinantes de la especie y el fenotipo de sensibilidad antibiótica de la flora causante, está en función, entre otros aspectos, del tratamiento antibiótico previo. Así, en pacientes con peritonitis posoperatoria (paradigma de la IIA nosocomial) que habían recibido cobertura antibiótica previa a la reintervención, se ha observado que presentaban cultivos positivos para microorganismos con un patrón de resistencia muy elevado, como E. coli y Klebsiella spp. resistentes a los β-lactámicos (productores de β-lactamasas), SARM, Acinetobacter spp., E. faecium y Candida spp., entre otros.
Evaluación de la gravedad de la infección intraabdominalEvaluación clínica de la gravedad de la infección intraabdominalEl inicio precoz del tratamiento antibiótico adecuado, en función de la gravedad del paciente, se ha asociado a un mejor pronóstico de la infección grave12,13. Así pues, se precisan medios de valoración de la gravedad sensibles y de fácil y rápida obtención para que los pacientes puedan beneficiarse precozmente del tratamiento antibiótico más adecuado.
Entre los sistemas de puntuación más empleados en la evaluación de la gravedad de pacientes sépticos destacan los utilizados en el ámbito de la UCI, como son el APACHE II y el SOFA. El APACHE II14, ha sido validado como predicción de mortalidad al ingreso en la UCI o en la reanimación posoperatoria. El SOFA permite la graduación de la alteración de seis órganos o sistemas y la evaluación continuada ha demostrado ser útil en la valoración del pronóstico de los pacientes quirúrgicos15. Sin embargo, para el diagnóstico de gravedad del paciente con IIA parece más conveniente la evaluación mediante puntuaciones de fácil obtención, al pie de la cama del paciente en el servicio de urgencias o en la sala de hospitalización.
Hasta la fecha, y a pesar de las críticas recibidas, la clasificación más útil por su simplicidad y fácil aplicación ha sido la del síndrome de respuesta inflamatoria sistémica (SIRS).h Los criterios publicados por Bone et al16 han demostrado su utilidad en la identificación de la sepsis grave y el shock séptico, observándose una buena correlación con el porcentaje de mortalidad de los pacientes con infección grave17. A pesar de que la clasificación del SIRS adolece de falta de especificidad, la facilidad de obtención y cuantificación de los principales parámetros, ha resistido el embate de sus principales críticos. Así por ejemplo, se ha establecido que el paciente con IIA que presenta dos o más criterios de SIRS, junto a un parámetro de insuficiencia orgánica (hipotensión, oliguria o alteración del estado mental), se clasifica como portador de sepsis grave y constituye el punto de corte para iniciar tratamiento mediante una pauta antibiótica de mayor espectro. Sin embargo, existen datos de que la clasificación de sepsis grave es poco sensible para detectar a todos los pacientes de riesgo. En este sentido, estudios sobre una cohorte de pacientes con infección grave, han demostrado que la mortalidad de los casos que presentaban cuatro criterios de SIRS (17%) era similar a los clasificados en el grupo de sepsis grave (20%)17. También se ha observado que, dada la rápida evolución de la sepsis, algunos parámetros como el recuento leucocitario, pueden no estar presentes cuando el paciente está en tránsito hacia la leucopenia y, consecuentemente, se puede infravalorar la gravedad. Además, estudios iniciales en pacientes con infección grave posoperatoria han puesto de manifiesto que la taquicardia y la taquipnea son parámetros de SIRS más sensibles en las fases precoces de la IIA, mientras que la alteraciones del recuento leucocitario y la fiebre no se manifiestan o lo hacen tardíamente18. Por lo tanto, la clasificación del SIRS es todavía una clasificación útil, pero urge definir parámetros más sensibles y precoces para alertar al clínico que se halla delante de un paciente que está desarrollando un shock séptico e iniciar sin dilación el mejor tratamiento antibiótico para esta situación.
Marcadores biológicosLos marcadores biológicos son sustancias producidas por las células inflamatorias o derivadas del metabolismo celular en respuesta a estímulos inflamatorios, traumáticos o sépticos. El marcador biológico ideal para la valoración del paciente con IIA, debería tener una adecuada relación de sensibilidad/especificidad en la detección de sepsis grave, ser fácilmente cuantificable en plasma y que los cambios de su concentración plasmática fueran sensibles a la curación o a la persistencia de la IIA. Los marcadores que se han demostrado útiles en la clínica son la determinación del ácido láctico, la proteína C reactiva (PCR) y la procalcitonina (PCT).
Ácido lácticoEs un indicador de hipoxia tisular y la presencia de concentraciones superiores a 4mmol/l12 en el contexto de infección, clasifica al paciente en la fase de shock séptico. Además, se ha observado que concentraciones elevadas de lactato (2–4mmol/l) se correlacionan con la mortalidad independientemente del estado hemodinámico del paciente y, por lo tanto, puede detectar la sepsis grave antes del diagnóstico clínico de shock séptico19. La determinación del ácido láctico es de fácil realización y permite conocer la gravedad de los pacientes de forma precoz e iniciar rápidamente el tratamiento antibiótico adecuado20.
Proteína C reactivaLa PCR es una proteína de fase aguda que se produce en el hígado y cuya síntesis es estimulada por la IL-6. A pesar de que se ha considerado un marcador de la respuesta inflamatoria, existen datos que indican una participación activa en la respuesta inmune innata y en la regulación de la respuesta inflamatoria21. La PCR puede detectarse a partir de las 4h del estímulo, alcanzando la concentración máxima entre las 48–72h. Se ha documentado que las concentraciones de PCR son más elevadas en los pacientes con infección que en los que presentan inflamación no séptica22. Además, en pacientes en situación crítica se ha observado que un descenso significativo de los valores de PCR entre el día del ingreso y el 4.º día, pronostica una recuperación completa con una sensibilidad y especificidad del 89 y 79%, respectivamente23. La PCR también ha demostrado ser un marcador de la respuesta al tratamiento antibiótico. Así, los pacientes ingresados en la UCI que responden al tratamiento antibiótico de forma satisfactoria, presentan un descenso más rápido de los valores de la PCR, en tanto que el ascenso de los valores de la PCR a las 48h del inicio del tratamiento antibiótico, predice el fracaso terapéutico con una sensibilidad del 77% y una especificidad del 67%24. Por lo tanto, la PCR cumple los criterios de marcador útil en la clínica: ensayo biológico al alcance del laboratorio medio, reproducible, con una variabilidad aceptable entre individuos y con capacidad de predecir gravedad y respuesta al tratamiento empleado.
ProcalcitoninaLa PCT es un polipéptido precursor de la calcitonina, cuya concentración es prácticamente indetectable en individuos sanos (<0,5ng/ml). Aumenta levemente en relación a infecciones virales y bacterianas localizadas (0,5–2ng/ml), se eleva en forma moderada en el síndrome de respuesta inflamatoria sistémica de origen no infeccioso (5–20ng/ml) y presenta un marcado incremento en infecciones bacterianas sistémicas, donde alcanza concentraciones entre 10 y 1.000ng/ml.
La PCT es fácil de determinar y los cambios de concentración sérica son tempranos, rápidos y se mantienen estables. La PCT se incrementa y aclara rápidamente en respuesta al tratamiento (antibiótico y quirúrgico), se relaciona mejor con la gravedad de la sepsis y parece tener, en comparación con la PCR, una mejor capacidad pronóstica del riesgo de mortalidad posoperatoria. Además, estudios clínicos han observado, a diferencia de la PCR, una menor alteración tras la intervención quirúrgica25,26. Sin embargo, existen datos discordantes que podrían ser la causa de la falta de consolidación en su aplicación clínica generalizada. Así, se ha visto que la sensibilidad en la detección de la persistencia o recidiva de la IIA es inferior a la observada con la PCR27. En estas circunstancias, el clínico precisa de un marcador altamente sensible que alerte del proceso inflamatorio en curso. La falta de especificidad será resuelta con los pro cedimientos diagnósticos adecuados. Además, un metaanálisis reciente no apoya por el momento la aplicación sistemática de la determinación PCT en la diferenciación de la inflamación y la infección28. Sin embargo, un último estudio, en el que se ha evaluado los cambios (cociente) de la concentración de PCT, ha obtenido resultados más esperanzadores26.
Este documento ha incluido en la clasificación de la gravedad de la IIA, la puntuación del SIRS y APACHE y la concentración de lactato venoso (tabla 1). La PCR se recomienda como marcador de evolución, útil en la valoración del fracaso terapéutico y en la duración del tratamiento antibiótico.
Evaluación de la gravedad de la infección intraabdominal
| Infección intraabdominal leve-moderada | Infección intraabdominal grave |
| Presencia de cuatro criterios de SIRS | |
| o | |
| SIRSa con lactato venoso de ≤2mmol/lb | SIRS con fallo de un órgano (sepsis grave), hipotensión que requiere el uso de fármacos vasoactivos (shock séptico) o lactato venoso >de 2 mmol/l |
Entre los factores pronósticos más importantes de la infección grave destacan la adecuación3,29–34 y la precocidad35 del tratamiento antibiótico. Estudios retrospectivos han demostrado que la ventana terapéutica (espacio de tiempo en el que el tratamiento antibiótico podría ser efectivo para contener la IIA antes de que la progresión local y sistémica condicione la biodisponibilidad del antibiótico y el éxito terapéutico) en la IIA puede ser limitada. Se ha observado una mejor evolución en aquellos pacientes en los que el tratamiento empírico fue activo frente a los patógenos que crecieron en las muestras de la intervención índice. La inadecuación del tratamiento antibiótico en la IIA se da en el 13–16% de los casos34,36, observándose una tasa de fracaso terapéutico por resistencia al tratamiento empírico del 11% en la IIA de la comunidad y de alrededor del 30% en las IIA de origen nosocomial37. En estos trabajos la definición de inadecuación del tratamiento se ha establecido basándose en las sensibilidades teóricas y no sobre los resultados del antibiograma específico de cada muestra, por lo que este porcentaje podría ser aún mayor. Otros puntos débiles de los estudios de adecuación del tratamiento antibiótico empírico, son la falta de estratificación de gravedad y la ausencia de información en relación al tiempo en que el cultivo y antibiograma estuvieron disponibles38.
En circunstancias especiales y con un adecuado control del foco inicial, es posible que la persistencia de la IIA debida al fracaso del tratamiento antibiótico inicial pueda solucionarse con un cambio precoz de la antibioterapia, basándose en el contexto epidemiológico del paciente, los resultados de la tinción de Gram y la presunción de las principales causas de infección (rescate del tratamiento antibiótico).
La mayoría de las recomendaciones o guías de tratamiento de la IIA están de acuerdo en la necesidad de tratamiento con antibióticos de amplio espectro cuando hay riesgo de fracaso terapéutico, como son los pacientes con infección grave, los previamente tratados con antibióticos39 y aquellos con comorbilidad importante40. Si bien en las pautas anteriores al empleo de los β-lactámicos asociados a inhibidores de β-lactamasas (p. ej., las combinaciones de cefalosporinas de 3.a generación y metronidazol) el fracaso terapéutico se asociaba a infecciones por E. faecalis.41 o Pseudomonas spp., en la actualidad las causas de persistencia o recidiva de la IIA (a diferencia de las bacteriemias nosocomiales, en las que los fracasos se relacionan con al presencia de Enterococcus spp. resistente a vancomicina, Candida spp. o SARM32) radican en las infecciones por bacterias gramnegativas resistentes, Enterococcus spp. resistente a los β-lactámicos y/o a la infección fúngica.
A continuación se discute la relevancia de los principales patógenos implicados en la inadecuación del tratamiento antibiótico empírico.
Enterobacterias productoras de β-lactamasas de espectro extendido o de AmpCLas β-lactamasas de espectro extendido (BLEE) derivan de las mutaciones de los genes TEM y SHV y afectan a los patógenos principales de la IIA como E. coli y K. pneumoniae. Inactivan a las cefalosporinas, amoxicilina-clavulánico y en grado variable a piperacilina-tazobactam, lo suficiente, sin embargo, para inhabilitar esta combinación para el tratamiento antibiótico empírico de la IIA con riesgo de ser producida por enterobacterias productoras de BLEE. Además, las BLEE inutilizan a aztreonam, monobactámico utilizado en las combinaciones antibióticas en pacientes alérgicos a los β-lactámicos42. Algunos aminoglucósidos (amikacina), los carbapenémicos y tigeciclina son activos frente las enterobacterias productoras de BLEE.
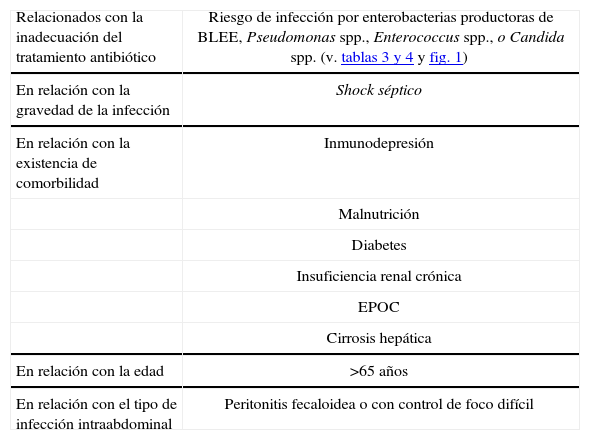
Factores de riesgo de mala evolución en la infección intraabdominal
| Relacionados con la inadecuación del tratamiento antibiótico | Riesgo de infección por enterobacterias productoras de BLEE, Pseudomonas spp., Enterococcus spp., o Candida spp. (v. tablas 3 y 4 y fig. 1) |
| En relación con la gravedad de la infección | Shock séptico |
| En relación con la existencia de comorbilidad | Inmunodepresión |
| Malnutrición | |
| Diabetes | |
| Insuficiencia renal crónica | |
| EPOC | |
| Cirrosis hepática | |
| En relación con la edad | >65 años |
| En relación con el tipo de infección intraabdominal | Peritonitis fecaloidea o con control de foco difícil |
Las prevalencia de β-lactamasas tipo AmpC se incrementa después de la exposición a antibióticos como amoxicilina, cefalosporinas y ureidopenicilinas, y afectan a especies como Enterobacter spp., Serratia spp., Citrobacter spp., Morganella morgagnii y P. aeruginosa. Confieren resistencia a los β-lactámicos asociados a inhibidores de β-lactamasas y a las cefalosporinas de 3.a generación, en tanto que cefepima, aminoglucósidos (sobre todo amikacina), carbapenémicos y tigeciclina mantienen su actividad.
Estudios multicéntricos han documentando un constante incremento de la participación de enterobacterias productoras de BLEE en la IIA. Así, la frecuencia de aislamientos de E. coli y Klebsiella spp. en IIA (comunitaria y nosocomial) ha pasado del 7 y 13% en el 2002 al 12 y 18% en el 2005, res- pectivamente8,43. Sin embargo, estos datos representan la media de una prevalencia muy desigual por continentes. Así por ejemplo, se ha observado una frecuencia de E. coli con BLEE en el 2004 del 6, 3, 12 y 20% para Europa, Estados Unidos, América Latina y Asia, respectivamente8–10. En Europa, la frecuencia más elevada se encuentra en los países del sur y del este44. En España, la frecuencia de BLEE es del orden del 6, 8 y 5% para E. coli, Klebsiella spp. y Enterobacter spp., respectivamente45.
Si hasta hace poco tiempo, las enterobacterias BLEE positivas, en particular por Klebsiella spp. productoras de β-lactamasas del tipo SHV y TEM, se observaban en infecciones nosocomiales, recientemente se ha documentado un incremento de infecciones de origen comunitario (sobre todo en países del sur y del este de Europa) producidas por E. coli con expresión de β-lactamasas del tipo CTX-M44,46,47, debido a la transmisión de elementos génicos móviles (plásmidos) que codifican las resistencias48. Si el arsenal terapéutico que se dispone en la actualidad para el tratamiento empírico de las IIA por enterobacterias productoras de BLEE es ya limitado, existen datos sobre la aparición de carbapenemasas que pueden comprometer la utilidad de los carbapenémicos en el futuro49,50.
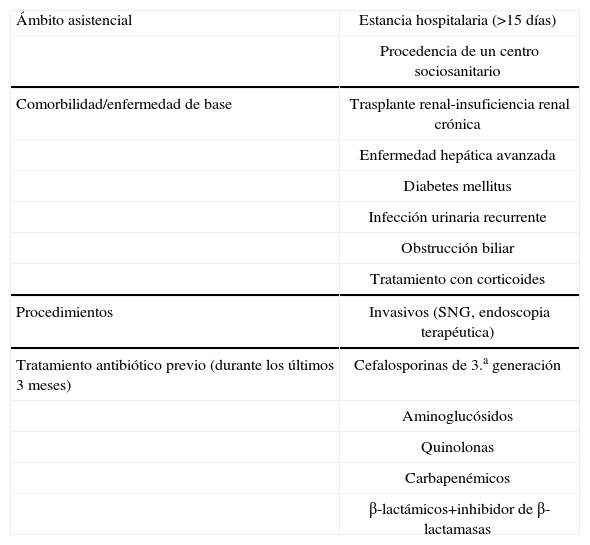
El incremento de las enterobacterias capaces de expresar BLEE en infecciones de la comunidad, complica aún más el diseño de protocolos de tratamiento antibiótico efectivos en la IIA. La prevalencia de la enfermedad y el escaso arsenal terapéutico amenazado por la expresión de nuevos elementos de resistencia en relación a la utilización extensiva de antibióticos de amplio espectro50, hace necesario identificar aquellos pacientes que presentan factores de riesgo de IIA producidas por enterobacterias resistentes y que pueden ser causa de inadecuación del tratamiento antibiótico empírico y fracaso terapéutico. La mayor parte de las pruebas de estos factores de riesgo proviene de estudios realizados en pacientes con bacteriemia51–54, infección urinaria grave55, infección del espacio quirúrgico56 y estudios puntuales de patógenos resistentes al tratamiento antibiótico en las IIA57. Entre los factores de riesgo identificados con mayor frecuencia está el tratamiento antibiótico previo. En este sentido, se ha observado en pacientes en tratamiento con cefalosporinas de 3.a generación o piperacilina-tazobactam una rápida colonización entérica por bacterias resistentes al antibiótico recibido, bien durante el tratamiento (grupo de piperacilina-tazobactam) y hasta 15 días después de finalizar el mismo (grupo de ceftazdima)58. Estos hechos refuerzan el concepto de que la colonización entérica por patógenos resistentes, puede preceder a la IIA y ser causa de inadecuación del tratamiento antibiótico empírico59. En la tabla 3 se recogen los factores de riesgo de colonización por enterobacterias productoras de BLEE.
Factores de riesgo de infección por enterobacterias productoras de BLEE
| Ámbito asistencial | Estancia hospitalaria (>15 días) |
| Procedencia de un centro sociosanitario | |
| Comorbilidad/enfermedad de base | Trasplante renal-insuficiencia renal crónica |
| Enfermedad hepática avanzada | |
| Diabetes mellitus | |
| Infección urinaria recurrente | |
| Obstrucción biliar | |
| Tratamiento con corticoides | |
| Procedimientos | Invasivos (SNG, endoscopia terapéutica) |
| Tratamiento antibiótico previo (durante los últimos 3 meses) | Cefalosporinas de 3.a generación |
| Aminoglucósidos | |
| Quinolonas | |
| Carbapenémicos | |
| β-lactámicos+inhibidor de β-lactamasas |
La emergencia de enterobacterias resistentes añade un factor de gravedad adicional al tratamiento antibiótico de la IIA. Estudios retrospectivos han observado un incremento de la mortalidad en aquellos pacientes con bacteriemia de foco abdominal, en la que crecieron bacilos gramnegativos resistentes al tratamiento empírico60. Así mismo, estudios en pacientes ingresados en la UCI han demostrado que el tratamiento antibiótico inadecuado era más frecuente en los casos de infección nosocomial después de infección comunitaria (45% de los tratamientos inadecuados), observándose una mortalidad del 42%. Es de destacar que un elevado porcentaje de tratamiento inadecuado se relacionó con la presencia de bacilos gramnegativos resistentes (25% de los casos)30. En la misma línea, se ha observado una mayor mortalidad en pacientes en estado crítico con infección por E. coli y Klebsiella spp. resistentes al tratamiento antibiótico habitual61.
El incremento de la resistencia de las especies de enterobacterias8–10 para los antibióticos β-lactámicos (en especial por β-lactamasas del tipo AmpC o BLEE en E. coli y K. pneumoniae y Enterobacter spp.) debe de poner en alerta ante aquellos pacientes que no siguen la evolución esperada o que desarrollan una infección grave.i Así, se ha documentado que los fracasos terapéuticos observados en la IIA grave en pacientes que fueron tratados con la combinación de amoxicilina- clavulánico estaban en relación con enterobacterias como Enterobacter spp., Morganella spp. o Klebsiella spp.62. En este sentido se ha detectado una tasa de resistencia a amoxicilina-clavulánico para E. coli de origen peritoneal de hasta el 25%63. Dado el incremento de las infecciones por bacterias productoras de β-lactamasas, es preciso identificar aquellos pacientes de riesgo de infección por BLEE. Estudios caso-control han observado una mayor incidencia de infecciones por BLEE en pacientes previamente tratados con antibióticos β-lactámicos, aminoglucósidos y quinolonas, y aquellos con una estancia hospitalaria superior a los 15 días51.
En estas circunstancias el tratamiento mediante un carbapenem (imipenem, meropenem o ertapenem) podría ser más seguro30. Sin embargo, el uso indiscriminado de estos podría incrementar la resistencia de P. aeruginosa64,65 o ser inductor también de infecciones por bacterias productoras de BLEE52. Por lo tanto, es preciso utilizar otras familias de antibióticos como las glicilciclinas (tigeciclina) con mecanismos de acción y de resistencias diferentes, que permite diversificar del tratamiento antibiótico empírico de la IIA66,67.
Enterococcus spp.Las principales especies de enterococos que participan en la IIA son E. faecalis (80%) y en menor medida, E. faecium68. Estudios experimentales sobre la fisiopatología de la IIA han demostrado que Enterococcus spp., a diferencia de las enterobacterias y los microorganismos anaerobios, parece que actúa en un «segundo nivel»69. En contraste con S. aureus o Streptococcus pyogenes, Enterococcus spp. no secreta exo-toxinas ni produce superantígenos. Sin embargo, se ha observado que en ciertas circunstancias puede tener capacidad patogénica propia. Los productos de superficie celular que favorecen la adherencia a las válvulas cardíacas y al epitelio urinario y un grupo de proteínas-serinas, podrían incrementar la virulencia de esta bacteria70. Además, dada su resistencia natural a muchos antibióticos, pueden ser seleccionados y proliferar en pacientes debilitados o receptores de un trasplante de órgano sólido71. Esta propiedad podría ser la causante de la aparición de superinfecciones en pacientes con IIA que hayan recibido tratamiento antibiótico con un control del foco deficiente. Así, se ha observado una mayor frecuencia de aislamiento de Enterococcus spp. en la IIA de origen nosocomial7 en comparación con la comunitaria3. Además, la infección enterocócica es causa de fracaso terapéutico en forma de infección incisional o de órgano o espacio, después del tratamiento quirúrgico de la IIA de foco colónico, sobre todo cuando el tratamiento antibiótico empírico inicial no es activo frente a Enterococcus spp. (p. ej., cefotaxima más metronidazol)41.
Estudios randomizados, en donde se han comparado pautas terapéuticas con diferente actividad frente a enterococo, han obtenido resultados dispares. En pacientes con IIA de gravedad moderada, cultivo positivo para enterococo y tratamiento con antibióticos con/y sin actividad enterocócica, se ha observado una tasa de respuesta clínica y erradicación microbiológica similar72,73. Este efecto paradójico, podría ser debido a que, la acción bactericida del antibiótico sobre los patógenos principales de la IIA, dificultaría también el crecimiento de otros menos sensibles como el enterococo en pacientes con una respuesta inmune adecuada74. Otros estudios, en cambio, han mostrado una respuesta clínica menor en aquellos pacientes con cultivo positivo para enterococo y que no recibieron tratamiento específico (63,5 frente a 88,9% en el grupo de ertapenem y piperacilina-tazobactam, respectivamente)75. En estudios en los que se compararon antibióticos con actividad enterocócica limitada, se observó una alta incidencia de cocos grampositivos en relación al fracaso terapéutico76. En el campo de la profilaxis antibiótica, aunque partiendo de premisas fisiopatológicas diferentes, se ha visto un predominio de cocos grampositivos en la infección posoperatoria de colon con el empleo de antibióticos sin actividad enterocócica77. A la espera de nuevos estudios y dado el peor pronóstico de los pacientes con IIA en los que se ha aislado enterococo11, el tratamiento antibiótico con actividad para Enterococcus spp. debe de administrarse a los pacientes con los factores de riesgo mencionados en la tabla 4.
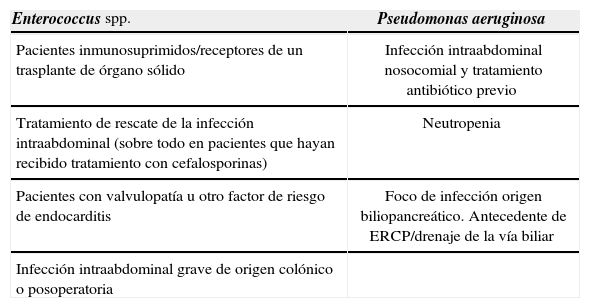
Indicaciones de tratamiento antibiótico activo frente a Enterococcus spp. y/o Pseudomonas aeruginosa en la infección intraabdominal
| Enterococcus spp. | Pseudomonas aeruginosa |
| Pacientes inmunosuprimidos/receptores de un trasplante de órgano sólido | Infección intraabdominal nosocomial y tratamiento antibiótico previo |
| Tratamiento de rescate de la infección intraabdominal (sobre todo en pacientes que hayan recibido tratamiento con cefalosporinas) | Neutropenia |
| Pacientes con valvulopatía u otro factor de riesgo de endocarditis | Foco de infección origen biliopancreático. Antecedente de ERCP/drenaje de la vía biliar |
| Infección intraabdominal grave de origen colónico o posoperatoria |
En la IIA grave, con la consolidación del tratamiento mediante piperacilina-tazobactam y otros β-lactámicos (que proporcionan buena cobertura para E. faecalis), el papel de E. faecium como patógeno implicado en el fracaso terapéutico es ahora más relevante. E. faecium expresa una resistencia intrínseca a los antibióticos β-lactámicos como ampicilina y carbapenémicos, y a quinolonas78. Sólo vancomicina, linezolid, tigeciclina y daptomicina tienen actividad contra E. faecium. En el tratamiento de la infección mixta mediante monoterapia, únicamente tigeciclina mantiene una buena actividad contra la mayoría de E. faecium79,80. Estos antibióticos también son efectivos en las infecciones, todavía poco frecuentes en nuestro medio11, producidas por Enterococcus spp. resistente a vancomicina.
Candida spp.En la práctica, el aislamiento de Candida spp. en el peritoneo (cultivo positivo en cavidad u órgano estéril) debe considerarse una candidiasis grave, aunque todavía no está claro si su presencia en una peritonitis secundaria a perforación gastrointestinal constituye una contaminación o una infección y, por lo tanto, con indicación de tratamiento antifúngico. Candida albicans es la especie más frecuentemente aislada (63%), seguida por C. Parapsilosis (17%)81, C. tropicalis (17%), C. glabrata y C. krusei (menos del 10% las dos últimas)82.
Por su especial capacidad patogénica y condición de levadura oportunista, la participación y causalidad de Candida spp. en la IIA ha sido ampliamente debatida. Candida spp. coloniza con una elevada frecuencia (72%) el paciente quirúrgico83 y se ha encontrado en el 3–8% de las IIA, hallándose con más frecuencia en los cultivos de las IIA de origen nosocomial3,6,7,84. Candida spp. es el quinto patógeno asilado en frecuencia en la UCI85 y se ha identificado como agente causal de infección de herida quirúrgica con una frecuencia del 7%, inferior sólo a la producida por Staphylococcus coagulasa-negativo y Enterococcus spp.86. Además, Candida spp. se ha detectado en abscesos intraabdominales posoperatorios (10% de los aislamientos)87, habiéndose observado una mayor dificultad en el control del foco88. Estudios en la UCI han documentado una incidencia de infección candidiásica del 5,8%84, y una mayor mortalidad en los pacientes que sufren una infección fúngica adquirida en el hospital89. Además, se ha observado una relación entre mortalidad y colonización-infección por Candida spp. (p. ej., 28% en la colonización unifocal, 51% en la multifocal y 58% en la infección candidiásica demostrada)84.
Estudios prospectivos observacionales han demostrado la relevancia y gravedad de la candidiasis peritoneal. En pacientes con candidemia el foco inicial fue peritoneal en el 17% de los casos82, de ellos, el 24% tenían perforación gastrointestinal y el 11% estaban siendo tratado por una pancreatitis grave.
Estudios de caso-control han identificado un buen número de factores de riesgo útiles en la detección de pacientes con IIA con participación relevante de Candida spp., y por lo tanto con indicación de recibir tratamiento empírico antifúngico. Entre los factores más frecuentemente implicados se encuentra el tratamiento antibiótico prolongado, la dificultad del control de foco de la IIA y su adquisición nosocomial6,57,84,81,85. Estudios experimentales han demostrado que la administración de antibióticos con actividad frente a microorganismos anaerobios (piperacilina-tazobactam, metronidazol, y clindamicina) promueve la colonización intestinal por Candida spp.90.
También se ha observado una relación entre el tipo y control de foco de la IIA y la mortalidad de los pacientes infectados por Candida spp. Se ha documentado un porcentaje elevado de fracaso terapéutico en relación al foco gastroduodenal (sobre todo en la IIA nosocomial posoperatoria) y la presencia de Candida peritoneal no cubierta en el tratamiento antibiótico empírico inicial57,89. Este efecto puede ser debido a la presencia de Candida en el estómago del paciente sometido a cirugía gástrica y que presenta una dehiscencia anastomótica con un control de foco difícil de conseguir.
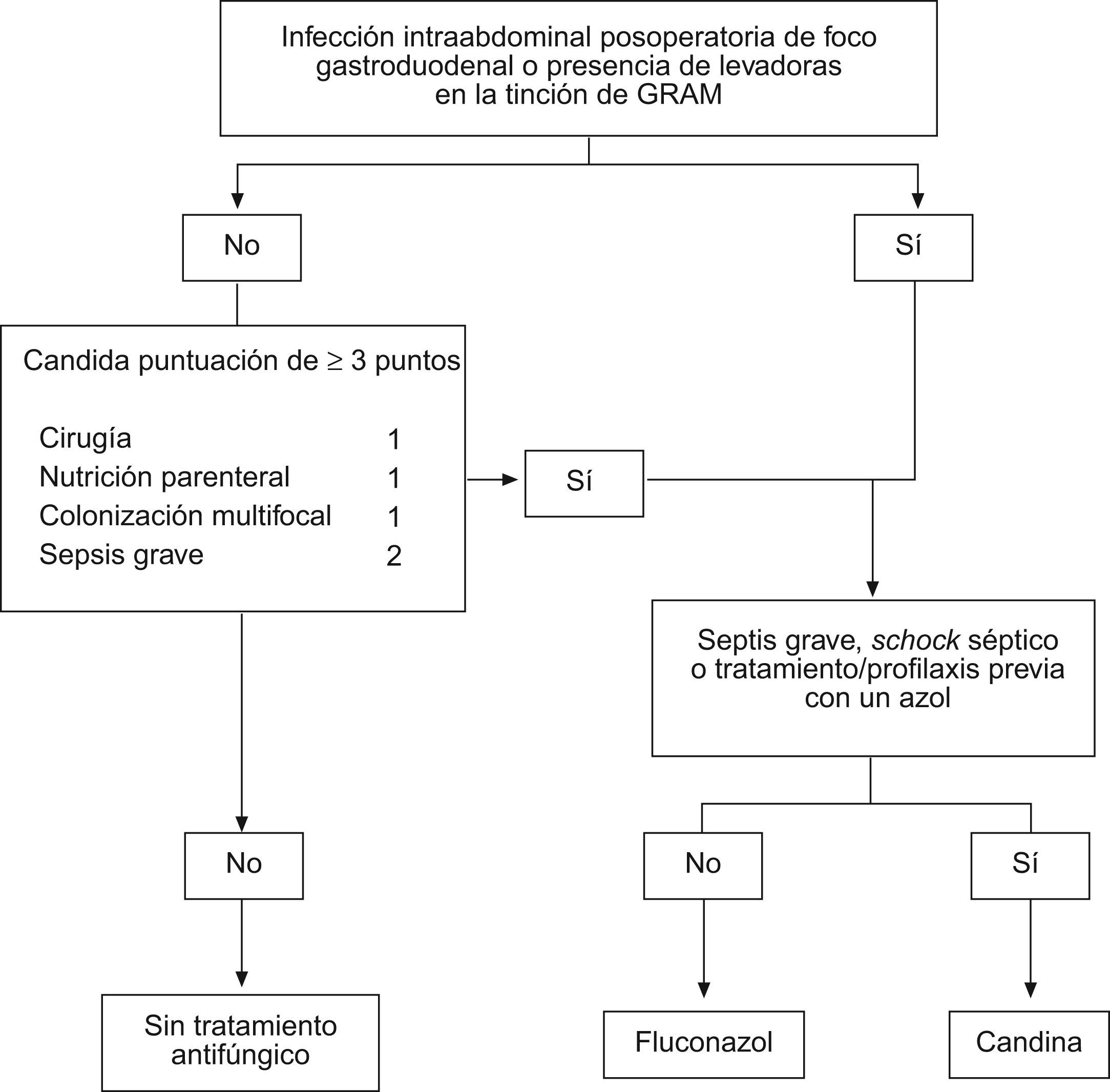
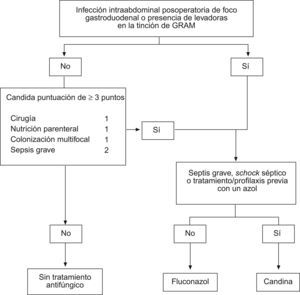
Estudios observacionales recientes han diseñado una puntuación de fácil aplicación y útil para decidir el tratamiento antifúngico empírico en el paciente con sepsis grave84. Una puntuación de ≥3 puntos, obtenida en una fórmula que combina nutrición parenteral total, sepsis grave, cirugía al ingreso de la UCI y colonización multifocal por Candida spp., tiene una sensibilidad del 81% en la detección de pacientes con candidiasis grave demostrada que puede beneficiarse de tratamiento antifúngico empírico precoz. Otro de los factores asociados al pobre pronóstico de los pacientes con candidiasis grave, ha sido el retardo del inicio del tratamiento antifúngico, dado que en la mayoría de los casos se realiza en función del crecimiento de Candida en los cultivos realizados, o como rescate terapéutico en un paciente que no evoluciona satisfactoriamente82,89.
A pesar de estas pruebas, la falta de estudios aleatorizados, ha impedido consolidar el tratamiento antifúngico empírico en los pacientes con IIA de riesgo. Sin embargo, existen guías donde se recomienda el tratamiento empírico antifúngico en pacientes con IIA en los que se evidencia formas compatibles con levaduras en la tinción de Gram del líquido peritoneal91. La disponibilidad de fármacos pocos tóxicos (azoles y equinocandinas) y la posibilidad de suspender el tratamiento si el cultivo no confirma la infección candidiásica, justifica el tratamiento antifúngico empírico precoz sin el necesario cumplimiento de los estrictos criterios de infección invasora92 (fig. 1).
La mayoría de C. albicans son sensibles al fluconzol, sin embargo, la profilaxis o el tratamiento antifúngico previo puede determinar la presencia especies de Candida resistentes (C. krusei, C. glabrata) y ser causa de fracaso terapéutico por tratamiento inadecuado93.
Pseudomonas aeruginosaP. aeruginosa es una bacteria gramnegativa que no fermenta los carbohidratos y crece en ambientes aerobios. Esta bacteria ha sido implicada en procesos como bacteriemias, neumonía, infecciones osteoarticulares, infecciones urinarias e infecciones graves de partes blandas (sobre todo en pacientes quemados)94. El ámbito de su aparición es fundamentalmente nosocomial e incide en mayor medida en pacientes con baja capacidad de respuesta o sometidos a tratamiento invasivos como la diálisis peritoneal en forma de peritonitis primaria. Entre los factores de riesgo más relevantes de bacteriemia por P. aeruginosa se han identificado la adquisición nosocomial, antecedentes de procedimiento invasivo en las 72h precedentes, inmunosupresión, neutropenia y estancia hospitalaria superior a 30 días95 (tabla 4).
El tratamiento antibiótico de las infecciones en las que interviene P. aeruginosa puede ser un reto durante los próximos años. Si en la década de 1990, el tratamiento estaba asegurado mediante cefalosporinas de 3.a generación (ceftazidima), aminoglucósidos, ureidopenicilinas y carbapenémicos, la aparición y transmisión de múltiples mecanismos de resistencia han disminuido de forma preocupante los antibióticos útiles disponibles. Esto alerta sobre la necesidad, en primer lugar de adecuar el tratamiento frente a P. aeruginosa de forma selectiva para evitar que el sobretratamiento y el empleo indiscriminado de antibióticos, hasta ahora efectivos, conduzca a su pérdida de actividad y a inducir resistencias; y en segundo lugar, es preciso una mayor inversión en el desarrollo de nuevas moléculas activas y bien toleradas frente a especies resistentes.
P. aeruginosa ha sido identificada también en los cultivos peritoneales de los pacientes con IIA, sin embargo la cobertura de este patógeno debe ser selectiva. P. aeruginosa es el tercer bacilo gramnegativo más prevalente (9–13%), pero lejos de E. coli. Su importancia es anecdótica en la infección comunitaria (3%)4 y más relevante en la nosocomial(6,7,11). La gravedad del paciente también influye en la presencia de este microorganismo. En una serie en la que el 29,3% de los pacientes hospitalizados sufrían IIA, se observó que P. aeruginosa representó el 5,9% de las bacterias aisladas en los casos de shock séptico ingresados en la UCI13. Estos datos indican que los pacientes con IIA con criterios de shock séptico, deben recibir tratamiento antipseudomónico específico. Estudios observacionales han demostrado que los focos de infección que con más frecuencia se asocian a infección grave por P. aeruginosa (bacteriemia) son los de origen pancreáticobiliar (incluidos los que requieren drenaje biliar), pulmonar (sobre todo en el ambiente de la UCI), urinario y de partes blandas. Sólo en el 4% de las bacteriemias por este microorganismo se documentó un foco peritoneal primario95. No es infrecuente observar que pacientes ingresados en la UCI por IIA presenten coinfección de foco pulmonar. En estos casos, la persistencia o recidiva del cuadro séptico también requerirá tratamiento específico frente P. aeruginosa.
Otro de los factores de riesgo de colonización-infección por P. aeruginosa en el paciente grave es el tratamiento antibiótico previo. Se ha observado una relación entre este hecho y el tratamiento durante los últimos 12 meses con cefalosporinas de 3a generación, quinolonas e imipenem96.
La decisión de tratamiento activo frente a P. aeruginosa debe tener en cuenta la gravedad y el origen de la IIA. Estudios en pacientes con IIA comunitaria y gravedad moderada (APACHE medio de 6), en los que se ha comparado el efecto de imipenem frente a tigeciclina (sin acción contra esta baceria), no observaron diferencias en la tasa de curación clínica y microbiológica en el grupo de pacientes en los que se aisló P. aeruginosa66. Sin embargo, en estudios donde se incluyeron pacientes con IIA posoperatoria (origen nosocomial y más graves), el grupo con tratamiento específico contra P. aeruginosa (piperacilina-tazobactam) presentó una tasa de curación clínica ligeramente superior al grupo que recibió tratamiento sin actividad antipseudomónica (ertapenem), 88,5% frente a 73,1%, respectivamente73. La tabla 4 recoge las principales indicaciones de tratamiento antibiótico activo contra P. aeruginosa en la IIA.
Factores de riesgo del huésped: edad y comorbilidadLos efectos que la IIA produce sobre el huésped están en función de la patogenia de la infección (fundamentalmente foco primario y patógenos responsables), del estado previo del paciente y de la capacidad de respuesta del mismo a la infeción.
La edad del paciente y su comorbilidad, que se han mostrado como factores de riesgo de mala evolución en análisis previos, se han validado en estudios muestrales extensos y forman parte, en la actualidad, de los dos sistemas de puntuación de gravedad mas empleados en la estratificación de pacientes en estudios de IIA: el APACHE II y el índice pronóstico de Manheim (IPM). Las dos puntuaciones se han correlacionado satisfactoriamente con la mortalidad observada97,98, sin que se hayan visto diferencias en su capacidad pre dictiva99.
EdadEstudios de Wacha et al., en relación al IPM, han demostrado que la tasa de mortalidad de los pacientes era significativamente superior a partir de la franja de los 50 años (de aquí que la edad superior a 50 años, ya puntúa en el IPM)98. El APACHE II también tiene una mayor puntuación a partir de los 65 años.
La edad también se ha relacionado como factor de riesgo de infección por patógenos resistentes al tratamiento antibiótico y en consecuencia a un peor pronóstico. Así, se ha observado una relación entre la edad mayor de 60 años y colonización59 o infección por BLEE55, infección por Pseudomonas spp.96 e infección enterocócica68.
Otro factor a tener en cuenta, es la prevalencia de IIA grave por segmentos de edad. Hay un pico de alta incidencia entre los 70 y 80 años, con un 17% en mayores de 80 años100. A pesar de que estudios recientes en pacientes con IIA han observado una mayor mortalidad a partir de la franja de 70 años, el panel de este documento considera factor de riesgo la edad a partir de 65 años, sobre todo en el llamado anciano «frágil».
ComorbilidadInmunosupresión o inmunodeficiencia. Los pacientes receptores de un órgano o sometidos a tratamiento mediante quimioterapia y/o corticoides de forma activa tienen un mayor riesgo de sufrir infecciones por cocos grampositivos multirresistentes y P. aeruginosa101.
Desnutrición. La mayoría de índices de valoración nutricional incluyen parámetros bioquímicos (albúmina) difíciles de obtener en la situación del paciente afecto de una IIA grave. Por ello, se aconseja la aplicación de la valoración subjetiva del estado nutricional (SGA, Subjective Global Assessment) de más fácil aplicación en la situación urgente. La SGA incluye una anamnesis sobre la ingesta calórica y la pérdida ponderal (pérdida del 10% en los últimos 6 meses), el estado del compartimento graso y el estrés metabólico actual. Esta exploración sirve para clasificar al paciente como bien nutrido, moderadamente nutrido o mal nutrido. Así pues, el factor de riesgo de desnutrición se aplicaría en aquellos pacientes con malnutrición moderada o grave en la SGA.
Otros factores. La cirrosis hepática, diabetes mellitus, insuficiencia renal crónica, insuficiencia cardíaca, EPOC grave, y enfermedad neoplásica activa son factores de riesgo de fracaso terapéutico. La causa de esta asociación es multifactorial y comparten una mayor predisposición a la infección por patógenos resistentes, una elevada frecuencia de tratamiento antibiótico previo y un estado de inmunosupresión por tratamientos coadyuvantes y malnutrición11.
Factores en relación al control de focoEl control del foco de la IIA consiste en la eliminación de la fuente de infección y la contención de la contaminación y disminución del inóculo, con la máxima restauración anatómica y funcional posible. Aunque, en general, este tipo de control se ha asociado a intervención quirúrgica, es posible rea lizarlo adecuadamente mediante el drenaje percutáneo, guiado por técnicas de imagen. El tipo de intervención estará en función de la causa de la sepsis intraabdominal, las condiciones locales de la cavidad peritoneal y el estado del paciente. Ante una peritonitis difusa evolucionada y un síndrome séptico establecido (repercusión sistémica grave), lo mejor es practicar una laparotomía abreviada para lograr un drenaje adecuado del foco séptico, obviando gestos quirúrgicos, como nuevas anastomosis intestinales, que prolonguen la intervención y comprometan la evolución posoperatoria del paciente. Este procedimiento permite eliminar la mayor parte de las causas de contaminación con el menor estrés adicional posible para el paciente, objetivo principal de esta fase del tratamiento quirúrgico. Una vez solucionada la IIA grave, se podrán plantear otros tratamientos definitivos.
En estas recomendaciones se considera que el control de foco inadecuado es un factor de gravedad adicional de la IIA y se asocia a una peor evolución. Así por ejemplo, la peritonitis fecaloidea se ha asociado a un peor pronóstico y tiene una puntuación más elevada en el índice de peritonitis de Manheim. En esta situación, puede actuar el efecto inóculo sobre la efectividad del tratamiento antibiótico empleado, incrementándose los valores de concentración mínima inhibitoria (CMI) para ciertos antibióticos betalactámicos (cefalosporinas de 3.a generación). Además, la persistencia del inóculo bacteriano puede favorecer la selección de patógenos resistentes y ser una causa de persistencia recidiva de la IIA.
Conceptos del tratamiento antibióticoIndicaciones del tratamiento antibiótico en la infección intraabdominalEl grupo de la American Surgical Infection Society (SIS-A) identifica aquellas infecciones en las que el tratamiento antibiótico no está justificado más allá de la profilaxis perioperatoria102. La tabla 5 recoge los principales cuadros quirúrgicos en los que el paciente no precisa tratamiento antibiótico convencional más allá de la profilaxis antibiótica, en función del tipo de infección y sobre todo del control del foco primario (intervención precoz y efectiva).
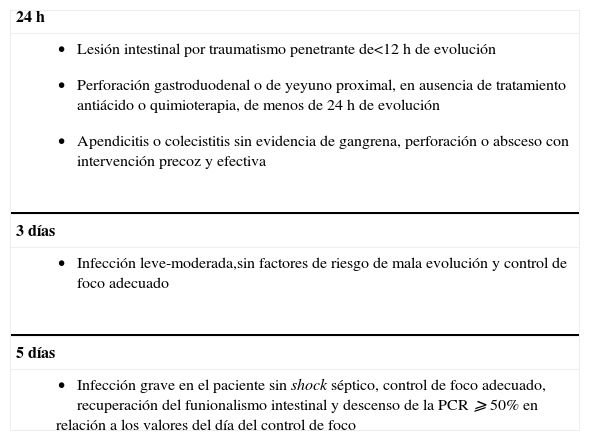
Recomendaciones sobre la duración del tratamiento antibiótico en la infección intraabdominal
| 24h |
|
| 3 días |
|
| 5 días |
|
El tratamiento antibiótico es más efectivo cuando, además de la adecuación a la sensibilidad de los patógenos de la IIA, se inicia de forma precoz. Estudios de cohorte en pacientes con sepsis grave, han demostrado que por cada hora que se retrasa el inicio del tratamiento antibiótico adecuado, se incrementa la mortalidad en un 7,6%13. Así pues, el comienzo precoz del tratamiento antibiótico de la infección grave12,35 puede mejorar el pronóstico de los pacientes con IIA.
Duración del tratamiento antibióticoLa normalización del recuento leucocitario, la apirexia y la recuperación del funcionalismo intestinal, han sido los parámetros empleados clásicamente para decidir la finalización del tratamiento antibiótico en la IIA. A pesar del conocimiento de estas recomendaciones, la media de la duración del tratamiento antibiótico en los pacientes que presentan un buen curso suele exceder los 7 días103. Además, estudios clásicos han demostrado que los parámetros clínicos y biológicos presentan un valor predictivo negativo limitado (curación clínica en ausencia de fiebre o leucocitosis)104. Existen pruebas de que, en el paciente con una respuesta inmune apropiada y después de un control de foco adecuado, el inóculo residual puede responder a un tratamiento antibiótico más breve. Bajo estas circunstancias favorables, la prolongación del tratamiento antibiótico quizás sólo «trate» la inflamación más que la infección, además de favorecer la selección de patógenos resistentes. Por otro lado, es probable que en el paciente que no responde, la prolongación del tratamiento antibiótico no evite el fracaso terapéutico.
Estudios retrospectivos han observado que los pacientes con IIA que recibieron tratamiento durante sólo 5 días, presentaron una incidencia de infección posoperatoria del 5%, no muy diferente de la observada en series históricas. Sin embargo, la cultura del tratamiento «corto» no se ha consolidado y la mayoría de los cirujanos consideran que 7 días es la duración mínima de tratamiento que deben recibir los pacientes con IIA105.
El grupo de Shein estudió, de forma prospectiva la duración óptima del tratamiento antibiótico, estableciendo pautas estrictas en función del tipo de IIA. Los pacientes con IIA grave recibieron antibióticos durante un máximo de 5 días, tuvieran o no fiebre. En los 28 pacientes que siguieron esta pauta sólo se observó la presencia de un absceso subhepático y tres infecciones de herida106. El tratamiento antibiótico de duración fija, podría tener sentido en tanto que se pudiera demostrar que el fracaso terapéutico es inevitable a pesar de la prolongación del tratamiento más allá de los 5 días. En este sentido, estudios aleatorizados en pacientes afectos de IIA de moderada gravedad, en los que se ha comparado la eficacia del tratamiento durante 3 o 5 días, no han demostrado diferencias en la tasa de curación clínica107.
Estudios recientes han demostrado la utilidad de los marcadores biológicos en la evaluación de la respuesta al tratamiento antibiótico. Se ha observado que los pacientes en los que la suspensión del antibiótico se realizó en función de la concentración de la PCR, tuvieron un curso de tratamiento más abreviado que aquellos en los que se aplicaron los criterios clásicos de curación108. Es razonable considerar que en la IIA de gravedad leve-moderada, en el paciente inmunocompetente y con un control de foco adecuado, el tratamiento antibiótico de 3 días de duración es suficiente. En cualquier otra situación, el tratamiento antibiótico puede ser retirado al 5.º día en el paciente estable, con el funcionalismo intestinal recuperado y con un descenso notable de la respuesta inflamatoria (caída de más del 50% de los valores de la PCR en relación a las 48h del control del foco) (tabla 5).
En conclusión, si el cirujano participa de la nueva cultura del mínimo tratamiento efectivo y realiza un adecuado control del foco, la posibilidad de superinfecciones por patógenos seleccionados resistentes disminuirá y se reducirán los efectos adversos de la terapia antibiótica prolongada109 (tabla 7).
Parámetros útiles de farmacocinética/farmacodinamiaLos cambios compartimentales más relevantes durante la sepsis grave son la obtención de energía mediante el incremento de la lipolisis y proteolisis, así como la hipoalbuminemia y expansión del agua extracelular110. Estos cambios pueden influir en los parámetros farmacodinámicos y farmacocinéticos de los antibióticos administrados. Así, los antibióticos hidrofílicos (aminoglucósidos, glucopéptidos) pueden ver limitada su efectividad en el paciente grave con aumento del agua extracelular111. En cambio, antibióticos como tigeciclina o linezolid con un volumen de distribución más elevado (más de 10l/kg y 0,7l/kg, respectivamente), apenas se modifican por la expansión del volumen extracelular. Los antibióticos con una elevada fijación proteica (ertapenem) también pueden ver modificada su vida media y requerir una mayor frecuencia de administración en aquellas situaciones de gravedad que se acompañan de hipoalbuminemia extrema o en pacientes con obesidad112.
Esquema del tratamiento antibótico empírico de la infección intraabdominalEl esquema del tratamiento antibiótico empírico (tabla 6 and 7) tiene en cuenta el origen de la IIA, comunitaria y nosocomial, la gravedad en función de los parámetros de SIRS, APACHE y lactato venoso (tabla 1) y los factores de riesgo de mala evolución (tabla 2). En la IIA nosocomial se ha diferenciado la infección posoperatoria, que incluye también aquella IIA que se origina después de una endoscopia terapéutica, de la IIA persistente o recidivante en la que el factor de riesgo de mala evolución y de fracaso terapéutico que predomina es el tratamiento antibiótico previo.
Tratamiento antibiótico empírico en la infección intraabdominal
| ORIGEN | COMUNITARIA | NOSOCOMIAL | ||
| Tipo | Leve-moderada1 | Grave1 | Posoperatoria (incluye endoscopia terapéutica) | Recidivante-persistente (peritonitis terciaria) |
| SIN FACTORES DE RIESGO DE MALA EVOLUCIÓN2 | Amoxicilina-clavulánico o Cefalosporina 3a + metronidazol o Ertapenem Gentamicina o aztreonam+metronidazol | Piperacilina-tazobactam3±Fluconazol4Tigeciclina3±Fluconazol4 | Meropenem o imipenem3+Linezolid o daptomicina o glucopéptido+Fluconazol o candina4 o Tigeciclina3-5+Ceftacidima o amikacina+Fluconazol o candina4 | |
| CON FACTORES DE RIESGO DE MALA EVOLUCIÓN2 | Ertapenem Tigeciclina | Imipenem3 o Meropenem o Tigeciclina3-5±Fluconazol o candina4 | ||
El signo±indica la posibilidad de tratamiento adicional a las diferentes pautas antibióticas citadas anteriormente.Los caracteres en itálica corresponden al tratamiento antibiótico alternativo cuando el paciente refiere hipersensibilidad a los β-lactámicos.
En pacientes con riesgo de infección por P. aeruginosa o en aquellos que presenten shock séptico es preciso añadir un fármaco antipseudomónico específico como amikacina, ceftazidima o cefepima. Debe contemplarse la administración de colistina en aquellos pacientes tratados previamente con un antibiótico con actividad antipseudomónica y que presenten persistencia o recidiva de la infección intraabdominal.
En pacientes con riesgo de infección intraabdominal en la que puede participar Candida spp. debe añadirse al tratamiento un antifúngico (fluconazol o una candina). Las candinas están indicadas en los pacientes afectos de sepsis grave o shock séptico y en aquellos que han recibido previamente fluconazol.
Puntos críticos del tratamiento antibiótico de la infección intraabdominal
|
|
|
En este tipo de infección son necesarios pocos días de tratamiento antibiótico cuando el foco está controlado y/o la peritonitis no es fecaloidea. El escaso inóculo residual se puede eliminar con el empleo de amoxicilina-clavulánico o la combinación de una cefalosporina de 3.a generación junto a metronidazol. Ertapenem (1g/24h) es un opción para tratamiento en régimen ambulatorio ya que es activo en la infección mixta y tiene vida media larga (tabla 6).
Infección intraabdominal leve-moderada de origen comunitario con factores de riesgo de mala evoluciónLos pacientes incluidos en este apartado tienen riesgo de infección por enterobacterias productoras de BLEE y AmpC por lo que en esta situación, ertapenem (1g/24h) se consiera una buena opción terapéutica (tabla 6).
Infección intraabdominal grave de origin comunitario y posoperatoria sin factores de riesgo de mala evoluciónEn este grupo de pacientes la pauta antibiótica de elección debe ser activa frente a los patógenos principales (enterobacterias, anaerobios y cocos grampositivos). Además, debe abarcar Enterococcus spp. en las infecciones de origen colónico y en la infecciones posoperatorias. El perfil de los patógenos implicados en la IIA posoperatoria (que normalmente ocurre a los pocos días del ingreso hospitalario y sin tratamiento antibiótico intrahospitalario) no difiere demasiado de aquellos afectos de IIA comunitaria grave. Este grupo puede responder a piperacilina-tazobactam para la cobertura enterocócica necesaria en estos enfermos más graves y/o con infección posoperatoria. Ertapenem 1g/12h puede ser una alternativa en los casos de IIA con bajo riesgo de infección enterocócica (tabla 8).
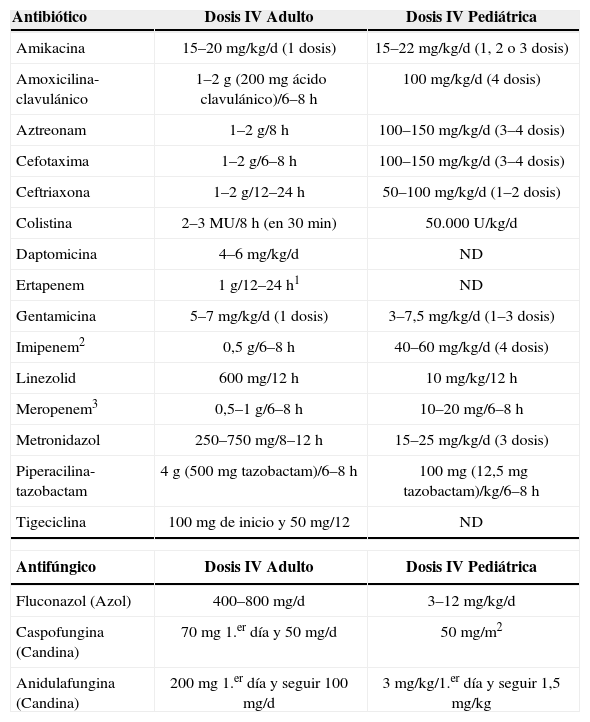
Dosificación de los principales antibióticos empleados en el tratamiento empírico de la infección intraabdominal
| Antibiótico | Dosis IV Adulto | Dosis IV Pediátrica |
| Amikacina | 15–20mg/kg/d (1 dosis) | 15–22mg/kg/d (1, 2 o 3 dosis) |
| Amoxicilina-clavulánico | 1–2g (200mg ácido clavulánico)/6–8h | 100mg/kg/d (4 dosis) |
| Aztreonam | 1–2g/8h | 100–150mg/kg/d (3–4 dosis) |
| Cefotaxima | 1–2g/6–8h | 100–150mg/kg/d (3–4 dosis) |
| Ceftriaxona | 1–2g/12–24h | 50–100mg/kg/d (1–2 dosis) |
| Colistina | 2–3MU/8h (en 30min) | 50.000U/kg/d |
| Daptomicina | 4–6mg/kg/d | ND |
| Ertapenem | 1g/12–24h1 | ND |
| Gentamicina | 5–7mg/kg/d (1 dosis) | 3–7,5mg/kg/d (1–3 dosis) |
| Imipenem2 | 0,5g/6–8h | 40–60mg/kg/d (4 dosis) |
| Linezolid | 600mg/12h | 10mg/kg/12h |
| Meropenem3 | 0,5–1g/6–8h | 10–20mg/6–8h |
| Metronidazol | 250–750mg/8–12h | 15–25mg/kg/d (3 dosis) |
| Piperacilina-tazobactam | 4g (500mg tazobactam)/6–8h | 100mg (12,5mg tazobactam)/kg/6–8h |
| Tigeciclina | 100mg de inicio y 50mg/12 | ND |
| Antifúngico | Dosis IV Adulto | Dosis IV Pediátrica |
| Fluconazol (Azol) | 400–800mg/d | 3–12mg/kg/d |
| Caspofungina (Candina) | 70mg 1.er día y 50mg/d | 50mg/m2 |
| Anidulafungina (Candina) | 200mg 1.er día y seguir 100mg/d | 3mg/kg/1.er día y seguir 1,5mg/kg |
Notas: 1. La dosificación de ertapenem cada 12h esta indicada en pacientes con sobrepeso y en infecciones graves en las que el volumen de distribución puede ser elevado. 2. Imipenem se comercializa unido a cilastatina, un inhibidor de la dihidropeptidasa renal que puede producir toxicidad neurológica (convulsiones). En la insuficiencia renal, la vida media de la cilastatina se alarga más que la del imipenem. 3. Meropenem puede administrarse en bolus, no se asocia a cilastatina, tiene una discreta menor actividad para enterococo con una mejor actividad antipseudomónica.
En los pacientes con foco biliopancreático o con una manipulación reciente de la vía biliar (colangiografía retrógrada endoscópica), el tratamiento debe ser activo frente a P. aeruginos. Puede emplearse un betalactámico antipseudomónico (ceftazidima, cefepima, piperacilina-tazobactam, meropenem o imipenem), asociado o no a amikacina o tobramicina. En la IIA posoperatoria de foco gastroduodenal o de cualquier otro foco, en presencia de Candida en la tinción de Gram del líquido intraabdominal, es conveniente añadir fluconazol o una candina en los casos más graves (fig. 1).
Infección intraabdominal grave de origen comunitario y posoperatoria con factores de riesgo de mala evoluciónEl tratamiento antibiótico debe ser activo frente a los patógenos principales, enterococo y las enterobacterias productoras de β-lactamasas del tipo AmpC o BLEE. Se recomienda el empleo de un carbapenémico (meropenem o imipenem) o tigeciclina. En los casos de sepsis grave o shock séptico o si el paciente presenta factores de riesgo de infección por P. aeruginosa (tabla 4), se aconseja asociar a la tigeciclina, amikacina, ceftazidima o cefepima. En caso de que se utilice un carbapenem puede asociarse amikacina.
Los pacientes con IIA de foco gastroduodenal o si se han observado levaduras en la tinción de Gram, es preciso administrar fluconazol, y en los casos de shock séptico establecido, una candina dado que proporciona un mayor espectro antifúngico y una mejor actividad fungicida (fig. 1).
Infección intraabdominal persistente o recidivante (peritonitis terciaria)La mayor parte de estos pacientes tienen como principales factores de riesgo de mala evolución, la administración previa de antibióticos en el mismo ingreso, el control de foco repetido y la escasa respuesta inflamatoria e inmunosupresión resultante. Es necesario considerar, además de los patógenos principales de la infección mixta, enterobacterias resistentes (BLEE), cocos grampositivos resistentes a los β-lactámicos (como E. faecium), P. aeruginosa y Candida spp.
Las combinaciones recomendadas son:
- 1.
La asociación de un carbapenémico (meropenem o imipenem) con un antibiótico activo contra cocos grampositivos resistentes (linezolid, daptomicina o un glucopéptido) y fluconazol o una candina. Para la cobertura de cocos grampositivos, puede ser útil la administración de vancomicina. Sin embargo, se ha observado fracaso terapéutico en aquellos casos de infecciones graves por S. aureus con CMI de vancomicina >de 1μg/ml y cuando las situación del paciente no asegure una relación ABC24h/CMIj superior a 400 a las dosis habituales, como sucede en los pacientes con un incremento del volumen extracelular114.
- 2.
La asociación de tigeciclina (activa frente a cocos grampositivos resistentes) con amikacina, ceftazidima o cefepima y fluconazol o una candina. El tratamiento combinado con cefepima o amikacina es útil también para tratar alguna cepa aislada de Enterobacter spp. con una sensibilidad disminuida a tigeciclina113.
En el caso de sepsis grave o shock séptico y en pacientes con factores de riesgo de infección por P. aeruginosa, hay que considerar el refuerzo de la cobertura antipseudomónica. Si recibe un carbapenem (incremento de la resistencia a imipenem para P. aeruginosa) puede añadirse colistina o amikacina. La elección del antibiótico antipseudomónico que es preciso añadir a tigeciclina deberá evaluarse de forma individual teniendo en cuenta la presencia de insuficiencia renal (evitar los aminoglucósidos) y el mejor perfil farmacocinético-fármacodiámico (mejor ceftazidima o cefepima que amikacina).
Tratamiento antibiótico de la infección intraabdominal en el paciente con hipersensibilidad a los betalactámicos (en la tabla 6, párrafos en itálica)- 1.
IIA leve-moderada de origen comunitario sin factores de riesgo. El tratamiento alternativo puede consistir en gentamicina o aztreonam (sensibilidad cruzada menor del 1%) junto con metronidazol.
- 2.
IIA leve moderada de origen comunitario con factores de riesgo. En estos pacientes tigeciclina en monoterapia puede ser suficiente para cubrir los pacientes de riesgo de IIA por enterobacterias productoras de β-lactamasas tipo BLEE o AmpC.
- 3.
IIA grave de origen comunitario y posoperatorio con o sin factores de riesgo. Los β-lactámicos pueden sustituirse por tigeciclina asociada a amikacina o aztreonam si el paciente presenta shock séptico o tiene factores de riesgo de infección por P. aeruginosa (tabla 4).
- 4.
IIA persistente o recidivante (peritonitis tericaria). En estos casos es preciso asociar tigeciclina junto a amikacina o colistina para la cobertura de P. aeruginosa.
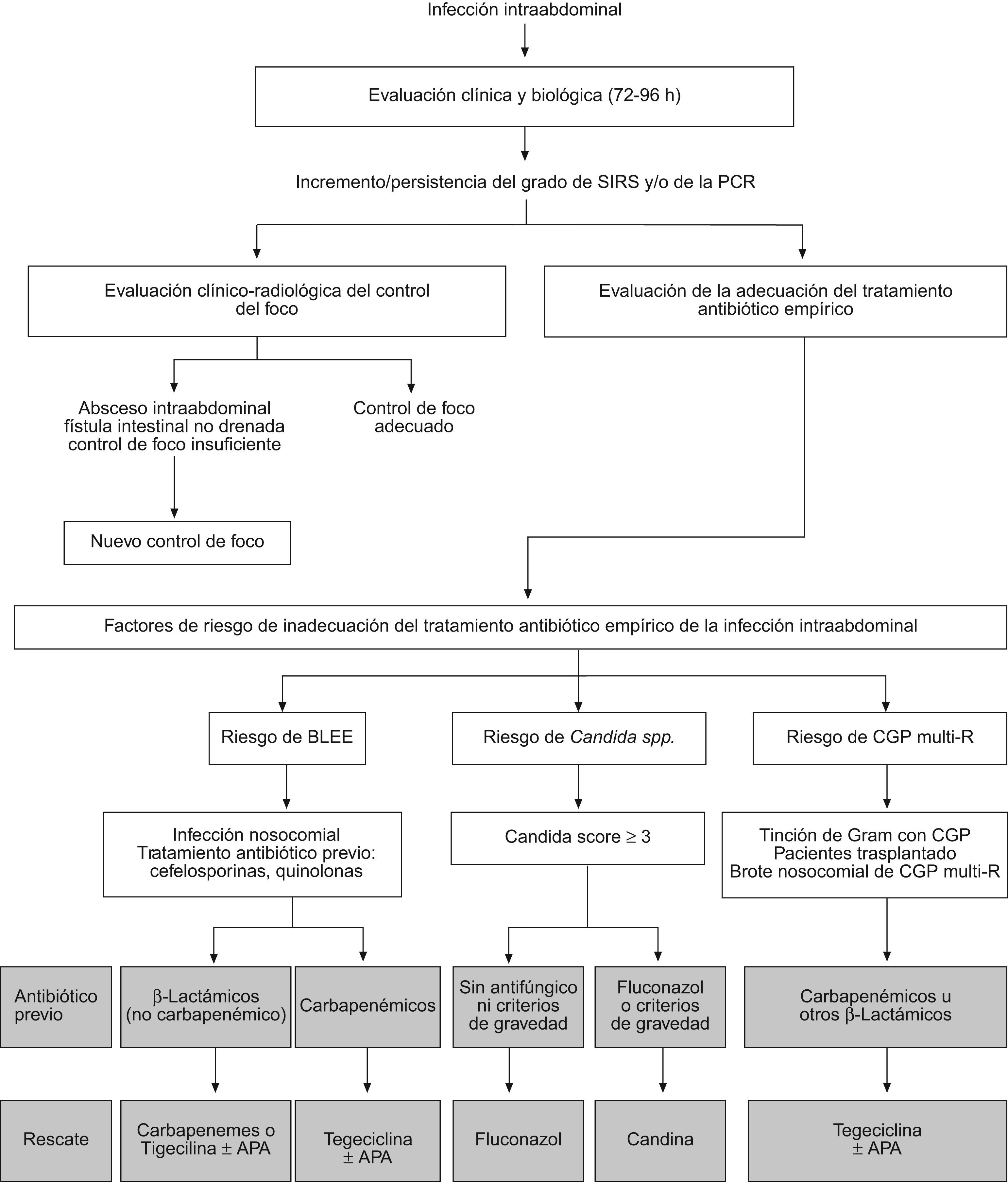
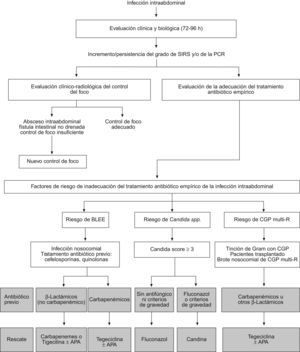
La aparición progresiva de patógenos resistentes causantes de IIA y la escasez de antibióticos efectivos disponibles, hace necesario la evaluación precoz y sistemática del tratamiento antibiótico empírico iniciado y en el caso de evolución clínica desfavorable, plantear su cambio («rescate») sin esperar los resultados del cultivo obtenidos el día de la intervención quirúrgica (fig. 2).
En las condiciones asistenciales del hospital medio, el resultado del antibiograma está disponible alrededor de los 4–5 días, período de tiempo considerado excesivo para que el cambio de tratamiento antibiótico sea efectivo3. En un estudio multicéntrico en las UCI de nuestro país se observó que en el 44% de los casos se realizaba el cambio de antibióticos durante el tratamiento de la infección. En el 62% de los casos, el cambio se realizaba en base a los resultados del antibiograma y sólo en el 32%, en relación a la mala evolución clínica29. Estudios observacionales en pacientes con peritonitis, han demostrado una mortalidad similar en los enfermos a los que se adecuó el tratamiento antibiótico al resultado de los cultivos y antibiograma (22% sin cambio frente a 26% con cambio). Sin embargo, no falleció ninguno de los pacientes a los que se cambió el tratamiento antibiótico de forma empírica de función de la evolución clínica («rescate empírico»)63. A pesar de estas pruebas, estudios observacionales han demostrado que sólo el 30% de los intensivistas se plantearían cambiar el tratamiento antibiótico teniendo en cuenta el deterioro clínico y el 27% añadirían un antifúngico al tratamiento inicial115.
Además de la resistencia de las enterobacterias a los β-lactámicos de amplio espectro, otra de las causas de posible fracaso terapéutico radica en la persistencia o sobreinfección por Candida en aquellos pacientes graves que precisan el ingreso en la unidad de cuidados intensivos. La mala evolución, la presencia de flora mixta (bacilos gramnegativos y cocos grampositivos) en la tinción de Gram del líquido intraabdominal de la intervención índice y la existencia de un Candida score elevado, debería alertar al clínico para mejorar el espectro antibacteriano y añadir al tratamiento un antifúngico (fluconazol o candina). Si el β-lactámico administrado previamente no hubiera sido un carbapenémico, la pauta antibiótica se puede sustituir por meropenem o imipenem115 añadiendo un antifúngico si se obtiene un Candida score mayor de 3. Otra posible estrategia sería cambiar el tratamiento a tigeciclina junto a un antibiótico con actividad antipseudomónica (aztreonam, amikacina o colistina) si existe riesgo de infección por P. aeruginosa, reduciendo la asociación según antibiograma, sobre todo si el antibiótico empleado hubiera sido un aminoglucósido y así evitar la posible nefrotoxicidad (fig. 2).
ConclusionesPara mejorar el pronóstico de los pacientes con IIA grave es preciso aplicar los conceptos que se han demostrado eficaces en el tratamiento de la sepsis grave como la detección y el tratamiento antibiótico precoz. Además, se necesita controlar y disminuir el inóculo bacteriano de la forma más eficaz, en función del tipo de IIA y del estado del paciente. La aplicación de estos principios básicos debe de acompañarse, además, de la adecuación del tratamiento antibiótico en función de la gravedad y de la tasa de resistencias sospechadas en el ámbito en el que se ha iniciado la IIA. El tratamiento antibiótico no será del todo adecuado si no se toma en consideración su duración para retardar la aparición de nuevas resistencias.
Asesores independientes
De acuerdo con los autores y los editores, este artículo se publicó de forma íntegra en: Rev Esp Quimioter 2009;22(3):151–172.
Dos o más criterios de fiebre >38°C o <36°C, frecuencia cardíaca >90ppm, frecuencia respiratoria >20rpp, recuento leucocitario >12.000L/mm3 o <4.000L/mm3 o >10% de cayados.