Dentro de los grados de evidencia científica, el ensayo clínico aleatorizado (ECA) es el diseño metodológico que nos proporciona una información de mayor calidad1.
El ECA es aquel estudio que los participantes se dividen al azar en grupos de intervención. Se trata de un estudio analítico, experimental, prospectivo —es decir, con dirección anterógrada— y controlado, ya que el investigador está presente en el momento de la exposición y en el efecto (temporalidad concurrente). La finalidad de aleatorizar un estudio clínico es la de equilibrar y homogenizar lo grupos que participan en él y poder así poder reducir el sesgo de selección. La aleatorización provoca que los grupos generados sean similares y comparables en todo excepto en la intervención, por lo que si se detectan diferencias estadísticas en la respuesta entre los grupos generados, es probable que se deban a la intervención de estudio2.
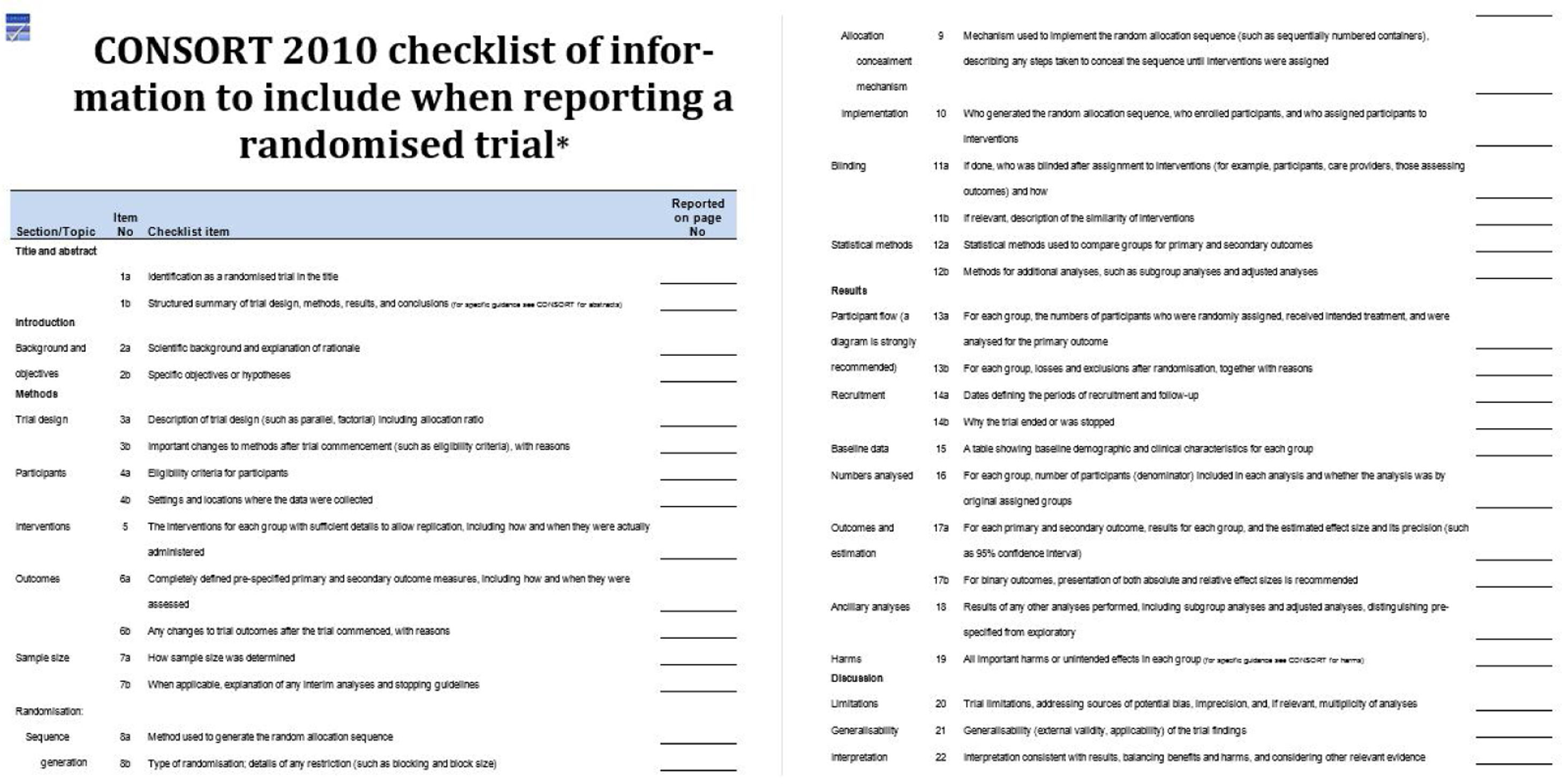
Para poder evaluar la metodología de un ECA se debe detallar con exactitud y con transparencia su diseño, su ejecución, los análisis y los resultados. Para ello utilizaremos la declaración CONSORT (CONsolidated Standards Of Reporting Trials) (fig. 1)3.
Hipótesis de investigaciónEl ECA debe responder a una pregunta claramente definida y estructurada, de tal forma que debe plantear con claridad la hipótesis de trabajo con sus correspondientes hipótesis nula y alternativa sobre una intervención que sea clínicamente relevante. Además, tiene que tener definidas las variables básicas, como la muestra a estudio, la intervención, o cómo se realizará el análisis.
La mayoría de los ECA son ensayos de superioridad, en los que se plantea la hipótesis mediante la cual se quiere demostrar que una intervención es superior a otra de manera estadísticamente significativa. Algunos ECA son ensayos de equivalencia en los que la hipótesis es que dos intervenciones son indistinguibles entre sí. Por último, los ECA de no inferioridad son aquellos que determinan si una nueva intervención no es peor que un tratamiento de referencia4.
Clasificación según diseño- -
Diseño paralelo. Es el diseño más utilizado. En este diseño tenemos una muestra inicial que se divide aleatoriamente en dos grupos: un grupo que recibe la intervención a estudio y otro grupo que es el control, que sirve de comparación y que suele ser sometido a un placebo, a la ausencia de intervención o a un tratamiento alternativo.
- -
Diseño cruzado. La población inicial es aleatorizada en dos grupos. Cada grupo recibe una de las dos intervenciones y, tras un periodo ventana, recibe la otra intervención. Es decir, en este tipo de diseño cada grupo recibe en momentos distintos las dos intervenciones (estudio y control), por lo que cada grupo será su propio control.
- -
Diseño factorial. Este tipo de diseño permite evaluar dos o más intervenciones en un mismo estudio, siempre y cuando los tratamientos o intervenciones estudiados tengan mecanismos de acción y efectos independientes. La forma más básica sería la siguiente: se divide la muestra aleatoriamente en cuatro grupos; el primer grupo recibe las dos intervenciones, el segundo grupo recibe una intervención, el tercer grupo recibe la otra intervención a estudio y el cuarto grupo recibe el placebo5.
- -
Diseño con asignación por grupos (conglomerados o cluster). Es un ensayo en el cual la asignación de la intervención a estudio se realiza por grupos de individuos previamente establecidos (conglomerados) de forma aleatoria, como áreas sanitarias u hospitales
- -
Diseño secuencial. En este tipo de ensayo clínico las observaciones se evalúan a medida que se van produciendo; el número total de participantes no está predeterminado, sino que depende de los resultados acumulados6,7.
La validez interna está directamente relacionada con la metodología utilizada para su diseño, ejecución, recogida de datos e interpretación de resultados. En cambio, la validez externa hace referencia a la aplicabilidad de los resultados obtenidos en nuestra práctica clínica habitual y a la reproductibilidad de los resultados.
Las dos principales amenazas a la validez interna son el error aleatorio y el sesgo.
El error aleatorio se puede dividir en dos tipos. El error de tipoI, riesgo de significación o riesgo α, se refiere a la probabilidad de definir una conclusión falsa positiva mediante el rechazo incorrecto de una hipótesis nula verdadera (0,05-0,025). El error de tipoII, riesgo β o potencia de la prueba, se refiere a la probabilidad que el investigador no rechace la hipótesis nula siendo esta falsa (90-80%)8,9.
Dentro de los sesgos que pueden afectar a los ECA hay que destacar el sesgo de selección, el cual se controla mediante la aleatorización. La aleatorización es la asignación no predecible de los participantes en el ensayo a una de las alternativas de intervención. El objetivo fundamental de la aleatorización es equilibrar los grupos que intervienen en el ensayo, de forma que sean homogéneos en la distribución de todos aquellos factores, conocidos o desconocidos, que puedan sesgar los resultados del estudio10.
Las técnicas de aleatorización más frecuente son:
- -
Aleatorización simple. Esta técnica asigna a cada participante de forma aleatoria a un grupo de intervención sin tener en cuenta la asignación de los participantes anteriores.
- -
Aleatorización por bloques. En este caso la secuencia de aleatorización se divide en bloques y la asignación de cada participante se realiza de forma aleatoria pero teniendo asegurando un balance periódico en el número de sujetos asignados a cada grupo.
- -
Aleatorización estratificada. Este modelo es similar al de los bloques, pero divide los grupos en diferentes subgrupos o estratos teniendo en cuenta un factor importante que se piense que puede influir en los resultados finales y se divide según puntos de corte basados generalmente en conocimientos de estudios previos.
- -
Aleatorización mediante minimización. También llamada aleatorización adaptativa, intenta que las diferencias entre los distintos grupos sean las mínimas posibles. Se inicia el proceso con una aleatorización simple hasta un número previamente acordado y posteriormente se va ajustando la probabilidad de asignación a cada grupo basándose en los desequilibrios que se hayan podido generar entre los distintos grupos de intervención o entre factores pronósticos que puedan influir en los resultados11,12.
Para evitar el sesgo de selección o sesgo de clasificación utilizaremos el proceso de aleatorización y el proceso de ocultación de la secuencia de aleatorización. Estos dos procesos están complementados por el enmascaramiento, mediante el cual evitaremos el sesgo de información en la medida de la variable resultado y posibles co-intervenciones a lo largo del ensayo. Mientras la ocultación de la secuencia se realiza previa a la aleatorización, el enmascaramiento se realiza posterior al mismo. Existen cuatro tipos de enmascaramiento: ensayo abierto o no ciego, simple ciego, doble ciego, triple ciego.
Seguimiento y pérdida de informaciónDurante este periodo puede existir una pérdida de información o de participantes. Es importante tener en cuenta la cronología de las pérdidas. Las pérdidas prealeatorización afectan fundamentalmente a la generalización de las conclusiones del estudio, comprometiendo la validez externa. En cambio, las pérdidas postaleatorización pueden comprometer la validez interna del estudio al disminuir el número de sujetos, reduciendo de esta forma el tamaño muestral efectivo. Suele considerarse que más del 10% de pérdidas puede comprometer la validez de los resultados.
Análisis de resultadosLos sujetos deben ser preferiblemente analizados según el grupo al que fueron inicialmente asignados (análisis por intención de tratar) y no según el grupo en el que finalmente participaron (análisis por protocolo). Para realizar un adecuado análisis de resultados hay que determinar qué variables se han medido y expresar de forma adecuada la magnitud y la precisión de los resultados. Una variable de resultado de un ECA es toda característica medida en los sujetos de estudio que nos permita diferenciar el efecto encontrado en los grupos comparados y plantear el contraste de hipótesis. De manera habitual, la hipótesis nula de un ensayo clínico afirma que no existe diferencia de efecto entre las intervenciones comparadas con respecto a la variable de resultado elegida13.
Las variables de resultado se clasifican en primarias y secundarias. Las primarias son las que ayudan a contestar la pregunta principal de la investigación y condicionan el tamaño de la muestra del ensayo clínico. En casos de variables de resultado continuas lo habitual es expresar la magnitud de los resultados como diferencias de medias o medianas, dependiendo de la medida de centralización más adecuada a la distribución de la variable. Por otro lado, en casos de variables dicotómicas se utilizarán el riesgo relativo, las diferencias absoluta y relativa del riesgo y el número necesario a tratar. La precisión de los resultados se expresa mediante los intervalos de confianza de los estimadores calculados14,15.
Conflicto de interesesLos autores firmantes declaran que no existe ningún potencial conflicto de intereses relacionado con el artículo.