Introducción
Las alteraciones intestinales que se producen en la hipertensión portal son principalmente vasculares, con aumento del número y el tamaño de los vasos mucosos y submucosos, y por esta razón se ha propuesto la denominación de "vasculopatía intestinal hipertensiva portal"1. Sin embargo, también se ha descrito la asociación de inflamación inespecífica con estas alteraciones vasculares2-4. Así, el intestino presenta un infiltrado inflamatorio crónico constituido por células mononucleares y se asocia con atrofia de las vellosidades, edema de la lámina propia, proliferación muscular y engrosamiento de la muscularis mucosa2,4.
En ratas con hipertensión portal prehepática, la vasculopatía intestinal se asocia con incremento de la infiltración de la mucosa y submucosa por células cebadas5,6. Por esta razón, se ha propuesto que la enteropatía hipertensiva portal experimental podría tener naturaleza inflamatoria mediada por las células cebadas, cuyos mediadores estarían implicados en su fisiopatología5-7. En este supuesto, las alteraciones estructurales que se producen a largo plazo en esta enteropatía se corresponderían con un proceso de remodelación de características similares al que se describe en otros procesos inflamatorios crónicos8.
Para demostrar la existencia de alteraciones estructurales intestinales, así como su relación con mediadores de la inflamación, en la enteropatía hipertensiva portal crónica, se determinaron la densidad de células caliciformes y las concentraciones de factor de necrosis tumoral (TNF) α, interleucina (IL)-1β e IL-10 en el intestino delgado de ratas con triple ligadura parcial de la vena porta (TLPP) a los 3 meses y 1 año de evolución postoperatoria.
Material y método
Se utilizaron ratas macho de la cepa Wistar procedentes del Animalario de la Facultad de Medicina de la Universidad Complutense de Madrid con pesos corporales que oscilaron entre 250 y 300 g.
El procedimiento experimental empleado en este estudio se efectuó según los principios para el cuidado y la utilización de los animales de experimentación, publicados en España en el RD 1202/2005.
Para su estudio, los animales fueron divididos en 4 grupos: 2 grupos control de 3 meses (n = 9) y 1 año (n = 8) de evolución (grupos I y III, respectivamente), y 2 grupos con hipertensión portal (HTP) prehepática por TLPP de 3 meses (n = 8) y 1 año (n = 10) de evolución (grupos II y IV, respectivamente).
Todos los animales fueron sacrificados por sobredosis de tiopental sódico una vez concluido el tiempo de evolución previsto para cada grupo.
Técnica quirúrgica de hipertensión portal
Se anestesió a las ratas con ketamina (80 mg/kg) y xilacina (12 mg/kg) por vía intramuscular. Se realizó una laparotomía media, desplazando las asas intestinales y el estómago a la izquierda del animal, y los lóbulos hepáticos medio y lateral izquierdo en sentido craneal mediante una torunda de algodón subdiafragmática. A continuación, se disecó el tramo de vena porta comprendido entre el drenaje de la vena gastroduodenal y el hilio hepático. Para realizar la TLPP se fijaron 3 ligaduras de seda 4/0 a una guía Silastic con 3 muescas, cuya finalidad es mantenerlas equidistantes. Las estenosis fueron calibradas por ligadura simultánea alrededor de la vena porta y de un catéter 20 G, que posteriormente se retiró con el fin de permitir la reexpansión parcial de la vena porta hasta ese calibre conocido (20 G; 1,2 mm de diámetro externo). La laparotomía se cerró en dos planos con catgut y seda 2/09.
Estudio histológico intestinal
En todos los animales se resecó la segunda porción del duodeno, proximalmente al drenaje del colédoco. El duodeno fue perfundido intraluminalmente con suero salino. Posteriormente, las muestras fueron fijadas con formol al 10%, deshidratadas e incluidas en parafina. Secciones de 5 μm perpendiculares a la luz intestinal fueron teñidas con hematoxilina-eosina, visualizadas con un microscopio digital (Leica DM 5000B) y las imágenes obtenidas fueron valoradas con un sistema de análisis de imagen (Qwin, Leica Microsystems). En todas las muestras se cuantificó el número de células caliciformes en un área de, al menos, 150.000 μm2, y el resultado se expresó como número de células caliciformes/1.000 μm2 de epitelio glandular.
Preparación de homogeneizados intestinales
Las muestras de íleon se congelaron inmediatamente tras su extracción y se introdujeron en tubos de polipropileno (Falcon; Becton Dickinson, Lincoln Park, Estados Unidos) que contenían tampón de lisis a
4 °C (10 ml de tampón/g de tejido). El tampón de lisis contiene fenilmetilsulfonil flúor (PMSF; Sigma Chemical Company), pepstatina A 1 μg/ml (Sigma Chemical Company), aprotinina (Sigma Chemical Company), antipaína (Sigma Chemical Company) y leucopeptina en tampón fosfato a pH 7,2 con el 0,05% de azida sódica. Las muestras se homogeneizaron 3 veces durante 30 s con un homogeneizador eléctrico (Polytron; Brinkmann Instruments, Westminster, Estados Unidos) a máxima velocidad, y se midió el volumen final de homogeneizado con una pipeta graduada. A continuación, se centrifugaron a 3.000 g, y se congeló el sobrenadante a 80 °C para permitir la formación de agregados macromoleculares.
Citocinas intestinales
Se midió las concentraciones de TNFα, IL-1β e IL-10 en íleon mediante una técnica de ELISA utilizando kits comerciales específicos para rata (BioNOVA Científica Ltd., Madrid, España). La concentración mínima detectable de TNFα es de 0,5 pg/ml. El rango de variación intraensayo oscila entre el 3,1% (mínimo de la curva estándar) y el 4,2% (máximo), con una variabilidad entre ensayos del 5,2 al 5,6%. La concentración mínima detectable de IL-1β es de 1,5 pg/ml. El rango de variación intraensayo oscila entre el 3,5% (mínimo de la curva estándar) y el 4,3% (máximo), con una variabilidad entre ensayos del 6,1 al 7,4%. La concentración mínima detectable de IL-10 es de 2,5 pg/ml. El rango de variación intraensayo oscila entre el 4,2% (mínimo de la curva estándar) y el 7,5% (máximo), con una variabilidad entre ensayos del 5,8 al 9,3%.
Análisis estadístico
Los resultados se expresan como la media ± desviación estándar (DE). El análisis de la varianza (ANOVA) y el test de Duncan para contrastes a posteriori fueron utilizados para comparar las variables entre los diferentes grupos. Los resultados se consideran estadísticamente significativos si p < 0,05.
Resultados
Células caliciformes intestinales
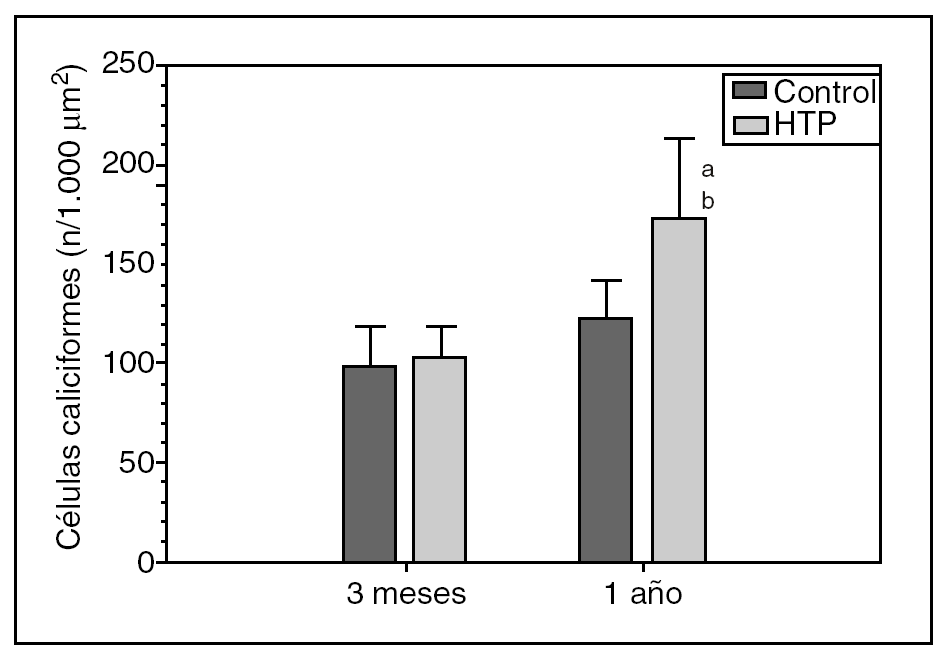
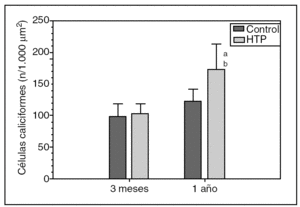
Hay un aumento progresivo del número de células caliciformes duodenales en las ratas con HTP (grupos II y IV) respecto de sus controles (grupos I y III, respectivamente), tanto a los 3 meses (103,63 ± 14,37 frente a 99,42 ± 19,19 células caliciformes/1.000 μm2) como al año (172,79 ± 40,46 frente a 121,76 ± 20,74 células caliciformes/1.000 μm2) de evolución, si bien esta diferencia sólo es estadísticamente significativa al año de evolución (p < 0,01) (fig. 1).
Fig. 1. Número de células caliciformes/1.000 μm2 de epitelio glandular en el duodeno de los animales de los grupos I (control) y II (hipertensión portal; HTP) a los 3 meses de evolución, y en los grupos III (control) y IV (HTP) al año de evolución. ap < 0,01; diferencia estadísticamente significativa respecto de su grupo control. bp < 0,001: diferencia estadísticamente significativa respecto del grupo II.
Citocinas intestinales
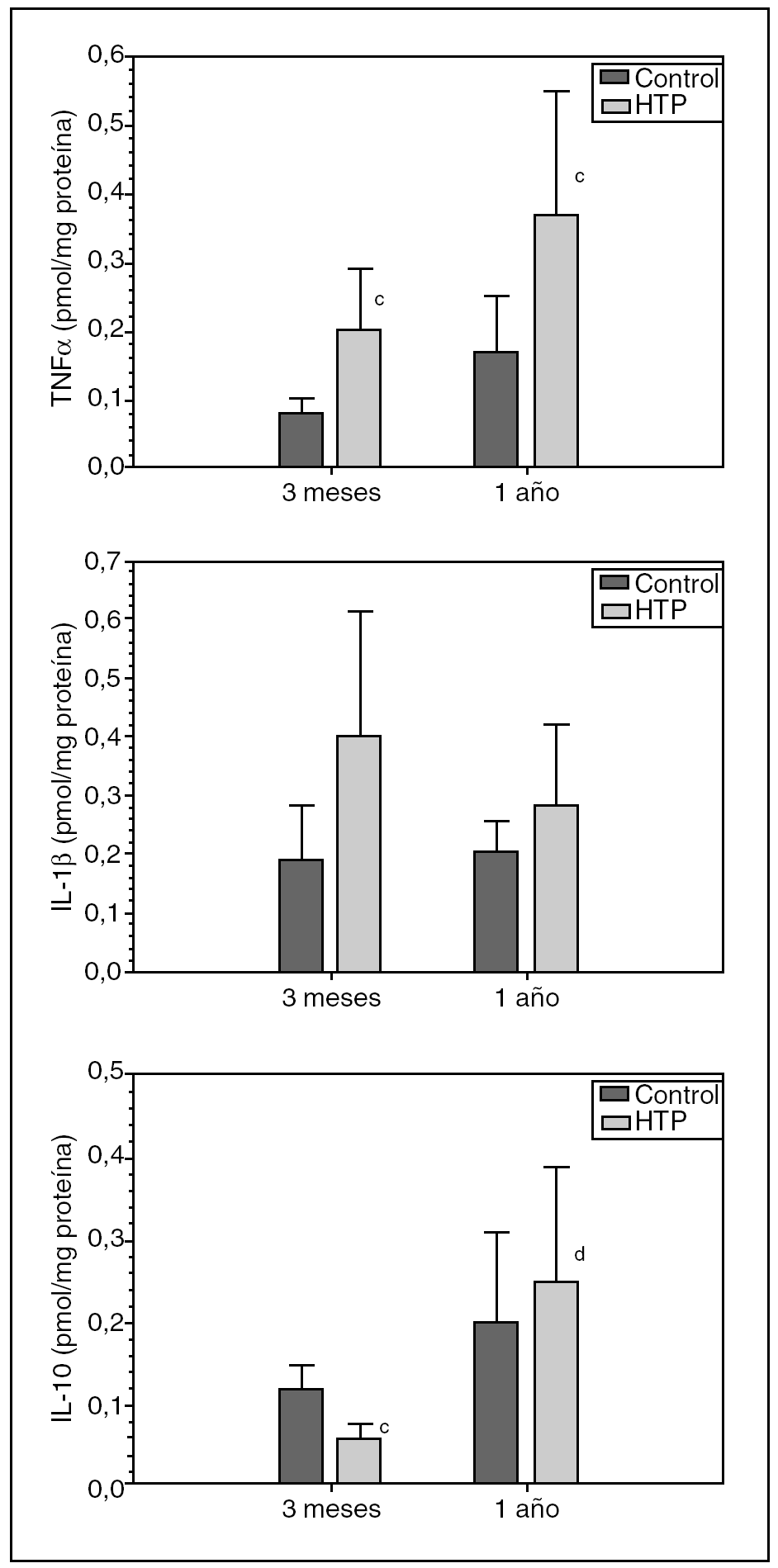
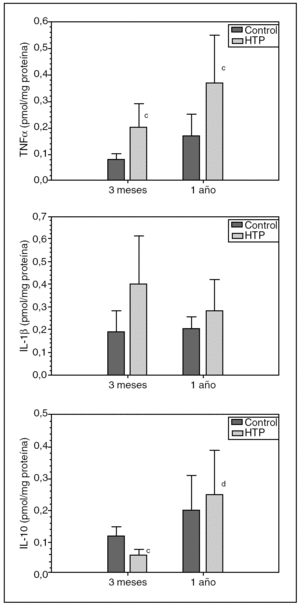
En los animales con HTP por TLPP (grupos II y IV), se observa un aumento (p < 0,05) de las concentraciones ileales de TNFα respecto de los animales control (grupos I y III), tanto a los 3 meses (0,20 ± 0,09 frente a 0,08 ± 0,02 pmol/mg proteína) (p < 0,05) como al año (0,37 ± 0,18 frente a 0,17 ± 0,08 pmol/mg proteína) (p < 0,05) de evolución (fig. 2).
Fig. 2. Concentración ileal de TNFα, IL-1βe IL-10 en ratas control y con hipertensión portal (HTP) a los 3 meses (grupos I y II, respectivamente) y al año de evolución postoperatoria (grupos III y IV, respectivamente). cp < 0,05; diferencia estadísticamente significativa respecto de su grupo control. dp < 0,01; diferencia estadísticamente significativa respecto del grupo II.
Se comprueba que también hay un aumento de la concentración ileal de IL-1β en ratas con HTP, tanto a los 3 meses (grupo II) (0,40 ± 0,21 frente a 0,19 ± 0,09 pmol/mg proteína) como al año (grupo IV) (0,28 ± 0,14 frente a 0,205 ± 0,05 pmol/mg proteína) de evolución, con respecto a sus grupos control (grupos I y III, respectivamente).
Asimismo, se ha podido comprobar una disminución (p < 0,05) de la concentración ileal de IL-10 en ratas con HTP a los 3 meses de evolución (grupo II) con respecto a su grupo control (grupo I) (0,06 ± 0,02 frente a 0,12 ± 0,03 pmol/mg proteína), mientras que en los animales con HTP, al año de evolución (grupo IV), aumenta (0,25 ± 0,14 frente a 0,20 ± 0,11 pmol/mg proteína) respecto de su control (grupo III) (fig. 2).
La diferencia entre las concentraciones ileales de IL-10 que se aprecia en los animales con HTP a los 12 meses (grupo IV) y a los 3 meses de evolución (grupo II) (0,25 ± 0,14 frente a 0,06 ± 0,02 pmol/mg proteína) es estadísticamente significativa (p < 0,01).
Discusión
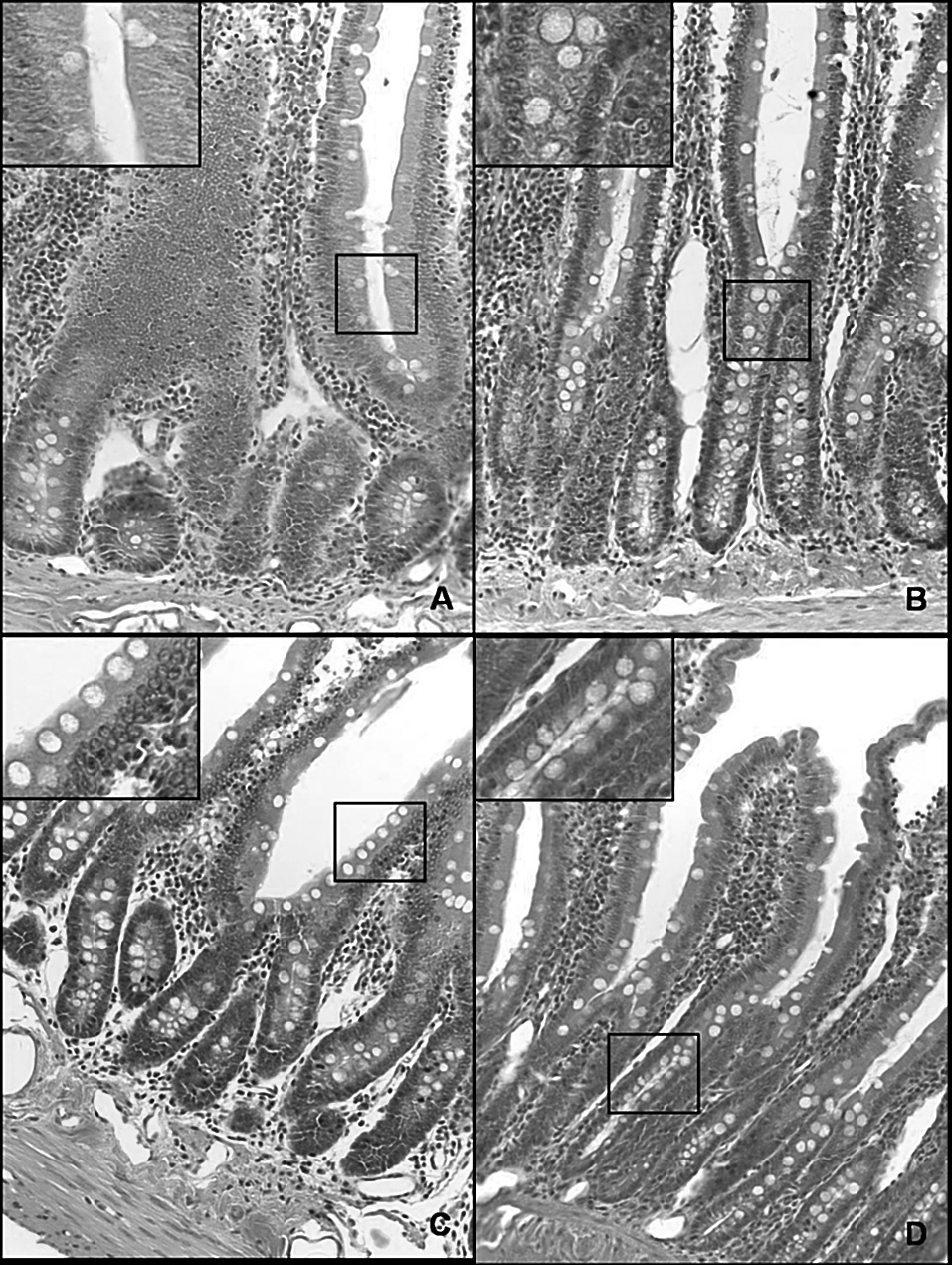
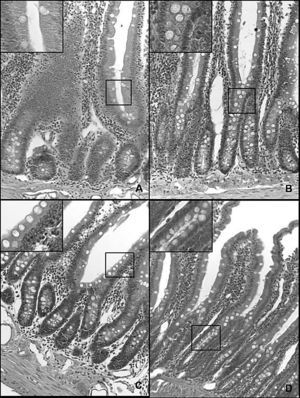
La hiperplasia intestinal de células caliciformes (fig. 3) asociada al incremento de las concentraciones de TNFα e IL-1β en ratas con HTP prehepática crónica indica un proceso inflamatorio crónico que induciría la remodelación epitelial del intestino delgado.
Fig. 3. Microfotografía de una sección duodenal en la rata (hematoxilina-eosina, *20). A. Control a los 3 meses de evolución (grupo I). B. Hipertensión portal a los 3 meses de evolución (grupo II). C. Control al año de evolución (grupo III). D. Hipertensión portal al año de evolución (grupo IV). Se observa un aumento de la infiltración de la mucosa por células caliciformes en los animales con hipertensión portal (B y D) respecto de las ratas control (A y C, respectivamente), especialmente al año de evolución (D).
La naturaleza inflamatoria de la enteropatía hipertensiva portal experimental se ha propuesto por el hallazgo de hiperplasia de células cebadas en el intestino delgado y ganglios linfáticos mesentéricos de ratas con HTP5,6. Las células cebadas tienen la capacidad de almacenar TNFα y, por lo tanto, esta citocina puede ser liberada espontáneamente tras su activación10. En particular, la traslocación bacteriana intestinal podría ser el estímulo apropiado para causar la liberación de mediadores proinflamatorios por las células cebadas de la mucosa y submucosa intestinal, así como de los ganglios linfáticos mesentéricos en las ratas con hipertensión portal prehepática, tanto a corto11 como a largo plazo12.
El incremento intestinal de TNFα en ratas con HTP también causaría incremento de la síntesis de óxido nítrico (NO) y prostaciclina; estos mediadores proinflamatorios parcialmente son la causa de la vasodilatación mesentérica y, por lo tanto, del síndrome de circulación hiperdinámica que caracteriza la evolución de este modelo experimental13,14. Así, la inhibición de la síntesis de TNFα por talidomida o anticuerpo policlonal anti-TNFα reduce la síntesis de NO y bloquea el desarrollo de la circulación hiperdinámica13-15. La respuesta biológica de TNFα, a su vez, se amplifica por la liberación secundaria de otras citocinas proinflamatorias como IL-1β, así como por NO16,17.
El incremento de la producción intestinal de TNFα en ratas con HTP de 3 meses de evolución se asocia12 con el incremento portal de las concentraciones de NO y CO. En particular, la actividad de la sintasa inducible de NO (iNOs) puede ser aumentada por lipopolisacárido y citocinas proinflamatorias18, factores que, a su vez, estarían aumentados en este modelo experimental de hipertensión portal19-21.
Otros mediadores inflamatorios producidos por las células cebadas, como histamina y oxidantes, también podrían colaborar en la instauración de la traslocación bacteriana intestinal, ya que aumentan la permeabilidad epitelial22,23. Aunque el mecanismo de la traslocación bacteriana en la hipertensión prehepática crónica se desconoce, se ha propuesto que la hipoxemia crónica de la mucosa intestinal secundaria a la congestión vascular sería un importante factor etiológico, ya que produciría lesión por estrés oxidativo de los enterocitos24,25. Avala esta hipótesis el efecto beneficioso que se obtiene con los tratamientos con alopurinol o vitaminas E y C, conocidos antioxidantes, en la hipertensión portal crónica. Estos antioxidantes atenúan la incidencia de traslocación bacteriana, aunque haya sobrecrecimiento bacteriano intestinal24-26.
El incremento de las células caliciformes en la mucosa intestinal de las ratas con hipertensión portal crónica es una alteración estructural significativa. Se considera que la hiperplasia de células caliciformes con hipersecreción de moco es una alteración propia de la remodelación epitelial del tracto respiratorio en procesos inflamatorios crónicos, como son el asma y la enfermedad pulmonar obstructiva crónica8,27,28. Este mismo sentido se podría atribuir a la hiperplasia de células caliciformes en la hipertensión portal prehepática experimental crónica29. En este supuesto, la respuesta hiperplásica de las células caliciformes, en tanto que signo de remodelación epitelial intestinal, podría estar mediada por el estímulo luminal que supone la alteración de la flora intestinal, así como por mediadores inflamatorios endógenos30.
Se cree que en el intestino sano hay un delicado equilibrio para regular los estímulos proinflamatorios y antiinflamatorios de manera que se produzca la inflamación justa y necesaria para controlar una potencial agresión microbiana sin causar lesión de la barrera epitelial31. Entre los mecanismos que posee el intestino para efectuar eficazmente este control destaca la producción de una capa adherente de moco que ejerce funciones citoprotectoras, ya que contiene factores (trefoil factor family; TFF) que modulan la inflamación producida por el TNFα porque antagonizan sus efectos31-33. En este sentido, la hiperplasia de células caliciformes y la consiguiente hipersecreción de moco tendría un carácter defensivo del epitelio y modulador de la inflamación intestinal en las ratas con HTP.
En la hipertensión portal prehepática experimental, la hiperplasia de células caliciformes en el intestino delgado también reflejaría una alteración de la proliferación y la diferenciación en el eje cripta/vellosidad34. En particular, se ha descrito que la inhibición de la vía Notch con inhibidores gammasecretasa potenciarían la expresión del epitelio secretor, e incluso inducirían la diferenciación de células caliciformes en adenomas35.
Se considera que la inflamación mucosa intestinal puede ser mediada por 2 vías, bien por una respuesta excesiva celular TH1, con aumento de la secreción de IL-12, interferón (IFN) α y TNFα, o bien por la excesiva respuesta celular TH2, que se asociaría con aumento de la secreción de IL-4, IL-5 e IL-1333. En un modelo experimental de cirrosis se ha demostrado que se produce una polarización inflamatoria de tipo TH1, estableciéndose una cascada inflamatoria que se iniciaría con la hiperproducción de IL-12 e IL-18 por monocitos, que a su vez activarían la hiperproducción por células T de IFNα. Por último, IFNα estimularía la síntesis y la liberación de TNFα por monocitos36.
Sin embargo, en el modelo experimental de HTP prehepática por TLPP las alteraciones histológicas5-7,29 y bioquímicas7,11,12 que se producen indican el predominio de una respuesta inflamatoria intestinal de tipo TH2, quizá mediada por células cebadas. En este caso, entre las consecuencias a largo plazo de la respuesta inflamatoria destacaría la remodelación esplácnica29, tanto epitelial, con hiperplasia de células caliciformes (figs. 1 y 3), como vascular, con exacerbada angiogénesis, que sería la causa tanto de la vasculopatía intestinal hipertensiva portal5 como del desarrollo de circulación colateral portosistémica37.
Trabajo realizado mediante ayudas de la Consejería de Sanidad. Junta de Comunidades de Castilla-La Mancha (Ref. N.o 01011 y 04047-00).
Correspondencia: Dra. M.A. Aller.
Cátedra de Cirugía. Facultad de Medicina. Universidad Complutense.
Pza. de Ramón y Cajal, s/n. 28040 Madrid. España.
Correo electrónico: maaller@med.ucm.es
Manuscrito recibido el 20-3-2006 y aceptado el 25-4-2006.