La supervivencia a largo plazo de los pacientes intervenidos por cáncer de colon depende de múltiples factores. La obesidad disminuye la expectativa de vida de la población general que la padece, pero no está claro si la obesidad, medida con el índice de masa corporal (IMC), es un factor pronóstico de supervivencia para los pacientes intervenidos por cáncer de colon.
Material y métodosHemos incluido en este estudio a pacientes en estadios TNM I, II y III, sometidos a cirugía electiva por cáncer de colon en el Hospital Universitari de Girona entre 1990 y 2001. El IMC se ha categorizado siguiendo la clasificación de la OMS. Hemos estudiado 38 parámetros distintos realizando un estudio bivariable con el IMC. El modelo de Cox ha sido construido posteriormente con los parámetros más clínicamente relevantes y con los más fuertemente asociados con la supervivencia en el estudio bivariable.
ResultadosEl IMC no se asoció con la supervivencia en el análisis bivariable. El análisis multivariable tampoco mostró que el IMC sea un factor pronóstico independiente de supervivencia a largo plazo en el cáncer de colon sin metástasis, pero sí lo fueron el estadio TNM, la puntuación ASA, la técnica quirúrgica, la edad a la cirugía y la respuesta inmunitaria celular.
ConclusionesEl IMC no es un factor pronóstico de supervivencia a largo plazo en pacientes con cáncer de colon.
The long-term survival of patients operated on for colonic cancer depends on many factors. Obesity decreases the life expectancy of the general population who suffer from it, but it is not clear whether obesity, measured by the Body Mass Index (BMI), is a prognostic factor of survival for patients operated on for colonic cancer.
Material and methodsThe patients included in this study had TNM stage I, II y III, and were subjected to elective surgery for cancer of the colon in the Girona University Hospital between 1990 and 2001. The BMI was classified according to the WHO classification. A total of 38 different variables were studied using a bivariate analysis with BMI. A Cox model was subsequently constructed with the most clinically relevant parameters, and with those most strongly associated with survival in the bivariate analysis.
ResultsBMI was not associated with survival in the bivariate analysis. Neither did the multivariate analysis show that BMI was an independent prognostic factor of long-term survival in cancer of the colon without metastasis, but it did show that the TNM stage, ASA score, surgical technique, age at surgery, and the immune cell response were prognostic factors.
ConclusionsThe body mass index is not a prognostic factor of the long-term survival of patients with colonic cancer.
El cáncer colorrectal (CCR) es la segunda causa de muerte por cáncer en Norteamérica y Europa occidental1,2. La supervivencia a largo plazo del CCR depende de multiples factores; los principales son los relacionados con el tumor3, pero hay otros implicados como la edad, las comorbilidades4, los factores humorales como los niveles de antígeno carcinoembrionario5. Factores hormonales, Nagel y Göke publicaron un studio mostrando que la progresión tumoral parecia más rápida en pacientes con diabetes mellitus tipo 2 (DM2)6. Otros factores como la técnica quirúrgica, el tipo de hospital7, el tipo de terapia adyuvante8 también han sido implicados en el pronóstico de los pacientes con cáncer de colon (CC). Incluso factores económicos y sociales como la pobreza o la raza se han encontrado asociados al pronóstico del CCR.
Sabemos que la expectativa de vida en la población general disminuye cuando aumenta la obesidad9,10. Esta disminución se debe principalmente a los cambios fisiopatológicos que ocurren en el paciente obeso, los cuales lo predisponen a sufrir una serie de enfermedades denominadas comorbilidades asociadas a la obesidad, que son las que disminuyen su expectativa de vida9. De ellas, cabe destacar por su importancia las comorbilidades cardiovasculares (hipertensión arterial, cardiopatía isquémica, accidente cerebrovascular), así como hiperuricemia, dislipemia, DM2 y síndrome de apnea del sueño.
Recientemente, Birmingham et al11 han publicado que la leptina, hormona producida por los adipocitos y con niveles elevados en pacientes obesos, puede tener un posible efecto favorecedor de la progresión tumoral y metastatización, al estimular el factor de crecimiento del endotelio vascular (VEGF). Varios estudios han intentado evaluar el impacto de estos factores en la supervivencia a largo plazo de los pacientes con CC, pero la influencia de la obesidad en los resultados a largo plazo de los pacientes operados por CC no está del todo aclarada12.
El objetivo de este estudio es determinar si la obesidad se encuentra entre los principales factores pronósticos de supervivencia en los pacientes intervenidos electivamente por CC.
Pacientes y métodosHemos incluido en el estudio a los pacientes sometidos a cirugía electiva con intención curativa por cáncer de colon en el Hospital Universitari de Girona Dr. Josep Trueta entre 1990 y 2001. Hemos incluido a pacientes en estadios I, II y III TNM, con peso y talla registrados preoperatoriamente (el 93,2% del total).
SeguimientoLos pacientes fueron visitados en consulta del hospital por un cirujano tras el alta los meses 1, 3, 6, 12, 18 y 24 y después anualmente. El estado clínico fue evaluado en esos controles, así como el análisis sistemático de sangre, los marcadores CEA y CA19.9 y la radiografía de tórax y ecografía abdominal. La colonoscopia y/o la TC sólo se realizaron si había sospecha de recidiva tumoral.
Parámetros de estudioHemos analizado 38 parámetros: el grado de obesidad se evaluó con el índice de masa corporal (IMC). Este parámetro se categorizó siguiendo los límites de la OMS13: peso insuficiente, IMC < 18,5; normopeso, 18,5-24,99; preobesidad (sobrepeso), 25-29,99, y obesidad, > 30. Los demás parámetros estudiados fueron el sexo, la edad, los antecedentes quirúrgicos, la localización tumoral, la respuesta inmunitaria celular medida con un test comercial (Multitest IMC®; Rhône-Poulenc), los niveles preoperatorios de proteínas (normal, > 6,6g/dl), albumina preoperatoria (normal, > 3,4 g/dl), transfusiones perioperatorias, tipo de cirujano, técnica quirúrgica, complicaciones intraoperatorias, complicaciones postoperatorias, estancia hospitalaria, estadio tumoral siguiendo la clasificación TNM14, la mortalidad el primer mes, parámetros de laboratorio (niveles de inmunoglobulinas G, A, M, complemento C3, C4, haptoglobina, transferrina, α1-antitripsina, CEA, CA 19.9, TPA [tissue polipeptide antigen]).
Parámetros tumoralesLa recurrencia tumoral se valoró en el seguimiento y se consideró como tal la enfermedad neoplásica nueva locorregional o a distancia confirmada por métodos clínicos, biológicos, radiológicos o quirúrgicos. La supervivencia se valoró con el estado en la última visita a consulta o la fecha de fallecimiento. Las comorbilidades y el riesgo de muerte asociado a ellas se valoraron con la clasificación de Yancik et al15, que estudia 29 grupos de comorbilidades y su impacto en la supervivencia, y también con la puntuación ASA (American Society of Anesthesiologists)16.
Plan de trabajoUn único cirujano (ACC) ha realizado la recogida de todos los datos de manera prospectiva durante el ingreso hospitalario y el seguimiento (fecha límite del estudio, 1 de septiembre de 2003), a excepción de los datos relativos a comorbilidades y mortalidad perioperatoria, que no estaban registrados en la base de datos original y se estudiaron retrospectivamente revisando, por parte del primer autor, las historias clínicas de todos los pacientes.
Método estadísticoPrimero se ha realizado un análisis univariable de todos los pacientes, posteriormente un análisis bivariable donde se ha analizado la influencia de cada variable en la supervivencia.
Se ha utilizado el software para análisis estadístico SPSS 10.0 para Windows. Las variables continuas se describen con la media (intervalo de confianza [IC] del 95%) y el mínimo y el máximo de la distribución. Se usó test de ANOVA para valorar si hay diferencias globales en los distintos grupos y pruebas a posteriori mediante el test de Scheffé. Se ha considerado significativo p<0,05.
Las posibles diferencias entre grupos para las variables categóricas se han analizado mediante la prueba de la χ2 de Pearson o el test exacto de Fisher.
Se ha construido un modelo de Cox con 12 variables de las 38 estudiadas, teniendo en cuenta las más fuertemente asociadas con la supervivencia en el estudio bibariable y otras consideradas de relevancia clínica.
ResultadosEstudio univariableSe intervino a 213 pacientes por CC: 122 (57,3%) varones, 91(42,7%) mujeres. La edad media fue 66,2±10 (36-87) años. El IMC medio fue 25,6±3,8 (18-37). La distribución por IMC se muestra en la tabla 4. Casi el 50% de los pacientes estaban en normopeso y 94 (44,1%) tuvieron niveles patológicos preoperatorios de proteínas plasmáticas (< 6,6 g/dl).
La respuesta inmunitaria celular retardada fue normal en 25 (11,7%) pacientes, 36 (16,9%) tenían hipoergia y 91 (42,7%), anergia.
El número medio de comorbilidades en los pacientes con CC fue 3,2±2 (0-11). El riesgo de muerte por comorbilidades valorado con la escala de Yancik et al17 se muestra en la tabla 1. Con este método, el número medio de comorbilidades por paciente es 3,2±2,2 (0-11), y destaca que más del 75% tienen con esta escala un riesgo de muerte moderado o alto.
El riesgo de muerte por comorbilidades, valorado con la escala de Yancik et al15
| Riesgo | n (%) |
| Sin riesgo | 7 (3,6) |
| Insignificante | 17 (8,7) |
| Bajo | 24 (12,2) |
| Moderado | 77 (39,1) |
| Alto | 72 (36,6) |
La puntuación ASA fue 1 en 9 (4,6%) pacientes, ASA 2 en 89 (45,6%), ASA 3 en 77 (39,5%) y ASA IV en 20 (10,3%).
Datos relacionados con la cirugíaUn cirujano coloproctólogo intervino quirúrgicamente a 84 (39,4%) pacientes, 85 (39,9%) fueron operados por cirujanos generales, no especificamente dedicados a la coloproctología, y 44 (20,7%), por cirujanos jovenes tutelados por un cirujano experto. La técnica quirúrgica realizada fue hemicolectomía derecha en 82 (38,5%) pacientes, hemicolectomía izquierda en 24 (11,2%), sigmoidectomía en 74 (34,7%), intervención de Hartmann en 8 (3,8%) y otras colectomías en 24 (11,3%). Todas las cirugías se realizaron por laparotomía (cirugía abierta).
Por lo que respecta a la aparición de complicaciones, 50 (23,5%) pacientes tuvieron complicaciones en los primeros 30 días postoperatorios: respiratorias, 7 (3,3%); cardíacas, 4 (1,9%); infección de herida, 18 (8,5%); evisceración, 1 (0,5%); fallo de sutura, 3 (1,4%); fístulas, 6 (2,8%); hemorrágicas, 8 (3,8%); de estoma, 1 (0,5%), y miscelánea, 7 (3,3%). La mortalidad postoperatoria fue 2 (0,9%) pacientes.
Datos del tumorHan sido previamente publicados17. En la mayoría de los casos —200 (93,9%)— el tipo histológico del tumor es adenocarcinoma. El 46,9% de los tumores eran bien diferenciados; el 45,5%, moderadamente diferenciados y el 3,8%, pobremente diferenciados.
La localización tumoral era el colon derecho en 87 (40,9%) casos, el izquierdo en 121 (56,8%) y 5 (2,4%) tenían neoplasias dobles o triples. El estadio tumoral fue I en 10 (4,7%) pacientes, II en 25 (58,7%) y III en 78 (36,6%). No existen diferencias estadísticamente significativas por lo que respecta al estadio tumoral entre grupos de IMC.
SeguimientoEl seguimiento en CC ha sido de 13,2 años, con un promedio de 5,8 años; 59 pacientes (23,5%) presentaron una recurrencia tumoral en el seguimiento. La supervivencia media por grupos de IMC se muestra en la tabla 4.
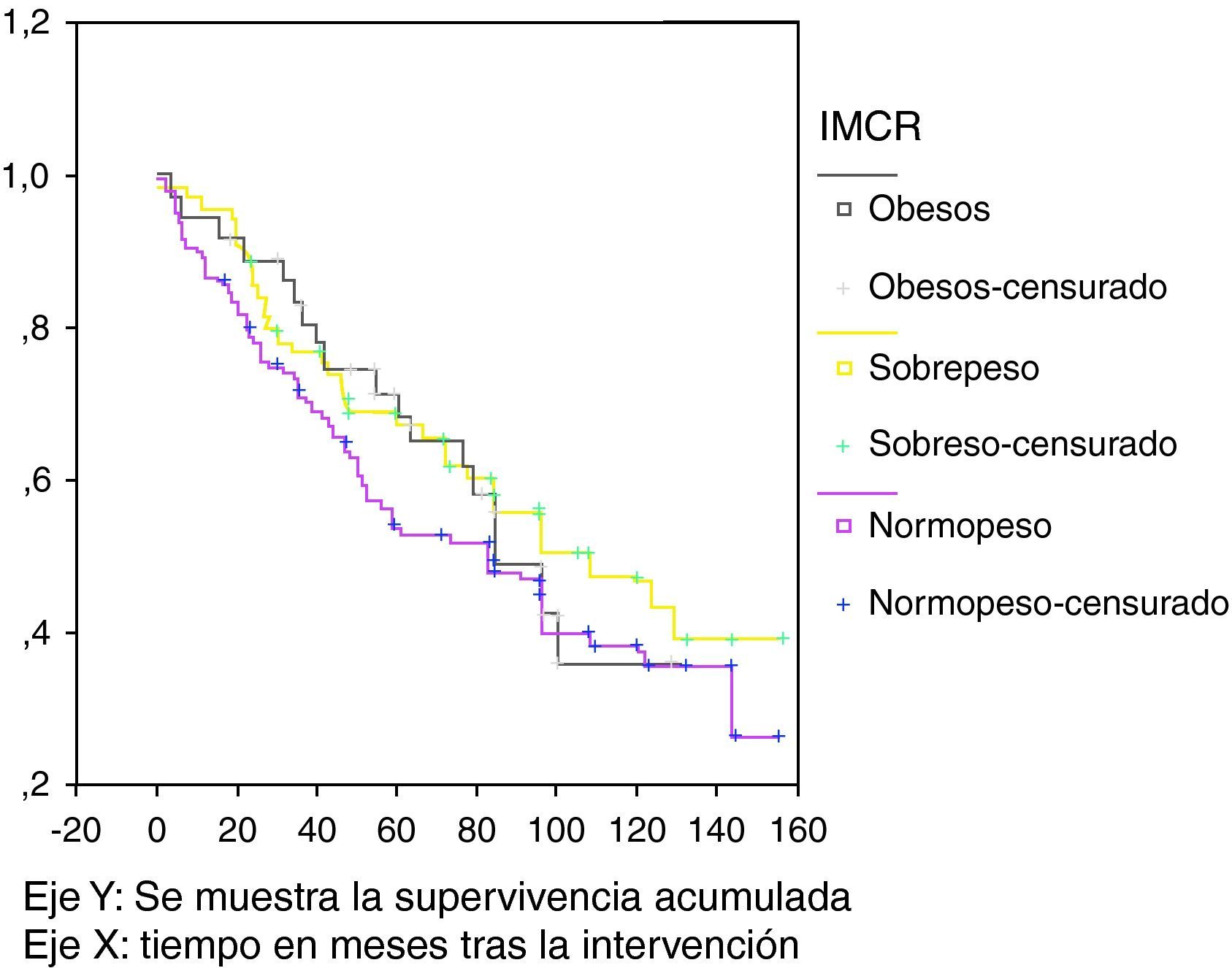
Estudio bivariableCómo ha influido cada variable en la supervivencia de la serie se muestra en la tabla 2. En la figura 1 se muestran las curvas de supervivencia (Kaplan-Meier) por grupos de IMC. Entre los valores significativamente asociados a la supervivencia, destacamos la inmunidad celular; sin embargo, los niveles de C3, C4, IgG, IgA o IgM o hatoglobina no influyeron. Sí influyeron en la supervivencia los niveles de proteínas y albumina, así como α1-antitripsina (p=0,001). La presencia de complicaciones y la necesidad de transfusión se asociaron a la supervivencia y, como era esperable, los parámetros relacionados con el estadio tumoral también. Es importante observar que la presencia de comorbilidades tiene un fuerte impacto en la supervivencia, ya sea valorado con el método de Yancik o con la clasificación ASA.
Estudio bivariable de supervivencia
| Factor | p |
| Edad | < 0,001 |
| Sexo | 0,343 |
| Antecedentes personales cirugía | 0,561 |
| Test de inmunidad celular | 0,046 |
| IMC | 0,691 |
| Proteínas totales preoperatorias | < 0,001 |
| Albumina preoperatoria | < 0,002 |
| Otros parámetros de laboratorio (se indican sólo los valores significativos) | |
| CA19.9 | 0,012 |
| Transferrina | 0,042 |
| α1-antitripsina | 0,001 |
| Transfusiones de hemoderivados | 0,007 |
| Tipo de cirujano | 0,115 |
| Técnica quirúrgica empleada | 0,041 |
| Días de ingreso hospitalario | 0,056 |
| Complicaciones intraoperatorias | 0,015 |
| Complicaciones postoperatorias | 0,031 |
| Estadio tumoral TNM | 0,027 |
| Localización tumoral | 0,287 |
| Tipo histológico | 0,05 |
| Grado de diferenciación tumoral | 0,987 |
| Tipo de infiltración tumoral | 0,01 |
| Número de ganglios estudiados | 0,055 |
| Número de ganglios afectados | < 0,001 |
| Recurrencia tumoral | < 0,001 |
| Número total de comorbilidades | 0,013 |
| Riesgo de muerte asociado a las comorbilidades | 0,072 |
| Puntuación ASA | < 0,001 |
IMC: índice de masa corporal.
Las variables incluidas en el modelo final de Cox y su influencia relativa en la supervivencia se muestran en la tabla 3. Las variables asociadas a la supervivencia en nuestro modelo de Cox (análisis multivariable) fueron: el estadio TNM, la puntuación ASA preoperatoria, el estado de la inmunidad celular preoperatoria y la técnica quirúrgica realizada.
Modelo de Cox y su influencia relativa en la supervivencia
| Variable | HR (IC del 95%) | p |
| Edad (años) | 1,02 (1,00-1,05) | 0,034 |
| IMC | ||
| Normopeso | 1 | |
| Sobrepeso | 0,64 (0,38-1,09) | 0,103 |
| Obesos | 0,8 (0,42-1,52) | 0,509 |
| Puntuación ASA | 1,59 (1,17-2,17) | 0,003 |
| Técnica quirúrgica | ||
| Hemicolectomía derecha | 1 | |
| Hemicolectomía izquierda | 1,11 (0,66-1,86) | 0,682 |
| Intervención de Hartmann | 3,72 (1,41-9,78) | 0,008 |
| Otras técnicas | 1,43 (0,7-2,93) | 0,322 |
| TNM | 1,31 (1,13-1,52) | < 0,001 |
| Inmunidad celular | 0,72 (0,58-0,91) | 0,007 |
| Transfusiones | ||
| No | 1 | |
| Sí | 1,37 (0,83-2,26) | 0,215 |
| Cirujano | ||
| Coloproctólogo | 1 | |
| General | 1,3 (0,81-2,08) | 0,269 |
| «Joven» tutelado | 1,74 (0,81-3,73) | 0,149 |
| α1-antitripsina | 1,13 (0,67-1,88) | 0,636 |
| CA19.9 | ||
| Normal < 50 | 1 | |
| Patológico > 50 | 1,36 (0,81-2,28) | 0,241 |
| Proteínas totales preoperatorias | ||
| Normal > 6,6 | 1 | |
| Patológico < 6,6 | 1,14 (0,72-1,81) | 0,577 |
HR: hazard ratio; IC: intervalo de confianza; IgA: inmunoglobulina A; IMC: índice de masa corporal.
Hay evidencia científica de que la obesidad y el sobrepeso claramente disminuyen la expectativa de vida de la población general que la padece18. De los distintos métodos para evaluar el grado de obesidad, el IMC es el más internacionalmente aceptado por su facilidad de uso, entre otros motivos13. Aunque también tiene limitaciones para valorar la obesidad (p. ej., la inclusión en la categoría de obesos de personas con mucha masa muscular).
IMC y meses de SPV en CC
| Pacientes, n (%) | Meses de supervivenciaa | |
| Normopeso | 105 (49,3) | 85 (6) 1-156 |
| Sobrepeso | 70 (32,9) | 98,6 (7,2) 1-157 |
| Obesidad | 36 (16,9) | 85,5 (7,6) 4-131 |
Actualmente, para evaluar el riesgo de morbimortalidad que puede tener un paciente en función de su exceso de peso, hay que realizar una valoración individualizada, y ese riesgo dependerá principalmente de la distribución de la grasa corporal, el exceso de peso presente y la presencia de otras comorbilidades, especialmente las que son factores de riesgo cardiovascular19. Por otro lado, en los pacientes con CC, las comorbilidades presentes también pueden llegar a influir en el manejo diagnóstico y terapéutico15,20. Por lo tanto, es fundamental analizar detalladamente la existencia de esas comorbilidades, y eso es lo que hicimos, para cada uno de los pacientes de nuestra serie. Utilizando la clasificación ASA y el índice de comorbilidad de Yancik et al15, descrito previamente por esos autores para evaluar impacto de las comorbilidades en la supervivencia de pacientes con CC.
En nuestro estudio hemos apreciado que, coincidiendo con lo esperado, la supervivencia en el CC está influida por el número de comorbilidades del sujeto, ya sea valorándolas con la puntuación ASA o con el sistema de Yancik et al15. Por lo tanto, parece obvio que los pacientes obesos, al tener mayor número de comorbilidades con importante repercusión en el estado de salud, deben tener una peor supervivencia, pero nuestros resultados no apoyan esta afirmación, ya que la obesidad medida con el IMC en el estudio bivariable o en el multivariable no se ha mostrado como factor pronóstico importante de supervivencia en el CC.
Existen otros estudios en que la obesidad valorada con el IMC no sólo no se muestra como factor de mal pronóctico, sino que puede influir positivamente en la supervivencia. Es el caso de los estudios de Ogino et al, en los que aprecian incluso una supervivencia mayor en los pacientes obesos con cáncer de colon, cuando tienen alteraciones del gen p27, la cual se da en el 84% de sus pacientes obesos, o cuando existe una expresión aumentada del gen STMN121,22. En el reciente trabajo de Healy et al, tampoco se identifican diferencias significativas entre el grupo de pacientes obesos y el de los no obesos cuando se valora la supervivencia, aunque en ese trabajo valoran conjuntamente a los pacientes con CC y con CR23.
El estudio australiano de 2006 de Haydon et al24, con 526 pacientes de cáncer colorrectal seguidos 5 años, analizó también la influencia de la obesidad en la supervivencia, y al igual que nosotros, no encontró un efecto negativo de la obesidad en la supervivencia, valorando también la obesidad con el IMC. Sin embargo, en ese mismo trabajo, cuando se valora la obesidad con el tamaño de la cintura o el porcentaje de grasa corporal medido por impedancia bioeléctrica, sí se detecta una peor supervivencia entre los pacientes con mayor perímetro de cintura o mayor porcentaje de grasa corporal. Por lo tanto, la influencia de la obesidad en la supervivencia parece estar más relacionada con otros parámetros que cuantifican el tipo de adiposidad presente mejor que el propio IMC, aunque en ese estudio, a diferencia del nuestro, el peso, la talla y demás parámetros antropométricos no son los existentes en el momento del diagnóstico ni en el momento preoperatorio, sino los presentes cuando se reclutó a los enfermos con otro objetivo (estudios de la influencia de factores epidemiológicos y cáncer), por lo que puede haber cambiado el grado de obesidad del individuo en ese periodo, que en algunos casos fue de años.
Meyerhardt et al12, sin embargo, publicaron un trabajo donde si aprecia una influencia significativa de la obesidad, valorada con el IMC, en la supervivencia global de sus pacientes con CC, pero sólo cuando se trata de mujeres. Nosotros no hemos apreciado influencia del IMC en la supervivencia cuando hemos analizado por separado a varones y mujeres, aunque podría influir el menor número de casos de nuestra serie (n=213), comparado con el de Meyerhardt et al (n=3.759).
En ese estudio existen además otras diferencias respecto al nuestro que los hacen no comparables. Ellos determinan el peso y la talla del paciente en el momento de iniciar la quimioterapia, y no en el preoperatorio como nosotros, y excluyen a los pacientes en estadio I (nosostros los incluimos), y la serie está compuesta por los enfermos incluidos en un ensayo clínico que comparaba diferentes regímenes de adyuvancia.
Pero en 2008 Meyerhardt et al25 publicaron un nuevo estudio con 1.053 pacientes en estadio III de CC, y en este caso no encontraron influencia del IMC en la mortalidad a largo plazo. Sinicrope et al26 en 2010 sí hallaron diferencias de supervivencia en 4.381 pacientes con CC tratados con quimioterapia en función del IMC. Así, los varones con IMC > 35 muestran peor supervivencia global, y las mujeres también con IMC 30-35. Nosotros no hemos encontrado estas diferencias, tal vez por el menor número de pacientes que forman nuestro estudio.
Además de existir datos no concluyentes sobre la influencia del IMC en la supervivencia de pacientes con CC, debemos cuestionarnos sobre todo su idoneidad como medida de obesidad, ya que no diferencia entre los distintos tipos de distribución de la grasa corporal.
A este respecto, existen trabajos27 que indican su gran importancia en cuanto a la influencia en el pronóstico de los pacientes obesos. En especial por lo que al riesgo cardiovascular se refiere. Así, en España, un índice cintura/cadera (C/C) > 1 en varones y > 0,9 en mujeres se asocia con un mayor riesgo cardiovascular.
El síndrome metabólico se define como una serie de comorbilidades que se asocian a la obesidad abdominal (hipertensión arterial, dislipemia aterogénica y resistencia a la insulina)28. La importancia de este síndrome es el elevado riesgo de diabetes y/o enfermedad cardiovascular que confiere a los pacientes que lo padecen. Esto tiene una indudable repercusión negativa en la expectativa de vida de esos pacientes.
Otra consideración que habría que tener en cuenta a la hora de definir la obesidad es la edad del paciente, puesto que conforme aumenta la edad de las personas, aumenta el peso y también el peso ideal, y este hecho queda reflejado en los estudios epidemiológicos como el SEEDO 200719. La edad media de nuestra serie es de 66,3 años. Por lo tanto, la clasificación de la obesidad de la OMS o la modificada por la SEEDO parece que no serían del todo apropiadas para esta subpoblación, puesto que el peso ideal real podría ser más alto que el indicado en dichas clasificaciones. Aunque este «error» en la definición de obesidad, al no ajustar el IMC ideal del paciente a la edad, es un problema general de los estudios que tratan el tema que nos ocupa.
En el metaanálisis de Heiat et al29, también queda reflejado este hecho, al apreciar que el impacto que el exceso de peso tiene en la salud es menor en la población anciana que en la población adulta general.
Como debilidades de nuestro estudio, tendríamos que señalar que la base de datos original no fue creada con la idea del estudio que nos ocupa, por lo que recoge de manera prospectiva la mayoría de los datos, pero no así los de comorbilidades y mortalidad perioperatoria, por lo que esos datos se analizaron retrospectivamente con las limitaciones que eso supone. Por otro lado, sólo se incluyó en el estudio a los pacientes con peso y talla registrados preoperatoriamente, por lo que existe un mínimo sesgo, ya que se excluyó al 6,8% de nuestros pacientes por este motivo.
De este modo, tras la realización de nuestro análisis, podemos considerar que el IMC no es un factor pronóstico de supervivencia a largo plazo en pacientes con cáncer de colon. Sin embargo, sí lo son la biología tumoral, la puntuación ASA, la técnica quirúrgica realizada, la edad y el estado de la inmunidad celular del paciente.
No podemos pasar por alto la necesidad de establecer un método y el momento adecuados para la cuantificación de esa obesidad. Tal vez la utilización de otras medidas de obesidad distintas del IMC y más especificas de obesidad abdominal pueda poner de manifiesto una influencia negativa de la obesidad en la supervivencia a largo plazo de los pacientes con CC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el personal del servicio de Cirugía General y del Aparato Digestivo del Hospital Universitario de Girona, donde se ha realizado de manera excelente todo el proceso asistencial de los pacientes estudiados en este trabajo. A la Dra. María del Mar García Gil por el análisis estadístico de los datos.
El presente estudio está confeccionado con datos de la tesis doctoral del primer autor, leída el 11 de junio de 2009 y realizada en la Universitat Autònoma de Barcelona.