El instrumento ideal para realizar la transección hepática debería aunar en una sola herramienta hemostasia segura y rápida. Presentamos nuestra investigación multidisciplinar encaminada al desarrollo de un dispositivo de transección hepática asistido por radiofrecuencia (RF); la investigación incluye: modelado teórico por computador, estudio experimental y ensayo clínico de este dispositivo. El modelado teórico se realizó por computador basado en el Método de Elementos Finitos (MEF) con objeto de estudiar la distribución de energía eléctrica y temperatura en el tejido y valorar el efecto de las características del instrumento. El estudio experimental basado en un modelo in vivo porcino sugiere que el nuevo instrumento permitiría aumentar la velocidad de transección del parénquima hepático con una menor hemorragia por área de transección al compararlo con otras técnicas ampliamente extendidas en la cirugía hepática. Estos datos permitieron afrontar la realización de la primera fase de un ensayo clínico, cuyos resultados preliminares sugieren que el nuevo instrumento es seguro y eficaz.
The ideal instrument for performing hepatic transection should combine safe and rapid haemostasis in a single tool. We present a new multidisciplinary investigation designed to develop a hepatic transection device assisted by radiofrequency (RF); the investigation included: a computerised theoretical model, and experimental study and a clinical trial of this device. The theoretic modelling was performed by computer, based on the Finite Elements Method (FEM), with the objective of studying the distribution of electrical energy and temperature in the tissue, and to assess the effect of the characteristics of the instrument. The experimental study, based on an in vivo porcine model, suggested that the new instrument would allow the transection velocity of the hepatic parenchyma to be increased with lower bleeding per transection area compared with other techniques extensively used in liver surgery. These data should enable the first phase of clinical trial to be conducted, with preliminary results that suggest that the new device is safe and effective.
En los últimos años hemos visto proliferar múltiples instrumentos para realizar la transección hepática. Esto se traduce en dos cosas: por un lado, la preocupación de nuestro colectivo por disminuir la morbi-mortalidad relacionada con la cirugía directamente asociada, entre otros aspectos, con la hemorragia intraoperatoria y el tiempo quirúrgico; y por otro lado, la inexistencia de un instrumento único que agrupe las ventajas y evite los inconvenientes.
En cuanto al primer aspecto, hoy en día se dispone de múltiples evidencias que relacionan la hemorragia intraoperatoria y la necesidad de transfusiones con una elevada tasa de mortalidad1–3, complicaciones postoperatorias, sobre todo, de tipo infeccioso4–7 y un aumento del riesgo de recidiva tumoral8. Las unidades de cirugía hepática han tomado medidas encaminadas a reducir el binomio hemorragia/necesidades transfusionales y con ello han mejorado de forma progresiva los resultados obtenidos tras hepatectomia, con tasas de mortalidad inferiores al 5% en muchas de ellas6,9.
Respecto a los instrumentos de transección10 se pueden distinguir dos tipos: aquellos cuya función primordial es la disección (ej. pinza hemostática o disector ultrasónico) y aquellos cuya función más notable es la hemostasia-coagulación (ej. suturas, endograpadoras, selladoras, etc.)5,10–14. Dentro del segundo grupo, han surgido en los últimos años aquellos que utilizan la radiofrecuencia (RF) como fuente de energía (ej. Habib® o TissueLink®)3,6,7,15–18, hecho que supone el salto de la RF como estrategia ablativa-paliativa a la resectiva-curativa.
El objetivo del artículo es presentar nuestra investigación multidisciplinar, que incluye diseño y fabricación del instrumento desde la perspectiva de la ingeniería biomédica, estudio experimental en modelo animal y finalmente ensayo clínico con objeto de evaluar la seguridad y la efectividad clínica del nuevo instrumento asistido por RF para la transección hepática19–21.
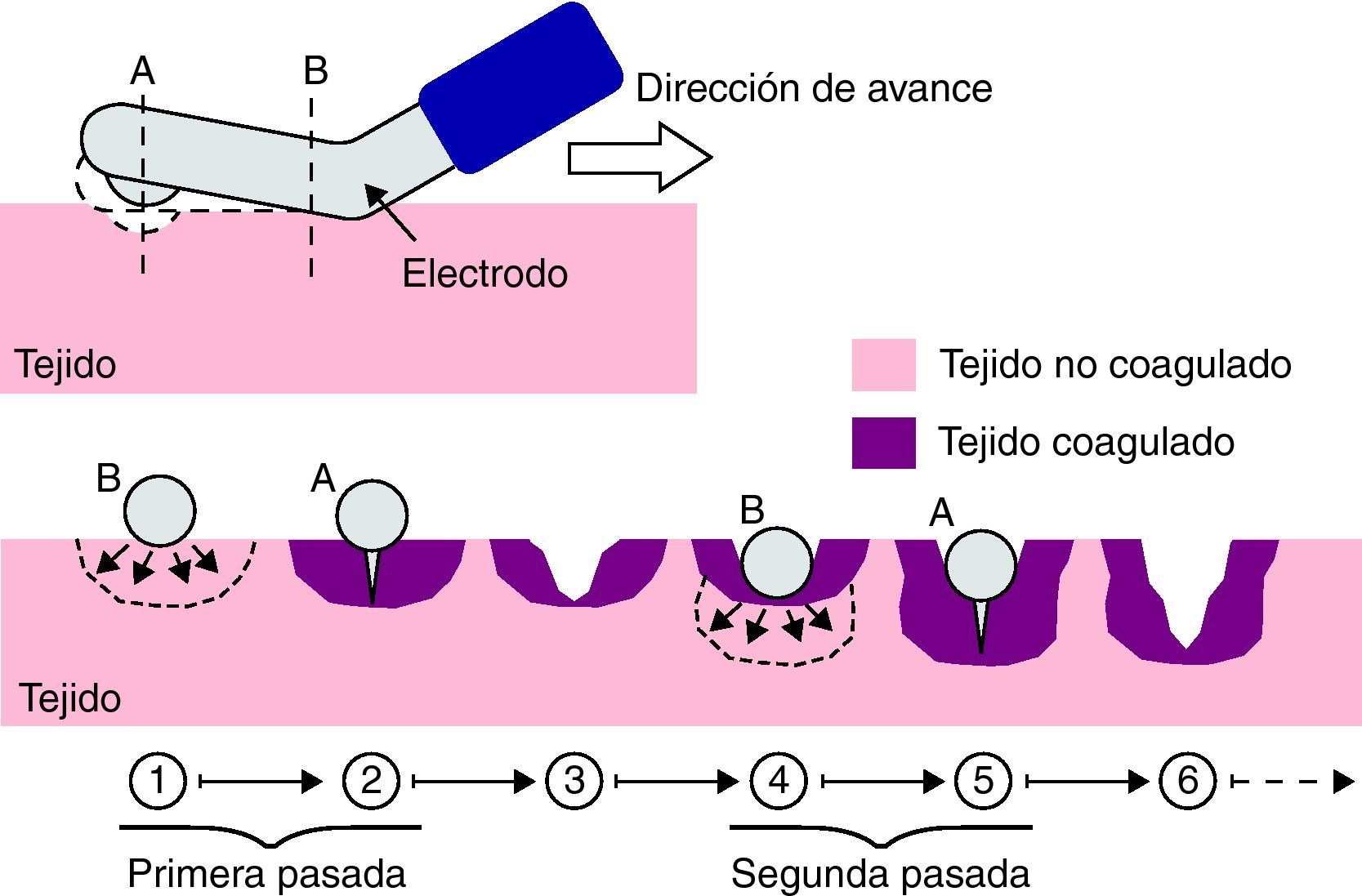
DesarrolloEl nuevo dispositivo Coolinside® (Apeiron Medical, Valencia, España) es un instrumento de mano que realiza simultáneamente la coagulación (mediante RF) y el corte (mediante bisturí frío) del hígado. Dicho instrumento y su manejo tanto para técnica laparotómica como laparoscópica han sido descritos en artículos previos19–23 (fig. 1). La coagulación se realiza mediante un electrodo metálico situado en el extremo distal, de punta redondeada, que es eléctricamente conectado a un sistema coagulador Cosman CC-1 (Radionics, Burlington, MA, EE. UU.) que opera a una potencia máxima de 90W. El corte se realiza mediante una fina hoja situada en el extremo distal.
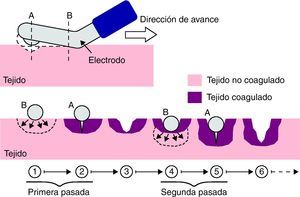
Esquema de funcionamiento del dispositivo Coolinside®. En la parte superior: vista lateral que muestra la sección distal con la hoja de bisturí y la coagulación con la parte proximal activa, así como su sentido de avance sobre el tejido. En la parte inferior: vista transversal de un fragmento de tejido coagulado y seccionado en dos aplicaciones secuenciales.
El electrodo activo tiene en su interior un circuito hidráulico cerrado con suero salino frío a 0°C que es impulsado hasta el extremo distal mediante una bomba de perfusión continua Radionics (Burlington, MA, EE. UU.) a una velocidad aproximada de 130mL/min. El líquido frío mantiene la superficie del tejido por debajo de 100°C, al refrigerar el electrodo activo. El retorno del suero calentado implica que en ningún momento el suero salino caliente pueda entrar en contacto con el paciente (como es el caso del dispositivo Tissuelink®).
La clave del funcionamiento del dispositivo está en que la profundidad de sección del parénquima hepático está adaptada al efecto coagulador generado por la porción proximal del electrodo activo, aquella que primero entra en contacto con el tejido (fig. 1). De este modo, cada vez que el cirujano desliza el dispositivo sobre la superficie del hígado, consigue la sección del parénquima y lo coagula de forma sincrónica.
Modelado teóricoEl modelado teórico ha sido ampliamente aceptado para estudiar el rendimiento electro-térmico de electrodos y aplicadores de RF sobre tejidos biológicos. La temperatura en el tejido se estima resolviendo la llamada Bioheat Equation, la cual incluye las características del tejido densidad, calor específico y conductividad eléctrica y térmica del tejido, así como el calor perdido por la perfusión continua de sangre. En nuestro caso las ecuaciones del modelo teórico fueron resueltas mediante el Método de los Elementos Finitos (MEF) mediante el programa comercial ANSYS (Canonsburg, PA, EE. UU.)19,22.
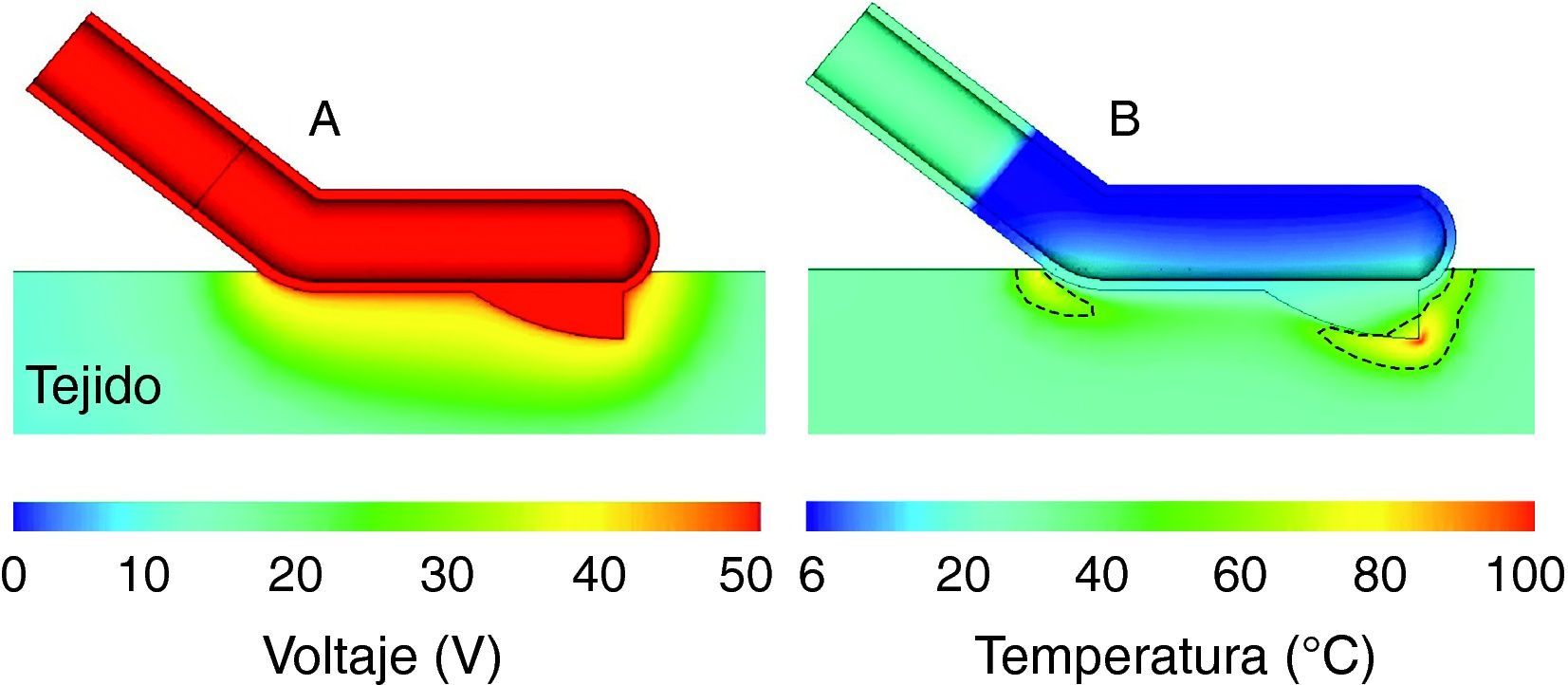
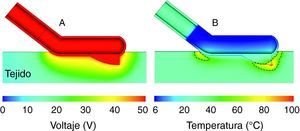
De esta forma se estimó la densidad de distribución de corriente en el tejido y, de forma subsecuente, la distribución de temperatura para diferentes condiciones de tejido, anatómicas, de protocolo de distribución de potencia eléctrica, etc. La figura 2 muestra un ejemplo de resultado de una simulación, en concreto de la distribución de temperatura en el tejido. Las dimensiones físicas del aplicador fueron calculadas teniendo en cuenta las dimensiones del tejido y la longitud del aparato. Conociendo los resultados del estudio teórico se ajustaron las características del prototipo definitivo, tanto para el abordaje laparotómico como para el laparoscópico (fig. 3).
Resultados de simulaciones por computador del modelo teórico del instrumento Coolinside®. Distribución de voltaje eléctrico A) y temperatura B) en el tejido a los 4 s de aplicación de 50V. Correspondiente. La línea discontinua representa la isoterma de 55°C que sirve como estimador del límite de lesión térmica. Obsérvese la tendencia a concentrarse la potencia en aquellas zonas con mayor gradiente espacial de voltaje (zona proximal y punta de la cuchilla). El modelado teórico permite valorar fácilmente diferentes diseños geométricos de electrodo, cuchilla, etc.
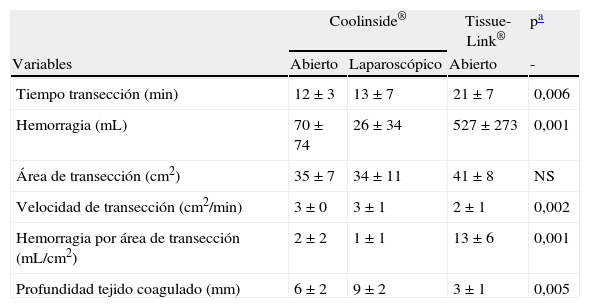
Tras la aprobación del estudio in vivo por el Comité Ético de Experimentación Animal local se realizaron 24 hepatectomías en 12 cerdos, repartidas de la siguiente manera: 16 hepatectomías parciales con el nuevo dispositivo de transección hepática como único método de sección (ocho mediante abordaje abierto en cuatro cerdos y otras ocho vía laparoscópica en otros cuatro animales), y las ocho restantes, utilizando como dispositivo de transección el dispositivo TissueLink® modelo DS 3.0 (Tissue-Link Medical, Doverm, NH, EE. UU.)19,21. En todos los casos se evaluó la eficiencia de cada instrumento para la transección y la hemostasia sin necesidad de aplicar otros instrumentos (a menos que la hemorragia durase más de 2 min) mediante el registro de las variables: tiempo de transección, volumen de hemorragia, área de transección, velocidad de transección, hemorragia ajustada al área de transección y profundidad del tejido coagulado.
Durante la transección del hígado se encontraron, al menos, una o dos venas de diámetro mayor a 5mm. Con TissueLink®, en 7 de las 8 transecciones se precisó asociar algún punto de sutura para conseguir la hemostasia. En cambio, con Coolinside® no fue necesario asociar ningún punto de sutura ni otras maniobras para lograr la hemostasia completa (sin diferencias para los dos tipos de abordaje). Por otro lado, tal y como se muestra en la tabla 1, Coolinside® consiguió incrementar la velocidad de transección hasta en un 30%, comparado con TissueLink®. Pero lo que es más importante aún, la media de hemorragia por área de transección fue casi 7 veces menor en el grupo en que se utilizó Coolinside® respecto al que se usó TissueLink®. Todos los animales toleraron bien el procedimiento, siendo sacrificados posteriormente.
Resultados del estudio in vivo en el animal de experimentación comparando el Coolinside® con el Tissue-Link®. Se realizaron 24 hepatectomías en 12 cerdos, 8 con cada técnica
| Coolinside® | Tissue-Link® | pa | ||
| Variables | Abierto | Laparoscópico | Abierto | - |
| Tiempo transección (min) | 12±3 | 13±7 | 21±7 | 0,006 |
| Hemorragia (mL) | 70±74 | 26±34 | 527±273 | 0,001 |
| Área de transección (cm2) | 35±7 | 34±11 | 41±8 | NS |
| Velocidad de transección (cm2/min) | 3±0 | 3±1 | 2±1 | 0,002 |
| Hemorragia por área de transección (mL/cm2) | 2±2 | 1±1 | 13±6 | 0,001 |
| Profundidad tejido coagulado (mm) | 6±2 | 9±2 | 3±1 | 0,005 |
Las diferencias en las variables se consideraron significativas siempre y cuando p<0,05.
NS: no existe diferencia significativa.
Tras estas experiencias iniciales se realizaron algunas modificaciones de los accesorios que conforman el Coolinside®19. En primer lugar, se diseñó una caja de conexión que actúa como interfase entre el generador de RF y el instrumento, con el fin de evitar el cese del funcionamiento del generador cuando la impedancia del tejido sobrepasa un valor determinado, ya sea por la liberación de potencia de RF sobre el tejido, ya por la aplicación simultánea de otros instrumentos (como, por ejemplo, TissueLink®), cosa que suele ser habitual en la cirugía hepática.
Por otro lado, para evitar problemas con el rango de impedancia del tejido, la caja de conexiones incluye resistencias internas que equilibran y mantienen la impedancia total «observada» por el generador de RF dentro de unos rangos adecuados para el generador, incluso en condiciones extremas de cortocircuito y circuito abierto. La caja de conexión permite también que el Coolinside® se accione mediante un pedal y no mediante el panel frontal del generador de RF.
Ensayo clínicoDado que los resultados del estudio in vivo fueron satisfactorios, se decidió llevar a cabo un ensayo clínico (registro: AGEMED 312/08 EC) con la previa aprobación por el Comité Ético de Ensayos Clínicos del Hospital del Mar y por la Agencia Española del Medicamento y de Productos Sanitarios (AEMPS)23.
En síntesis, el ensayo clínico consta de dos fases: la primera, denominada «de seguridad», en la que se incluyen 8 pacientes; y la segunda, denominada «de eficacia», que incluye 18 pacientes y se encuentra en vigor actualmente (razón por la que no se aportarán datos en este artículo). Los criterios de inclusión de los pacientes, así como el modo de recolección de datos, se encuentran detalladamente explicados en artículos previos. Cabe destacar, en cuanto a los criterios de inclusión, que en la primera fase eran más restrictivos y que, a la vista de los satisfactorios resultados obtenidos de la misma, se han ampliado de manera que en la segunda fase, actualmente en curso, ya se incluye cualquier tipo de hepatectomía con el nuevo instrumento.
Entre septiembre de 2008 y mayo de 2009 se realizaron con el Coolinside® 11 hepatectomías que incluyen un total de 12 tumores en ocho pacientes (5 varones y 3 mujeres) cuya edad media es de 69,4 años (61-78 años). El diámetro medio tumoral fue de 2,07cm (rango 0,8-6cm). De todos ellos se recogieron una serie de variables preoperatorias e intraoperatorias entre las que destacan las referidas para el estudio in vivo y, finalmente, variables del curso postoperatorio tanto analíticas como clínicas (complicaciones según escala de gravedad de Clavien24 y mortalidad).
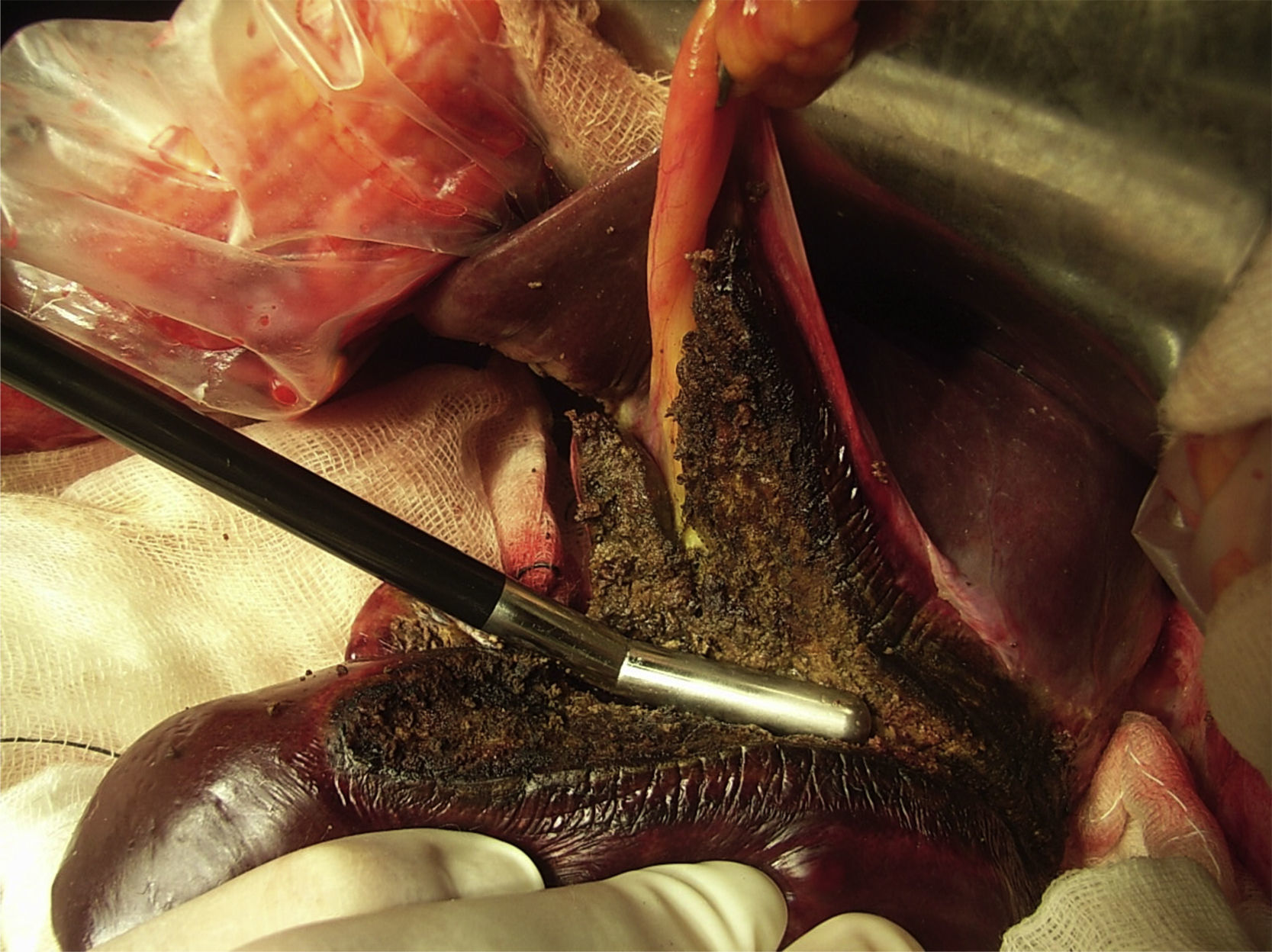
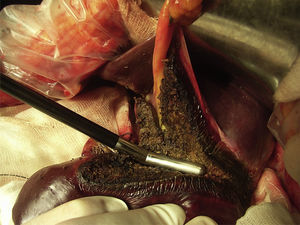
En cuanto a la cirugía, cabe decir que todas las hepatectomías fueron completadas únicamente con este instrumento (fig. 4), sin asociar ningún otro (esto incluye ligaduras o clips) y en ausencia de estrategias de oclusión vascular temporal (maniobra de Pringle). El tiempo medio de resección en cada paciente fue de 51 min (rango 38-87min) y la velocidad media de transección fue de 1,28cm2/min, si analizamos los datos para cada hepatectomía, el tiempo medio de transección hepática fue de 39,9 min (rango 13-65min), siendo la velocidad de transección por cm2 de 1,18 min (rango: 0,49-1,73). En 4 de los pacientes se realizó algún otro acto quirúrgico asociado (tabla 2). La hemorragia intraoperatoria media relacionada con la sección hepática fue de 42,5mL (rango 5-420mL), siendo la hemorragia media ajustada al área de transección de 0,79mL/cm2 (rango 0,05-7,37mL). Ninguno de los ocho pacientes precisó transfusión de hemoderivados durante la cirugía ni en el postoperatorio.
Características de la cirugía y el postoperatorio de los pacientes incluidos en el ensayo clínico (Fase I)
| Experiencia | Cirugía hepática | Cirugía asociada | Complicaciones (Clavien) | Días estancia |
| 1 | Resección limitada | Cierre de estoma | Infección de herida (I) | 9 |
| 2 | 2 resecciones limitadas | Ligadura de la porta izquierda | — | 6 |
| 3 | Bisegmentectomía 2-3 | Resección anterior recto+histerectomía+cistectomía parcial | Dehiscencia anastomótica. Reintervención: Hartman (IIIb) | 33 |
| 4 | 2 resecciones limitadas | — | — | 6 |
| 5 | Bisegmentectomía 2-3 y resección limitada | — | — | 6 |
| 6 | Resección limitada | — | Enterocolitis (II) | 18 |
| 7 | Resección limitada | Eventroplastia | Seroma (I) | 4 |
| 8 | Bisegmentectomía 6-7 | — | — | 4 |
En lo que respecta a curso postoperatorio y complicaciones, cabe decir que ninguna de ellas se relaciona directamente con el procedimiento hepático. Dichas complicaciones, en la mayoría de los casos, están relacionadas con los otros procedimientos quirúrgicos asociados (tabla 2). Cabe destacar que no hubo fuga biliar en ninguno de los pacientes incluidos. La mortalidad fue nula.
DiscusiónEl despliegue, en los últimos años, de nuevos y diferentes instrumentos ideados para la transección hepática no es más que el reflejo de una problemática subyacente, a través del cual se muestra nuestra preocupación por mejorar los resultados de este complejo tipo de cirugía que históricamente ha asociado elevada morbi-mortalidad10,11.
Reducir las complicaciones potencialmente asociadas a la cirugía hepática es muy importante, más cuando en los últimos años se ha producido un cambio en la estrategia del tratamiento de las metástasis hepáticas, que supone un aumento de este tipo de intervenciones. El porcentaje de pacientes tributarios a cirugía de las metástasis hepáticas se ha doblado desde la Conferencia-Consenso de San Francisco, pasando del 20-25% al 58% que aparece en las series más recientes. Esto se debe a la ampliación de los criterios de resecabilidad en los que se tiene en cuenta «lo que se deja» en lugar «de lo extirpado», tendiéndose a llevar a cabo cirugías más económicas/conservadoras del parénquima hepático.
La ampliación de los criterios de resecabilidad ha hecho aumentar sustancialmente la cantidad de resecciones no anatómicas que, por su parte, se asocian a mayor hemorragia intraoperatoria. Sin duda, la hemorragia intraoperatoria es una de las grandes batallas/temores del cirujano hepático ya que se relaciona con una elevada morbi-mortalidad tanto a corto como a largo plazo y una disminución de la supervivencia libre de enfermedad1,2. Para solventar este problema, surgen diferentes instrumentos, todos ellos con algunas ventajas individuales que se potencian al aliarlos entre sí, convirtiéndose este tipo de cirugía en laboriosa.
De los distintos instrumentos de transección hepática, destacamos los que utilizan la RF como fuente de energía (Habib®, Inline® o Tissuelink®), hecho que ha logrado reducir de forma significativa la hemorragia intraoperatoria4,6,7,25–29, sobre todo si se asocian a otros dispositivos (suturas o clips) para completar la hemostasia de las ramas venosas o portales. En el contexto de la creación de instrumentos específicamente ideados para la transección del hígado, nuestro grupo presenta y describe una nueva técnica cuya fuente de energía es también la RF y cuya característica principal es aunar en un único instrumento la sección del parénquima y la hemostasia sin precisar ningún otro método asociado para conseguirlo, ni siquiera las maniobras de oclusión vascular temporal19–23. La eficacia del nuevo instrumento ha sido probada en el animal de experimentación y optimizada mediante modelado teórico para posteriormente aplicarlo, con buenos resultados, en el paciente.
En el ensayo clínico que aquí se presenta se demuestra que la hemorragia ajustada al área de transección es menor (0,79mL/cm2, rango: 0,05-7,37) que los datos presentados por otros grupos en diferentes estudios realizados con instrumentos ampliamente validados y utilizados. Bien es cierto que esta aseveración debe ser tomada todavía con cautela ya que nuestro trabajo, al tratarse de un estudio de seguridad, no dispone de grupo control.
En referencia a la velocidad de transección nos hallamos en una situación similar. Los datos disponibles apuntan a que el instrumento propuesto, cuando es empleado de forma aislada, está en el mismo rango de velocidad que otras combinaciones de instrumentos. Por otra parte, es más que probable que esa velocidad pueda ser aumentada con la generalización del procedimiento, hecho que se pudo constatar en el estudio in vivo19,20.
Otro dato también que destacar de la primera fase del ensayo clínico es que no hubo ninguna complicación de fuga biliar. Señalamos este aspecto pues se trata de una temida y relativamente frecuente complicación de este tipo de cirugía (supone hasta el 12% en algunas series30–32). Sin duda, su ausencia en nuestra serie está en relación con la precoagulación de hasta 5mm de profundidad en el plano de sección del hígado que queda, y el subsecuente sellado de vasos y probablemente de conductos biliares debido a la similitud histológica del ducto. No obstante, hemos de ser cautos en la interpretación de este resultado favorable, ya que probablemente también se halle relacionado con el número de pacientes, así como con la proporción de resecciones realizadas (mayor número de resecciones limitadas que resecciones regladas).
Las ventajas potenciales de la tecnología Coolinside® parecen evidentes: se dispone de una herramienta que permite reducir la hemorragia intraoperatoria y aumentar la velocidad de transección, ya que se trata de un instrumento que aúna la coagulación y el corte y no es preciso combinarlo con otros (ni siquiera puntos de sutura ni clips). Por otra parte, tampoco es necesario realizar maniobras de oclusión vascular, la coagulación del parénquima es homogénea, y por último, existe la posibilidad de utilizarlo en el abordaje laparoscópico. Todo esto, sin duda, simplifica la técnica; pero no hemos de olvidar que la sencillez del método no exime de la experiencia y pericia del cirujano.
Pero al lado de esas ventajas, también quedan patentes una serie de limitaciones. Al igual que otros instrumentos que utilizan RF, la precoagulación del tejido puede alterar las estructuras de manera que sea difícil la identificación de vasos o conductos hepáticos principales33. Además, la cantidad de tejido hepático sacrificado puede ser mayor que en otras técnicas, ya que con este dispositivo la zona coagulada puede alcanzar hasta 5mm, hecho que podría limitar aunque no contraindicar la aplicación de esta técnica en pacientes cirróticos. Obviamente con este dispositivo, como en cualquier otro que utiliza la electricidad como fuente de energía, deben extremarse las precauciones para evitar errores en la colocación de electrodos dispersivos. Una última limitación está relacionada con la aplicación clínica del dispositivo. Los datos disponibles hasta el momento se ciñen al estudio de seguridad, lo que sugiere que el Coolinside® es un dispositivo seguro para la transección hepática. Sin embargo, su utilidad final deberá ser contrastada en estudios comparativos con las herramientas habituales.
Los resultados de este estudio multidisciplinario que incluye todas las fases de diseño y prueba de un instrumento ideado para la transección hepática sugieren la seguridad del dispositivo, la falta de necesidad de asociar otro instrumento para obtener la hemostasia, y apuntan, a la espera de concluir el estudio de eficacia, a una reducción de las pérdidas hemáticas y a un aumento de la velocidad de transección con respecto a otros instrumentos disponibles hoy en el mercado.
FinanciaciónLos autores agradecen al Ministerio de Ciencia e Innovación el apoyo financiero otorgado mediante el Programa de Proyectos de I+D+i (Proyecto n.° TEC2008-01369/TEC), y el Programa de Promoción de la Investigación Biomédica y en Ciencias de la Salud (Proyecto n.° PI080934).
Conflicto de interesesLos doctores F. Burdío y E. Berjano declaran que poseen un interés en Apeiron Medical, una compañía que tiene una licencia para la solicitud de patente EP2145597A1, sobre la cual está basada el dispositivo Coolinside® descrito en este artículo.