La implicación de los microorganismos en el cáncer humano se conoce desde hace más de un siglo y diferentes tipos de parásitos, bacterias y virus se han relacionado con procesos oncogénicos. Dentro de las bacterias, la primera reconocida como carcinogénica fue Helicobacter pylori, que causa cáncer gástrico y podría estar relacionada con cánceres extragástricos en el hombre. Helicobacter hepaticus se ha relacionado con cánceres hepáticos utilizando modelos animales. Otras bacterias, como Chlamydia psitacii, Borrelia burgdorferi y Streptococcus bovis, se han relacionado con cánceres oculares, de piel y colorrectal, respectivamente. Además, una bacteria comensal del intestino humano, Bacteroides fragilis, se ha vinculado muy recientemente con el cáncer colorrectal utilizando modelos animales.
Microorganism involvement in cancer has been known for over a century, and different types of parasites, bacteria and viruses have been associated with oncogenic processes. Among the bacteria, the first recognised was Helicobacter pylori which causes gastric cancer and might be related to extra-gastric cancer in humans. Helicobacter hepaticus has been associated with liver cancers using animal models. Other bacteria such as, Chlamydia psitacii, Borrelia burgdorferi and Streptococcus bovis have been associated with ocular, skin and colorectal cancers, respectively. Also, a commensal bacterium in the human intestine, Bacteroides fragilis, has been linked, very recently, with colorectal cancer using animal models.
El descubrimiento de que los microorganismos producían enfermedades fue uno de los principales hitos de la Microbiología en el siglo xix y, ya a finales de ese siglo, los microbiólogos buscaron en estos organismos el origen de muchas enfermedades, incluido el cáncer. Varios autores han llevado a cabo recientemente revisiones sobre los microorganismos que causan cáncer en el hombre1–3, entre los que cabría destacar a Zur Hausen, galardonado en 2008 con el Premio Nobel de Medicina por sus trabajos sobre el papilomavirus humano y su implicación en el cáncer de cérvix4,5. Las evidencias de que diferentes parásitos, virus y bacterias están implicados en cáncer humano son cada vez más numerosas (tabla 1) y los resultados de las últimas investigaciones indican la necesidad de profundizar en la investigación del papel de los microorganismos en el cáncer.
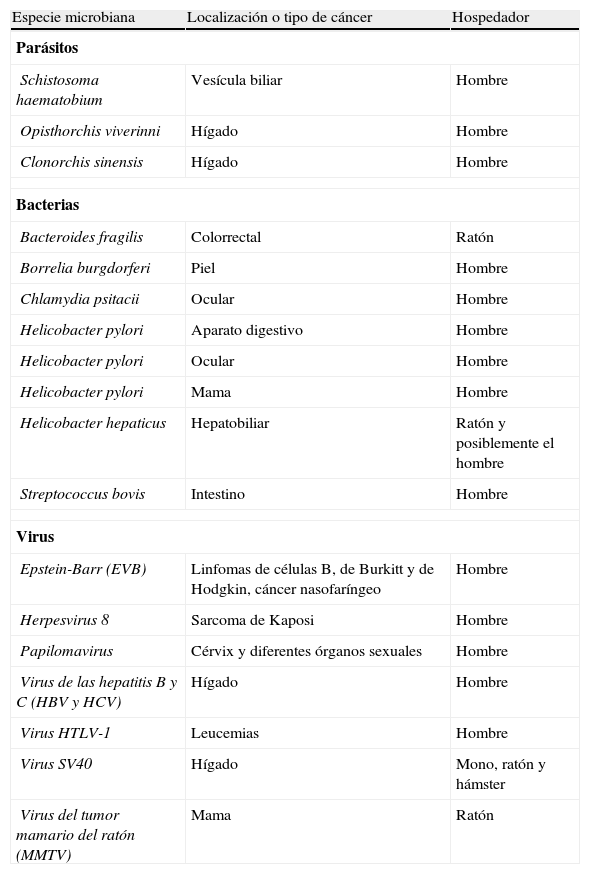
Microorganismos que han sido relacionados con diferentes cánceres
| Especie microbiana | Localización o tipo de cáncer | Hospedador |
| Parásitos | ||
| Schistosoma haematobium | Vesícula biliar | Hombre |
| Opisthorchis viverinni | Hígado | Hombre |
| Clonorchis sinensis | Hígado | Hombre |
| Bacterias | ||
| Bacteroides fragilis | Colorrectal | Ratón |
| Borrelia burgdorferi | Piel | Hombre |
| Chlamydia psitacii | Ocular | Hombre |
| Helicobacter pylori | Aparato digestivo | Hombre |
| Helicobacter pylori | Ocular | Hombre |
| Helicobacter pylori | Mama | Hombre |
| Helicobacter hepaticus | Hepatobiliar | Ratón y posiblemente el hombre |
| Streptococcus bovis | Intestino | Hombre |
| Virus | ||
| Epstein-Barr (EVB) | Linfomas de células B, de Burkitt y de Hodgkin, cáncer nasofaríngeo | Hombre |
| Herpesvirus 8 | Sarcoma de Kaposi | Hombre |
| Papilomavirus | Cérvix y diferentes órganos sexuales | Hombre |
| Virus de las hepatitis B y C (HBV y HCV) | Hígado | Hombre |
| Virus HTLV-1 | Leucemias | Hombre |
| Virus SV40 | Hígado | Mono, ratón y hámster |
| Virus del tumor mamario del ratón (MMTV) | Mama | Ratón |
Los primeros microorganismos relacionados con cáncer humano fueron distintos parásitos4. Concretamente, Opisthorchis felineus con cáncer de higado6, Bilharzia (esquistosomiasis) con cáncer de vejiga7 y Spirocerca lupi con granulomas en perro que pueden derivar a sarcomas8. Teniendo en cuenta los resultados de todos estos y otros estudios, la IARC (International Agency for Research on Cancer) concluyó que hay suficientes evidencias para implicar en el cáncer humano a Schistosoma haematobium y Clonorchis viverrini9. Actualmente Schistosoma haematobium es una de las principales causas de cáncer de vesícula biliar en Egipto y Opisthorchis viverinni y Clonorchis sinensis son factores importantes en colangiocarcinomas y carcinomas hepáticos en el sureste de Tailandia y en el sur de China5.
Después los virusLos siguientes microorganismos implicados en diferentes tipos de tumores fueron los virus4,5 y ya en 1898 M’Faydan y Hobday habían publicado la transmisión de verrugas entre animales10. En 1911 Rous demostró la transmisión de un tumor sólido, el sarcoma del pollo, con extractos libres de células11. A partir de este momento, otros virus fueron relacionados con la producción de tumores en animales, como el virus del tumor mamario del ratón12, los poliomavirus13, un virus que produce eritroblastosis en hígado de ratón adulto14 y el virus SV40, que, procedente de hígado de monos, al ser inoculado en hámsteres recién nacidos, provocaba en unos meses tumores invasivos15,16. Aunque en estos tumores no se reproducía el virus, se originaba un antígeno específico17 igual que sucedía en el caso de los tumores inducidos por el papilomavirus18.
En el caso del hombre, el primer virus oncogénico fue descrito por Burkitt, un cirujano que trabajó en África y detectó un linfoma en niños de determinadas áreas geográficas19. Después se descubrió que la causa era un virus20, posteriormente denominado Epstein-Barr, responsable de la mononucleosis infecciosa21. El desarrollo de las técnicas inmunológicas de detección de antígenos virales permitió descubrir altos títulos de anticuerpos en los pacientes con linfoma de Burkitt22 y en carcinomas nasofaríngeos23.
En los años 70 se consiguió la caracterización de un virus aislado de la leucemia mieloide aguda24 y se detectó la presencia del virus del tumor mamario del ratón en leche de mujeres y en cáncer de mama25. Posteriormente se descubrió la implicación del virus de la hepatitis B en el cáncer de hígado26, se identificaron retrovirus en una forma rara de leucemia humana27, se descubrió la implicación del papilomavirus en el cáncer de cérvix en mujeres4,5, la implicación del virus de la hepatitis C en cáncer de hígado28 y la del herpesvirus 8 como el más probable agente del sarcoma de Kaposi29.
Las bacterias después de los virusAunque la Bacteriología se desarrolló mucho antes que la Virología, los últimos microorganismos implicados en cáncer humano fueron las bacterias, ya que hasta 1905 no se publicaron los primeros resultados sobre el aislamiento de una bacteria a partir de tumores, a la que el cirujano Doyen30 denominó Micrococcus neoformans. Incluso preparó una vacuna que, según decía, curaba el cáncer y que fue aplicada por Wright, que describió la curación con esta vacuna de un caso de cáncer inoperable31. El grupo de Wright observó que las características de esta bacteria eran compatibles con las del género Staphylococcus32. Obviamente, las técnicas de aquella época para el diagnóstico del cáncer o la identificación de bacterias no eran lo suficientemente seguras para implicar a las bacterias del género Staphylococcus en cáncer, aunque sea causante de infecciones en pacientes con cáncer33,34 y se haya aislado, junto con otras bacterias, en tumores sólidos, como los de mama35.
El interés que despertó la implicación de varios virus en diferentes cánceres relegó el estudio de la de las bacterias en estas enfermedades a un segundo plano y, hasta finales del siglo xx, ninguna bacteria fue claramente relacionada con la producción de tumores, siendo Helicobacter pylori la primera bacteria considerada carcinogénica para el hombre. Su implicación en el cáncer gástrico fue descubierta en el año 199136–39 y en el año 1994 se reconoció a H. pylori como agente carcinogénico9. Algunos años más tarde se descubrió que la capacidad para producir cáncer gástrico estaba relacionada con la presencia de determinadas regiones en el genoma de la bacteria, denominadas islas de patogenicidad porque en sus extremos tienen secuencias de ADN directas repetidas que las separan del resto del genoma. Estas regiones están ausentes en cepas no patógenas, que pueden adquirirlas por transferencia genética40,41. Las islas de Helicobacter pylori pertenecen al sistema de secreción IV42,43, presente en otras bacterias patógenas como Agrobacterium tumefaciens, responsable de la formación de tumores en plantas superiores44.
A partir del descubrimiento de la implicación de H. pylori en cáncer gástrico, varias bacterias se han identificado en diferentes tipos de tumores, aunque todavía no se ha podido demostrar que sean la causa directa de la carcinogénesis, como ocurre en el caso de Chlamydia psitacii y diversos tipos de cánceres oculares45, Borrelia burgdorferi y linfomas de piel46, diferentes especies de Streptococcus y cáncer de colon y otros cánceres digestivos47,48 y, finalmente, entre Bacteroides fragilis y el cáncer colorrectal49.
Los postulados de Koch en el cáncerYa en el siglo xxi la investigación sobre bacterias posiblemente implicados en cáncer ha continuado, aunque básicamente centrada en Helicobacter pylori, sobre la que existen innumerables revisiones recientemente publicadas50–52. Demostrar que un microorganismo es capaz de inducir cáncer es difícil, ya que un agente infeccioso puede disparar los eventos iniciales de la oncogénesis pero estar ausente en el tumor final1,5. Desde que Robert Koch enunció sus famosos postulados, que deben cumplirse para asegurar que un microorganismo es responsable de un proceso infeccioso, solo en el caso de Helicobacter pylori se han podido demostrar en el hombre y únicamente en el caso de la gastritis. Y aún así, desde que se observó por primera vez esta bacteria en el estómago humano ligada a úlceras53 hasta que Marshall demostró los postulados de Koch tuvo que pasar más de un siglo54. Sin embargo, el reconocimiento de esta bacteria como carcinogénico de clase I llegó tan solo 9 años más tarde9. Actualmente, los postulados de Koch solo pueden cumplirse utilizando modelos animales, pero en muchas ocasiones ni siquiera se puede aislar al microorganismo responsable y ha de recurrirse a estudiar los genes microbianos presentes en las muestras de tejidos cancerosos. Por lo tanto, quizá sería conveniente redefinir los postulados de Koch cuando los microorganismos pueden no estar presentes en los tumores en el momento de su detección.
Bacterias implicadas en cáncer del aparato digestivoDespués de dos décadas de investigación, actualmente está plenamente aceptado el papel de H. pylori en determinados tipos de cáncer gástrico y la terapia de erradicación de esta bacteria forma parte del tratamiento de estos cánceres55–57. Numerosos estudios se han llevado a cabo para tratar de establecer los mecanismos concretos de la interacción de esta bacteria con el hombre58,59, sus factores de virulencia60,61 y el sistema de secreción al que pertenecen sus islas de patogenicidad62,63. Se ha demostrado, que el riesgo de cáncer gástrico producido por H. pylori se incrementa en los pacientes infectados con cepas que portan el gen cagA localizado en una isla de patogenicidad64. No obstante, la amplia distribución de esta isla en la población infectada con H. pylori arroja dudas sobre estos hallazgos y parece que hay diferencias entre los tipos de cánceres, siendo más evidente la relación de las cepas que portan la isla con los tumores gástricos con similitud morfológica con el tejido intestinal relacionada con las mutaciones p53 halladas en el cáncer de intestino65. Sin embargo, en los cánceres gástricos de tipo difuso están implicadas tanto cepas portadoras de la isla como las que no la contienen66. Además determinados alelos del gen vacA, implicado fundamentalmente en gastritis, también están relacionados con cáncer gástrico67,68. Aunque se han encontrado variaciones en las secuencias de los genes cag de la isla de H. pylori en algunas poblaciones, que dificultarían su uso en el diagnóstico de cepas virulentas de esta bacteria69,70, lo que sí parece claro es que la presencia de la isla completa en H. pylori está relacionada con síntomas gástricos más intensos71. Muy recientemente se ha confirmado además que la gastrina es un cofactor esencial en los cánceres gástricos inducidos por H. pylori en modelos animales72.
Teniendo en cuenta la gravedad y el incremento del cáncer gástrico en la última década en algunas regiones del mundo73, incluido el producido por H. pylori, se ha propuesto la erradicación de esta bacteria en todos los pacientes en los que esta se encuentre, aunque no se haya desarrollado el cáncer, ya que este es un proceso largo; en las primeras etapas se puede manifestar solo como una gastritis atrófica74 y se ha demostrado la curación de prácticamente todos los pacientes con linfomas gástricos tipo MALT57. Sin embargo, en otros tipos de cáncer gástrico, la erradicación de esta bacteria solo consigue reducir en un tercio su prevalencia75. Además la erradicación de esta bacteria no se consigue en todos los casos y los pacientes infectados con cepas que portan las islas de patogenicidad vacA y cagA presentan mayor fracaso en la erradicación61. Por ello, se han llevado a cabo numerosos estudios sobre los mecanismos implicados en la respuesta inmune del huésped ante la infección76 que faciliten el desarrollo de una vacuna que permita la prevención de los cánceres producidos por Helicobacter pylori77.
Teniendo en cuenta la relación de H. pylori con el cáncer de estómago, se ha planteado la posible implicación de esta bacteria en cáncer de órganos relacionados con el aparato digestivo, ya que se ha encontrado en bilis y vesícula biliar, postulándose la implicación de H. pylori en cánceres de estas vísceras en el hombre78. No obstante, se precisan más estudios y protocolos más estandarizados para detectar el ADN de la bacteria o bien anticuerpos anti-Helicobacter para poder relacionar esta bacteria con cánceres del tracto biliar79,80. En diversos estudios se ha hallado ADN de H. pylori en carcinomas hepáticos en el hombre, pero en algunos casos no se estableció exactamente la especie de Helicobacter presente en los mismos81–83. Otra especie del género Helicobacter, H. hepaticus, se ha implicado en cáncer hepatobiliar en modelos animales78,79,84,85. Muy recientemente, mediante técnicas de biología molecular e inmunología se ha descrito la presencia de H. hepaticus en vesícula biliar de pacientes con diferentes dolencias digestivas, incluido el cáncer gástrico86. En cuanto al cáncer de páncreas, los resultados son contradictorios, aunque se ha hallado una relación positiva entre la presencia de H. pylori y este tipo de tumores en individuos no fumadores ni bebedores87. En el caso del esófago y de la laringe los resultados indican que no existe relación con esta bacteria88,89.
El incremento del riesgo de padecer un cáncer colorrectal se ha relacionado con la infección con diversos microorganismos90, entre los que cabe destacar las bacterias H. pylori91 y Streptococcus bovis92, en el hombre, y H. hepaticus, en ratón93. No obstante, se necesitan más estudios para dilucidar si esta última especie puede causar este tipo de cánceres en humanos94. En el caso de Streptococcus bovis, su relación con el cáncer colorrectal está bien establecida desde la década de los 7047,95, aunque actualmente algunas cepas de esta especie se han reclasificado en S. infantarius y en S. gallolyticus96. De acuerdo con estudios epidemiológicos, se ha encontrado una relación muy alta en el caso de S. gallolitycus con cáncer de colon, mientras que S. infantarius presenta mayor correlación con cánceres de otros órganos relacionados con el aparato digestivo, como los de páncreas y de conductos biliares96. Otros estudios muy recientes han encontrado que S. gallolyticus juega un papel esencial en la progresión de una mucosa colorrectal normal a un adenoma y cáncer colorrectal97. Dado que las endocarditis producidas por Streptococcus están relacionadas con el cáncer colorrectal47,48,95, se ha propuesto que la colonoscopia debería ser obligatoria en casos de endocarditis por estos microorganismos98.
Además de estas bacterias, recientemente se ha publicado la inducción de tumores por Bacteroides fragilis, una bacteria comensal del intestino del hombre, cuyo papel en el cáncer colorrectal podría ser similar al de H. pylori en el cáncer gástrico. Se ha evidenciado que las cepas enterotoxigénicas de esta bacteria producen colitis e inducen la formación de tumores en el colon de ratones vía activación de linfocitos helper tipo T que podría estar implicada en la producción de cáncer también en humanos49.
Bacterias implicadas en cánceres extragástricosAunque la primera bacteria descrita como agente productor de cáncer podría corresponder a Staphylococcus aureus y algunos autores han pretendido relacionarla con el cáncer de mama32, nunca se ha demostrado su implicación en el cáncer humano; incluso en un reciente estudio utilizando cultivos celulares se ha comprobado que una proteína extracelular implicada en la adherencia de S. aureus puede prevenir las metástasis óseas del cáncer de mama99. No obstante, recientemente se han descrito casos de infección por S. aureus concomitante con cáncer de mama en los que no está muy clara la relación entre ambas enfermedades100. Además, también recientemente se ha descrito la presencia de papilomavirus tipo 16 (HPV-16) en el genoma de diferentes bacterias, incluyendo Staphylococcus aureus, aisladas a partir de cáncer de cérvix101. Los autores sugieren que la presencia de estos virus en el genoma bacteriano podría explicar la progresión de una infección por el HPV-16 a un cáncer cervical utilizando la bacteria como vector101.
Recientes investigaciones han relacionado también a H. pylori con cánceres extragástricos, como los de pulmón y mama102–104 principalmente vía inducción de la gastrina, que, aparte de una hormona, es un factor de crecimiento tumoral implicado en carcinogénesis y metástasis de estos dos tipos de tumores102,103. Conjuntamente, el estrés y los mastocitos localizados en la barrera hematoencefálica pueden desencadenar una serie de reacciones que facilitan el desarrollo de las metástasis cerebrales de tumores de pulmón y mama105. H. pylori está implicado en este proceso y se ha propuesto que su erradicación podría prevenir este tipo de metástasis cerebrales106.
La presencia de ADN de Borrelia burgdorferi en determinados linfomas ha conducido a sugerir una relación de esta bacteria con linfomas cutáneos no-Hodgkin46. Esta bacteria puede pervivir en la piel de los pacientes durante décadas y, ocasionalmente, se pueden desarrollar linfomas de células B y, adicionalmente, otras neoplasis de tipo carcinoma, por lo que se ha propuesto una relación de B. burgdorferi con este tipo de tumores107.
En los últimos años también se han relacionado diferentes bacterias con distintos tipos de cáncer ocular108 entre las que podemos destacar a H. pylori y Chlamydia. En cánceres oculares tipo MALT se han encontrado resultados contradictorios con respecto a la implicación de H. pylori, ya que algunos estudios sugieren una participación de esta bacteria109,110, mientras otros muestran resultados negativos111. Parece que Chlamydia está más probablemente implicada en los cánceres oculares y se ha propuesto su erradicación, junto con la de H. pylori, como tratamiento previo a terapias más agresivas46,109. Chlamydia psittaci es la única especie identificada por el momento en cánceres oculares tipo MALT109,111,112 y algunos autores han encontrado diferencias geográficas111, siendo positiva la relación entre esta bacteria y cánceres oculares en Italia46 y Austria112 y negativa en Estados Unidos113. Se piensa que estas discordancias pueden deberse a la metodología utilizada para la detección de las bacterias114. Algunos autores han hallado que otra especie, Chlamydia trachomatis, podría ser un factor de riesgo cuando coexiste con los papilomavirus en algunos tipos de carcinomas115. En el caso del cáncer de ovario parece que esta bacteria podría inducir una respuesta inflamatoria que desembocaría en diferentes tipos de cáncer, aunque los autores recomiendan realizar estudios más amplios116.
La metagenómica, nueva vía de detección de bacterias productoras de tumoresActualmente se admite que las bacterias pueden estar implicadas en diferentes tipos de cánceres; sin embargo, no es fácil detectarlas1 debido a múltiples causas, que incluyen el hecho de que el cáncer no es el resultado de una infección aguda y por tanto el agente causal puede no recuperarse a partir del tumor5. Sin embargo, el ADN vírico o bacteriano puede persistir durante bastante tiempo, bien en el propio tumor, bien en la zona peritumoral, por lo que las técnicas moleculares basadas en la amplificación de ADN bacteriano en los tejidos tumorales son las más comúnmente aplicadas para la detección e identificación de bacterias en tumores. Incluso se han propuesto técnicas de detección basadas en «encontrar» las secuencias correspondientes a ADN exógeno al tumor después de secuenciar fragmentos de ADN del mismo117–119. Es necesario asumir que pocas veces se van a poder cumplir los postulados de Koch, ya que, aunque dispusiéramos de cultivos puros, la confirmación del poder carcinogénico de los microorganismos hay que obtenerla en modelos animales, como ha ocurrido recientemente en el caso de la bacteria Bacteroides fragilis, cuyo papel carcinogénico en el hombre se presupone a partir de los hallazgos en ratón49.
Las técnicas de biología molecular que permiten la identificación de microorganismos en ausencia de aislamiento se conocen como metagenómica y se basan en la amplificación de genes microbianos directamente a partir de una muestra, cuya secuenciación posterior permite la identificación de los microorganismos presentes en la misma120,121. Algunas técnicas metagenómicas tienen la ventaja de permitir analizar los microorganismos presentes en ecosistemas complejos, como son la cavidad oral122 o el intestino123. Para analizar este tipo de muestras se pueden aplicar varias técnicas, como el DGGE124 o SSCP125, basadas, respectivamente, en la diferente movilidad electroforética por cambios en el patrón de desnaturalización o en la conformación secundaria de las cadenas simples de ADN del gen ribosómico 16S, cuya secuencia es la base de la clasificación e identificación de las bacterias. No obstante, para el análisis de poblaciones complejas son especialmente útiles los espacios intergénicos localizados entre los genes ribosómicos 16S y 23S (ITS) en bacterias y entre los genes 18S y 28S en hongos, que pueden ser separados electroforéticamente en la técnica denominada RISA (ribosomal intergenic spacer analysis). Dado que el tamaño de los ITS en bacterias es muy variable, la técnica RISA permite la separación de los ITS de la mayoría de los grupos bacterianos126. La secuenciación posterior de los fragmentos separados permite la identificación de las bacterias, ya que están secuenciados en todas las bacterias patógenas y en los principales comensales del hombre126. Mediante esta técnica se han analizado las poblaciones bacterianas intestinales en individuos afectados por cáncer colorrectal127 y de laringe126.
Las técnicas metagenómicas tienen la ventaja de que permiten la identificación de microorganismos cultivables y no cultivables presentes en el microbioma humano tanto de individuos sanos como de aquellos afectados por procesos tumorales128,129. Durante estos se producen cambios en el microbioma originados por el propio proceso tumoral129, por tratamientos antibióticos130,131 o por tratamientos radiológicos y quimioterápicos130,132. Por lo tanto, la metagenómica es la herramienta más prometedora en la investigación de los microorganismos presentes en tumores, ya que las nuevas técnicas de secuenciación masiva (next-generation sequencing) permiten el análisis de millones de secuencias en tiempos récord y a precios muy competitivos. No cabe duda de que este tipo de técnicas, que permiten la detección de genes microbianos en cualquier muestra, contribuirán sustancialmente al conocimiento de los microorganismos implicados en la producción de tumores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.