Introducción
La resección quirúrgica sigue siendo una opción fundamental en el tratamiento del carcinoma esofágico. Los dos abordajes más frecuentemente utilizados, la esofagectomía transtorácica y la transhiatal, no muestran diferencias sustanciales en cuanto a la mortalidad operatoria o la supervivencia a largo plazo1. Sin embargo, una serie de complicaciones específicas aparecen ligadas a la toracotomía1.
Con la progresiva experiencia adquirida en la cirugía laparoscópica avanzada, los avances tecnológicos y la creciente especialización de los servicios quirúrgicos, las indicaciones de la cirugía mínimamente invasiva se han ido ampliando a casi todos los procedimientos, incluida la esofagectomía. Las primeras experiencias fueron descritas hace una década de la mano de autores como DePaula et al 2 y Luketich et al3. Las ventajas esperadas con estas técnicas de acceso mínimo son la disminución de la agresión quirúrgica, las complicaciones cardiopulmonares, el dolor postoperatorio y la estancia hospitalaria4.
El objetivo de este trabajo es describir la factibilidad y la seguridad de la esofagectomía total mediante ciru-gía mínimamente invasiva, a partir de la experiencia de nuestra sección de cirugía esofagogástrica.
Pacientes y método
Desde noviembre de 2003 hasta marzo de 2005, en nuestra sección se ha tratado quirúrgicamente a 17 pacientes con cáncer de esófago. En 14 pacientes se utilizó la técnica EMI (esofagectomía mínimamente invasiva) en 3 tiempos mediante toracoscopia, laparoscopia y cervicotomía. Se excluyó del estudio a 3 pacientes: un paciente en el que se inició la toracoscopia y se consideró irresecable el tumor, otro paciente con infección por el virus de la inmunodeficiencia humana y antecedentes de tuberculosis pulmonar, al que se practicó una esofagectomía transhiatal por laparotomía, y finalmente, otro paciente con enfermedad respiratoria avanzada, al que se practicó una esofagectomía transhiatal por laparoscopia.
De los 14 pacientes, 11 eran varones (79%) y 3, mujeres, con una edad media de 61,7 (intervalo, 48-73) años. Un paciente había sufrido una amputación abdominoperineal por adenocarcinoma de recto 10 años antes.
Desde el punto de vista anatomopatológico, 11 casos tenían un carcinoma epidermoide (3 del esófago torácico supracarinal y el resto, infracarinales), y 3 pacientes presentaban displasia de alto grado en un esófago de Barrett, si bien en uno de los casos existía una alta sospecha de transformación maligna.
La decisión terapéutica se establece a partir del estudio de extensión de la enfermedad por, sobre todo, tomografía computarizada (TC) y ultrasonografía endoscópica. Las modalidades de tratamiento que utilizamos en nuestro centro, dependiendo del estadio preoperatorio, son: cirugía directa, cirugía tras radioquimioterapia neoadyuvante y radioquimioterapia radical. La cirugía se desestima ante hallazgos indicativos de tumores T4 y/o M1b. En presencia de tumores localmente avanzados (T3 y/o N1, incluso M1a susceptibles de radioterapia preoperatoria), el paciente es sometido a tratamiento neoadyuvante previo a la cirugía. La resección quirúrgica directa se considera el tratamiento de elección en los tumores en estadios evolutivos iniciales (T1-2, N0,M0). En nuestra serie, de los 14 casos intervenidos, 7 T3N0-1 recibieron radioquimioterapia neoadyuvante previa a la cirugía y otros tantos fueron operados directamente (tabla 1). La pauta neoadyuvante aplicada a nuestros pacientes ha sido para la radioterapia de 40 Gy, distribuidos en 1,8 Gy/día en 22 días, y para la quimioterapia, cisplatino a 80 mg/m2 y 5-FU a 1.000 mg/m2 en la primera y la cuarta semana de la radioterapia. El tiempo de espera para la intervención quirúrgica es de 1 semana por cada 10 Gy.
Técnica quirúrgica
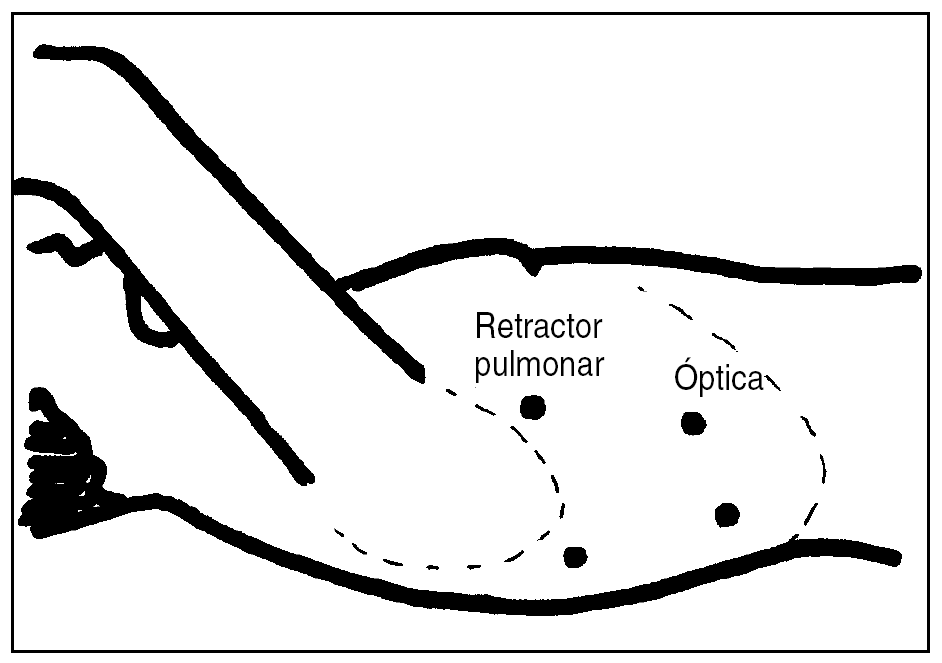
La intervención quirúrgica se realiza con intubación selectiva para excluir el pulmón derecho durante el tiempo de toracoscopia. Se coloca al paciente en decúbito lateral izquierdo, se introducen 4 trócares de 10 mm (fig. 1) y se inicia el tiempo torácico con la liberación del ligamento triangular del pulmón. Tras la apertura de la pleura mediastínica se secciona el cayado de la vena ácigos mediante la aplicación de una endo-GIA vascular 2,5 (blanca) y se completa la liberación del esófago con linfadenectomía estándar. Un Penrose o lazo situado alrededor del esófago puede facilitar la tensión necesaria para una correcta disección. Conviene respetar la pleura mediastínica por encima de la ázigos, para mantener la plastia gástrica en posición y prevenir la difusión caudal de una posible fuga cervical. Igualmente, es preciso que la disección distal no se extienda demasiado hacia el hiato, para evitar dificultades en el mantenimiento del neumoperitoneo durante la laparoscopia.
Fig. 1. Colocación de los trócares en el tórax.
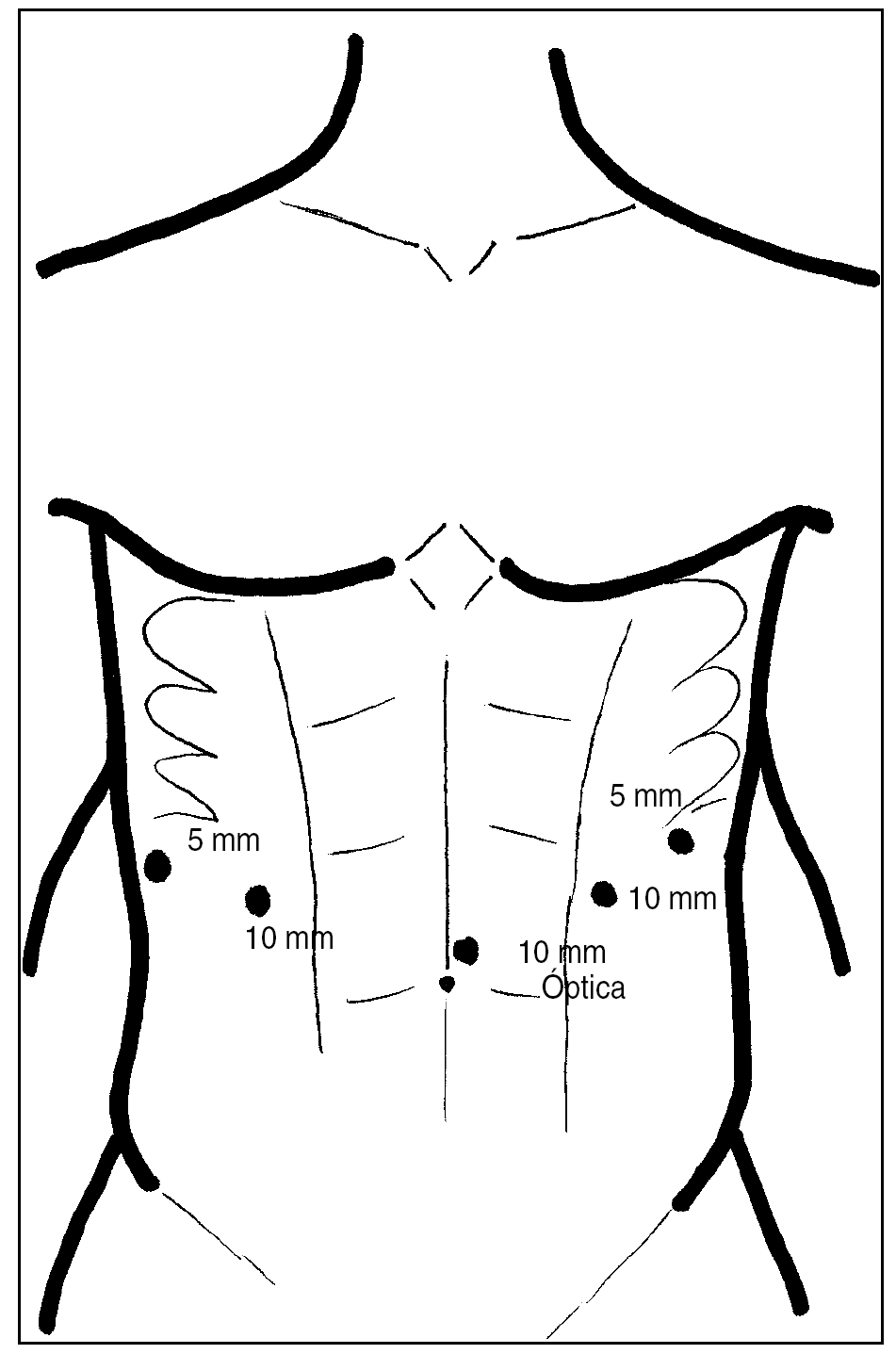
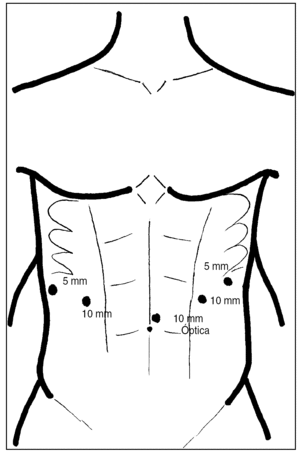
Para el tiempo abdominal, se coloca al paciente en posición de anti-Trendelenburg, con el cirujano colocado entre las piernas y el cuello hiperextendido y lateralizado hacia la derecha, preparando simultáneamente el campo abdominal y cervical. Se introducen 5 trócares, según muestra la figura 2, y se procede inicialmente a realizar una amplia maniobra de Kocher, continuando con la gastrólisis a lo largo de la curvatura mayor gástrica, respetando la arcada gastroepiploica, ligadura y sección de los vasos coronarios estomáquicos en su origen con una endoGIA vascular 2,5 (blanca) y tubulización gástrica mediante la aplicación sucesiva de varias cargas de endoGIA 3,5 (azul), tratando de realizar un tubo ancho, de 5 a 6 cm. Para evitar pérdidas de presión intraabdominal y dificultades técnicas por la entrada de CO2 hacia la cavidad torácica, la apertura de la membrana frenoesofágica se deja para el final de esta fase. No realizamos piloroplastia ni yeyunostomía de alimentación.
Fig. 2. Colocación de los trócares en el abdomen.
En el tiempo cervical, simultáneo a la última parte de la laparoscopia, se extrae la pieza quirúrgica por la herida cervical, ascendiendo la plastia gástrica con control visual para evitar el riesgo de torsión, y se confecciona una anastomosis esofagogástrica L-L mecánica. Tras la colocación de un drenaje Jakson-Pratt, se procede al cierre por planos.
Los pacientes reciben analgesia convencional en el período postoperatorio y no utilizamos analgesia peridural.
El paciente pasa desde quirófano a la unidad de cuidados intensivos. Al sexto día postoperatorio, se realiza un tránsito con contraste hidrosoluble tipo Gastrografin antes de iniciar la ingesta oral.
Resultados
La duración media de la intervención fue de 299 (intervalo, 195-425) min. Se hizo necesaria la reconversión a cirugía abierta en 2 (14%) casos debido a problemas técnicos, y hubo que realizar una toracotomía por dificultades con la exclusión pulmonar y una laparotomía ante la imposibilidad de ascender la plastia hasta el cuello. En un caso no se pudo extraer la pieza por el cuello y hubo que realizar una minilaparotomía, debido al hallazgo de un gran paquete de adenopatías a nivel cardial que no había sido diagnosticado preoperatoriamente ni por la TC ni por la ecoendoscopia.
La mortalidad fue de 0%. En cuanto a la morbilidad, 3 (21%) pacientes presentaron complicaciones mayores que requirieron cirugía urgente: un desgarro de la plastia gástrica debido a un bucle de la sonda nasogástrica reintervenido a las 24 h; un cuadro de hipovolemia por hemotórax en un paciente en el que hubo que liberar densas adherencias pleurales y precisó reintervención en el postoperatorio inmediato (a las 10 h), y una fístula del conducto torácico que se reintervino a las 3 semanas, practicándose ligadura simple por toracotomía y aplicación de pegamento biológico.
A estas complicaciones hay que sumar otras 4 (28%) menores: 3 alteraciones postoperatorias de la fonación y una disnea. No ha habido ninguna dehiscencia anastomótica ni infecciones de herida quirúrgica.
Los requerimientos de transfusión de sangre en los períodos operatorio y postoperatorio han sido de 1,1 unidades de concentrado de hematíes por paciente. La mitad de ellos no han precisado transfusión.
A excepción de los 3 pacientes con complicaciones mayores, la estancia en la unidad de cuidados intensivos ha sido inferior a 48 h. La estancia hospitalaria media ha sido de 21 (9-64) días.
La tabla 1 muestra los hallazgos anatomopatológicos en relación con el estadio clínico preoperatorio. La media de ganglios extirpados ha sido de 10,2 (intervalo, 5-17) por paciente.
Entre las complicaciones tardías, cabe destacar que un paciente presentó una herniación diafragmática a los 3 meses de la esofagectomía y requirió intervención; 4 (28%) han precisado dilatación neumática de la anastomosis cervical por grados variables de intolerancia alimentaria, con buena respuesta clínica.
El seguimiento postoperatorio oscila entre 1 y 17 meses, y todos los pacientes están vivos y libres de enfermedad, salvo una paciente con metástasis hepáticas.
Discusión
La extirpación quirúrgica continúa siendo el único tratamiento potencialmente curativo para el carcinoma de esófago. En lo que a la técnica quirúrgica se refiere, las principales controversias residen en la vía de abordaje, la extensión de la resección esofágica y la linfadenectomía5.
La toracotomía derecha proporciona un buen campo para una linfadenectomía mediastínica adecuada, pero conlleva una importante morbilidad1. Este hecho propició el uso de la vía transhiatal, menos invasiva, que con una linfadenectomía menos extensa obtiene buenos resultados en los tumores del esófago inferior.
Con la introducción de las técnicas mínimamente invasivas se pretende mejorar la morbimortalidad postoperatoria, con un mayor bienestar para el paciente, y conseguir unos resultados similares a los de la cirugía abierta desde el punto de vista oncológico. En particular, la toracoscopia pretende recuperar las ventajas de la disección tumoral mediante visualización directa, disminuyendo la morbilidad ligada a la toracotomía.
La esofagectomía mínimamente invasiva es técnicamente exigente, pues requiere una curva de aprendizaje para dominar la técnica que, según distintos autores, puede oscilar entre 20 y 34 intervenciones6,7. De todas formas, la experiencia de un equipo quirúrgico que trabaje en una unidad especializada con volumen importante de actividad y una perfecta estandarización de la técnica son pilares fundamentales para el éxito de estos procedimientos2,3,6-8.
Se han publicado diferentes modalidades para la esofagectomía mínimamente invasiva. Algunos grupos utilizan técnicas mixtas, como toracotomía y laparoscopia10 o toracoscopia y laparotomía6,15. Otros grupos realizan la esofagectomía transhiatal con2,11,13 o sin cervicotomía12. Nuestro grupo, siguiendo la experiencia de Luketich et al3, decidió realizar la cirugía en 3 tiempos para la resección del esófago siempre que hubiera indicación para ello y fuera técnicamente posible14. Cuesta et al5 afirman que todos los cánceres operables en cualquier localización del esófago pueden ser abordados por cirugía mínimamente invasiva.
Desde nuestro punto de vista, la selección de los pacientes3,5,7,9,14,15 no debe diferir esencialmente de los criterios generales para la esofagectomía. En primer lugar, hay que valorar mediante ecoendoscopia y TC3 la resecabilidad del tumor, y en segundo lugar, las condiciones generales del paciente. Aproximadamente 1 de cada 4 pacientes diagnosticados de carcinoma esofágico en nuestro hospital es remitido para intervención quirúrgica. Algunos consideran las toracotomías previas, los procesos inflamatorios pleurales (TBC) o las laparotomías anteriores como contraindicaciones relativas para la cirugía mínimamente invasiva14, sobre todo en fases precoces de la experiencia. Uno de nuestros pacientes había sufrido una amputación abdominoperineal de recto 10 años antes, a pesar de lo cual se pudo completar la laparoscopia sin especiales dificultades.
Respecto a la técnica quirúrgica, con la cirugía mínimamente invasiva reproducimos los mismos gestos que en la cirugía abierta, de manera similar a lo descrito por el grupo de Pittsburgh y que también practican otros grupos3,5,7,14,16-19. Lo único que debemos hacer es sustituir la toracotomía por toracoscopia y la laparotomía por laparoscopia. Los tiempos operatorios, en un principio más largos que para la cirugía por vía abierta, van disminuyendo según aumenta la experiencia del equipo quirúrgico7,10,12.
En cuanto a la tubulización gástrica, parece que un tubo estrecho presenta menos problemas de vaciamiento que el ancho, aunque como contrapartida aumenta la incidencia de fugas anastomóticas. Luketich et al3,19 recomiendan realizar un tubo ancho con piloroplastia. Nosotros no realizamos piloroplastia y no hemos observado complicaciones relacionadas en ningún paciente, como sucede con los 15 pacientes de la serie de Nguyen et al14. Cuesta et al5 consideran que ni la piloroplastia ni la maniobra de Kocher son necesarias.
La tasa de reconversiones debe ser mínima, en particular por accidentes intraoperatorios como la rotura de vena ázigos, bronquio principal o aorta15,17, sin olvidar que debe mantenerse un umbral de conversión bajo cuando parece más seguro continuar la intervención por vía abierta que endoscópica. La de nuestra serie (14%) no difiere mucho de las presentadas por otros autores3,7,8,14, y la selección de los pacientes es un factor muy importante para evitarlas5.
En todos los trabajos consultados, la pérdida hemática parece ser menor que en la cirugía abierta7,9,10,14,17. También parece reducirse el período de estancia en cuidados intensivos7,14. La morbilidad postoperatoria en nuestro caso ha sido del 50% (7 de 14), con 3 (21,4%) complicaciones mayores que precisaron reintervención, cifra similar a la presentada por otros autores8-14. Luketich et al3 refieren una baja incidencia de neumonía, lo que señala la ventaja de la esofagectomía mínimamente invasiva: evitar el dolor de la toracotomía permite una excursión respiratoria más amplia, con el consiguiente descenso de las complicaciones pulmonares, que no obstante siguen figurando entre las más frecuentes6,7. Solamente uno de nuestros pacientes ha presentado trabajo respiratorio.
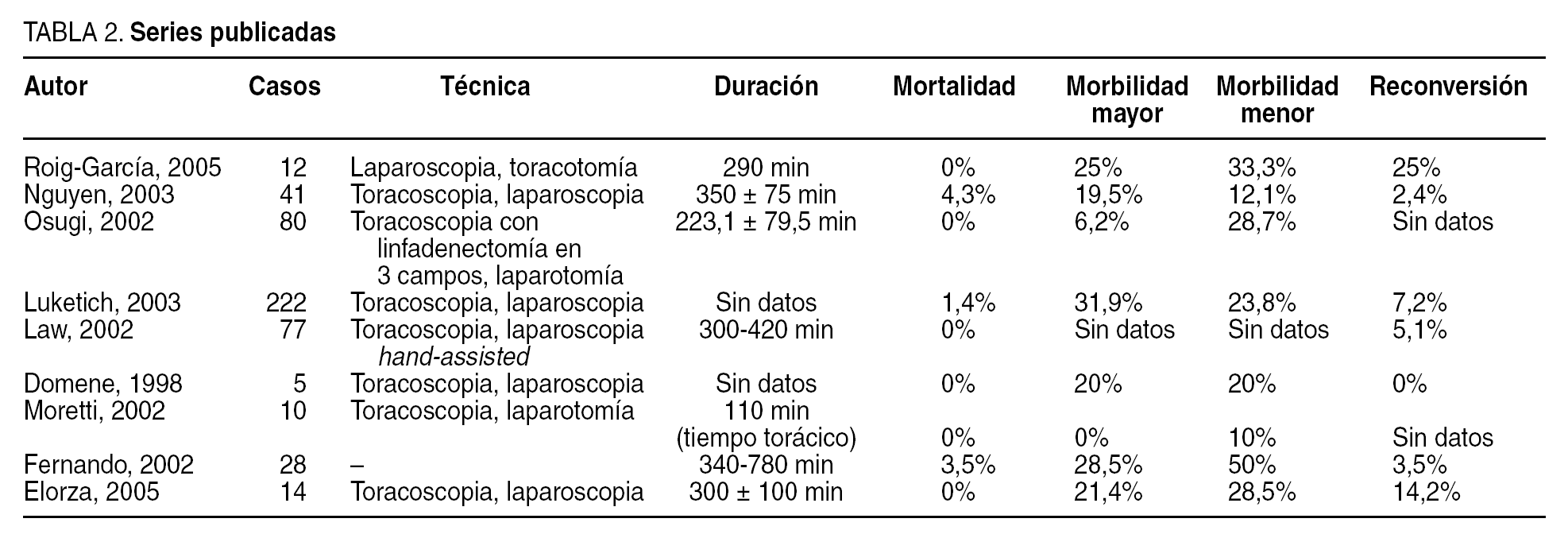
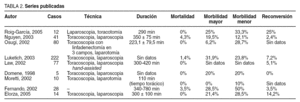
La incidencia de fugas anastomóticas no debiera ser diferente que con la cirugía convencional, tal como publican distintos autores7,14,17. Luketich et al3 observan una incidencia de dehiscencias del 6,1% usando un tubo ancho (6 cm), frente a un 27,6% con un tubo más estrecho (3-4 cm). Nosotros hemos tratado de acercarnos a los 6 cm y no hemos tenido ninguna fuga anastomótica. Como otros autores, realizamos un control radiológico antes de iniciar la ingesta oral14. Las alteraciones de la fonación por afectación del nervio recurrente de nuestra serie6,7 son complicaciones comparables a las de la cirugía abierta y a las presentadas por otros autores. La tabla 2 recoge los datos más destacables de varias series publicadas.
La mortalidad en el postoperatorio inmediato es baja (0-4,3%)3,5,7,8,10,14-16. Como sucede con la cirugía abierta, en la que la mortalidad se sitúa en el 4,9% si los hospitales realizan más de 20 esofagectomías al año y en el 18% si son menos de 53,20, estas cifras de mortalidad parecen tener relación con la experiencia del equipo quirúrgico en relación con el volumen de trabajo. Nosotros realizamos unas 12 esofagectomías al año.
El número de ganglios extirpados, para los diferentes autores, es 33 de media para las linfadenectomías más extensas6 o entre 10,3 y 16 para la linfadenectomía estándar, número de ganglios comparable al de nuestra serie7-9,14,17. La toracoscopia permite una perfecta visualización del mediastino y consigue una buena disección ganglionar14.
A lo largo de nuestro corto período de seguimiento no ha fallecido ningún paciente y, salvo una paciente con metástasis hepáticas, todos se hallan libres de enfermedad. Tampoco se han detectado implantes metastásicos en los orificios de los trócares7,14 ni en la herida cervical.
Las estenosis en la anastomosis cervical son más frecuentes que en las torácicas, y responden habitualmente de forma favorable a la dilatación neumática, como ha sucedido en los 4 casos observados en nuestra serie5,12,15,21. Ningún paciente ha presentado problemas relacionados con el vaciamiento gástrico.
Consideramos que, a pesar de ser una técnica muy exigente, la esofagectomía mínimamente invasiva para el tratamiento del cáncer de esofago, mediante toracoscopia, laparoscopia y cervicotomía, es técnicamente posible y tiene una aceptable morbimortalidad postoperatoria. Por ello, una vez superada la curva de aprendizaje y siempre que el juicio clínico nos haga mantener un umbral de conversión bajo, habría que considerarla como una alternativa a la cirugía abierta. En cuanto a los resultados a largo plazo, desde el punto de vista oncológico, sólo el tiempo y la casuística serán los jueces inapelables de esta nueva técnica.
Correspondencia: Dr. J.L. Elorza Orúe.
Catalina de Erauso, 7, 3.o C. 20010 Donostia-San Sebastián. Guipúzcoa. España.
Correo electrónico: jlelorza@ya.com
Manuscrito recibido el 22-9-2005 y aceptado el 4-5-2006.