A pesar de los avances en el tratamiento médico de la colitis ulcerosa (CU), entre el 25 y el 40% de los pacientes necesitarán cirugía a lo largo de la evolución de su enfermedad. El fin que persigue el tratamiento quirúrgico de la CU es extirpar el órgano diana de la enfermedad con mínima morbilidad postoperatoria, y ofrecer a largo plazo una buena calidad de vida. Existen varias opciones para el tratamiento quirúrgico de la CU, siendo el más común en la actualidad la proctocolectomía con reservorio ileoanal.
El cirujano y el paciente deben asumir los riesgos asociados a una cirugía técnicamente compleja y las posibles complicaciones postoperatorias, incluyendo la posibilidad de infertilidad, estoma permanente, o re-intervenciones por complicaciones relacionadas con el reservorio.
El conocimiento preciso de cada técnica, y sus indicaciones, complicaciones, riesgos y beneficios a largo plazo es útil para ofrecer al paciente la opción que mejor se adecuará a sus necesidades.
Se realizó una búsqueda en PubMed, MEDLINE, EMBASE de todo tipo de artículos (todas la publicaciones hasta abril de 2012). Trabajos sobre enfermedad de Crohn, colitis indeterminada u otras formas de colitis se excluyeron de la revisión. Se revisaron los resúmenes y se identificaron artículos potencialmente relevantes. Se utilizaron como palabras MeSH de búsqueda: «ulcerative colitis», «surgery», «indications», «elective surgery», «colectomy», «proctocolectomy», «laparoscopy», «complications», «outcome», «results», «quality of life».
Ciento cuatro artículos se incluyeron en la presente revisión.
Despite recent advances in the medical treatment of ulcerative colitis (UC), approximately 25-40% of patients will need surgery during their disease. The aim of elective surgical treatment of UC is to remove the colon/and rectum with minimal postoperative morbidity, and to offer a good long-term quality of life. There are several technical options for the surgical treatment of UC; at present, the most frequently offered is restorative proctocolectomy and ileal pouch-anal anastomosis. Both the surgeon and patient should be aware of the risks associated with a technically demanding procedure and possible postoperative complications, including the possibility of infertility, permanent stoma, or several surgical procedures for pouch-related complications.
A precise knowledge of each surgical technique, and its indications, complications, long-term risks and benefits is useful to offer the best surgical option tailored to each patient.
We searched in PubMed, MEDLINE, and EMBASE for all kinds of articles (all the publications until April 2012). Papers on Crohn's disease, indeterminate colitis, or other forms of colitis were excluded from the review. We reviewed the abstracts and identified potentially relevant articles. MeSH words were used as search, “ulcerative colitis”, “surgery”, “indications”, “elective surgery”, “colectomy,” “proctocolectomy,” “laparoscopy”, “Complications,” “outcome”, “results” “quality of life”.
One hundred and four articles were included in this review.
La colitis ulcerosa (CU) es una enfermedad idiopática crónica inflamatoria que afecta a la mucosa del recto y se extiende de forma proximal para afectar una longitud variable del colon. En un 25% de los pacientes se produce la afectación de todo el colon o pancolitis1.
A pesar de los avances en el tratamiento médico de la CU y sus buenos resultados a corto y medio plazo, alrededor del 25-40% de los pacientes necesitarán cirugía a lo largo de la evolución de su enfermedad2–4. La probabilidad de colectomía es mayor durante el primer año de diagnóstico, llegando hasta el 10% según distintas series; la extensión y gravedad de los síntomas al diagnóstico siguen siendo los mejores predictores de la necesidad de colectomía5.
Puesto que la CU se limita a afectar a la mucosa1, la proctocolectomía curará al paciente de sus síntomas intestinales. Una ventaja adicional de realizar la exéresis completa del colon y el recto es que el riesgo de malignización prácticamente desaparece. Aunque existen numerosas ventajas del tratamiento quirúrgico de la CU, el paciente debe entender que habrá cambios permanentes en su estilo de vida tras la cirugía. El cirujano y el paciente deben asumir los riesgos asociados a una cirugía técnicamente compleja y las posibles complicaciones postoperatorias, incluyendo la posibilidad de infertilidad, estoma permanente, o re-intervenciones por complicaciones relacionadas con un reservorio.
Este estudio tiene como objetivo realizar una revisión basada en la evidencia de los resultados tanto a corto como a largo plazo del tratamiento quirúrgico electivo de la CU.
MétodoSe realizó una búsqueda sistemática de la literatura sobre «colitis ulcerosa» y «tratamiento quirúrgico». Para este estudio se aceptó la definición de CU de la American College of Gastroenterology3.
En primer lugar se realizó una búsqueda en PubMed, MEDLINE y EMBASE de todo tipo de artículos (todas la publicaciones hasta abril de 2012). Trabajos sobre enfermedad de Crohn, colitis indeterminada u otras formas de colitis se excluyeron de la revisión. Se revisaron los resúmenes y se identificaron artículos potencialmente relevantes. Se utilizaron como palabras MeSH de búsqueda: «ulcerative colitis», «surgery», «indications», «elective surgery», «colectomy», «proctocolectomy», «laparoscopy», «complications», «outcome», «results», «quality of life».
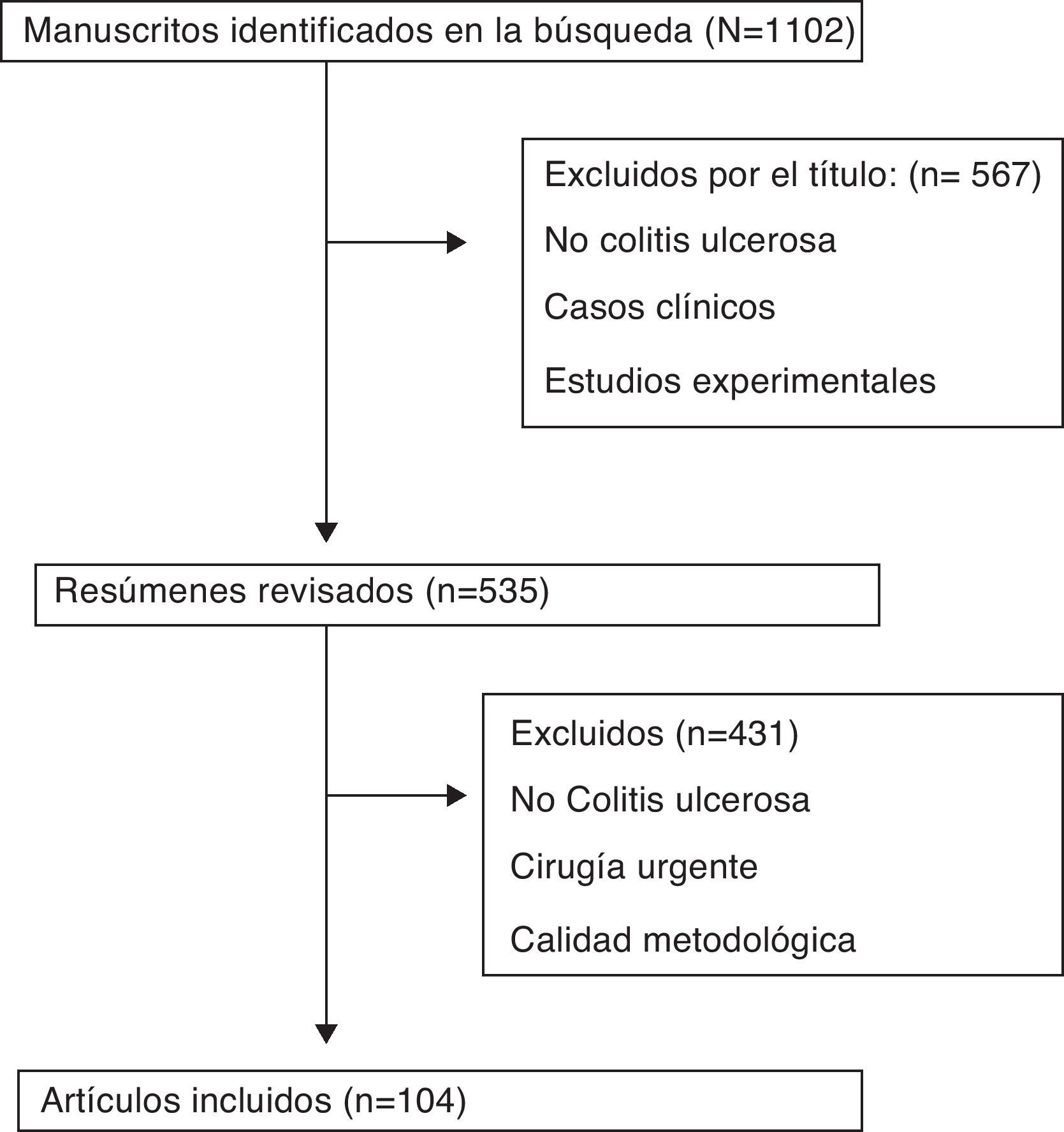
Se encontraron 1.102 estudios relacionados con los criterios de búsqueda (fig. 1). Se excluyeron los casos clínicos y estudios experimentales, así como los artículos sobre tratamiento quirúrgico en edad pediátrica. Se revisaron ensayos aleatorizados controlados, estudios comparativos no aleatorizados, estudios epidemiológicos observacionales, recomendaciones o «guidelines» nacionales o internacionales, revisiones de estudios observacionales sobre tratamiento quirúrgico electivo y estudios de calidad de vida.
Después de identificar los títulos relevantes, se realizó revisión del resumen si el artículo cumplía los criterios de inclusión. Los autores han seguido los pasos propuestos en estudios previos para llegar a conclusiones relevantes6. Dado que hay una falta significativa de estudios aleatorizados sobre el tratamiento quirúrgico de la colitis ulcerosa, la valoración de la calidad de la mayoría de los estudios incluidos se basó en la lista de los 12 ítems propuestos por el índice metodológico para estudios no-aleatorizados (MINORS)7. Este es un instrumento válido para valorar la calidad metodológica de estudios quirúrgicos no-aleatorizados, tanto comparativos como no comparativos. Todos los artículos se han incluido por su impacto histórico-científico sobre el tratamiento quirúrgico de la CU. Las revisiones y artículos editoriales se han incluido por la calidad de las revistas donde fueron publicadas.
Indicaciones de la cirugía electivaLas indicaciones para cirugía electiva incluyen la enfermedad refractaria al tratamiento médico, complicaciones debidas al tratamiento médico, retraso de crecimiento en los niños, displasia o carcinoma y, en ocasiones, intentos de mejorar las manifestaciones extraintestinales: el pioderma gangrenoso, el eritema nodoso, la artritis periférica y la uveítis pueden remitir espontáneamente tras la cirugía. La indicación más frecuente de cirugía es la persistencia de síntomas crónicos refractarios a pesar de tratamiento médico máximo (combinaciones de derivados del ácido 5-aminosalicilato, corticoides, 6-mercaptopurina, azatioprina, infliximab), lo que conlleva debilidad física, disfunción psicosocial, o efectos secundarios intolerables de la medicación3,4.
Cualquiera que sea la indicación de cirugía, se debe informar a los pacientes de todas las opciones quirúrgicas disponibles8. Las técnicas quirúrgicas utilizadas con más frecuencia son: la proctocolectomía restauradora con reservorio ileoanal, la proctocolectomía total con ileostomía terminal y la colectomía total con anastomosis ileorrectal. La elección de la técnica depende de las características del paciente, el estado de los esfínteres y la decisión consensuada con el paciente.
Preparación preoperatoria para la cirugíaEn la cirugía electiva se debe elegir bien el momento apropiado de la intervención. Los factores más importantes que predisponen a las complicaciones postoperatorias (especialmente las fugas anastomóticas) son la malnutrición, las transfusiones perioperatorias y la inmunosupresión9. El estado nutricional preoperatorio debilitado (pérdida de peso > 10%, albúmina < 3,0g/dl) ha sido claramente relacionado con deficiencias en la cicatrización y fugas anastomóticas10.
La inmunosupresión es otro factor de riesgo mayor para las complicaciones postoperatorias. Los estudios indican que la toma de 20mg/día de prednisolona durante más de 6 semanas es un factor de riesgo de complicaciones quirúrgicas11. En cuanto a la azatioprina y la ciclosporina no parecen afectar la tasa de complicaciones12. El uso cada vez más frecuente de tratamientos biológicos anti-TNF ha llevado a la necesidad de buscar recomendaciones sobre su uso en relación con la cirugía. Varios estudios han mirado el efecto de las medicaciones anti-TNF (en concreto el infliximab) y las complicaciones tras la cirugía de la CU13,14. Mor et al. utilizaron un estudio de casos-control para evaluar el impacto del tratamiento con anticuerpos anti-TNF sobre los resultados de los reservorios ileoanales15. Los pacientes en tratamiento con anti-TNF preoperatorio presentaban 3,5 veces más riesgo de complicaciones tempranas posquirúrgicas comparados con los pacientes control. Además, tenían un riesgo 14 veces superior de presentar complicaciones sépticas.
Otra revisión de 413 pacientes con CU y EC no encontró asociaciones entre el uso de infliximab y las complicaciones postoperatorias. Los autores concluyeron que lo más probable es que los pacientes que precisan tratamiento con agentes anti-TNF representan una población de pacientes con mayor riesgo de complicaciones postoperatorias por la propia gravedad de la enfermedad16,17.
En un metaanálisis de 5 estudios y 706 pacientes, el uso preoperatorio de infliximab incrementó el número total de complicaciones postoperatorias a corto plazo (OR 1,80; 95% CI; 1,12-2,87), aunque no se encontró una asociación significativa entre el tratamiento preoperatorio con infliximab y las complicaciones a corto plazo infecciosas (OR 2,24; 95% CI; 0,63-7,95) o no-infecciosas (OR 0,85; 95% CI; 0,50-1,45). Al existir diferencias significativas entre las poblaciones estudiadas, sus características y definiciones de complicaciones entre los estudios incluidos, los resultados son poco concluyentes18.
En el momento actual se recomienda una cirugía en 3 tiempos (primero colectomía) si un paciente lleva tratamiento con 20mg/día o más de prednisolona durante más de 6 semanas4,19, y probablemente será recomendable también en pacientes tratados con infliximab en las 12 semanas previas a la cirugía10.
La preocupación relacionada con la enfermedad más común en pacientes con enfermedad inflamatoria intestinal es la necesidad de llevar estoma. El cambio en la imagen corporal a veces lleva a una disminución del funcionamiento social y ocupacional, con depresión, aislamiento y dificultades en las relaciones sociales. El marcaje preoperatorio y los consejos de un estomaterapeuta entrenado reducen las complicaciones relacionadas con el estoma y mejoran la calidad de vida de los pacientes con enfermedad inflamatoria intestinal que precisan un estoma tanto temporal como permanente20,21.
Alternativas quirúrgicasProctocolectomía restauradora con reservorio ileoanalLa proctocolectomía restauradora con reservorio ileoanal se ha convertido en la opción quirúrgica más común en cirugía electiva de la CU22.
El reservorio original de Parks y Nicholls era en forma de S con 3 brazos23. Este reservorio era difícil de construir y el asa eferente se obstruía con relativa frecuencia cuando tenía una longitud mayor de 1cm22,24. Desde entonces se han descrito varios tipos de reservorios ileoanales, los más frecuentes en forma de J, W y S. El reservorio en J, descrito por Utsonomiya25, es el más comúnmente utilizado en la actualidad por su facilidad de construcción y porque es el que menor cantidad de intestino delgado utiliza26. En los estudios comparativos, los resultados en cuanto a complicaciones son similares entre los distintos reservorios: el reservorio en S requiere con mayor frecuencia la intubación para evacuar heces, y el reservorio en W parece que disminuye el número de deposiciones con respecto a los otros tipos de construcción27.
La longitud máxima de mucosa anorrectal entre la línea dentada y la anastomosis ileoanal no debería ser mayor de 2cm28. La persistencia de este anillo de mucosa puede ser causa de inflamación crónica («cuffitis»), disfunción del reservorio o, raras veces, foco de displasia o cáncer29,30.
La anastomosis mecánica grapada tiene como ventajas su mayor facilidad técnica, evitando la fase perineal de la intervención, menos tensión en la línea anastomótica y mejores resultados funcionales31–36, con menor índice de lesiones esfinterianas y preservación de la zona de transición anal con su innervación correspondiente. La facilidad de uso y los beneficios de la mejoría funcional han hecho que la anastomosis con doble grapado sea la técnica anastomótica más utilizada. Estos beneficios deben ser sopesados con la posibilidad potencial de persistencia de enfermedad y cambios malignos en la mucosa retenida36,37. No obstante, en ocasiones no es posible la realización de una anastomosis mecánica (por ejemplo, displasia o cáncer), y se debe realizar la mucosectomía y anastomosis manual37.
La cirugía laparoscópica del reservorio ileoanal es al menos tan segura como la cirugía abierta, o incluso presenta mejores resultados en el tiempo de tolerancia a la ingesta, estancia hospitalaria postoperatoria y tasa global de complicaciones38. Los beneficios potenciales a largo plazo incluirían menos adherencias y menos formación de hernias, mejoría en la fertilidad, y mejor calidad de vida37,39. Otra ventaja de la cirugía laparoscópica es la mejoría cosmética. No obstante, la única revisión sistemática publicada con el objetivo de comparar los efectos beneficiosos y negativos de la cirugía de reservorio ileoanal laparoscópica vs abierta para pacientes con CU y PAF no encontró diferencias significativas en mortalidad, complicaciones, tasas de reoperación y readmisión entre los grupos. Según los autores, el valor clínico de la cirugía laparoscópica para la CU quedará mejor establecido con más estudios bien diseñados y de seguimiento a largo plazo40.
Complicaciones de la proctocolectomía restauradora con reservorio ileoanalLa creación de un reservorio ileoanal requiere una disección pélvica y puede estar asociada inherentemente a complicaciones como hemorragia, oclusión intestinal, sepsis pélvica secundaria a fugas de la anastomosis ileoanal o del reservorio, fístulas reservorio-vaginales, estenosis o problemas de disfunción del reservorio y reservoritis22,41,42. La proctocolectomía restauradora tiene menor tasa de morbimortalidad y menor tasa de fracaso del reservorio si se realiza en centros de mayor volumen y experiencia43,44.
Se considera que la utilización de ileostomía lateral de protección minimiza tanto las complicaciones sépticas postoperatorias como la morbilidad asociada a la dehiscencia anastomótica, al igual que en las resecciones ultrabajas por cáncer de recto45–47. No obstante, hay autores que han publicado resultados favorables de la proctocolectomía restauradora sin ileostomía48–51. Se ha sugerido que en casos seleccionados de pacientes relativamente sanos, no anémicos, sin dosis altas de esteroides y con factores intraoperatorios favorables (buena vascularización del intestino delgado, escasa pérdida de sangre, estabilidad hemodinámica, anastomosis sin tensión) se podría omitir la realización de la ileostomía51. Sin embargo, un metaanálisis de 17 estudios con casi 1.500 pacientes con reservorio ileoanal encontró que, cuando esta cirugía se realiza sin ileostomía de protección, los resultados funcionales son similares a los casos con ileostomía pero se incrementa el riesgo de fuga anastomótica. De forma notable, el 30% de estos pacientes sometidos a un reservorio ileoanal precisaron reintervenciones por complicaciones postoperatorias incluyendo fugas anastomóticas, sepsis pélvica/absceso, estenosis anastomótica y oclusión intestinal52.
La hemorragia del reservorio puede ocurrir en alrededor del 3-4% de los casos. Es importante revisar las líneas de sutura antes de la anastomosis ileoanal; aunque en muchos casos el sangrado ocurre en las primeras 24h y no es detectado intraoperatoriamente. La irrigación del reservorio con una solución de adrenalina 1:200.000 consigue controlar la hemorragia en hasta un 80% de los casos22. Si esto no se consigue, precisa revisión endoscópica o quirúrgica para hemostasia.
La oclusión intestinal tras cirugía del reservorio tiene una incidencia variable según las series, pero acumulativa a los 10 años de alrededor del 30%28,42, con tasas de reintervención de alrededor del 7%.
La sepsis pélvica se mantiene como la mayor fuente de morbilidad tras el reservorio, es la causa más frecuente de fracaso del reservorio y puede variar entre el 6% y el 37%53,54. Varios estudios retrospectivos han sugerido que existen diversos factores asociados a la ocurrencia de sepsis pélvica postoperatorias, como son el uso de corticoides preoperatorios, infliximab, transfusiones sanguíneas perioperatorias, obesidad, enfermedad de Crohn y el cirujano55,56. El análisis de más de 3.000 pacientes con reservorio a lo largo de 24 años demuestra que la sepsis pélvica lleva a peores resultados funcionales y calidad de vida incluso cuando no conlleva fracaso del reservorio57. Los pacientes que desarrollaron sepsis presentaron significativamente mayor tasa de incontinencia a largo plazo.
La aparición de fiebre en el postoperatorio de un paciente con un reservorio debe hacer sospechar un foco de sepsis pélvica. El tratamiento de la sepsis dependerá de su tamaño, presencia o no de ileostomía de protección y su repercusión sobre el estado clínico del paciente22,41. El tacto rectal puede demostrar una zona de defecto anastomótico o una masa indurada o fluctuante. Una TAC abdominopélvica suele ser la prueba de imagen más útil para valorar la extensión. Cuando el defecto anastomótico es grande, en ocasiones se puede colocar un catéter de drenaje y lavado con el tacto rectal, pero ante la duda está indicado el examen bajo anestesia para lavar y aspirar el contenido del absceso y colocar un drenaje. Cuando hay una colección presacra y no hay defecto anastomótico visible, normalmente lo recomendable es crear uno en la cara posterior de la misma22,47. La re-laparotomía estaría indicada en casos en los que la revisión menor no ha controlado la sepsis, o no se puede colocar un drenaje percutáneo guiado por TC. Las fugas anastomóticas mayores precisan manejo con ileostomía lateral si no la llevan previamente. Si hay una disrupción anastomótica completa, en ocasiones es útil exteriorizar el reservorio; cuando hay isquemia franca, la resección. Las tasas de fracaso del reservorio a largo plazo tras sepsis pélvica pueden llegar hasta el 29%53,56,57.
Las fístulas reservorio-vaginales tienen una incidencia entre el 3 y el 16%22,53.Se han utilizado diversas estrategias quirúrgicas para su tratamiento, con resultados variables, entre ellas, el colgajo de avance ileal transanal, avance transabdominal de la anastomosis ileoanal, reparación transvaginal o transperineal, colocación de seton, y escisión del reservorio58–60.
Las estenosis anastomóticas ocurren del 4 al 18% de los casos61. La dilatación con dilatadores de Heger puede ser efectiva hasta en el 40% de los casos61, y en algunos de ellos se puede intentar un colgajo de avance reservorio-anal62, pero un 14% de los pacientes perderán finalmente el reservorio53.
La reservoritis («pouchitis») es la complicación más frecuente. Los episodios agudos aparecen en el 50% de los pacientes en los primeros 5 años tras la cirugía. Típicamente se presenta como un aumento del número de deposiciones que puede estar acompañado de fiebre, sangrado, dolor pélvico o deshidratación. Los pacientes pueden presentar un único episodio de reservoritis aguda, pero en hasta un 10% de los casos presentan episodios recurrentes o clínica de reservoritis cronificada63. La etiología no está completamente definida aún. Sobrecrecimiento bacteriano, alteración del balance de las bacterias intraluminales, isquemia mucosa, deficiencias nutricionales, falta de ácidos grasos de cadena corta y la toxicidad de la bilis fecal han sido sugeridas como posibles causas. Algunos autores sugieren que la reservoritis puede ser debida a una enfermedad de Crohn subyacente no diagnosticada, o a una nueva forma de enfermedad inflamatoria intestinal64, que requiere tratamiento inmunosupresor y/o biológico y en ocasiones la exéresis del reservorio65–67.
Una revisión sistemática reciente demuestra que, en conjunto, la calidad de vida relacionada con la salud de los pacientes tras el reservorio ileoanal alcanza niveles comparables con la población general al año tras la cirugía68. Aunque los resultados a largo plazo funcionales y de calidad de vida se consideran por algunos investigadores como muy satisfactorios y mantenidos a largo plazo, otros han demostrado que se produce un deterioro en varios ámbitos de calidad de vida con el tiempo69–74. Los estudios a largo plazo de los reservorios ileoanales indican que la tasa de fracaso aumenta con el tiempo, alcanza un 15-20% tras 10-15 años de seguimiento, y que las complicaciones sépticas y la mala función son las causas más frecuentes de fracaso75,76.
Las 2 intervenciones más comunes para el fracaso del reservorio incluyen la resección del mismo con formación de una ileostomía terminal o la derivación indefinida con una ileostomía en asa o terminal, dejando el reservorio in situ77,78. Hay un riesgo elevado de morbilidad tanto temprana como tardía relacionada con la exéresis del reservorio, casi siempre secundario a una intervención en muchas ocasiones técnicamente compleja por la fibrosis secundaria a una sepsis previa o a cirugía previa de rescate, a disfunción urinaria o sexual, a retrasos en la cicatrización de la herida perineal con supuración crónica y a sinus perineal persistente en hasta el 40% de los pacientes. Además, se debe considerar la posibilidad de malabsorción cuando se recomienda al paciente el tipo de intervención a realizar; tanto la exéresis del reservorio como la derivación indefinida conllevan algún grado de pérdida del íleon terminal.
Además de los riesgos ya descritos, a los pacientes se les debe aconsejar sobre los efectos de la realización de un reservorio sobre la fertilidad y la función sexual79. Un metaanálisis de 8 estudios encontró un aumento 8 veces mayor de infertilidad en mujeres tras el reservorio, comparado con pacientes con CU tratadas médicamente80. La fecundidad en las mujeres con CU antes de la cirugía es comparable con las mujeres sin CU, pero solo está al 20% de las tasas de fecundidad de los controles tras la proctocolectomía restauradora81–84.
Aproximadamente un 20% de las mujeres presentarán dispareunia o incontinencia fecal durante el coito a lo largo de un seguimiento de 3 años tras el reservorio42,84. Un metaanálisis de 43 estudios observacionales encontró un riesgo del 4% de disfunción sexual en los varones de forma postoperatoria42. No obstante, la mayoría de varones notan mejoría en su calidad de vida sexual global tras la cirugía, probablemente relacionada con la mejoría del estado general85.
En cuanto al parto, las pacientes con reservorio ileoanal tienen un riesgo mayor de perder su capacidad de continencia en comparación con la población general84. Esto ocurre porque muchos de los factores que se consideran importantes para mantener la continencia, como la solidez de las heces, sensación rectal, reflejo anorectal inhibitorio se han perdido en estas pacientes. Consecuentemente, necesitan que el esfínter tenga un funcionamiento correcto. Por esta razón, y teniendo en cuenta que las lesiones esfinterianas ocurren entre el 0,5 y el 3,5% de los partos vaginales86, muchos cirujanos recomiendan la cesárea para pacientes con reservorios. Aunque los estudios son algo conflictivos al respecto, parece no obstante que en casos seleccionados el parto vaginal no produce detrimento de la continencia a corto plazo86–88.
Colangitis esclerosante primaria y proctocolectomía restauradoraLa colangitis esclerosante primaria (CEP) es un trastorno idiopático que se caracteriza por una inflamación y por fibrosis progresiva del árbol biliar intra- y extra-hepático que progresa hacia la cirrosis e insuficiencia hepática en la mayoría de los casos, y en ocasiones hacia el colangiocarcinoma. La CEP aparece en un 11% de pacientes con CU, y su único tratamiento efectivo es el trasplante hepático. En general, los pacientes con CEP y CU presentan pancolitis extensa. La proctocolectomía con reservorio ileoanal es el tratamiento de elección cuando se indica cirugía89. La colectomía con ileostomía de Brooke no se considera una buena opción en pacientes con CEP avanzada, por el riesgo de sangrado grave recurrente de varices paraestomales, que son difíciles de tratar90. No hay muchos estudios publicados sobre los resultados del reservorio en pacientes con CEP, pero las 2 series más largas, de Mathis (Mayo Clinic) con 100 pacientes y de Gorgun et al. (Cleveland Clinic) con 65 pacientes, presentan resultados funcionales excelentes a largo plazo, sin diferencias significativas con respecto a pacientes sin CEP. Las complicaciones más frecuentes descritas fueron la hemorragia en el 9%, relacionada con un score de MELD más elevado prequirúrgico, y la sepsis pélvica. La mortalidad en estas series se relaciona con las complicaciones hepáticas y no se relaciona con la cirugía colónica.
Proctocolectomía total e ileostomíaLa proctocolectomía con ileostomía terminal ha sido la técnica de elección para la CU durante muchos años y sigue siendo una técnica segura y curativa, que permite a los pacientes llevar una vida activa y de buena calidad91.
Está indicado como la técnica de elección en pacientes que deciden no someterse a una proctocolectomía restauradora y para aquellos en los cuales el reservorio tiene más probabilidad de fracaso: pacientes con incontinencia fecal previa, lesiones esfinterianas, enfermedad anoperineal, o reserva funcional anorrectal disminuida debido a comorbilidades91. Hasta un 20% de los pacientes con CU todavía optan por la ileostomía permanente. Un estudio prospectivo con cuestionarios de calidad de vida encontró que la calidad de vida del paciente ostomizado que elige un estoma era igual a los pacientes con reservorio92.
La disección perineal del recto inferior se debe realizar en el plano interesfinteriano para minimizar las complicaciones perineales, a excepción de casos de cáncer rectal bajo, en los cuales se debe realizar la técnica estándar de amputación abdominoperineal.
Las complicaciones más frecuentes de esta técnica son las relacionadas con la ileostomía93 y otras similares a cualquier procedimiento abdomino-pélvico, como la oclusión intestinal, infección perineal y retraso de la cicatrización del periné, disfunción sexual o urinaria e infertilidad94,95.
Colectomía total y anastomosis ileorrectalLa colectomía total y anastomosis ileorrectal fue una operación común en pacientes antes del desarrollo del reservorio ileoanal, especialmente en aquellos que se oponían a una ileostomía permanente. Además, la anastomosis ileorrectal es menos complicada que el reservorio, con baja morbilidad postoperatoria. Hoy en día tiene indicaciones limitadas. No es un procedimiento curativo, y deja a los pacientes con el riesgo de síntomas persistentes y displasia o cáncer en el futuro96–98.
En una revisión reciente de 86 pacientes con anastomosis ileorrectal99, el recto tuvo que ser resecado en 46 de los 86 pacientes (53%) debido a proctitis refractaria en 24, displasia del recto en 15 y cáncer de recto en 7. Un 44% continúan teniendo una anastomosis ileorrectal funcionante tras un seguimiento medio de 11 años (rango 1-30). Las tasas de displasia y cáncer fueron del 17 y 8% respectivamente. El desarrollo de cáncer de recto se asoció a una duración mayor de la CU y al pobre seguimiento del muñón rectal.
Los pacientes con una anastomosis ileorrectal presentaron menor número de deposiciones durante el día y menos escapes nocturnos pero más sensación de urgencia que los pacientes con reservorios. La calidad de vida fue similar para los 2 grupos, pero aquellos con una anastomosis ileorrectal presentaron mayor número de restricciones dietéticas y de trabajo. Es importante mantener a estos pacientes bajo seguimiento frecuente con una rectoscopia anual y biopsias rectales múltiples.
Como la confección de un reservorio tiene riesgo de fracaso incluso en los grandes centros, el uso de una anastomosis ileorrectal podría considerarse como un procedimiento intermedio en pacientes jóvenes en edad fértil cuidadosamente seleccionados sin grave afectación rectal como opción transitoria hasta que termine de formar la familia100. La mayoría de pacientes en los que fracasa la anastomosis ileorrectal pueden ser posteriormente intervenidos para construirles un reservorio.
Ileostomía continenteDurante los años 70 y 80 la ileostomía continente (reservorio de Kock) era una alternativa atractiva a la ileostomía convencional en pacientes con CU. No necesitaba un dispositivo externo. Los pacientes evacuaban el reservorio 3-4 veces/día con un catéter y cubrían el estoma con una gasa pequeña101,102. La complejidad del procedimiento y la alta probabilidad de complicaciones que afectan el mecanismo valvular que mantiene la continencia, y que en muchos casos requiere varias re-intervenciones, desanimó a muchos cirujanos en su uso.
La conversión de un reservorio ileoanal fracasado a una ileostomía continente podría seguir siendo una alternativa, aunque la sepsis pélvica, cirugía previa, formación de adherencias y fibrosis pélvica pueden hacer que la disección sea imposible o demasiado arriesgada103,104.
ConclusionesUn porcentaje estable de pacientes afectos de CU precisarán cirugía electiva durante el curso de su enfermedad. Las opciones quirúrgicas disponibles tienen distintos riesgos y beneficios. La proctocolectomía total con ileostomía terminal está indicada en casos con mala función esfinteriana; la ileostomía continente se utiliza en muy pocos casos por sus frecuentes complicaciones. La colectomía total con anastomosis ileorrectal puede ser útil en casos de pacientes jóvenes en edad fértil, cuidadosamente seleccionados sin grave afectación rectal, como opción transitoria. La proctocolectomía restauradora con anastomosis ileoanal es la técnica más comúnmente utilizada. Presenta resultados a corto y largo plazo favorables, pero también tasas de complicaciones relativamente altas, como la reservoritis y complicaciones quirúrgicas postoperatorias. Elegir el momento apropiado para la cirugía y minimizar el tratamiento médico preoperatorio, así como el uso racional de la laparoscopia, podrían tener un efecto favorable sobre los resultados de la cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.