Objetivo. Presentar un estudio retrospectivo del tratamiento paliativo de las estenosis malignas de esófago, comparando el uso de prótesis metálicas autoexpandibles cubiertas y no cubiertas.
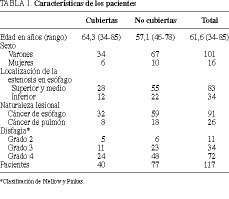
Pacientes y métodos. Hemos implantado 119 prótesis en 117 pacientes (101 varones y 16 mujeres, con un rango de edad de 34-85 años y una edad media de 65,3 años). La etiología de la estenosis era en 91 casos por cáncer de esófago y en 26 por cáncer pulmonar. Todos los pacientes presentaban un grado medio de disfagia de 3,52.
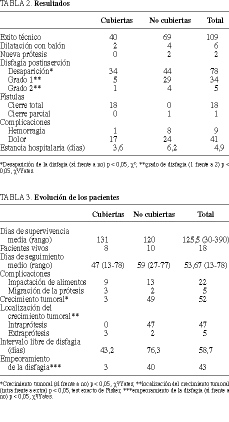
Resultados. Conseguimos el éxito técnico en 109 pacientes (93,1%). La disfagia desapareció en un mayor número de pacientes con prótesis cubiertas (p < 0,05). Las complicaciones técnicas y evolutivas se presentaron de forma similar en ambos grupos de pacientes. El intervalo libre de disfagia fue de 43,2 días ("cubiertas") y de 76,3 días ("no cubiertas"). La media de supervivencia fue de 131 días para las "cubiertas" y de 120 días para las "no cubiertas".
Conclusiones. Las prótesis metálicas autoexpandibles son efectivas y seguras para el tratamiento paliativo de estenosis malignas de esófago. Las prótesis cubiertas previenen el crecimiento tumoral a través de las redes de la malla y son de primera elección en el caso de existir fístulas esofágicas.
Objective. To present a retrospective study of the use of coated and uncoated expandable metallic prostheses in the treatment of malignant esophageal stenosis.
Patients and methods. We implanted 19 prostheses in 117 patients (101 men and 16 women; 34 to 85 years old; mean age: 65.3 years). The etiology was esophageal cancer in 91 patients and lung cancer in 26. The mean dysphagia grade before stent placement was 3.52.
Results. Technical success was achieved in 109 patients (93.1%). Dysphagia disappeared in a greater percentage of patients in the coated group (p < 0.05). The rates of technical and postoperative complications were similar in both groups. The mean dysphagia-free interval was 43.2 days in the coated group and 76.3 days in the uncoated group. The mean survival time was 131 days and 120 days, respectively.
Conclusion. Self-expanding metal stents are effective and safe for the palliative treatment of malignant esophageal stenosis. Coated prostheses prevent tumor ingrowth and their placement is the treatment of choice in the presence of esophageal fistulas.
Introducción
En los EE.UU. se diagnostican cada año 100.000 nuevos casos de cáncer de esófago aproximadamente, proporción que en Europa se estima en 7,5 casos por cada 100.000 habitantes1. En el momento del diagnóstico, sólo el 50% de las neoplasias de esófago son operables, y únicamente el 50% de éstas son susceptibles de cirugía con intención curativa2, con una supervivencia al año del 18% y a los 5 años del 5%; con todo, se obtienen porcentajes muy superiores a los de pacientes con neoplasias extraesofágicas que invaden por contigüidad el tracto digestivo superior.
La disfagia progresiva es el síntoma principal en la evolución de estos pacientes. Se trata de un síntoma tardío, ya que requiere la afectación del 50% de la circunferencia esofágica para su aparición, comprometiendo la supervivencia del paciente a muy corto plazo por desnutrición3. El objetivo del tratamiento paliativo será mejorar la calidad de vida de los pacientes disminuyendo la intensidad de la disfagia.
Entre los diferentes tratamientos paliativos disponibles, la cirugía no se considera indicada por la necesidad de hospitalización prolongada y la alta morbimortalidad que conlleva. El efecto de la radioterapia es corto, aparece tarde e inicialmen te produce una esofagitis transitoria que puede agravar la disfagia4-6. Mediante quimioterapia se obtienen unos efectos mínimos al principio y sólo si se asocia al tratamiento con láser7,8. El tratamiento con láser endoscópico, si bien es eficaz, presenta los inconvenientes del coste de la fuente de láser, la necesidad de sesiones repetidas cada 4 o 6 semanas, su limitación a lesiones cortas y el riesgo de perforación esofágica en el 6-9% de los casos8,9.
Las prótesis plásticas rígidas, conocidas desde hace años, precisan anestesia general para su inserción y son efectivas, aunque sólo permiten la ingestión de dietas líquidas o semisólidas y presentan una tasa de complicaciones de hasta el 36% según las series publicadas. Éstas incluyen la perforación esofágica (5-11%), su migración (11-15%), hemorragia (1-5%), necrosis esofágica debido a la presión sobre la pared (1-3%) y neumonía por aspiración, con una mortalidad asociada del 2- 4%3,9,10. Mediante las prótesis metálicas autoexpandibles, en un principio sin recubrimiento, se obtienen mejores resultados que con las endoprótesis rígidas convencionales, con una tasa de morbimortalidad prácticamente nula11,12. Con una estancia hospitalaria mínima se consigue un amplio diámetro luminal, con una rápida desaparición de los síntomas y un intervalo libre de disfagia más prolongado, pero el crecimiento del tumor a través de los orificios de la malla causa inevitablemente la reaparición de la disfagia8. Las prótesis metálicas autoexpandibles cubiertas fueron diseñadas para evitar esta infiltración tumoral y se consideran un buen tratamiento paliativo, ya que consiguen incrementar el estado nutricional y la calidad de vida de estos enfermos.
El objetivo de este trabajo es presentar nuestra experiencia con el uso de prótesis metálicas autoexpandibles cubiertas (PC) y no cubiertas (PNC), de introducción oral no endoscópica, en pacientes con estenosis esofágicas malignas, así como comparar los resultados.
Pacientes y métodos
Entre enero de 1993 y de 1998 hemos implantado 119 prótesis autoexpandibles en 117 pacientes con estenosis esofágica maligna (101 varones y 16 mujeres), con una edad media de 65,3 años (rango, 34-85 años). El diagnóstico de los pacientes fue de carcinoma escamoso de esófago en 72 casos (61,5%), carcinoma escamoso de pulmón en 22 casos (18,8%), adenocarcinoma de esófago en 19 casos (16,2%), carcinoma de pulmón de células pequeñas en 3 casos (2,5%), y carcinoma indiferenciado de pulmón en un caso (0,8%). Así mismo, en 19 pacientes (16,2%) se observaron fístulas traqueoesofágicas. Habían recibido tratamiento quimioterápico previo 32 pacientes (27,4%), quimio y radioterapia previas 37 pacientes (31,6%), y en el resto (41%) la prótesis fue el primer tratamiento paliativo utilizado. Las características descriptivas de nuestros pacientes se reflejan en la tabla 1.
Hemos indicado la colocación de una prótesis en los pacientes que cumplían los criterios recomendados por el grupo de trabajo sobre el uso de endoprótesis autoexpandibles en disfagia de origen neoplásico (auspiciado por el Ministerio de Sanidad y Consumo): pacientes con neoplasia maligna de esófago inoperable y/o irresecable en los que a) es imposible administrar tratamiento quimioterápico; b) presentan recurrencia tras el tratamiento con quimioterapia; c) tienen fístula pleuro o bronquioesofágica; d) presentan malnutrición severa, y e) tienen extensión locorregional de la enfermedad. Como contraindicaciones hemos considerado las alteraciones de la coagulación y la esperanza de vida menor de 30 días.
La clasificación de Mellow y Pinkas13 fue la utilizada para evaluar clínicamente la disfagia antes y después de la inserción de la prótesis. Esta clasificación divide la disfagia en cinco grados: posibilidad de ingerir dieta basal (grado 0), posibilidad de comer alimentos sólidos, pero con molestias (grado 1), sólo puede ingerirse dieta semisólida (grado 2), sólo se tolera la dieta líquida (grado 3) y, no puede ingerirse ningún tipo de alimento (grado 4). La distribución de los pacientes según el síntoma disfagia se observa en la tabla 1.
Las prótesis metálicas autoexpandibles utilizadas fueron de los tipos Wallstent, Strecker y Cook-Z Gianturco Rosch.
La prótesis de tipo Wallstent (Schneider AG, Bulack, Suiza) fue utilizada tanto en su modalidad cubierta como no cubierta; ambas tienen morfología tubular y están fabricadas con filamentos de acero inoxidable montados sobre catéteres guía de 11 y 18-22 F, respectivamente. Su longitud varía de 82-119 mm para las no cubiertas y de 105-110 mm para las cubiertas, con diámetros de 18-20 y 17-25 mm, respectivamente. La modalidad cubierta de poliuretano presenta, además, 2 cm no cubiertos proximales y distales para su mejor adaptación a la pared esofágica y evitar su migración. Hemos colocado 49 Wallstent en 47 pacientes, 30 PNC y 19 PC.
También se han utilizado las dos modalidades de prótesis Strecker (Medi-Tech Boston-Scientific Europe, Verviers, Bélgica). Ambas están fabricadas de nitinol, pero con diferente sistema de apertura. Las PNC (de 70-150 mm de longitud y 18 mm de diámetro) se presentan con una vaina estabilizante sobre la cual se comprime gracias a una gelatina sólida que se disuelve a temperatura corporal. Todo el sistema está montado sobre una vaina introductora de 24 F que se extrae liberando la prótesis. La modalidad cubierta de silicona está enlazada y comprimida por un lazo que es liberado tirando desde proximal a distal. El diámetro es de 18 mm y tiene 2 longitudes: 100 y 150 mm, con 15 mm adicionales no cubiertos en cada extremo para evitar su migración. Hemos implantado 66 Strecker: 49 PNC y 17 PC.
La PC Cook-Z Gianturco-Rosch (Cook Europe, Bjaeverkov, Dinamarca) está fabricada de acero inoxidable y viene monta-da sobre un catéter de 24 F. Tiene tres longitudes entre 100 y 140 mm, con un diámetro de 18 mm. Hemos implantado 4 Gianturco de 140 mm de longitud.
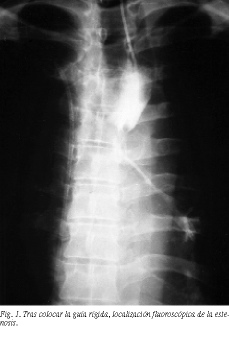
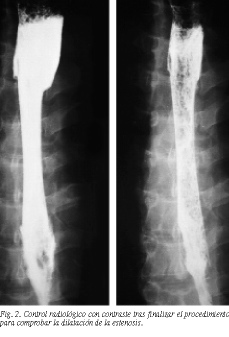
La técnica de implantación es diferente para cada tipo comercial de prótesis, pero presentan muchos puntos en común. En varios artículos se ha descrito de forma detallada8,14. El paciente es monitorizado y se administra anestesia local orofaríngea antes del procedimiento. Todas se introducen por la boca y requieren: a) cateterización del esófago para colocar una guía rígida Amplatz de alambre (0,038 pulgadas de grosor y 180 cm de longitud); b) localización y señalización fluoroscópica de la estenosis (fig. 1); c) dilatación con balón de la estenosis (8 12 mm); d) inserción de la prótesis guiada por fluoroscopia y su liberación, y e) control radiológico con contraste (fig. 2).
El procedimiento no requiere anestesia general. Únicamente utilizamos sedación con 1-2 mg de midazolam y analgesia intravenosa con 50 mg de petidina. Si no existen contraindicaciones, administramos 1 mg de atropina intravenosa 10 min antes del procedimiento para evitar la hipersalivación. En las primeras 24 h se realiza un control radiológico para comprobar la correcta ubicación y la completa apertura de la prótesis. A partir de ahí, los pacientes son controlados clínicamente cada 2 semanas y en todos los que presentan clínica se realiza control endoscópico y radiológico y con contraste.
Para el análisis estadístico comparativo entre ambos grupos de pacientes hemos utilizado los tests exacto de Fisher y de la * 2, aplicando la corrección de Yates cuando estaba indicada y obteniendo la correspondiente tabla de contingencia. También se ha utilizado el test de Kaplan-Meier (intervalo libre de disfagia y supervivencia). El nivel de significación elegido ha sido del 95%.
Resultados
La distribución por edad, sexo, localización y naturaleza de la lesión fue similar en ambos grupos de pacientes. Tampoco hubo diferencias en el grado de disfagia (tabla 1). Se consiguió éxito técnico inicial tras la implantación de la prótesis en 109 pacientes (93,1%), considerado por la liberación de la prótesis en el lugar deseado y la correcta dilatación de la estenosis, que corresponden al 100% (40 de 40) de los pacientes en los que se colocaron PC y al 89,6% (69 de 77) de los pacientes en los que se utilizaron PNC. Se observó fallo inicial en 6 pacientes (tres de tipo Wallstent y tres de tipo Strecker) porque las prótesis no completaron su apertura debido a las características de la lesión; en todos ellos se resolvió mediante la dilatación con balón. En los otros dos casos (Wallstent) se resolvió colocando una nueva prótesis, en un caso porque no conseguimos colocar la prótesis en el lugar deseado (centrada en la estenosis) y en el otro porque la longitud de la estenosis era mayor que la de la prótesis.
En cuanto a los resultados clínicos (tabla 2), la disfagia desapareció en un mayor porcentaje de pacientes con PC ( * 2, p < 0,05). No desapareció por completo en un mayor porcentaje de pacientes del grupo con PC, grupo en el que también perduró de mayor grado ( * 2/Yates, p < 0,05). El grado medio de disfagia tras la implantación protésica fue de 0,53 en pacientes con PNC y de 0,17 con PC. En el 100% de los 18 pacientes con fístula esofágica tratados con PC se observó el cierre de la fístula; en el paciente tratado con PNC (previamente a la comercialización de las PC) sólo se observó un cierre parcial de la fístula. Las complicaciones inherentes a la técnica fueron similares en ambos grupos de pacientes: dolor retrosternal y hemorragia. La estancia hospitalaria media por el procedimiento fue de 4,9 días.
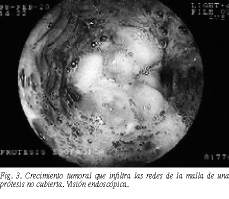
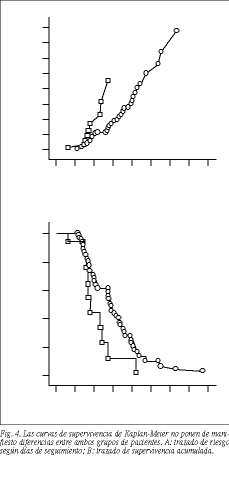
Las complicaciones observadas a medio y largo plazo (migración de la prótesis e impactación de alimentos) no fueron muy diferentes (tabla 3). La prótesis migró parcialmente (1-2 cm hacia abajo) en 2 pacientes con PC y en uno con PNC; en un paciente de cada grupo se observó desplazamiento total. Las prótesis fueron extraídas endoscópicamente. La impactación de alimentos se observó en 22 pacientes (18%), nueve con PC y trece con PNC. Se realizó endoscopia en todos los pacientes con reaparición o agravamiento de la clínica. El crecimiento del tumor así observado (tabla 2) fue diferente en cada grupo ( * 2/Yates, p < 0,05), sólo creció entre los filamentos de la malla protésica (fig. 3) en los pacientes con PNC (test exacto de Fisher, p < 0,05). El intervalo libre de disfagia fue de 43,2 días en los pacientes con PC y 76,3 días en los pacientes con PNC. La disfagia reapareció en un mayor porcentaje de pacientes con PNC ( * 2/Yates, p < 0,05). La supervivencia media fue de 131 días (PC) y de 120 días (PNC). Las curvas de supervivencia de Kaplan-Meier no ponen de manifiesto diferencias entre ambos grupos (figs. 4A y B).
Discusión
Los pacientes con neoplasia de esófago constituyen un desafío terapéutico, ya que la mayoría de ellos sólo podrán recibir tratamiento paliativo, y casi el 20% de los tratados quirúrgicamente desarrollarán una nueva disfagia por reestenosis en el lugar de la anastomosis15. Estos pacientes sufren un progresivo deterioro de su estado general condicionado, además de por su síndrome paraneoplásico, por un progresivo descenso de su capacidad para ingerir alimentos2,14,16. Existen varias posibilidades para el tratamiento paliativo del cáncer de esófago, y su objetivo es recuperar la permeabilidad esofágica para posibilitar la alimentación oral y un mejor control del crecimiento tumoral con otras alternativas terapéuticas (radioterapia, quimioterapia, etc.). Algunas posibilidades han sido comentadas en la introducción2-12,14,17-19. El uso de prótesis metálicas fue propuesto por Frimberger en 198320; desde entonces, varios autores21-24 y nosotros mismos en una comunicación preliminar25 hemos demostrado su eficiencia y seguridad como tratamiento paliativo de la estenosis maligna del esófago.
En nuestra experiencia, la implantación de las prótesis ha sido un éxito técnico en la mayoría de los pacientes (93,1%), sin necesidad de anestesia general14. Al igual que otros autores18,22, creemos que la técnica es más precisa utilizando fluoroscopia que con endoscopia, mediante la cual sólo puede observarse el extremo proximal. Además, el catéter guiado fluoroscópicamente sobrepasa la estenosis esofágica con más facilidad. No obstante, consideramos fundamental la colaboración del endoscopista, tanto antes como después del procedimiento, para resolver posibles complicaciones (migración, impactación de alimentos, etc.).
A pesar de la opinión de Acunas et al5, los indeseables fallos y complicaciones técnicas publicadas en la bibliografía son mínimas21-24. En nuestra experiencia, estos problemas han sido solucionados usando dilatación con balón o implantando una nueva prótesis. En todos los casos, el éxito técnico conllevó clínicamente una disminución de la disfagia. En un mayor porcentaje de pacientes con PC desapareció la disfagia por completo. Este beneficio, para el que no tenemos una explicación contundente, no ha sido referido en la bibliografía. También en un mayor porcentaje del grupo de pacientes con PC ha persistido la disfagia, pero estos casos eran los más graves de nuestra serie.
La morbilidad asociada fue mínima y muy bien controlada. El dolor retrosternal fue controlado en todos los casos con los analgésicos habituales, desapareciendo progresivamente en 2 o 3 días. No hemos observado mayor presentación del síntoma dolor según el tipo de prótesis, como habían referido Saxon et al21 para las prótesis de Gianturco, aunque esto podría ser explicado por el reducido número de éstas utilizadas en nuestra serie. En los casos en que observamos hemorragias, éstas fueron leves, sin repercusión clínica ni analítica, y autolimitadas. No se produjo mortalidad asociada a la técnica. No hemos observado ninguna de las otras complicaciones descritas en la bibliografía: hemorragia gastrointestinal, infecciones, fístula traqueoesofágica, etc.8,22,23. Cuando se sospechó perforación, se colocó una nueva PC sobre la primera durante la misma sesión técnica.
Al igual que Morgan et al26, creemos que en la perforación y las fístulas esofágicas el tratamiento de elección es la PC, relegando las PNC a una segunda posición, ya que el contenido esofágico puede pasar fácilmente a través de la malla al interior del defecto27-29. En consecuencia, hemos utilizado PC en pacientes con fístulas esofágicas, confirmando los buenos resultados al cerrarse la fístula sin recidiva posterior. Sólo en un paciente con fístula esofagorrespiratoria utilizamos PNC, debido a que las PC aún no estaban disponibles.
En el seguimiento posterior, las únicas complicaciones observadas han sido la impactación de alimentos y la migración de la prótesis. No hemos observado el resto de complicaciones que se han descrito en la bibliografía y que han supuesto la repetición del procedimiento hasta en el 51% de los casos: inclinaciones de las prótesis, fístulas mediastínicas, úlceras en los bordes de las prótesis, irritaciones de la mucosa y, como consecuencia, hemorragias5,18,21. La impactación de alimentos se resolvió por aspiración o endoscopia de forma ambulatoria. La migración total de la prótesis fue solucionada colocando una nueva prótesis, mientras que los desplazamientos parciales no precisaron tratamiento. Aunque el desplazamiento se observó más en las PC, como han recogido otros autores5,18,30, la diferencia no tuvo significación estadística, aunque posiblemente lo sería si el tamaño de la muestra fuese mayor.
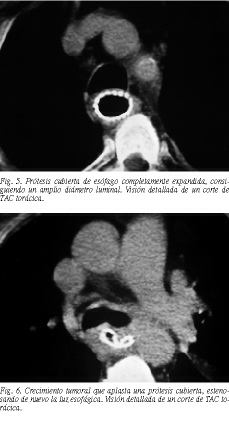
El principal problema evolutivo es el inevitable crecimiento tumoral, que causó mayores problemas en el caso de las PNC. En nuestra serie, al igual que en otras5,8,14,17,18,31, las PC logran el objetivo de evitar el crecimiento tumoral entre las redes de la malla, si bien en un período más tardío el inevitable crecimiento tumoral se observa desbordando la malla en sus extremos, e incluso aplastándola (figs. 5 y 6). En general hubo pocas diferencias entre las PNC y las PC. Las PNC se asocian con una mayor incidencia de crecimiento tumoral a través de la malla, y las PC con una mayor incidencia de migración protésica. El tipo de prótesis no influyó en la supervivencia; tampoco era el objetivo.
En conclusión, creemos que las prótesis autoexpandibles son un eficiente tratamiento paliativo de las estenosis esofágicas malignas. Producen una notable mejoría del síntoma disfagia mejorando de forma notoria la calidad de vida de este grupo de pacientes. El procedimiento es técnicamente sencillo, tiene una baja incidencia de complicaciones asociadas y precisa una corta estancia hospitalaria. Tras su inserción, las complicaciones evolutivas son muy pocas y tienen fácil solución. La principal complicación de estos pacientes es el crecimiento tumoral, que agrava de nuevo la disfagia, la cual aparece más tardíamente con las prótesis cubiertas. Éstas son de elección en el tratamiento de perforaciones y fístulas esofágicas. Por todo ello, creemos que en un futuro próximo, las prótesis autoexpandibles cubiertas desempeñarán un papel fundamental en el tratamiento de los pacientes con estenosis esofágicas malignas susceptibles de tratamiento paliativo.