Aunque en los últimos años se ha producido una disminución significativa de la utilización de transfusiones de sangre alogénica (TSA), la administración perioperatoria de hemoderivados es relativamente frecuente en los pacientes oncológicos sometidos a cirugía. La práctica transfusional, sin embargo, difiere mucho entre los diferentes hospitales. Blumberg et al1, en su metaanálisis, describen un índice transfusional de un 45-78%, mientras que Nilsson et al2 sitúan este índice en un 3-31% de los 14.052 pacientes sometidos a cirugía por cáncer colorrectal en 1994-2000. La TSA en los pacientes oncológicos se asocia a riesgos de especial relevancia. De ellos cabe destacar la inmunomodulación inducida por la transfusión de sangre alogénica (IMITA), que podría estar relacionada con un peor pronóstico clínico, un aumento de las infecciones postoperatorias y/o una mayor incidencia de recurrencia tumoral3-5.
Por otra parte, la anemia es la alteración hemática más frecuente en los pacientes neoplásicos; su prevalencia está determinada por el tipo de enfermedad y su tratamiento6. Generalmente se trata de una anemia moderada, aunque un 15-23% de los pacientes con tumores sólidos precisan transfusiones en algún momento de su evolución7. Para evitar o reducir al mínimo imprescindible el uso de TSA y minimizar los efectos adversos que la transfusión puede tener en el paciente neoplásico, es necesaria una estrategia de ahorro de sangre perioperatoria bien definida. Cualquier medida de ahorro deberá precederse de la realización de una adecuada anamnesis que permita optimizar la preparación preoperatoria del paciente.
Dada la carencia en España de información detallada sobre la situación biológica de los pacientes oncológicos que van a ser sometidos a cirugía electiva del cáncer, el objetivo que se plantea el presente estudio es el conocimiento más exhaustivo de esta población que nos permita evaluar factores de riesgo y profundizar en el adecuado manejo de las alternativas transfusionales para estos pacientes.
Material y métodoSe trata de un estudio observacional epidemiológico, de corte transversal, prospectivo y multicéntrico en el que participan 39 centros hospitalarios españoles.
El periodo de inclusión de los pacientes fue de 1 semana. Cada centro incluyó a todos los pacientes que iban a ser intervenidos en la semana del estudio y cumplían los criterios de inclusión: pacientes con diagnóstico de tumor digestivo, urológico o ginecológico sometidos a cirugía programada para resección tumoral en la semana de estudio (julio de 2005) que hubieran firmado el consentimiento informado. Al tratarse de un estudio tipo registro, no había un número predeterminado. Las variables que se registraron, recogidas de la historia clínica del paciente, fueron las siguientes: datos demográficos (edad y sexo), datos relativos a la enfermedad oncológica (localización del tumor, intervalo desde el diagnóstico hasta la fecha de la intervención quirúrgica, intervalo desde la consulta de preanestesia a la intervención quirúrgica, tratamientos previos de quimioterapia y/o radioterapia y estado clínico funcional valorado según el índice de Karnofsky [IK]), datos relativos a los parámetros biológicos o analíticos preoperatorios (hemoglobina, metabolismo del hierro, proteinograma y pruebas de función hepática), datos relativos a transfusiones preoperatorias (transfusión desde el diagnóstico de la enfermedad oncológica y transfusión en el mes previo a la intervención) y datos relativos al tratamiento de la anemia (tratamiento actual o no con hierro, ácido fólico y/o vitamina B12 y agentes estimuladores de la eritropoyesis).
Análisis estadísticoSe presentan las distribuciones de frecuencias absolutas y relativas de las variables cualitativas, así como las medidas de tendencia central y dispersión de las variables cuantitativas. Para la realización del análisis se utilizó el software SPSS Versión 13.0.
ResultadosEl número total de pacientes reclutados durante el periodo de estudio fue 492, de los que se excluyó a 20 por causas diversas (inclusión de diagnóstico erróneo en 7 casos; inclusión fuera del plazo en 1 caso; datos incompletos en 12 casos). La muestra efectiva del estudio fue, por lo tanto, de 472 pacientes: 261 varones (55,3%) y 211 mujeres (44,7%); la media de edad fue 65,6 ± 13 años.
El 83,5% de los tumores fueron primarios y la distribución según la localización tumoral fue la siguiente: el 38,3% (n = 181), urológicos; el 34,1% (n = 161), digestivos, y el 27,5% (n = 130), ginecológicos; destacan por su frecuencia las localizaciones en vejiga (22,2%), mama (18,2%) y colon (12,3%) (tabla 1).
Tabla 1. Localización tumoral
En 36 (7,6%) casos se había seguido tratamiento con quimioterapia previamente y en 7 (1,5%), radioterapia. Además, 10 (2,1%) pacientes habían recibido la combinación de quimioterapia y radioterapia. El total de pacientes con quimioterapia antes de la cirugía fue 46 (9,7%), y el total de pacientes tratados previamente con radioterapia fue 17 (3,6%); 419 pacientes no recibieron ningún tratamiento antes de la cirugía.
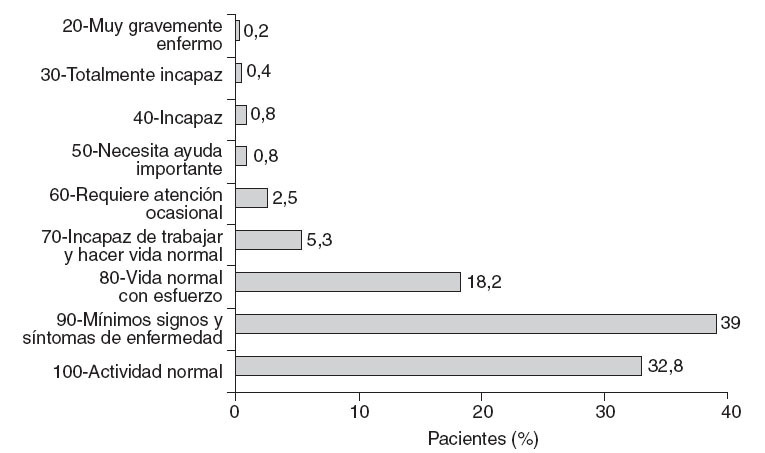
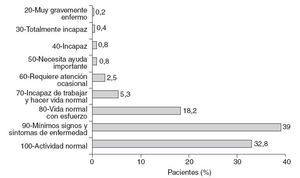
El 71,8% de los pacientes presentaron un IK > 80 y el 28,1%, ≤ 80 (fig. 1).
Fig. 1 – Estado funcional. Valoración según índice de Karnofsky.
El tiempo transcurrido desde el diagnóstico hasta la fecha de la cirugía fue de 6,2 ± 6 semanas y el tiempo medio transcurrido entre la visita preanestésica y la cirugía, 19,1 ± 23 días.
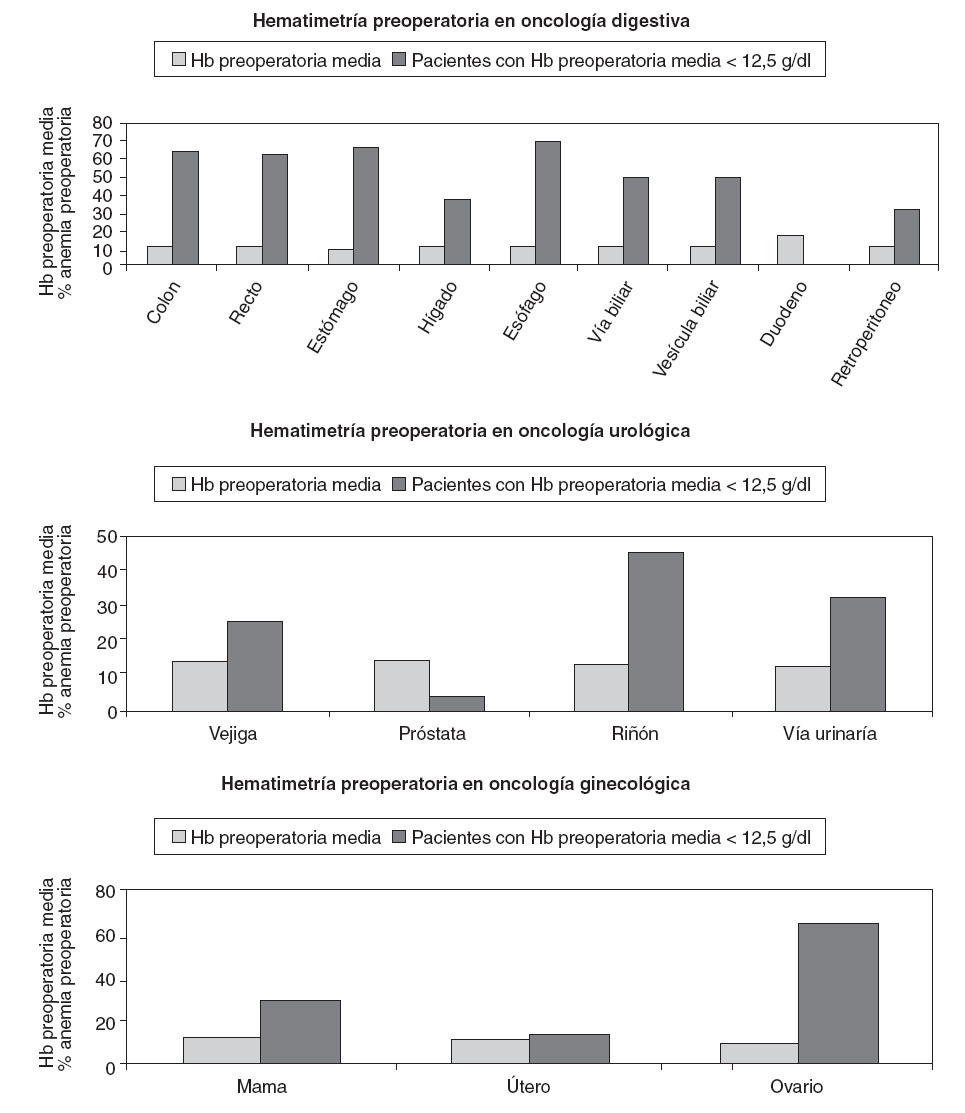
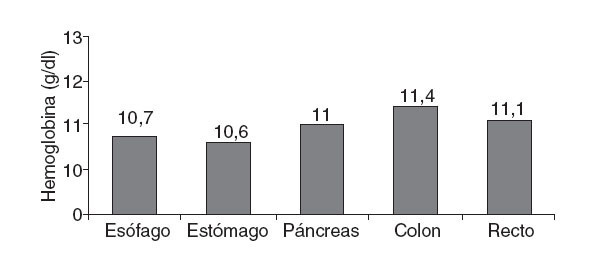
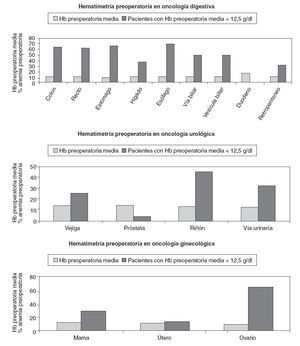
El valor preoperatorio medio de hemoglobina (Hb) fue 13,1 ± 2 g/dl y el 44,2% de los pacientes tenían cifras inferiores. Analizando los valores medios de Hb obtenidos según la localización tumoral, se observa que los valores más bajos corresponden a tumores del tracto gastrointestinal. El 49% de los pacientes con tumores primarios digestivos tenían antes de la cirugía valores de Hb < 12,5 g/dl, especialmente los pacientes candidatos a cirugía oncológica de esófago, estómago, colon y recto (fig. 2).
Fig. 2 – Valores hematimétricos preoperatorios.
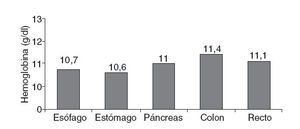
La relación del IK con el valor medio de Hb prequirúrgico objetivó que los más bajos se encontraban en el grupo de pacientes con IK 30-70, que presentan una media de Hb preoperatoria de 11,9 ± 2 g/dl. Para IK = 80, la Hb preoperatoria fue de 12,2 ± 2 g/dl. Analizando las subpoblaciones con IK 30-80 según la localización tumoral, los tumores digestivos son los que presentaron valores medios de Hb preoperatorios más bajos (fig. 3).
Fig. 3 – Relación entre índice de Karnofsky 30-80 y anemia preoperatoria.
El estudio de los parámetros biológicos preoperatorios del metabolismo del hierro y el grado de reacción inflamatoria sistémica se han practicado de forma dispersa y en insuficiente número de pacientes (n < 80), por lo que hay una gran dispersión de datos que impide su valoración (tabla 2).
Tabla 2. Valores preoperatorios del metabolismo del Fe y perfil inflamatorio
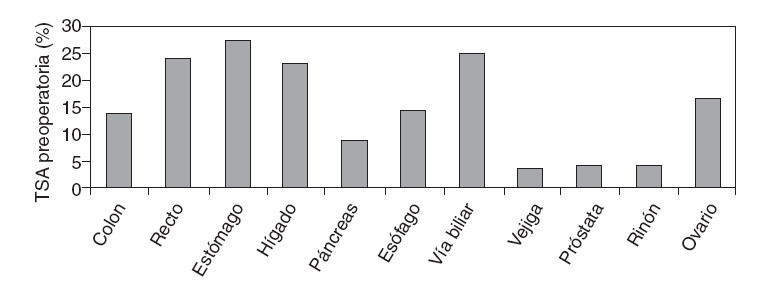
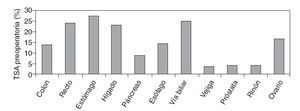
El 8,9% de los pacientes del estudio recibieron TSA preoperatoria, más frecuentemente en cirugía oncológica digestiva (19,9%) que en cirugía oncológica urológica o ginecológica (el 4,4 y el 1,5% respectivamente). Las localizaciones tumorales con mayor frecuencia de TSA preoperatoria fueron estómago, recto, hígado y vía biliar (fig. 4). La media de transfusiones desde el diagnóstico ha sido de 1,3 ± 0.7, pero no se pudo relacionar el episodio transfusional con quimioterapia previa.
Fig. 4 – Frecuencia de transfusión de sangre alogénica (TSA) preoperatoria.
En cuanto al tratamiento realizado para la anemia prequirúrgica, destaca que sólo 6 pacientes (el 1,3% del total) recibieron tratamiento con agentes estimuladores de la eritropoyesis (EPO), 40 (8,5%) fueron tratados con hierro y 15 (3,2%), con vitamina B12 o ácido fólico. De ellos, el 74% no había recibido tratamiento previo con quimioterapia y/ o radioterapia.
DiscusiónNumerosos estudios han descrito una elevada incidencia de anemia en el paciente con cáncer. Dunne et al8 investigaron la incidencia de anemia preoperatoria en pacientes sometidos a cirugía no cardíaca, y encontraron un 34% de 6.301 pacientes estudiados. En nuestro estudio la cifra media de Hb prequirúrgica fue de 13,1 ± 2 g/dl.
Al valorar la Hb prequirúrgica en función de la localización tumoral, destaca una mayor incidencia de Hb < 12,5 g/dl en los tumores del tracto digestivo, y se concluye que el 49% de los pacientes con tumores primarios digestivos tienen una Hb prequirúrgica < 12 g/dl, y de ellos, el 13% presenta cifras de Hb < 10 g/dl.
La anemia preoperatoria en pacientes con cáncer del tracto gastrointestinal está bien documentada9,10. Dunne et al11 estudiaron recientemente la incidencia de anemia preoperatoria en el cáncer colorrectal y evaluaron sus factores de riesgo. De 311 pacientes, documentan que el 46,1% tenía anemia preoperatoria, más frecuente en las localizaciones derechas y con incidencia que aumenta con la edad y según el estadio tumoral.
El mecanismo que causa la anemia en el paciente neoplásico es a veces difícil de identificar y se considera como una anemia de la enfermedad crónica. En su patogenia, aparte de las posibles pérdidas por hemorragia, pueden contribuir otras anomalías7. La anemia preoperatoria ha sido asociada con un aumento en la morbilidad y la mortalidad. En el paciente quirúrgico, los valores preoperatorios de Hb están relacionados de forma inversa con la mortalidad12.
En el estudio citado, Dunne et al11 determinan que la anemia preoperatoria es un factor independiente de riesgo de mayor morbimortalidad, y en el paciente con cáncer colorrectal es factor predictivo de mal pronóstico. Otros estudios, sin embargo, indican que no es la anemia en sí la que se asocia a una mayor mortalidad, sino la práctica transfusional lo que incrementa el riesgo. De hecho, la anemia está bien documentada como factor predictivo de riesgo transfusional. Tartter et al13 realizan un estudio prospectivo en 123 pacientes con cáncer colorrectal para identificar las variables determinantes de la transfusión de sangre perioperatoria. El análisis multivariable muestra varios factores, que incluyen la edad, las pérdidas sanguíneas intraoperatorias y una cifra baja de hematocrito al ingreso como factores significativos de riesgo transfusional.
De forma similar, Benoist et al14 determinan que los valores de Hb ≤ 12,5 g/dl son un factor independiente de riesgo de recibir transfusión de sangre en pacientes sometidos a resección quirúrgica por cáncer de recto.
Hay datos que hacen pensar que la TSA es un factor de riesgo independiente en el desarrollo de infecciones postoperatorias y que aumenta la recurrencia tumoral y disminuye la supervivencia. Sin embargo, el análisis de los resultados obtenidos en nuestro estudio muestra que sólo un 12,9% de los pacientes recibieron durante el preoperatorio algún tipo de tratamiento para su anemia y un 15% recibió transfusiones como único tratamiento preoperatorio para mejorar las cifras de hemoglobina.
Los agentes y mecanismos inmunitarios que están involucrados en la inmunodeficiencia relacionada con la transfusión de sangre no están completamente aclarados todavía. Se ha descrito una gran variedad de alteraciones y cambios inducidos por la TSA en las respuestas humoral y celular del sistema inmunitario1,3,4,15 (tabla 3). Diversos estudios sobre estos mecanismos proponen una hipótesis que cobra más fuerza sobre las demás3,16 y se basa en la estimulación de la respuesta de los linfocitos T helper (Th) 2 inmunodepresora que anula la inmunidad celular y contrarresta los efectos «inmunoestimuladores» producidos por una respuesta de los Th1.
Tabla 3. Cambios inmunitarios asociados a la transfusión de sangre alogénica
En la actualidad no disponemos de evidencias que confirmen de forma irrefutable que la TSA origina un aumento de infecciones bacterianas, un aumento de recidiva tumoral y una menor supervivencia en los pacientes oncológicos, porque puede haber otros factores con importante participación3.
Sin embargo, hay datos procedentes de numerosos estudios clínicos que justifican la necesidad de realizar un esfuerzo para reducir al mínimo imprescindible el uso de sangre alogénica. Así, Heiss et al17, en un estudio con 120 pacientes con cáncer colorrectal, encuentran una diferencia significativa en las tasas de infección postoperatoria cuando comparan a los pacientes transfundidos con sangre alogénica con los que recibieron su propia sangre. Otros trabajos llegaban a las mismas conclusiones demostrando que las transfusiones de sangre constituyen un factor de riesgo independiente en el desarrollo de infecciones de la herida postoperatoria18, de complicaciones infecciosas postoperatorias19 y de fracaso multiorgánico20. En un estudio en el que se incluyó a 6.301 pacientes sometidos a cirugía no cardíaca en 1995-2000, la transfusión de sangre perioperatoria se muestra como factor predictivo de infección y morbimortalidad8 y causa de una mayor utilización de recursos.
En cirugía colorrectal se encontró infección bacteriana postoperatoria en un 39% de los pacientes transfundidos, frente a un 24% de los no transfundidos, con lo que aumenta el riesgo relativo de infección para el paciente transfundido21. En un estudio prospectivo reciente sobre 740 pacientes sometidos a cirugía electiva por cáncer colorrectal, se constató un aumento de infección postoperatoria en los pacientes que recibieron concentrados de hematíes, aunque éstos fueran desleucocitados, respecto a los que no fuerontransfundidos. En un análisis multivariable, además, el riesgo de muerte fue significativamente superior en aquellos que contrajeron infección22. Los resultados de estos y otros estudios han sido objeto de un metaanálisis en el que los autores concluyen que «no existen evidencias definitivas en torno a la existencia de un efecto inmunomodulador de la TSA que cause un incremento de la recidiva de cáncer y/o de infecciones bacterianas postoperatorias», aunque está justificado un alto grado de sospecha de que la IMITA realmente existe y podría aumentar en un 10% el riesgo de infección postoperatoria4,23.
La relación entre TSA y un peor pronóstico a largo plazo en la cirugía oncológica no está clara, aunque la mayoría de los estudios al respecto demuestran una correlación entre recurrencia tumoral y TSA2. Heiss et al25 realizaron un estudio en cirugía colorrectal aleatorizado para transfusión de sangre autóloga y transfusión de sangre alogénica y encontraron un mayor tiempo de supervivencia libre de tumor en el grupo de sangre autóloga. En el trabajo de Bumblerg et al26, una revisión de 197 pacientes tratados de adenocarcinoma de colon, se objetivó un 9% de recurrencia en pacientes que no recibieron transfusión frente a un 43% de recurrencia entre los 129 pacientes que la requirieron. Dos metaanálisis trataron de resumir los datos publicados hasta entonces sobre la relación entre TSA y cirugía en cáncer colorrectal. En ambos se encuentra un significativo aumento en el riesgo relativo en cuanto al pronóstico27,28. Entre las alternativas que existen para reducir los riesgos transfusionales, corregir la anemia preoperatoria parece parte fundamental de la estrategia. Aunque son varias las anomalías que intervienen en su patogenia, la administración de eritropoyetina recombinante (EPO) estimula la eritropoyesis promoviendo la proliferación de precursores eritroides y su maduración a eritrocitos.
La administración perioperatoria conjunta de EPO y hierro a pacientes anémicos con cáncer sometidos a cirugía disminuye las transfusiones de sangre alogénica y/o el número de pacientes transfundidos y la incidencia de complicaciones postoperatorias29.
Un estudio prospectivo, a doble ciego y aleatorizado6 demostró que los pacientes tratados con EPO 300 U/kg/día durante 14 días más hierro intravenoso 100 mg/día mejoraron significativamente los valores de Hb preoperatorios y postoperatorios y que disminuyeron los riesgos de TSA en un 51%. Otros estudios encuentran resultados similares, aunque la traducción del aumento de la eritropoyesis en la reducción de los requerimientos transfusionales es variable dependiendo de la dosis de EPO administrada y de la disponibilidad de sus-tratos indispensables para la eritropoyesis: hierro, vitamina B12 y ácido fólico30,31. En nuestro estudio, sólo 6 (1,3%) pacientes habían seguido tratamiento preoperatorio con EPO, 40 (8,5%) habían seguido tratamiento con hierro y 15 (el 3,2% del total) con vitamina B12 y ácido fólico. De los pacientes tratados farmacológicamente por anemia, un 26% lo fueron tras ser sometidos a quimioterapia y/o radioterapia.
Clásicamente, puede pensarse que la falta de tratamiento preoperatorio de estos pacientes se debe a su precoz indicación quirúrgica tras el diagnóstico; sin embargo, el análisis de los datos de este estudio demuestra que en la mayoría de las situaciones se cuenta con tiempo suficiente para una óptima preparación preoperatoria del paciente (6,2 ± 6 semanas desde el diagnóstico hasta la fecha de la cirugía y 19,1 ± 23 días desde la visita preanestésica).
Asimismo constatamos una deficiente evaluación de los parámetros analíticos en el estudio preoperatorio. Es conocido que los déficit nutricionales en general afectan no sólo a la eritropoyesis, sino a varios aspectos del sistema inmunitario32. No contamos con datos en este estudio que indiquen que utilizar sangre autóloga sea una medida de ahorro de sangre alogénica en nuestros pacientes oncológicos sometidos a cirugía. Parece plausible que la transfusión de sangre aútologa no sólo no presenta efectos negativos inmunosupresores, sino que puede ejercer un beneficioso efecto estimulador6.
Una adecuada política transfusional y de ahorro de sangre sólo puede llevarse a cabo en cirugía oncológica optimizando previamente las condiciones preoperatorias del paciente. Es necesario crear conciencia de que esta preparación forma parte de una planificación quirúrgica que trate de evitar la TSA y sus posibles complicaciones. El estudio realizado muestra que hay tiempo para establecer protocolos preoperatorios de diagnóstico y tratamiento precoz de la anemia.
AgradecimientosA los anestesiólogos de todos los hospitales participantes. Al laboratorio Janssen Cilag por su apoyo logístico al proyecto.
Hospitales participantesH. Cruces (Bilbao), H. Basurto (Vizcaya), H. Miguel Servet (Zaragoza), Fundación H. Son Llàtzer (Palma de Mallorca), Complejo H. Orense, H. Vall d’Hebrón (Barcelona), H. General de Elda (Alicante), Centro Marina Alta, H. Clínico Universitario (Málaga), H. La Paz (Madrid), H. Ramón y Cajal (Madrid), H. de Móstoles (Madrid), H. General Yagüe (Burgos), H. San Jorge (Huesca), H. Juan Ramón Jiménez (Huelva), H. Universitario Virgen Macarena (Sevilla), H. San Agustín (Avilés), H. del Mar (Barcelona), H. Virgen de la Concha (Zamora), H. Ntra. Sra. de la Candelaria (Tenerife), H. Reina Sofía (Córdoba), Fundación Sanitaria de Igualada (Barcelona), H. Clínico de Conxo (Santiago), H. Clínico de Valencia, Complejo H. de Santiago de Compostela, H. Clínico San Carlos (Madrid), H. Virgen del Rocío (Sevilla), H. Puerta del Mar (Cádiz), H. de Fuenlabrada (Madrid), H. de Sant Pau (Barcelona), H.U. de Valme (Sevilla), H. de Castellón, H. Clínic (Barcelona), C.S. Torrecárdenas (Almería), C.H. General de Valencia, H. Clínico de Salamanca, H.I.U. de Las Palmas de Gran Canaria y H. Lluís Alcanys (Xàtiva).
*Autor para correspondencia.
Correo electrónico: ldurangi38@hotmail.com (L. Durán). 009-739X/$-see front matter © 2008 AEC. Publicado por Elsevier España, S.L. Todos los derechos reservados.