El tratamiento con intención curativa en los pacientes con MHCCR es la resección hepática (RH) siempre que se pueda conseguir la resección R0 con baja morbimortalidad1-3. Numerosos estudios4-11 han analizado los clásicos factores preoperatorios pronósticos de supervivencia, con el fin de seleccionar a los pacientes en quienes se podría evitar una cirugía innecesaria: factores relacionados con el paciente, con el tumor primario y con las metástasis hepáticas (MH). Sin embargo, algunos autores no contraindican la cirugía en estos pacientes con criterios de mal pronóstico siempre que se pueda conseguir un resección R0, ya que existen factores pronósticos que sólo se obtienen tras la resección de las MH (histológicos, morbilidad, antígeno carcinoembrionario [CEA] postoperatorio y quimioterapia [QMT] adyuvante).
Mientras que el CEA preoperatorio es considerado un factor de mal pronóstico (CEA > 1011,> 305,> 507, > 2004 ng/ml), pocos estudios2-10 han analizado el CEA a 1 y 3 meses tras la intervención como una medida de la eficacia de la cirugía, lo cual puede tener implicaciones relevantes en tratamientos posteriores.
El objetivo de este estudio es analizar, en 210 pacientes sometidos a RH por MHCCR, los factores preoperatorios e intraoperatorios y los obtenidos tras la RH, tales como los factores histológicos, la morbilidad postoperatoria, la concentración de CEA a 1 y 3 meses tras la intervención y la QMT adyuvante.
Pacientes y métodoEntre septiembre de 1996 y diciembre de 2006, hemos intervenido a 210 pacientes diagnosticados de MHCCR, en los que se realizaron 273 RH. La media ± desviación estándar (intervalo) de edad fue 61 ± 12 (23-84) años, con mayoría de varones (n = 140). La media de seguimiento fue 55 ± 3 (12-124) meses.
En ese periodo se evaluó en nuestra unidad a 270 pacientes con MHCCR, de los que se consideró resecables al inicio a 176 (65,1%) pacientes. De éstos, se realizó la RH a 162 pacientes (el 92% de resecabilidad), y los 14 restantes pasaron a QMT paliativa por enfermedad hepática irresecable (n = 9) o enfermedad diseminada (n = 5). De los 94 pacientes irresecables al inicio, se consiguió el rescate en 48 (51%) casos, 25 con QMT, 8 con técnicas de oclusión portal (TOP) y 15 con TOP y QMT. En 23 pacientes fue necesario realizar TOP debido al volumen hepático residual (VHR) insuficiente (embolización portal preoperatoria [EPP] en 7 casos y resección en dos tiempos en los 16 restantes).
En el caso de RH de 4 o más segmentos, realizamos una tomografía computarizada (TC) helicoidal con cálculo del VHR, y se consideró VHR insuficiente cuando fue < 25% en hígados sanos y < 35% en hígados patológicos (diabéticos o esteatosis por QMT previa)12.
De los 210 pacientes intervenidos, 99 (47,8%) presentaron MH sincrónicas. En 41 (19,5%), en el momento de la RH había enfermedad extrahepática que se pudo resecar de forma R0: 3 casos con recidiva del CCR; 8 casos de metástasis pulmonares; 8 casos con afección ganglionar hiliar (N1) en los que se practicó linfadenectomía; 20 casos en los que realizamos resección de implantes peritoneales localizados (en 2 casos con resección intestinal asociada) y/o de diafragma, 1 caso con metástasis pulmonares e implantes peritoneales, y 1 caso con afección ganglionar hiliar (N1) e implantes peritoneales. En todos los casos los implantes peritoneales fueron localizados, sin ascitis o carcinomatosis peritoneal.
Técnica quirúrgicaEn todos los casos, tras la exploración de la cavidad abdominal procedimos a palpación y ecografía intraoperatoria del hígado. Durante la sección del parénquima, mantuvimos una presión venosa central < 4 mmHg asociando una perfusión de nitroglicerina a 1 µg/kg/min. En las RH con abordaje por laparotomía, se realizó la sección parenquimatosa con cavitrón Cusa Excel y bisturí de argón. En las RH por abordaje laparoscópico, se utilizó el Ligasure Atlas, el bisturí armónico y las endoguías vasculares13,14. Se realizó la maniobra de Pringle en 63 pacientes en una media de 10 ± 2 (5-22) min.
Se realizaron 273 RH: en 153 pacientes, 1 RH; en 41 pacientes con recidiva intrahepática, 88 RH (en 36, 2 RH; en 4, 3 RH y en 1, 4 RH), y las 32 RH restantes fueron resecciones en dos tiempos en 16 pacientes. En 28 pacientes se realizó la RH por laparoscopia; 126 fueron RH mayores y 147, RH menores. En 19 casos se agregó radiofrecuencia intraoperatoria para completar la resección R0.
La media de tiempo quirúrgico fue 194 ± 88 min. Se transfundió a 50 (23%) de los 210 pacientes. En el 21% de las 273 resecciones fue necesario transfundir, con una media de 832 ± 539 (300-3.600) ml. En ningún caso de resecciones mayores con control vascular hemihepático se empleó oclusión vascular del hígado residual, con el fin de minimizar el riesgo de insuficiencia hepática postoperatoria.
SeguimientoEl mismo equipo quirúrgico realizó el seguimiento de todos los pacientes al mes, a los 3 meses y a partir del primer año cada 6 meses, con un protocolo prospectivo. No se perdió a ningún paciente para el seguimiento. Se determinaron, en todos los casos, las concentraciones de CEA preoperatorias el día previo a la cirugía, así como las postoperatorias al mes y a los 3 meses de la intervención. Los pacientes fueron remitidos al mes de la cirugía a las unidades de oncología para posterior tratamiento con QMT adyuvante.
Método estadísticoLas variables pronósticas analizadas se presentan en las tablas 1-5.
Los datos fueron procesados con el programa estadístico SPSS 11.5 para Windows. Se calcularon las tasas de supervivencia mediante el método de estimación de Kaplan-Meier y las curvas de supervivencia se compararon con el log-rank test o con el test de Breslow. Los datos de supervivencia de cada grupo se resumen mediante sus tasas de supervivencia a 1, 3 y 5 años con sus intervalos de confianza (IC) del 95%. Los posibles factores pronósticos de supervivencia se analizaron excluyendo a los pacientes que fallecieron en el postoperatorio inmediato y se evaluaron con el modelo de regresión por riesgo proporcional de Cox. Presentamos los resultados de los factores pronósticos de supervivencia, estadísticamente significativos seleccionados con la razón de riesgo de cada categoría (odds ratio) y su IC del 95% (se consideró estadística-mente significativo un valor de p < 0,05).
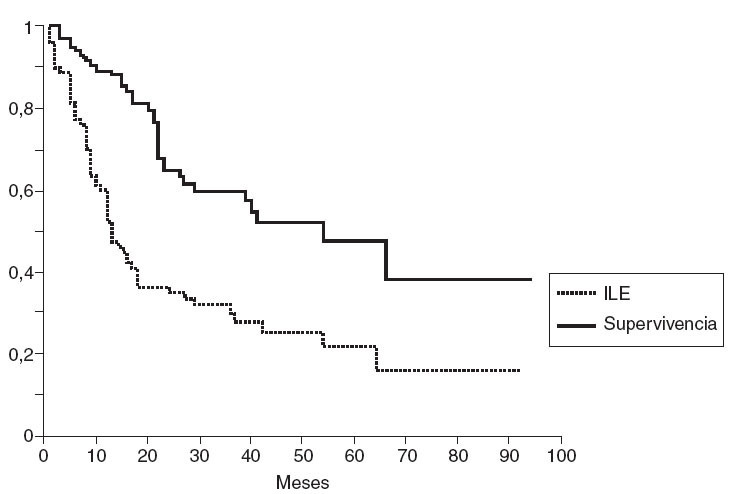
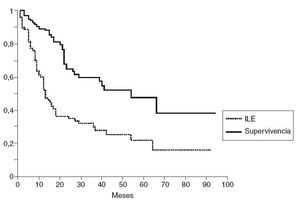
ResultadosTres pacientes fallecieron en el postoperatorio inmediato (1,4%): 2 de ellos debido a neumonía (Morganella morganii y Pseudomonas aeruginosa respectivamente) y 1 debido a insuficiencia cardíaca. La morbilidad fue del 22% (46 pacientes). La supervivencia a 1, 3 y 5 años fue del 89,9, el 66,9 y el 53,8% respectivamente. La supervivencia libre de enfermedad a 1, 3 y 5 años fue del 63, el 32 y el 23%, respectivamente (fig. 1). La media de estancia fue 9,8 ± 7 (3-72) días.
Fig. 1 – Supervivencia e intervalo libre de enfermedad en nuestra serie.
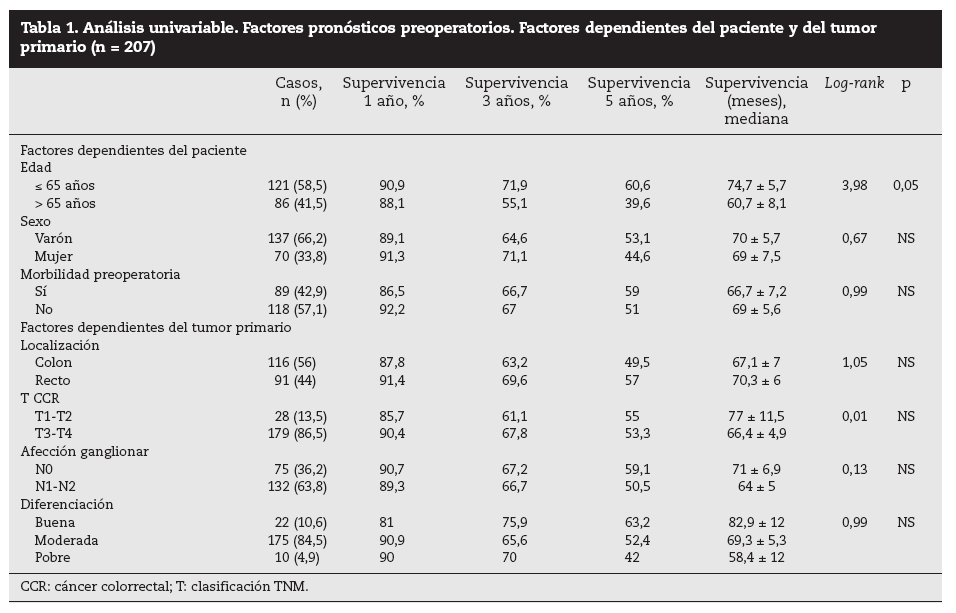
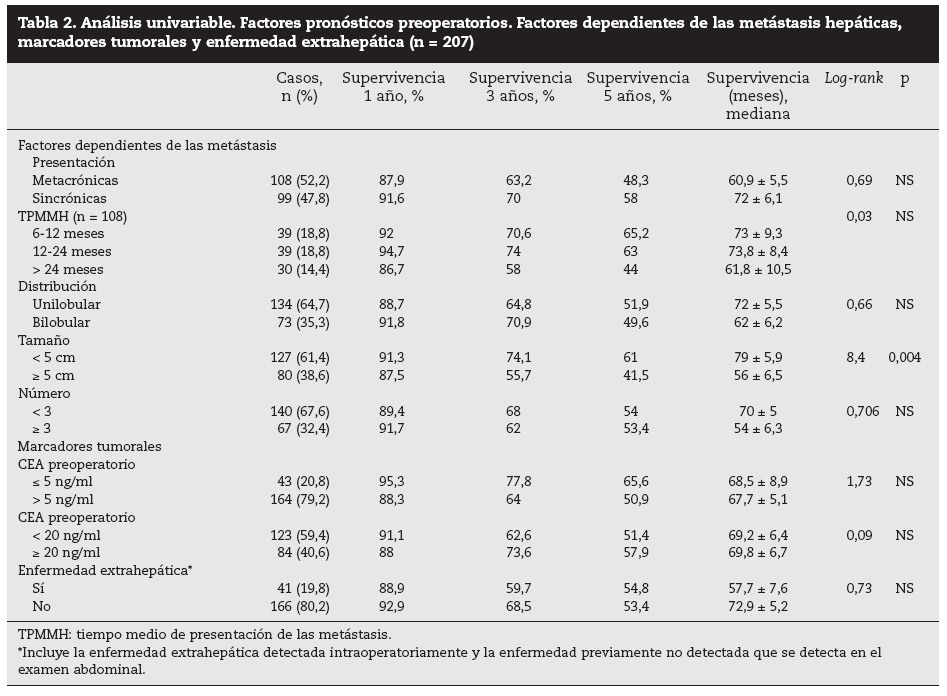
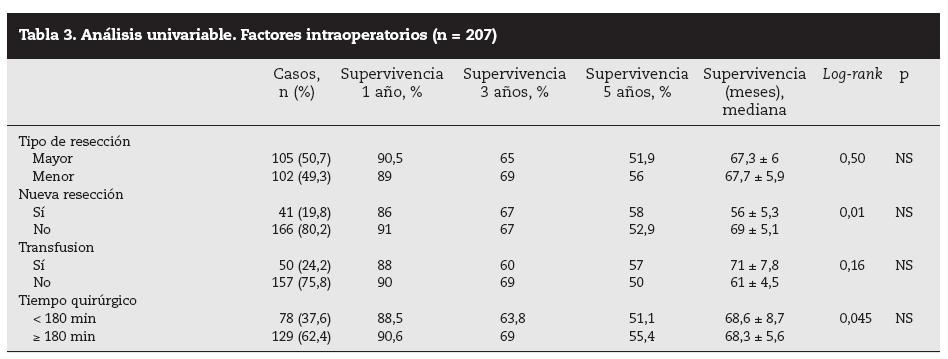
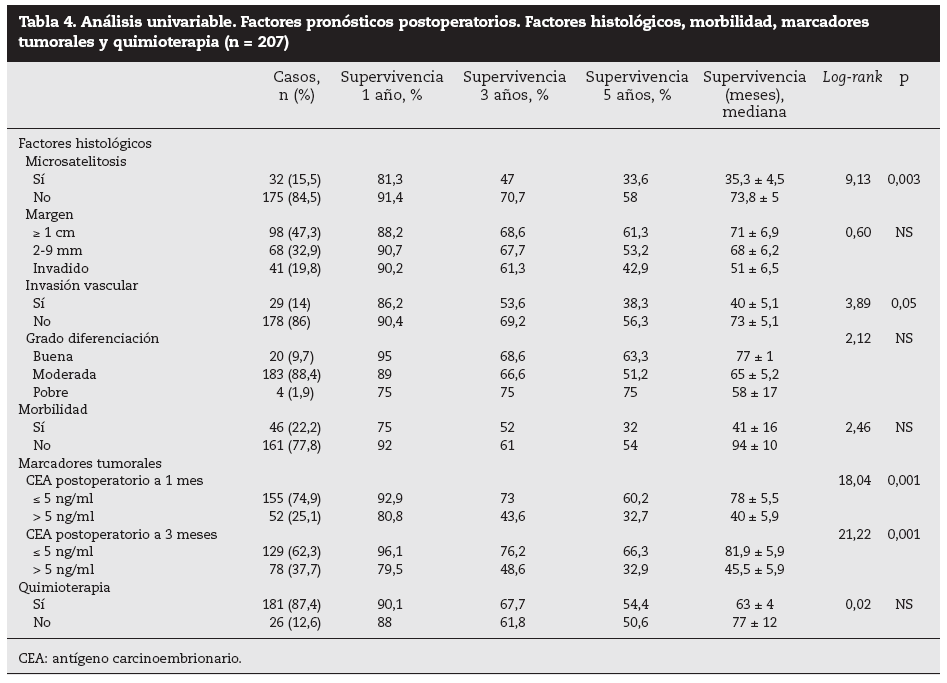
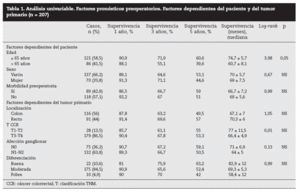
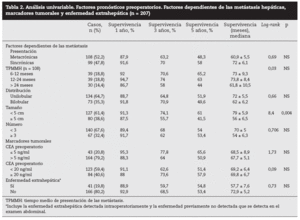
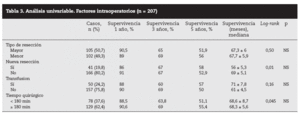
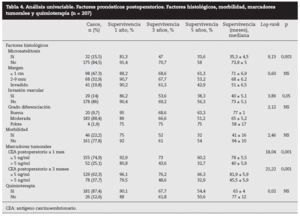
Factores pronósticos de supervivencia (n = 207)Análisis univariable: fueron factores de mal pronóstico preoperatorios estadísticamente significativos la edad > 65 años (p = 0,05) (tabla 1) y el tamaño de la metástasis > 5 cm (p = 0,004) (tabla 2). No hubo factores intraoperatorios de mal pronóstico (tabla 3). Fueron factores postoperatorios de mal pronóstico los microsatélites de la lesión principal (p = 0,003), la invasión vascular venosa microscópica por la metástasis (p = 0,05) (tabla 4) y valores de CEA elevados al mes y a los 3 meses de la intervención (p = 0,0001 y p = 0,0001) (tabla 4). No fueron factores de mal pronóstico: el sexo, la localización del CCR, el grado de infiltración parietal del CCR, el grado de diferenciación celular del CCR, la afección ganglionar en el tumor primario (N1-N2), la presentación sincrónica de las metástasis, el tiempo medio de aparición de las metástasis, la localización unilobular o bilobular, la presencia de más de tres metástasis, las cifras preoperatorias de CEA elevadas, la presencia de enfermedad extrahepática, el margen de resección invadido, el grado de diferenciación celular de las metástasis, el tipo de resección (mayor o menor), la realización de nuevas resecciones, la transfusión intraoperatoria, el tiempo quirúrgico, la presencia de morbilidad y haberse aplicado o no QMT adyuvante.
Tabla 1. Análisis univariable. Factores pronósticos preoperatorios. Factores dependientes del paciente y del tumor primario (n = 207)
Tabla 2. Análisis univariable. Factores pronósticos preoperatorios. Factores dependientes de las metástasis hepáticas, marcadores tumorales y enfermedad extrahepática (n = 207)
Tabla 3. Análisis univariable. Factores intraoperatorios (n = 207)
Tabla 4. Análisis univariable. Factores pronósticos postoperatorios. Factores histológicos, morbilidad, marcadores tumorales y quimioterapia (n = 207)
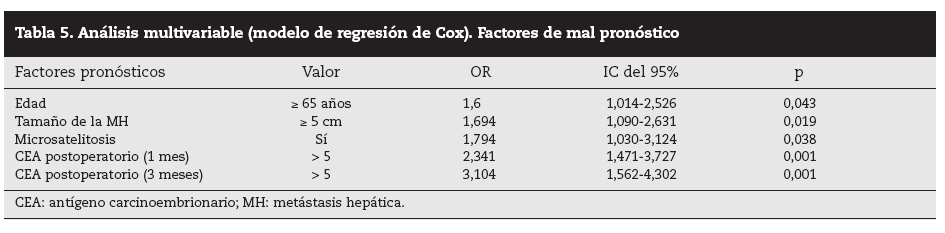
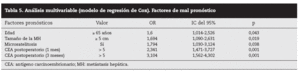
Análisis multivariable: entre los factores preoperatorios analizados, la edad > 65 años y el tamaño de la MH > 5 cm fueron factores de mal pronóstico independientes (p = 0,043 y p = 0,019, respectivamente), mientras que los otros factores estadísticamente significativos se obtuvieron de los analizados en el postoperatorio: las microsatelitosis (p = 0,038) y las cifras de CEA elevadas a 1 y 3 meses (p < 0,001 y p < 0,001, respectivamente) (tabla 5).
Tabla 5. Análisis multivariable (modelo de regresión de Cox). Factores de mal pronóstico
DiscusiónNumerosos autores15-32 han comunicado una serie de factores preoperatorios de mal pronóstico con el fin de seleccionar a los pacientes para cirugía. Con estos factores de mal pronóstico elaboran una serie de escalas y contraindican la cirugía en aquellos cuya suma de factores de mal pronóstico obtiene una supervivencia nula a 5 años; la más empleada es la clasificación de Fong et al4 (realizada sobre 1.001 pacientes intervenidos de MHCCR). Los pacientes con mal pronóstico serían tributarios de tratamiento con QMT, sobre todo si además, como consideran Adam et al32, la enfermedad está en progresión. Sin embargo, en la literatura hay muchas discrepancias respecto a los factores significativos obtenidos y es difícil contraindicar la cirugía en los casos en que se pueda conseguir una resección R0. En nuestra serie, la edad > 65 años fue un factor de mal pronóstico estadísticamente significativo, como ocurre en otras series4,5,16, aunque ello no supone una contraindicación formal para nosotros ni para otros autores. El tamaño de la metástasis principal > 4 cm4, > 5 cm4,5,17, > 8 cm6 o > 10 cm20 ha sido considerado como factor de mal pronóstico. Los resultados obtenidos en nuestra serie son similares a los de autores que describen un peor pronóstico cuando la lesión es > 5 cm. Otros autores7,8 no encontraron diferencias significativas en el tamaño tumoral menor o mayor de 5 cm.
Otros factores preoperatorios analizados no han sido estadísticamente significativos en nuestra serie. Así, la presencia de ganglios positivos en el tumor primario colorrectal, factor de mal pronóstico para algunos autores4,5,15, no se repite en otras series7,8,16,17. También los CCR que invaden la serosa (T3-T4) podrían tener un peor pronóstico6,17,18, aunque otros autores19,20 no encuentran tales resultados. Un intervalo corto entre la cirugía del tumor primario y la aparición de las MH, sincrónicas1,2,6,7,19, de menos de 12 meses2,5-7,17, de menos de 24 meses6 o menos de 30 meses1 se considera factor de mal pronóstico. El número de MH > 1 fue factor de mal pronóstico4; otros10 consideran de mal pronóstico un número > 3 y, recientemente, > 8 MH16. La localización bilobular es considerada de mal pronóstico por algunos autores1,4,5,9, pero no es significativa en otras series7,15,18,21. La enfermedad extrahepática resecable detectada preoperatoriamente, que en la serie de Fong et al4 contraindicaba per se la cirugía, para nosotros y otros autores no contraindica la cirugía siempre que toda la enfermedad pueda ser R0 una vez resecada22,23. Este mismo criterio se sigue con la resección de las recidivas hepáticas24, ya que los pacientes con 2 y 3 RH presentan una supervivencia similar a la primera RH.
También hay una serie de factores intraoperatorios (técnica quirúrgica realizada y la transfusión) que pueden influir en la supervivencia8 pero no han tenido significación estadística en nuestra serie ni para otros autores1,7,20. Nosotros, de acuerdo con la mayoría de los autores25-27, consideramos que las lesiones no palpables, profundas o próximas a los grandes vasos deberían ser tratadas con mayor radicalidad mediante resección segmentaria o hepatectomía reglada y, en el caso de lesiones superficiales múltiples o cuando haya dudas de la reserva hepática, son aconsejables las resecciones limitadas primando el margen sobre la técnica elegida.
La QMT adyuvante no ha sido un factor pronóstico de supervivencia para nosostros ni en otras series5,6,15,17.En cambio, Figueras et al31 obtuvieron que la QMT adyuvante es un factor de buen pronóstico de supervivencia (con un régimen de QMT basado en 5-fluorouracilo y ácido folínico, en un estudio no aletorizado) Con la QMT neoadyuvante actual podemos conseguir una subestadificación de la enfermedad hepática32 y hacer resecables a un 10-20% de pacientes que inicialmente eran irresecables, con una supervivencia de un 22-40% a 5 años. Algunos autores proponen un tratamiento secuencial invertido en este tipo de pacientes33,34. Ante la falta de estudios prospectivos y aleatorizados y siempre que las metástasis sean resecables e independientemente del número de lesiones, nuestro criterio es extirpar toda la enfermedad macroscópica para continuar con QMT adyuvante, dado que se desconoce cuáles son los enfermos que responderán a este tratamiento (hay un 30-50% de no respondedores a QMT actual).
Por otra parte, algunos factores obtenidos en el postoperatorio nos pueden orientar hacia el pronóstico y la eficacia de la cirugía realizada. Estos factores son el estudio histológico de la pieza de resección (invasión vascular microscópica, microsatelitosis y margen de resección) y la determinación postoperatoria precoz de la concentración postoperatoria de CEA. Así, el margen de resección < 1 cm se ha relacionado con un mayor número de recidivas locales y con menos supervi-vencia4,8,15,28, aunque en nuestra serie no ha tenido significación estadística en la supervivencia. Este aspecto está en con-troversia29,30, y en la actualidad algunos autores29 relacionan la recidiva con la distancia al margen de resección: el 13% de recidiva cuando el borde fue < 2 mm, el 2,8% con 2-4 mm y 0 cuando fue > 5 mm30. La invasión venosa microscópica fue un factor de mal pronóstico de supervivencia para Shirabe et al27: las lesiones > 4 cm fueron las que con más frecuencia presentaron estas alteraciones. En nuestra serie, 29 casos presentaron invasión vascular, y fue un factor de mal pronóstico en el estudio univariable. La presencia de microsatélites se ha relacionado con las recurrencias en la línea de corte, muy frecuentes cuando el borde de resección es < 5 mm. En nuestra serie, 32 pacientes presentaron microsatélites y tuvieron una supervivencia significativamente menor que la de aquellos que no la presentaron (el 33,6 frente al 58% respectivamente), lo que fue un factor significativo en los análisis univariable y multivariable.
La concentración de CEA preoperatoria > 5, > 50, > 100 o > 200 ng/ml fue un factor de mal pronóstico en numerosas series1-5,7,35. En la nuestra, no hubo diferencias estadística-mente significativas en la supervivencia entre los pacientes con CEA elevado (n = 164) y CEA normal (n = 43). Algunos autores36-38 determinan el CEA en el postoperatorio inmediato para valorar la eficacia del tratamiento quirúrgico y lo relacionan con la recidiva y la supervivencia. Ueno et al36,en un estudio retrospectivo sobre 68 pacientes intervenidos de MHCCR, analizaron el CEA postoperatorio a 1 y 3 meses de la cirugía y hallaron que las cifras postoperatorias de CEA elevadas se relacionaron con una mayor recidiva de la enfermedad. Hohenberger et al37 analizaron el CEA preoperatorio y el postoperatorio en 166 pacientes intervenidos de MHCCR; las cifras preoperatorias no fueron estadísticamente significativas, mientras que las postoperatorias elevadas fueron el factor predictivo negativo de mayor influencia en cuanto a la supervivencia. Gervaz et al38 analizan los valores postoperatorios de CEA y los márgenes de resección en una serie corta de 49 pacientes con resección de MHCCR, y determinaron que los valores elevados eran un factor de mal pronóstico y que los márgenes de resección no influyeron incluso cuando estaban invadidos. En nuestra serie, la supervivencia a 5 años en pacientes con CEA preoperatorio elevado que normalizaron sus cifras al mes postoperatorio fue significativamente mayor (60,2%) que la de los pacientes que mantuvieron cifras de CEA elevadas (32,7%) a 1 y 3 meses. En estos casos, la búsqueda de enfermedad residual (lesiones < 1 cm que podrían pasar inadvertidas), la posibilidad de reintervenciones o de una QMT más agresiva son factores que se debe tener presentes en el seguimiento.
En conclusión, en la literatura no hay evidencias que nos permitan rechazar a los pacientes con MHCCR para cirugía basándonos en los factores preoperatorios de mal pronóstico, siempre y cuando podamos resecar toda la enfermedad de forma R0, ya que en nuestra serie los factores de mal pronóstico más relevantes se obtienen tras la cirugía.
*Autor para correspondencia.
Correo electrónico: rirocam@um.es (R. Robles Campos). 009-739X/$-see front matter © 2008 AEC. Publicado por Elsevier España, S.L. Todos los derechos reservados.