El tratamiento del cáncer colorrectal (CCR) es habitualmente quirúrgico y conlleva una morbimortalidad. El objetivo de este estudio es cuantificar la mortalidad postoperatoria en nuestro hospital y determinar sus factores de riesgo.
Material y métodoEstudio prospectivo observacional de los 1.017 pacientes operados en nuestro hospital por CCR desde 1996 hasta 2007. Identificación de factores de riesgo independientes de mortalidad postoperatoria mediante estudio multivariante.
ResultadosLa edad media era de 67,8 años. La cirugía se programó en 879 pacientes (86,5%) y se consideró curativa en 878 (86,1%). La mortalidad postoperatoria fue del 3,6% (37 pacientes) (el 2,5% en la cirugía programada y el 10,9% en la cirugía urgente). Los factores de riesgo independientes identificados fueron el tipo de cirugía (odds ratio [OR] para urgente versus programada=2,8), el grado de la American Society of Anesthesiologists (ASA) (OR para ASA III–IV versus ASA I–II=2,4) y la edad (OR para edad ≥85 versus ≤74=7,6 y edad 75–84 versus ≤74=2,4).
ConclusionesTenemos una baja mortalidad postoperatoria que se asocia principalmente a una edad mayor de 75 años, a los grados ASA III–IV y a la cirugía urgente.
The treatment of colorectal cancer (CRC) is usually surgical and involves morbidity-mortality. The aim of this study is to quantify the postoperative mortality in our hospital and to determine their risk factors.
Materials and methodsProspective observational study from 1996 to 2007 included 1017 patients who underwent surgery for CRC in our hospital. Identification of independent risk factors for postoperative mortality by multivariate analysis.
ResultsThe mean age was 67.8 years. The surgery was elective in 879 (86.5%) and was considered curative in 878 (86.1%). The postoperative mortality was 3.6% (37 patients), 2.5% in the elective surgery and 10.9% in the urgent.
The independent risk factors identified were: type of surgery (odds ratio for urgent vs. elective=2.8), American Society of Anesthesiologists (ASA) grade (odds ratio for ASA III–IV vs. I–II=2.4), age (odds ratio for age ≥ 85 vs. ≤ 74=7.6 and age 75–84 vs. ≤ 74=2.4).
ConclusionsWe found a low postoperative mortality, which was mainly associated with age over 75 years, ASA III or IV stages and urgent surgery.
El cáncer colorrectal (CCR) es el cáncer más frecuente en ambos sexos (se excluyen los tumores de la piel) y se estima que hay 21.000 pacientes nuevos cada año en España1. La extirpación del tumor sigue siendo el tratamiento más eficaz para curar el CCR. El tratamiento quirúrgico ha ido mejorando sus resultados con una disminución progresiva de la morbimortalidad, pero sin desaparecer.
Conocer la mortalidad postoperatoria tiene una gran importancia por ser uno de los indicadores de calidad de un proceso asistencial2,3, y permite compararnos con los estándares. En la guías españolas4,5 se recomienda que la mortalidad postoperatoria sea menor del 5% en la cirugía programada y menor del 20% en la cirugía urgente. Por otra parte, el conocer sus factores de riesgo nos conduce a poder informar individualmente a cada paciente en función de ellos.
Si aceptamos que sólo se opera al 80% de los CCR6 y que la mortalidad postoperatoria es del 3%, 500 pacientes fallecerían cada año en nuestro país en el postoperatorio del CCR, lo que le confiere una gran importancia clínica y social.
El objetivo del presente estudio es cuantificar la mortalidad postoperatoria del CCR en nuestro hospital y determinar sus factores de riesgo.
Material y métodosEstudio prospectivo observacional realizado en un hospital de 500 camas, que atiende a una población de 250.000 habitantes, con docencia de pregraduados y formación de residentes. Se incluyó a todos los pacientes que se intervinieron quirúrgicamente en nuestro hospital por CCR desde enero de 1996 hasta diciembre de 2007. Los 5 cirujanos que integraban la unidad de Coloproctología y los residentes que rotaban por ella realizaron toda las cirugías programadas y el 70% de la cirugía urgente.
Con el objetivo de conocer nuestros resultados en el tratamiento del CCR, en 1996 se creó una base de datos en la que se recogían las características del paciente, el tumor, la cirugía, la anatomía patológica, los tratamientos complementarios y la evolución. La introducción de datos se realizaba con el alta hospitalaria y se actualizaba en la consulta externa con cada visita de control. En caso de pérdida de seguimiento se contactaba telefónicamente.
Se consideró mortalidad postoperatoria a la producida hasta el día 30 después de la intervención quirúrgica, aunque se les hubiera dado el alta de hospitalización.
Se clasificó como cirugía urgente a la que no se pudo demorar más de 48h. Se definió como cirugía programada a la que pudo diferirse, aunque el problema inicial se tratara de forma urgente, por ejemplo, una oclusión por neoplasia de sigma con colocación inicial de endoprótesis y cirugía programada en un segundo tiempo.
Para la valoración del grado de la American Society of Anesthesiologists (ASA) se utilizó la escala de estado físico de ésta7.
Se incluyó como localización rectal cuando el tumor se encontraba a menos de 15cm del margen anal. En los casos en los que había 2 o más tumores y estaban localizados uno en el colon y otro en el recto, se clasificó como localizado en ambos.
Se consideró cirugía radical aquélla en la que se realizó la extirpación total del tumor primario y las posibles metástasis sincrónicas, ya fuera en uno o en 2 tiempos, y en las que no quedara tumor macroscópico ni microscópico residual.
En la resecabilidad, se definió como tumor resecable aquél en el que se realizó la extirpación completa del tumor primario, aunque pudieran permanecer metástasis a distancia.
Para el estadio tumoral se utilizó la clasificación TNM de la American Joint Committee on Cancer8.
La mortalidad postoperatoria y el resto de los factores de riesgo estudiados se describieron mediante análisis univariante.
Posteriormente, con las variables que demostraron una relación suficiente (p<0,15) con la variable dependiente, se construyó un modelo de regresión logística multivariante para determinar la contribución independiente de cada uno de los factores de riesgo. Se calculó la odds ratio (OR) con un intervalo de confianza (IC) del 95%. El ajuste del modelo resultante se evaluó mediante el test de Hosmer-Lemeshow. A pesar de que la revisión se realizó sobre más de 1.000 pacientes, el número de episodios (fallecimientos) fue pequeño. Por esto, el grado ASA y el estadio TNM tuvieron que agruparse en 2 categorías (ASA: I–II/III–IV; TNM: I–II–III/IV) para facilitar la estabilidad de los estimadores obtenidos. Por la misma causa, la edad se agrupó en 3 categorías (<75/75–84/≥85).
El análisis se realizó con el programa SPSS para Windows (versión 16.0, Chicago, EE. UU.).
ResultadosEn el período que comprendía el estudio se intervino a 1.017 pacientes de CCR demostrado histológicamente. La edad media era de 67,8±12 años. El 63% eran hombres. El 13,6% precisó cirugía urgente (138 pacientes).
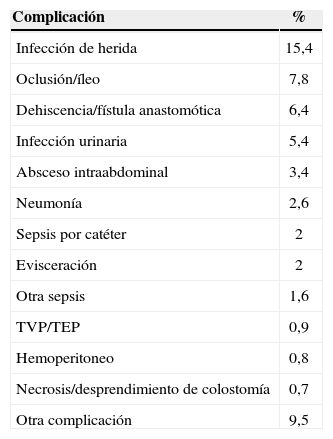
La morbilidad global fue del 40,6%, y fue menor en la cirugía programada (36,9%) que en la cirugía urgente (64,3%). El tipo de complicación y su porcentaje se muestra en la tabla 1.
Complicaciones postoperatorias
| Complicación | % |
| Infección de herida | 15,4 |
| Oclusión/íleo | 7,8 |
| Dehiscencia/fístula anastomótica | 6,4 |
| Infección urinaria | 5,4 |
| Absceso intraabdominal | 3,4 |
| Neumonía | 2,6 |
| Sepsis por catéter | 2 |
| Evisceración | 2 |
| Otra sepsis | 1,6 |
| TVP/TEP | 0,9 |
| Hemoperitoneo | 0,8 |
| Necrosis/desprendimiento de colostomía | 0,7 |
| Otra complicación | 9,5 |
TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
Fallecieron 37 pacientes (3,6%) en los 30 días postoperatorios: 22 (2,5%) tras cirugía programada y 15 (10,9%) tras cirugía urgente. En un paciente el fallecimiento se produjo en su domicilio, tras el alta, a los 12 días de la cirugía, por una muerte súbita. Los 36 pacientes restantes fallecieron en el hospital. La causa o la complicación que desencadenó el fallecimiento se muestra en la tabla 2.
Causas de mortalidad postoperatoria
| n (%) | |
| Dehiscencia/fístula anastomótica | 13 (35,1) |
| FMO en cirugía urgente¿ | 5 (13,5) |
| Neumonía | 3 (8,1) |
| Oclusión intestinal | 2 (5,4) |
| Sepsis de catéter | 2 (5,4) |
| Broncoaspiración | 2 (5,4) |
| Absceso intraabdominal | 1 (2,7) |
| Evisceración | 1 (2,7) |
| Hemorragia digestiva alta | 1 (2,7) |
| Sepsis urinaria | 1 (2,7) |
| Tromboembolia pulmonar | 1 (2,7) |
| Insuficiencia respiratoria | 1 (2,7) |
| Insuficiencia cardíaca | 1 (2,7) |
| Infarto de miocardio | 1 (2,7) |
| Pancreatitis aguda | 1 (2,7) |
| Muerte súbita de causa desconocida | 1 (2,7) |
FMO: fracaso multiorgánico.
Las características de los pacientes, del tumor y de la cirugía realizada junto con la mortalidad a los 30 días y el análisis univariante se muestran en la tabla 3.
Características de los pacientes y análisis univariante de los factores de riesgo asociados a la mortalidad postoperatoria
| Variables | Pacientes, n | Fallecidos, n | Mortalidad, % | Odds ratio (intervalo de confianza del 95%) | p |
| Sexo | |||||
| Hombre | 641 | 26 | 4,1 | 1 | |
| Mujer | 376 | 11 | 2,9 | 0,71 (0,35–1,46) | 0,355 |
| Edad | |||||
| ≤64 | 364 | 6 | 1,6 | 1 | |
| 65–74 | 317 | 7 | 2,2 | 1,35 (0,45–4,05) | 0,596 |
| 75–84 | 286 | 16 | 5,6 | 3,05 (1,45–6,42) | 0,003 |
| ≥85 | 50 | 8 | 16 | 9,79 (3,85–24,91) | <0,001 |
| Tipo de cirugía | |||||
| Programada | 879 | 22 | 2,5 | 1 | |
| Urgente | 138 | 15 | 10,9 | 4,75 (2,40–9,41) | <0,001 |
| Hb preoperatoria, g/dl | |||||
| <10 | 157 | 10 | 6,4 | 1 | |
| 10–15,9 | 774 | 25 | 3,2 | 0,49 (0,23–1,04) | 0,064 |
| ≥16 | 72 | 2 | 2,8 | 0,42 (0,10–1,97) | 0,271 |
| No consta | 14 | 0 | 0 | ||
| Grado ASA | |||||
| I–II | 694 | 13 | 1,9 | 1 | |
| III | 282 | 20 | 7,1 | 4 (1,96–8,16) | <0,001 |
| IV | 37 | 4 | 10,8 | 6,35 (1,96–20,54) | <0,001 |
| No consta | 4 | 0 | 0 | ||
| Localización | |||||
| Colon | 642 | 31 | 4,8 | 1 | |
| Recto | 355 | 6 | 1,7 | 0,34 (0,14–0,82) | 0,016 |
| Ambos | 20 | 0 | 0 | ||
| Radicalidad | |||||
| Radical | 878 | 24 | 2,7 | 1 | |
| Paliativa | 139 | 13 | 9,4 | 3,67 (1,82–7,40) | <0,001 |
| Resecabilidad | |||||
| Resecable | 982 | 33 | 3,4 | 1 | 0,126 |
| Irresecable | 35 | 3 | 8,6 | 2,6 (0,8–9,0) | 0,131 |
| Estadio TNM | |||||
| 0–I–II | 607 | 16 | 2,6 | 1 | |
| III | 260 | 9 | 3,5 | 1,32 (0,58–3,04) | 0,507 |
| IV | 150 | 12 | 8 | 3,21 (1,49–6,95) | 0,003 |
| Total | 1.017 | 37 | 3,6 | ||
ASA: American Society of Anesthesiology; Hb: hemoglobina; TNM: tumor, adenopatía, metástasis.
El análisis multivariante mostró que las variables que mantienen una asociación independiente a la mortalidad a los 30 días, como se muestra en la tabla 4, son ser mayor de 75 años (OR=2,4; IC del 95%=1–5,4) y, sobre todo, de 85 años (OR=7,7; IC del 95%=2,8–21,3), cirugía urgente (OR=2,8; IC del 95%=1,3–5,9) y ASA III–IV (OR=2,4; IC del 95%=1,1–5,1). La localización tumoral, el estadio TNM y la radicalidad de la cirugía tenían una asociación a la mortalidad en el análisis univariante, pero ésta no se mantuvo tras ajustarse por el resto de los factores implicados.
Análisis multivariante de los factores de riesgo asociados a la mortalidad postoperatoria
| Variables | Coeficiente β | Error típico de β | p | Odds ratio (intervalo de confianza del 95%) |
| 75–84 años | 0,86 | 0,42 | 0,040 | 2,35 (1,03–5,35) |
| ≥85 años | 2,04 | 0,52 | <0,001 | 7,67 (2,76–21,28) |
| Cirugía urgente versus cirugía programada | 1,03 | 0,38 | 0,007 | 2,81 (1,33–5,92) |
| ASA III–IV versus I–II | 0,88 | 0,38 | 0,021 | 2,40 (1,14–5,09) |
| Recto versus colon | −0,81 | 0,46 | 0,077 | 0,44 (0,18–1,09) |
| Cirugía paliativa versus cirugía radical | −0,96 | 0,66 | 0,145 | 0,39 (0,10–1,40) |
| TMN IV versus I–II–III | 0,39 | 0,68 | 0,571 | 1,47 (0,39–5,60) |
| Hemoglobina<10g/dl | 0,16 | 0,39 | 0,677 | 1,18 (0,55–2,50) |
ASA: American Society of Anesthesiology; TNM: tumor, adenopatía, metástasis.
Existe una llamativa discordancia en los porcentajes de mortalidad de las diferentes publicaciones, como puede apreciarse en la tabla 5. Las revisiones regionales o nacionales muestran unas cifras más elevadas, pero nos dan una visión más global, mientras que los estudios monoinstitucionales sólo se acostumbran a presentar cuando son buenos o aceptables. Algunos hospitales con amplia experiencia tienen una baja mortalidad postoperatoria, que varía entre el 0,8 y el 2,3%9,10, pero otros11–14 refieren unos porcentajes mayores, de entre el 5 y el 10,2%. En auditorías regionales o nacionales6,15–20 las cifras se sitúan entre el 4,2 y el 9,9%.
Mortalidad postoperatoria del cáncer colorrectal en la literatura médica
| Mortalidad, % | ||||||
| Primer autor | Año | Ámbito del estudio | n | Cirugía programada | Cirugía urgente | Global |
| Mella J16 | 1997 | Regional | 3.221 | 5,5 | 21,7 | 7,6 |
| Semmens JB6 | 2000 | Regional | 4.794 | NC | NC | 4,2 |
| Staib L9 | 2002 | Unicéntrico | 2.452 | NC | NC | 0,8 |
| Tekkis PP18 | 2003 | Regional | 7.374 | 5,6 | 14,9 | 7,5 |
| Tekkis PP24 | 2003 | Multicéntrico¿ | 1.017 | 3,2 | 23,4 | 7,5 |
| Tekkis PP27 | 2004 | Multicéntrico¿ | 6.883 | 2,8 | 12 | 5,7 |
| Fazio VW10 | 2004 | Unicéntrico | 5.034 | 2,2 | 6,5 | 2,3 |
| Pla R29 | 2004 | Regional | 4.443 | NC | NC | 3,3 |
| Alves A23 | 2005 | Multicéntrico | 1.421 | 1,6 | 11,5 | 3,4 |
| Nickelsen TN20 | 2005 | Regional | 5.187 | 7,1 | 23,3 | 9,9 |
| Wong SKC21 | 2005 | Multicéntrico | 1.217 | 1,9 | 6,8 | 3,4 |
| Vilallonga R13 | 2006 | Unicéntrico | 749 | 5,7 | 13,4 | 6,4 |
| Ferjani AM14 | 2007 | Unicéntrico | 618 | 6,7 | 20,2 | 10,2 |
| Errasti J | 2009 | Unicéntrico | 1.017 | 2,5 | 10,9 | 3,6 |
NC: no consta.
Son pocas las publicaciones prospectivas y que tengan más de 1.000 pacientes sobre la mortalidad postoperatoria del CCR y sus factores de riesgo11,18,21. En algunas, a pesar de ser prospectivas, el número de pacientes es relativamente pequeño14,17,22 o son auditorías sobre los resultados de la cirugía del CCR sin analizar sus factores de riesgo9,16. La mayoría son retrospectivas, por lo que algunos factores de riesgo no se han podido analizar adecuadamente, o tienen resultados no comparables con los nuestros por incluir enfermedad benigna23,24, sólo cáncer de colon25, sólo cáncer de recto26 o un determinado tipo de tratamiento. El objetivo de algunas publicaciones ha sido describir modelos para calcular individualmente la probabilidad de muerte postoperatoria, como el de la Association of Coloproctology of Great Britain and Ireland18, el Cleveland Clinic Foundation Colorectal Cancer Model10 o el CR-POSSUM (ColoRectal-Physiologic and Operative Severity Score for the Umeration of Mortality)27.
Los métodos de recogida de datos utilizados en la literatura médica son distintos. En algunas publicaciones6,20 se realiza por epidemiólogos en registros centrales; no obstante, en la mayoría de los estudios los especialistas clínicos efectúan la recogida de datos.
Por otra parte, las diferencias en la mortalidad pueden estar también condicionadas por ser series con algunas características diferentes que pueden influir en los resultados globales (algunas de estas características se comentarán más adelante). La proporción de cirugía urgente es también muy variable, ya que va del 3,1% de Fazio et al10 al 25% de Ferjani et al14. El porcentaje de varones está entre el 51 y el 60%, pero en la publicación de Longo et al11 llega al 98%. También existen diferencias, aunque menos acusadas, en la edad media de los pacientes, la localización, la estadificación y la resecabilidad tumorales. Además, el tipo de hospital, el número de casos por año y la especialización pueden también tener influencia en los resultados.
Es llamativo que en la serie de la Cleveland Clinic10, el 24% de los fallecimientos se produzca tras el alta. Esta situación sólo se produjo en el 2,7% de nuestros fallecimientos. Esta importante disparidad puede deberse a que nosotros tenemos unas estancias postoperatorias más largas, pacientes con mayor edad media y un porcentaje mucho mayor de cirugía urgente. No hemos encontrado en ninguna otra publicación la especificación del lugar de fallecimiento.
La edad es uno de los factores de riesgo que se describe habitualmente10,15,18,23,28. La OR se ha medido para diferentes grupos de edades. Longo et al11 lo han hecho a intervalos de un año, y resultó una OR de 1,032, que parece tener escaso efecto en la mortalidad. No obstante, si aplicamos ese factor a incrementos de 10 años, sí tiene mucho mayor impacto. Alves et al23 dividen a los pacientes en sólo 2 grupos, y encuentran que la mortalidad en los mayores de 70 años se multiplica por 2,2. Fazio et al10 y Tekkis et al18 hacen más subgrupos, y hallan respectivamente unas OR de 3,3 y 1,8 para los pacientes de 65–74 años, de 4,8 y 2,8 para los pacientes de 75–84 años, y de 9,5 y 3,6 para los pacientes de más de 85 años, con la salvedad de que Tekkis et al18 presentan que en los mayores de 94 años la mortalidad se multiplica por 13,3. En nuestro caso, el riesgo se modifica poco entre los 65 y los 74 años, pero se duplica a partir de los 75 años y se multiplica por 7 a partir de los 85 años. Esto no quiere decir que la edad avanzada contraindique la cirugía, pero sí que tenga una gran implicación para valorar cuidadosamente su realización de forma individualizada, según el estado del paciente y las características del tumor.
La cirugía urgente es otro de los factores relacionados11,14,16,18,23, ya que aproximadamente triplica la mortalidad en la mayoría de las series, al igual que en la nuestra. En la mayoría de las publicaciones el porcentaje de cirugía urgente se localiza entre el 15 y el 20%, pero en un caso10 sólo alcanza el 3%. Este escaso porcentaje de cirugía urgente disminuye y enmascara la mortalidad global. Por esto, creemos importante que los resultados por valorar deben ser mortalidad tras cirugía programada y tras cirugía urgente por separado, como acostumbran a recoger los estándares.
La existencia de enfermedades asociadas o de un mal estado físico incrementa la morbimortalidad postoperatoria. El estado físico se puede valorar de forma global y simple con el grado ASA, que está claramente asociado a la mortalidad postoperatoria tanto en la literatura médica11,10,18 como en nuestra serie. Puede argumentarse que el grado ASA es bastante inespecífico, pero es el sistema de clasificación de riesgo más simple y universal, por lo que es el utilizado en la mayor parte de las revisiones. Para Longo11, el riesgo no aumenta en el grado ii, pero se duplica progresivamente en el iii y en el iv–v. Para Fazio et al10 y Tekkis et al18 la mortalidad ya se duplica a partir del ASA II. Se han descrito diferentes enfermedades y síndromes que se asocian a una mayor mortalidad, como ascitis11, accidente cerebrovascular11 y comorbilidad neurológica23. También se ha asociado diversos trastornos analíticos a la mortalidad, como la hipopotasemia11, la trombocitopenia 11, la hipernatremia y la hiponatremia11.
El nivel de hemoglobina o el nivel de hematocrito como posibles factores de riesgo no se analizaron en la mayor parte de las publicaciones. Fazio et al10 encuentran que el hematocrito menor de 31 está asociado a mayor mortalidad. En nuestra experiencia, los pacientes con una hemoglobina menor de 10g/dl tenían una mayor mortalidad, pero sin significación estadística.
La cirugía de los tumores más evolucionados tiene una mayor mortalidad, que se relaciona con el estadio tumoral10,11,16, con la irresecabilidad tumoral10,18 o con la cirugía paliativa16. En nuestra serie, todas estas características se acompañaban de un mayor porcentaje de mortalidad, pero tras el análisis multivariante ninguna de ellas era un factor de riesgo.
El sexo masculino condiciona mayor mortalidad en algunas revisiones25,29. En nuestro estudio, al igual que en otros10,18, tiene un mayor porcentaje de mortalidad, pero sin diferencias significativas.
La localización colónica con respecto a la rectal se acompaña de una mayor mortalidad en nuestra serie y en otras10,18, pero sin tener una asociación en el estudio multivariante.
Se han descrito otros factores, como el sobrepeso23 y el estatus sociocultural bajo17, que nosotros no hemos valorado. Es posible que en algunos centros especializados con muy buenos resultados éstos estén condicionados por tener un escaso número de pacientes indigentes o de un bajo nivel educativo11.
Existe numerosa literatura médica que relaciona el número de pacientes atendidos por el hospital y por el cirujano con los resultados, que mayoritariamente concluyen que a menor número de pacientes mayor mortalidad postoperatoria25,30,31. No obstante, Pla et al29 revisaron el resultado del tratamiento de diferentes tumores en Cataluña entre 1996 y 2000 y encontraron relación entre el número de casos y la mortalidad en algunos tumores, pero no en el del CCR.
Tal como ya hemos comentado en el apartado de material y métodos, a pesar de que el estudio se realizó sobre 1.017 pacientes, el número de episodios (fallecimientos) fue pequeño, lo que pudo limitar la potencia del estudio para detectar asociaciones reales a alguno de los factores de riesgo. Por otra parte, hubiera sido deseable no haber tenido que agregar las categorías ASA o TNM para que la correspondencia con la realidad clínica fuera mayor.
Podemos concluir que los factores que han tenido mayor impacto en la mortalidad postoperatoria de nuestros pacientes han sido, por orden de importancia, la edad mayor de 84 años, el riesgo ASA III–IV, la cirugía urgente y la edad de 75–84 años.
Creemos necesario realizar auditorías, ya sean locales o regionales, para comprobar que se cumplen los estándares de mortalidad recomendados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.