Las fístulas recto-uretrales constituyen una rara entidad, pero representan un problema trascendental para el sujeto que la padece y un reto para el urólogo y/o coloproctólogo que debe resolverlo.
Se realiza en este trabajo una amplia revisión sobre los factores etiopatogénicos, procedimientos diagnósticos y actitud terapéutica, analizando las diferentes opciones quirúrgicas descritas en la literatura, mediante búsqueda bibliográfica en PubMed, MEDLINE y EMBASE hasta septiembre de 2014.
Rectouretral fistulas are a rare disease, but represent an important problem for the patient that suffers them and a challenge for the urologist and colorectal surgeon who has to manage them.
A wide review has been performed focusing on etiopathogenic factors, diagnostic and therapeutic options including the analysis of different surgical techniques. PubMed, MEDLINE y EMBASE medical database were searched up to September 2014.
Las fístulas recto-uretrales (FRU) constituyen una rara entidad, pero representan un trascendental problema para el sujeto que la padece y un reto para el urólogo y/o coloproctólogo que debe solucionarlo.
Las series publicadas son cortas, alcanzando las más numerosas 2 o 3 decenas de casos atendidos en largos periodos de tiempo. Esta circunstancia ha condicionado la existencia de una gran cantidad de opciones terapéuticas, basadas en la preferencia o mayor experiencia del cirujano correspondiente. No obstante, durante los últimos años ha existido una mayor tendencia a racionalizar el tratamiento basado en la etiopatogenia, tipo de fístula y grado de lesión.
Ahora bien, a pesar de su rareza y dificultades técnicas para su abordaje resaltadas por todos los autores (devasting pathology en la mayor parte de trabajos), con uno u otro procedimiento terapéutico se alcanzan cifras de curación próximas al 100%, ya sea mediante una sola intervención o tras varios intentos.
Se analizan en este trabajo los aspectos clínicos de esta excepcional enfermedad, así como las principales opciones terapéuticas.
MétodoSe ha realizado una búsqueda bibliográfica en PubMed, MEDLINE y EMBASE hasta septiembre de 2014, en español y en inglés, utilizando como palabras clave «fístulas recto-uretrales». Todos los artículos considerados importantes fueron evaluados prestando especial interés a la etiopatogenia, metodología diagnóstica y opciones terapéuticas. Se revisaron igualmente los artículos destacados citados en la búsqueda previa.
EtiopatogeniaAunque existen fístulas congénitas, fundamentalmente asociadas a malformaciones anorrectales, en este análisis contemplamos exclusivamente las fístulas recto-uretrales adquiridas.
Las causas son sumamente variadas, aunque la inmensa mayoría están relacionadas con el cáncer de próstata, bien por invasión tumoral o, lo más frecuente, como consecuencia de su tratamiento, estimándose que acontecen en torno al 1-2% de todos los pacientes tratados por esta enfermedad1–4.
De indudable interés es la evolución con relación a la causa exacta de su producción, en justa correspondencia a la incorporación de modernas tecnologías, no solo bajo el punto de vista quirúrgico con la aplicación de la cirugía laparoscópica y robótica5–12, sino por la aparición de nuevas opciones terapéuticas, como son la radioterapia externa, la braquiterapia, la crioterapia, los ultrasonidos de alta intensidad y la radiofrecuencia, fundamentalmente13–26.
Trascendental importancia encierra también el espectacular incremento de las FRU relacionadas con la radioterapia externa y la braquiterapia en los últimos años. En este sentido, Lane27 resalta cómo de los 315 casos de FRU recogidos hasta 1997 solo 12 (3,8%) habían sido sometidos a radioterapia pélvica, mientras que desde 1998, 113 de los 228 publicados (49,6%) habían sido sometidos a este tratamiento. Ahora bien, como aclara este autor, no todas las fístulas pueden atribuirse a la radioterapia de forma exclusiva, puesto que a muchos de estos pacientes se les había realizado algún tipo de cirugía, manipulación instrumental y biopsias, factores todos ellos que podrían haber contribuido a su desencadenamiento, aspecto sobre el que insisten otros autores28–30. Otras circunstancias, como el estado nutricional, la inmunodepresión, el tabaquismo y la edad avanzada han sido también implicados, aun sin poder llegar a conclusiones definitivas30,31.
La frecuencia con que se desencadena una FRU con relación a estos factores oscila en las diferentes series, desenvolviéndose sobre 0,53-9% tras prostatectomía radical1,32; 0,4-8,8% tras braquiterapia28,29,33,34; 0-6% tras radioterapia externa30; 0,4-3% tras crioterapia23,25,35 y 2,2% tras ultrasonidos de alta intensidad16.
El momento de aparición de la fístula oscila entre el 4.°-7.° día postoperatorio tras una prostatectomía radical36; entre la 4.ª y 7.ª semana tras crioterapia o ultrasonidos y hasta 3 años después tras administración de braquiterapia28–30,34.
Mucho menos frecuentes, pero de indudable importancia, son los traumatismos genitourinarios, como fracturas pélvicas, heridas de guerra, biopsias transrectales y algunos tan anecdóticos como originados por la cánula de un enema o inyección esclerosante de hemorroides13,36–38 y procesos inflamatorios e infecciosos pélvicos, como son enfermedad de Crohn, abscesos anales recurrentes y tuberculosis. El establecimiento de una FRU por invasión de un cáncer de recto, aunque posible, es excepcional.
DiagnósticoSe realiza mediante la sintomatología y las adecuadas pruebas diagnósticas.
Los síntomas fundamentales son la existencia de neumaturia y/o fecaluria y la expulsión de orina por el ano. La posibilidad de infecciones urinarias es permanente.
En proporciones variables puede sobreañadirse hematuria y dolor perianal o perirrectal; en ocasiones, el tacto rectal puede permitir localizar o sospechar la existencia del orificio fistuloso28,30,39,40.
Las pruebas diagnósticas pretenden confirmar la existencia de la comunicación recto-uretral, su localización y descartar la existencia de enfermedad sobreañadida.
Los estudios más habitualmente propuestos son rectoscopia, cistoscopia, uretroscopia y cistouretrografía, con grado de recomendación variable para los diferentes autores20,22,24,41.
La realización de enema opaco, TC, RM y ECO-endorrectal puede aportar datos en casos seleccionados, sobre todo para descartar abscesos o infiltración tumoral. Existe algún caso anecdótico sobre el hallazgo de una FRU tras la realización de PET-TC42.
Todas estas pruebas diagnósticas proporcionan la más completa evaluación de la fístula y permiten decidir el tratamiento más adecuado.
TratamientoTeniendo en cuenta su escasa incidencia y la amplísima variabilidad anatomopatológica con la que se presenta, características etiopatogénicas y circunstancias diferentes de cada paciente, se comprende fácilmente que no exista una guía metódica de actitud terapéutica generalizada. En consecuencia, en la mayor parte de ocasiones se actúa con arreglo a los hábitos y experiencia del equipo que se ocupa de su atención, careciéndose de datos que comparen evoluciones y resultados en función del procedimiento utilizado. En general, la elección se basa en el momento del descubrimiento de la fístula (durante la cirugía o con posterioridad), síntomas clínicos, etiología, alteraciones anatomopatológicas asociadas, función urinaria y fecal, edad, esperanza de vida y estado general del enfermo4,20–22,25,27,31,32,43,44.
El establecimiento de derivación fecal y urinaria se decidirá de forma individualizada.
Así pues, vamos a intentar reflejar la situación actual del problema, ordenando nuestra exposición en los siguientes apartados:
- 1.
Posibilidades de tratamiento conservador.
- 2.
Opciones quirúrgicas.
El cierre espontáneo de la fístula con sondaje vesical transuretral o derivación mediante punción suprapúbica es excepcional; no obstante, puede intentarse en pacientes sin signos de sepsis ni fecaluria32,45,46. El considerado «tratamiento conservador» incluye la posibilidad de derivación urinaria y/o fecal, lo cual, aunque no representa un tratamiento excesivamente agresivo, afecta de manera significativa la calidad de vida del paciente18.
El número de resoluciones es sumamente variable, oscilando según las diferentes series entre el 14% y el 54%32,47–49.
Como tratamiento «conservador» podemos considerar también la aplicación de diferentes tipos de sellantes de fibrina en el trayecto fistuloso, aunque su utilización se limita a casos aislados50–53.
Evidentemente, si fuese efectivo constituiría el procedimiento ideal: no invasivo, repetible y no incapacitante para cualquier otra intervención. Sin embargo, ni los resultados son espectacularmente buenos, ni está exento de complicaciones54.
Por último, ante casos con buena continencia esfinteriana anal, la «abstención» terapéutica podría proporcionar una buena calidad de vida, con mínima sintomatología, comparable a la que acontece tras una urétero-sigmoidostomía, aunque con el riesgo permanente de infecciones del tracto urinario y malignización secundaria.
En definitiva, la posibilidad de tratamiento conservador en los términos expuestos existe. La decisión ha de tomarse de forma individualizada en función del tipo de lesión y características del paciente.
Opciones quirúrgicasVarios aspectos son resaltados de manera unánime con relación al tratamiento quirúrgico de las FRU: que el primer intento de reparación es el más favorable55; que el abordaje óptimo es aquel con el que el cirujano está más familiarizado para llevar a cabo los gestos quirúrgicos necesarios en cada caso43; que decidir el momento más adecuado para la reparación constituye un aspecto trascendental56; y que no existe unanimidad con relación a la necesidad de derivación fecal como paso previo a la corrección quirúrgica18,25,32,39,47,48,57–60, salvo en las FRU secundarias a radioterapia y, sobre todo, a braquiterapia, en las que se recomienda la doble derivación previa a cualquier otro tratamiento4,21,22,27,31, llegando Linder24 a plantearse la opción de la derivación permanente, dados los malos resultados de la cirugía en estos pacientes.
Tras diversas publicaciones durante el siglo pasado, en 1958 Goodwin61 resalta los aspectos más importantes de la reparación, que con pequeñas variaciones se pueden concretar en los siguientes principios: buena liberación y escisión del trayecto fistuloso, movilización adecuada de los tejidos circundantes, obtención de márgenes sanos en uretra y recto, cierre uretral, cierre rectal en 2 planos (ambas suturas sin tensión), evitar superposición de ambas líneas de sutura e interposición de tejido sano siempre que se considere adecuado.
Las opciones quirúrgicas descritas son numerosas: desde la vía de abordaje hasta los detalles precisos sobre el manejo uretral, rectal y tejidos adyacentes, aspectos que han sido recogidos en amplias revisiones22,39,41,55,62.
Las vías de abordaje utilizadas son las siguientes: abdominal, transanal, transrectal, transesfintérica y perineal; sus principales características son:
Abordaje abdominalMínimamente utilizado, ya que aunque permite la interposición del epiplon, conlleva una mayor dificultad operatoria y tiempo de intervención, mayor estancia hospitalaria y mayor tiempo de recuperación y dolor postoperatorio58,63.
En algún caso se ha utilizado el abordaje laparoscópico, pero de forma excepcional64,65. Las lesiones originadas durante la prostatectomía laparoscópica pueden repararse también por esta vía6.
En casos extremadamente complejos, que requerirían la implantación de una colostomía permanente, Chirica66 propone la realización de una anastomosis coloanal según técnica de Soave.
Abordaje transanalTiene la ventaja de su simplicidad y limitada morbilidad. Por el contrario, presenta el inconveniente de pobre visibilidad, limitada capacidad de maniobrabilidad instrumental e imposibilidad de interposición tisular.
El procedimiento más simple es la técnica de Latzko, con denudación mucosa y cierre del orificio fistuloso sin extirpación del trayecto; ocasiona un mínimo dolor postoperatorio, no requiere estoma derivativo y puede repetirse las veces que sea preciso. Más utilizada en fístulas rectovesicales y vesicovaginales, puede ser útil en las FRU pequeñas y distales49,57.
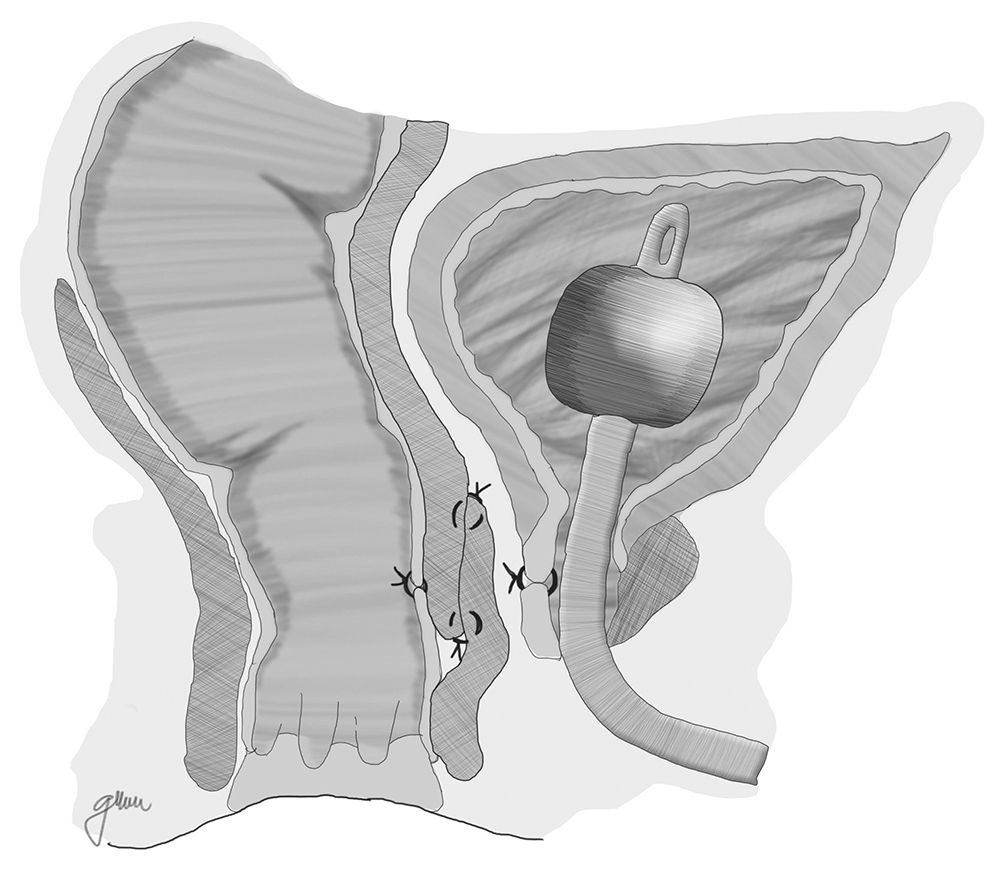
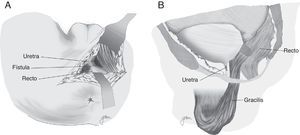
Otra opción consiste en la elaboración de un flap de avance de pared rectal total, con cierre del orificio uretral, evitando la superposición de las líneas de sutura, con el que se han obtenido resultados favorables (fig. 1)67. En algún caso, para separar ambas estructuras, se ha utilizado la interposición de un injerto de Alloderm, material biocompatible realizado con dermis de cadáver humano que proporciona una matriz acelular y permite la vascularización y crecimiento de tejido nativo14.
Se ha propuesto también la corrección mediante microcirugía endoscópica (TEM-TAMIS), con distinto tratamiento del trayecto fistuloso, orificio uretral y apertura rectal15,51,68–72.
Abordaje transrectal posterior (vía de Kraske)Descrita por Kraske en 1885, su valor es prácticamente histórico, debido a las múltiples complicaciones que conlleva, tanto urinarias como fecales73,74.
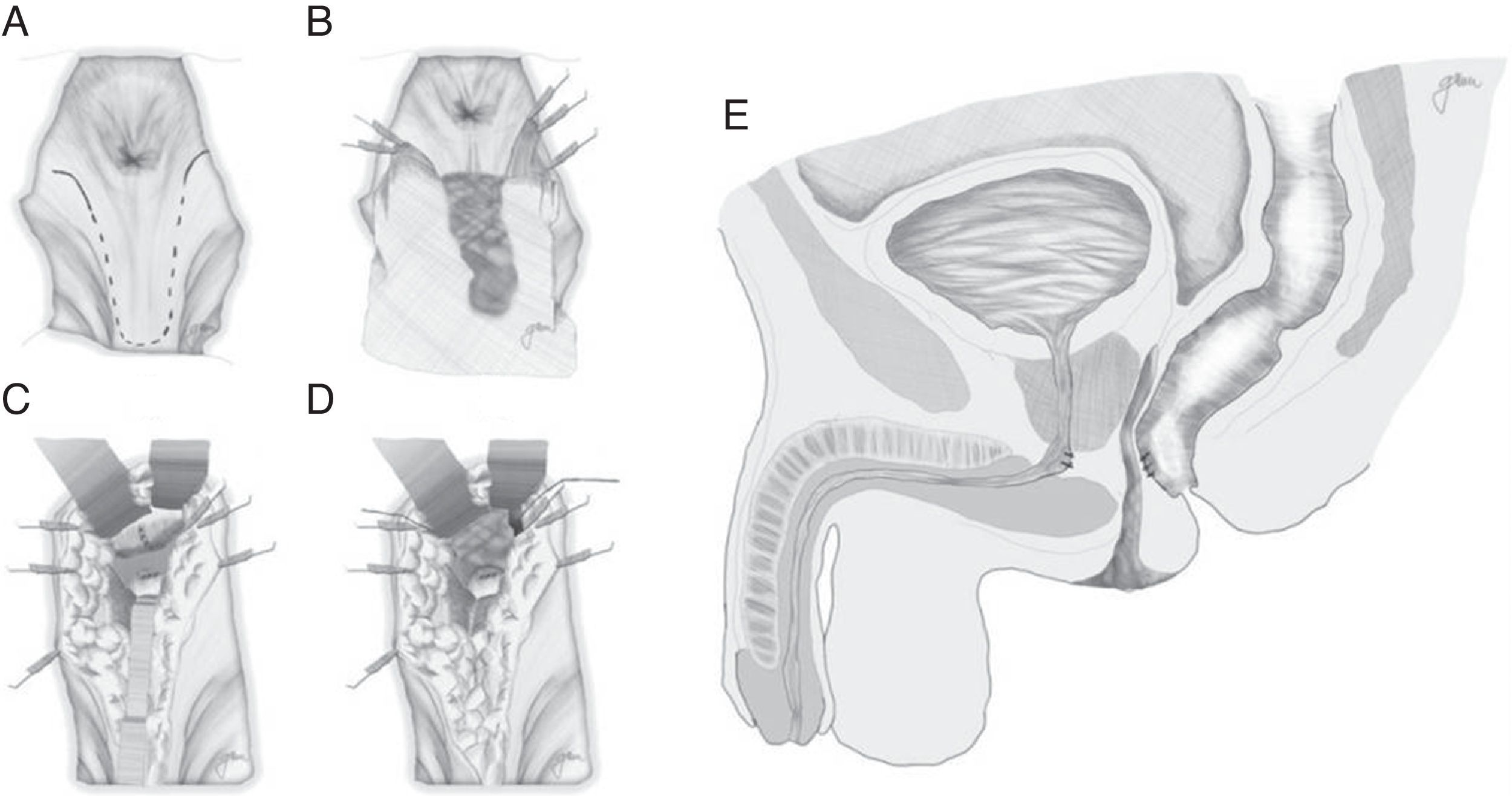
Abordaje transesfintérico posterior (vía de York-Mason)Realiza el acceso a la FRU mediante abordaje transesfintérico posterior y apertura de la cara posterior rectal.
Descrito por Kilpatrik y Mason en 196974, con apertura parasacro-coxígea transesfintérica y modificado en 1970 por York Mason75.
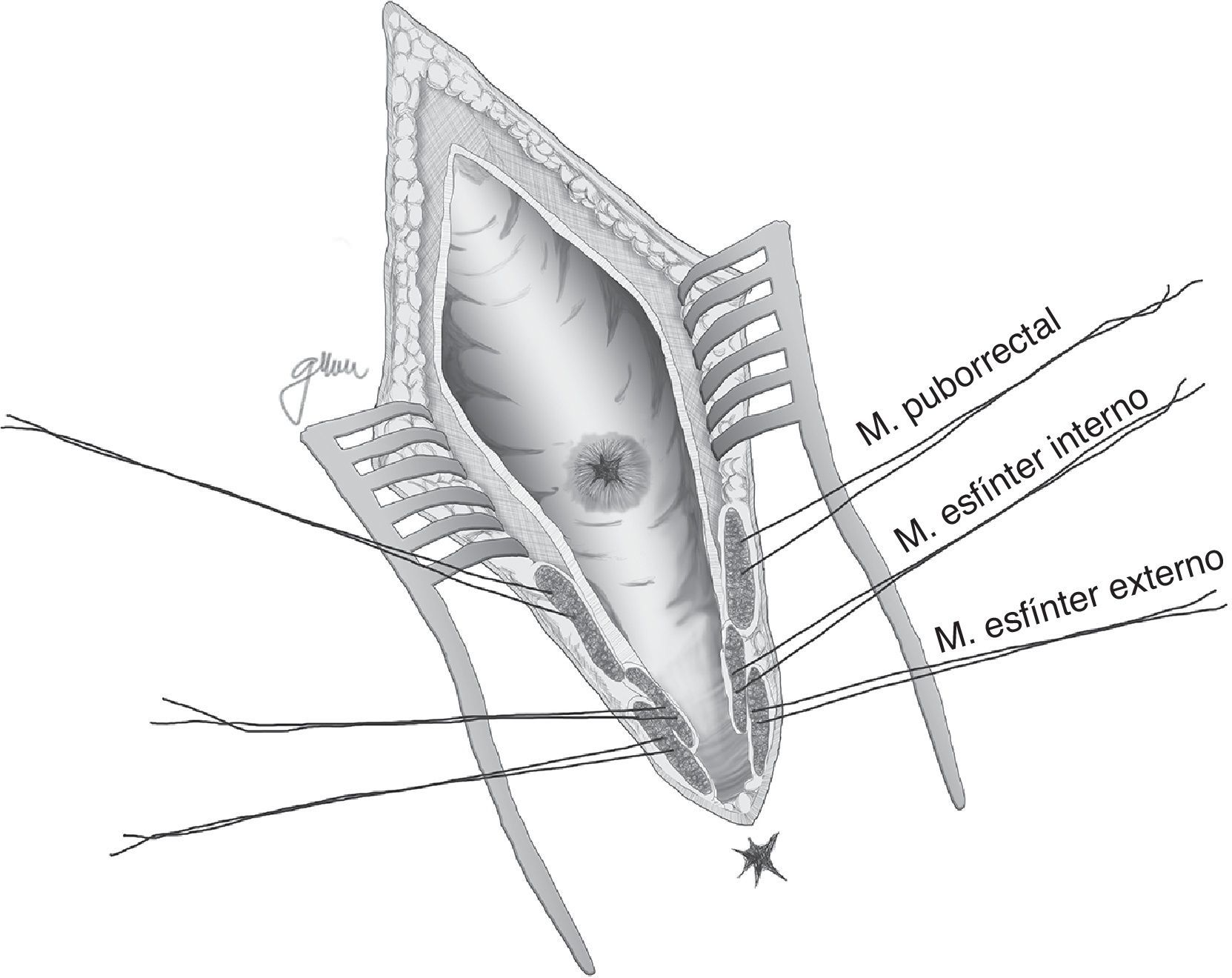
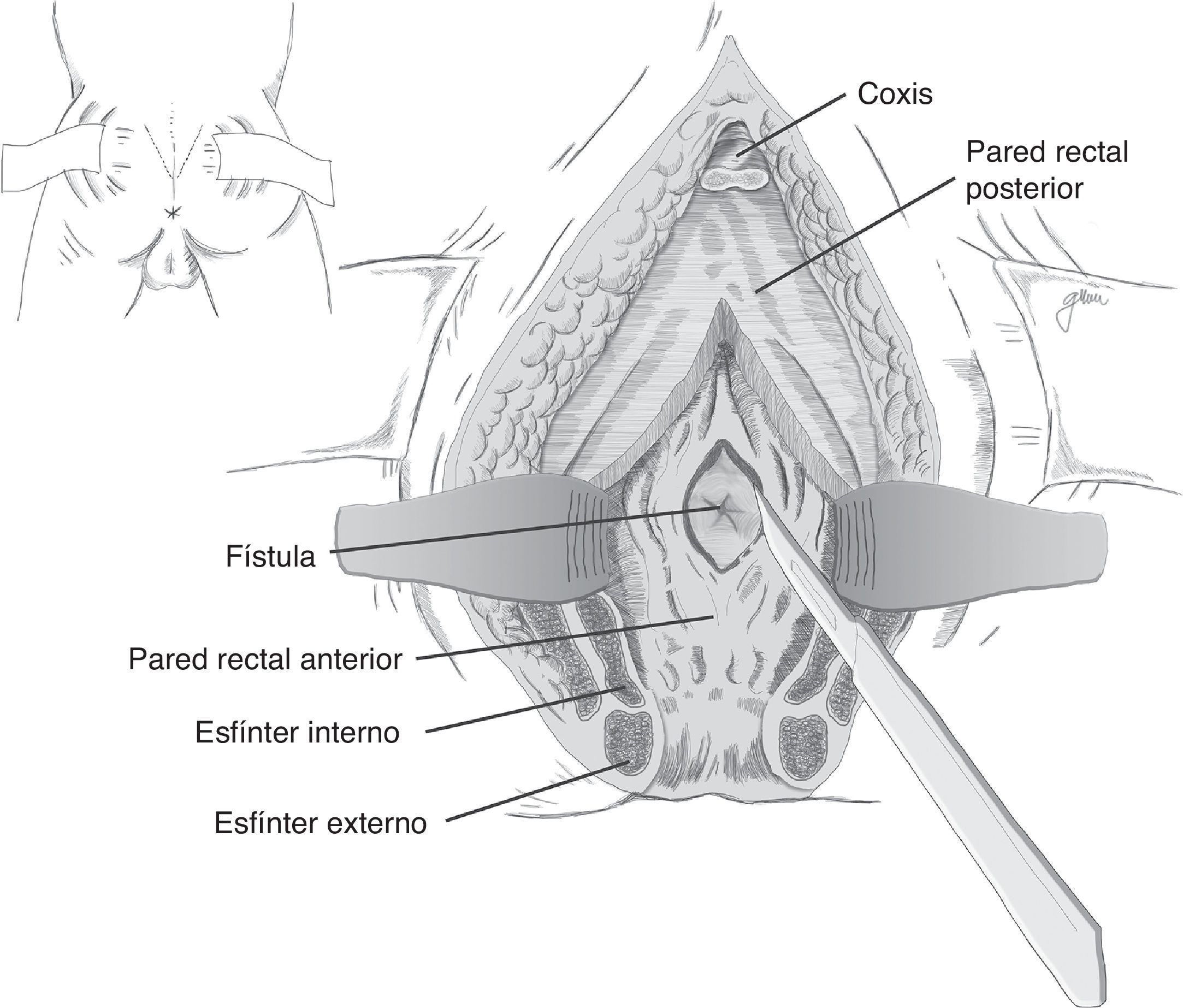
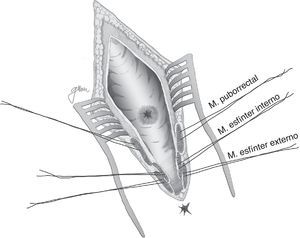
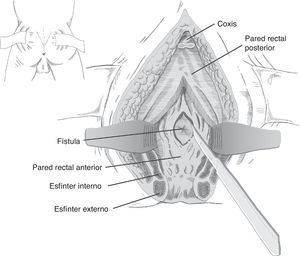
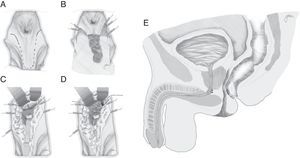
En esencia consiste en, tras preparación intestinal mecánica y profilaxis antibiótica, sonda vesical de 18Fr preoperatoria, posición de navaja en prono y separación de ambos glúteos, incisión oblicua desde el lado izquierdo del sacro y coxis hasta el margen anal posterior, seccionando todo el complejo esfintérico (esfínter externo, esfínter interno y puborrectal/elevador), dejándolos marcados con puntos para su más fácil reparación posterior. A continuación, apertura de la pared posterior del recto que permite una perfecta visualización de la cara anterior rectal con su orificio fistuloso (fig. 2). Se han hecho discretas modificaciones, como la apertura en línea media18 (fig. 3) o en el lado derecho58, sin que varíe lo esencial del procedimiento.
Se procede seguidamente a la resección de todo el trayecto fistuloso, incluyendo la pared rectal, la pared uretral y los tejidos circundantes que permitan una correcta sutura de tejidos sanos, procurando que no queden superpuestas las suturas de uretra y recto. En ocasiones se recomienda la realización de un flap de avance rectal, tal como se muestra en la figura 148.
Con pequeñas variaciones, sin gestos trascendentales diferentes, esta es la técnica recomendada por numerosos autores por su facilidad, accesibilidad, carencia de complicaciones y resultados satisfactorios, sobre todo ante FRU de pequeño tamaño5,18,43,55,56,58,76,77, aunque puede aplicarse en otras de mayor complejidad combinándola con otros procedimientos18,55,76,78. No todos los autores efectúan cierre del orificio uretral, salvo que se consiga sin tensión y sobre tejido sano37,48,79–81; en cambio es unánime la recomendación del cierre del orificio rectal en 2 planos: submucosa y muscular en el primero y mucosa evertida en el segundo, ambos con material reabsorbible.
Finalmente, cierre de la pared posterior del recto, reconstrucción esfinteriana, subcutáneo y piel, dejando un drenaje aspirativo a nivel subcutáneo durante 24-48h.
La sonda vesical se mantiene 6-8 semanas. En cuanto a la necesidad o no de derivación fecal, aunque la mayor parte de autores la recomiendan, se admite la posibilidad de obviarla en casos de fístulas pequeñas, sin extensa fibrosis y en ausencia de infección sistémica incontrolada, sepsis o abscesos58.
Si se realiza colostomía, el cierre se llevará a cabo a los 2-3 meses de la intervención. Como paso previo a la supresión de la derivación debe confirmarse el cierre completo de la fístula mediante la realización de una cistoscopia, cisto-uretrografía retrógrada, rectoscopia e incluso enema opaco, para confirmar el cierre de la comunicación.
Los porcentajes de curación mediante este procedimiento oscilan entre el 85% y el 100%, precisando algunos casos varias operaciones para conseguirlo, lo que evidencia que esta técnica puede ejecutarse de forma reiterada, sin incremento de morbilidad48,58.
Prácticamente en todas las series se comunica la ausencia de afectación de la continencia anal58.
Abordaje perinealGoodwin61, en 1958, basado en descripciones previas efectuadas por Weyrauch (1951) y Wilhelm (1955), recomienda el abordaje perineal para el tratamiento de las FRU complejas y establece los criterios y gestos básicos para la intervención, que en esencia son: paciente en posición de litotomía y sondado, amplia exposición perineal, transección de la fístula, liberación de los orificios uretral y rectal, 2 planos de sutura formando un ángulo recto entre ellos, adecuada separación de dichas suturas mediante la interposición del elevador, drenaje urinario mediante catéter uretral o suprapúbico durante al menos 2 semanas, colostomía en casos seleccionados y drenaje perineal. Con estos principios esenciales lograba una curación del 100%.
Al margen de todos estos gestos, se considera trascendental ante FRU complejas, grandes, con tejido fibrosado, infectado y/o abscesificado, interponer tejido sano entre ambas líneas de sutura para proporcionar un mayor índice de curación. Aunque el epiplon resulta útil, exige el abordaje abdominal; por otra parte, en casos de cirugía abdominal previa, no siempre resulta posible, por lo que, durante los últimos años, se han propuesto otras estructuras, fundamentalmente músculo gracilis, dartos, bulbocavernoso y glúteo, al margen de peritoneo y elevador utilizados con anterioridad.
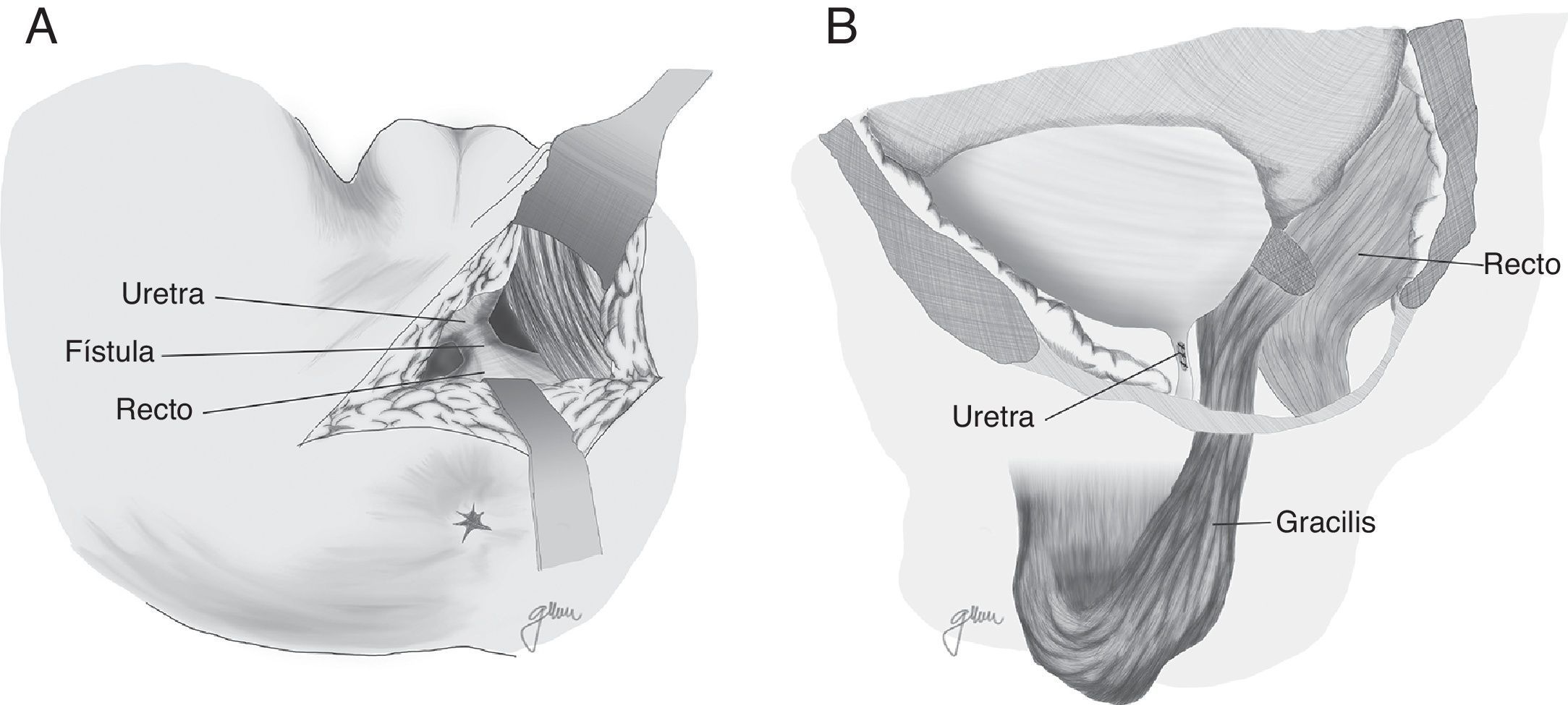
En 1979 Ryan80 utiliza el músculo gracilis en 3 casos, consiguiendo la curación en todos ellos. Desde aquel momento ha constituido una técnica ampliamente recomendada por numerosos autores, con mínimas complicaciones y elevados índices de curación, siendo factible su utilización de forma prácticamente generalizada, al margen de la edad, el sexo y la configuración corporal4,17,18,20,47,50,59,82–87, aunque las series publicadas son muy limitadas.
Al margen de los gestos establecidos por Goodwin61 se practica una liberación en toda su longitud del músculo gracilis respetando las estructuras neuromusculares en su parte proximal, elaboración de túnel subcutáneo en periné, rotación e implantación entre recto y uretra (fig. 4). Tras el desplazamiento del gracilis puede desencadenarse necrosis del flap, por lo que hay que estar preparados para la disección bilateral82 o una segunda transposición50. Se ha descrito la liberación endoscópica del gracilis, lo que evitaría alguna de las incisiones88.
Se recomienda el sondaje vesical durante 6 semanas, no existiendo unanimidad con relación a la necesidad o no de derivación fecal84. Lo que no hay duda es que debe utilizarse siempre ante intervenciones previas, reparaciones poco sólidas, infección activa y grandes orificios fistulosos, evitando la distensión rectal e incremento de la presión durante el periodo de la curación, minimizando el riesgo de dehiscencia de la sutura. Como derivación fecal se ha propuesto también la ileostomía, que puede realizarse mediante abordaje laparoscópico.
El índice de curaciones que proporciona oscila entre el 78% y el 100%, con una o varias intervenciones80,82,83,87.
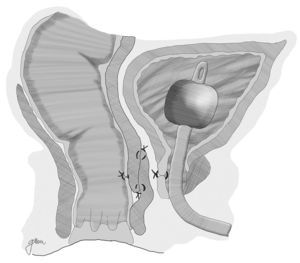
Youssef89, en 1999, propone por primera vez la interposición de un flap de músculo dartos pediculado entre recto y uretra (fig. 5). Se trata de un flap bien vascularizado, fácil de obtener, que forma un tabique completo entre recto y uretra, separando las líneas de sutura y rellenando el espacio existente entre ellos, por lo que facilita la curación y previene de la recurrencia. Obtiene la curación sin complicaciones ni recurrencias en sus 12 pacientes, por lo que lo plantea como la posible solución ideal. Otros autores resaltan los buenos resultados obtenidos con su utilización44,81,90–93.
Recientemente Iwamoto94 propone la interposición del músculo vasto lateral; Krand13 y Abdalla95 la de glúteo mayor y Solomon96 la bilateral del puborrectal. En todos los casos se resalta la fácil disección, rica vascularización, proximidad anatómica y ausencia de efectos secundarios. Su utilización ha sido hasta la actualidad meramente testimonial.
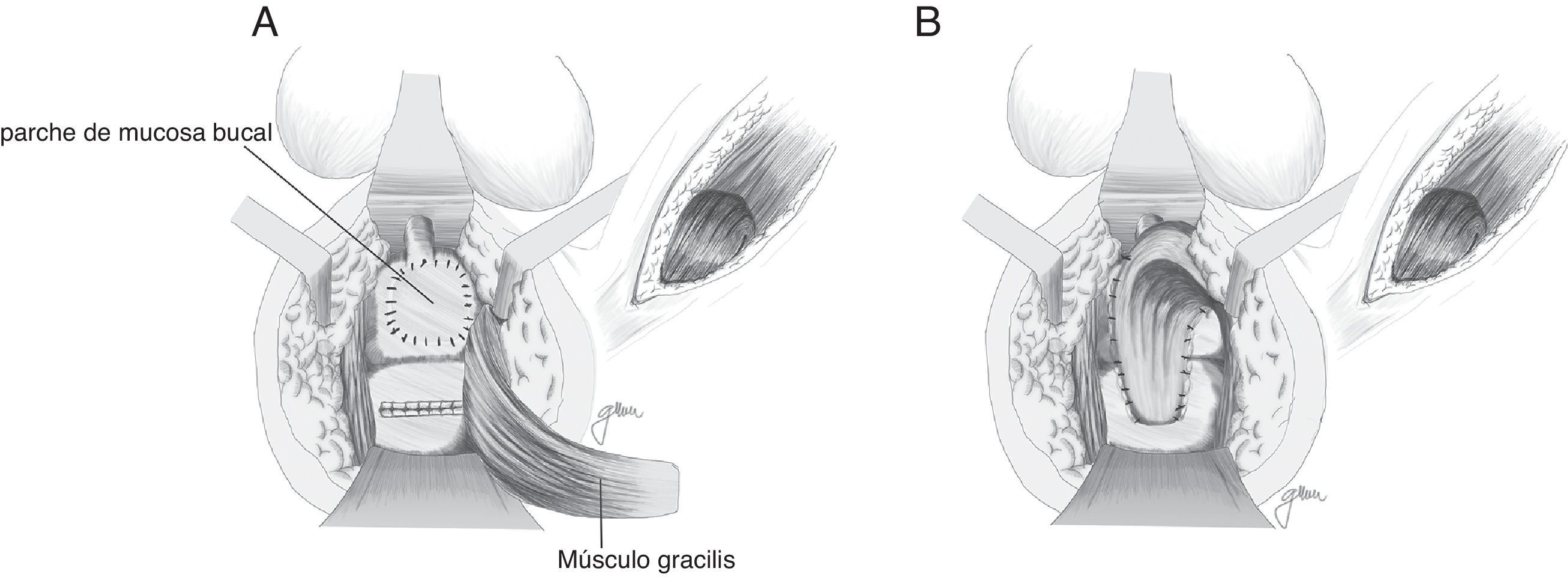
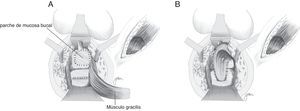
Basado en la utilización de mucosa bucal para la realización de uretroplastias97–99, Lane27 propone la implantación de un parche de mucosa bucal para el cierre de orificios ureterales amplios, asegurando un tejido sano y epitelizado; en la mayor parte de sus casos lo acompañan con una anastomosis coloanal mediante pull-through.
Se han efectuado variaciones técnicas tras la implantación de mucosa bucal. Así, Spahn100 la utiliza sola, sin ninguna otra interposición tisular; Zinman33, tras su implantación y cierre rectal, interpone gracilis, actitud adoptada también por Vanni17, quien resalta su aplicación sobre todo en pacientes sometidos con anterioridad a radioterapia y con dificultad para cierre primario (fig. 6). Se ha propuesto también la utilización de un parche de submucosa porcina, aunque solo hemos encontrado un caso descrito101.
Por regla general, el sondaje vesical o derivación suprapúbica se mantiene entre 2-4 semanas si la FRU es secundaria a prostatectomía y entre 6 y 8 en las posteriores a radioterapia; en cuanto a la derivación fecal, el plazo medio aceptado es de 3 meses. En todos los casos debe confirmarse el cierre de la fístula, tal como se ha mencionado con anterioridad.
Como complicaciones del abordaje perineal se han descrito impotencia sexual por lesión neuro-vascular, estenosis uretral, incontinencia urinaria y las derivadas del pedículo muscular.
Otras vías y opcionesAl margen de los abordajes descritos, que son los más habituales, han sido utilizados otros de forma más o menos anecdótica. Así, Gecelter102, en 1973, recomienda la vía transanorrectal anterior. Consiste en una incisión profunda en línea media anterior, desde escroto hasta el ano, que incluye fascia perineal superficial, porción central tendinosa del periné, esfínter interno y esfínter externo, hasta llegar a la cápsula prostática, a cuyo nivel se practica la extirpación de la fístula y sutura de los orificios uretral y rectal. Castillo7 resalta la buena exposición que proporciona, satisfactorio acceso a tejido bien vascularizado y relativa facilidad del procedimiento.
Finalmente, en determinados casos sumamente complejos, puede ser necesaria una cistoprostatectomía, proctectomía y derivación urinaria y fecal permanentes17,27,30,47,57 e incluso la exenteración pélvica19,22.
En definitiva, son numerosos los procedimientos recomendados, pero no existe una guía definitiva que oriente al cirujano hacia la opción más resolutiva, con un mínimo de complicaciones. En este sentido, Rivera76 efectúa una clasificación del tipo de fístula basado en el tamaño, localización y secundarias a irradiación o no, con la recomendación terapéutica que considera más adecuada. No obstante, se basa exclusivamente en 14 casos, por lo que el mismo autor concluye en la necesidad de una mayor experiencia y más prolongado periodo de control para confirmar la validez del 100% de curaciones obtenidas.
Recientemente, Hanna4,22 propone un algoritmo basado en la etiología de la fístula: post-radioterapia o no.
ConclusionesAunque infrecuentes, las fístulas rectouretrales constituyen una enfermedad importante, cuya etiología fundamental está relacionada con el cáncer de próstata, ya sea tras tratamiento quirúrgico o secundarias a radioterapia u otras opciones terapéuticas.
Clínicamente son fáciles de reconocer por la existencia de neumaturia y/o fecaluria y por la eliminación de orina por el ano. No obstante, deben realizarse pruebas diagnósticas para su confirmación, entre las que destacan rectoscopia, cistoscopia, uretroscopia y cistouretrografía. La realización de enema opaco, TC, RM y ECO-endorrectal puede aportar datos en casos seleccionados.
El tratamiento debe seleccionarse de forma individualizada. Aunque determinados casos favorables pueden resolverse mediante tratamiento conservador, lo habitual es que se precise tratamiento quirúrgico, con o sin derivación urinaria y/o fecal.
Las opciones son muchas, debiendo adaptarse a la experiencia del equipo quirúrgico, tipo de fístula, localización y etiología de la misma, fundamentalmente. Mediante esta actitud los niveles de curación oscilan entre el 80-100%, con una o varias intervenciones.
Conflicto de interesesDe igual modo los autores declaran que no existe ningún conflicto de intereses.