En la actualidad no existe consenso en cuanto a la necesidad de realizar linfadenectomía axilar (LA) en los casos en que se detectan macrometástasis en el ganglio centinela (GC). En este estudio se presenta la utilidad del ganglio secundario (GS), una nueva técnica diagnóstica, como factor predictor de afectación axilar.
MétodosSe diseñó un estudio observacional, retrospectivo y multicéntrico con el objetivo de validar la técnica del GS, entendido como tal el siguiente ganglio a nivel anatómico y de difusión linfogammagráfica tras el GC, como predictor de la afectación axilar. Sobre un total de 2.273 pacientes afectas de cáncer de mama se obtuvo una muestra válida de 283 pacientes a las que se había analizado el estado del GS de forma adicional. Las variables principales del estudio fueron el estado histológico del GC, del GS y del vaciamiento axilar y se valoró la sensibilidad, especificidad y exactitud de la prueba.
ResultadosLa prueba del GS, con GC positivo, presenta una sensibilidad del 61,1%, una especificidad del 78,7%, un valor predictivo positivo del 45,8% y un valor predictivo negativo del 87,3%, con una exactitud del 74,7%.
ConclusiónEl estudio del GS junto con la técnica del GC permite realizar una estadificación más precisa del estado axilar, en pacientes con cáncer de mama, en comparación con el estudio único del GC.
Currently, there is no agreement regarding if it would be necessary to perform an axillary lymph node dissection (ALND) in patients who have macrometastases in the sentinel lymph node (SLN). We studied the utility of the secondary node analysis (SN), defined as the following node after the SLN in an anatomical and lymphatic pathway, as a sign of malignant axillary involvement.
MethodsAn observational, retrospective and multicentre study was designed to assess the utility of the SN as a sign of axillary involvement. Among 2273 patients with breast cancer, a valid sample of 283 was obtained representing those who had the SN studied. Main endpoints of our study were: the SLN, the SN and the ALND histological pattern. Sensitivity, specificity and precision of the test were also calculated.
ResultsSN test, in cases with positive SLN, has a sensitivity of 61.1%, a specificity of 78.7%, a positive predictive value of 45.8% and a negative predictive value of 87.3% with a precision of 74.7%.
ConclusionThe study of the SN together with the technique of the SLN allows a more precise staging of the axillary involvement, in patients with breast cancer, than just the SLN technique.
El abordaje quirúrgico del cáncer infiltrante de mama ha evolucionado de forma sorprendente hacia tratamientos cada vez más conservadores manteniendo los estándares oncológicos. En la zona axilar, la técnica del ganglio centinela (GC) constituye el método «gold standard» para realizar una correcta estadificación del cáncer de mama y decidir posteriormente el tratamiento más adecuado1-4. Esta prueba tiene un alto valor predictivo negativo y, además, representa uno de los factores pronósticos más relevantes tras el diagnóstico de la enfermedad5-7.
En la actualidad se acepta no realizar linfadenectomía axilar (LA) ante la presencia de micrometástasis o células tumorales aisladas8,9. Sin embargo, existe controversia en cuanto a la necesidad de efectuar LA en los casos en que se detecta macrometástasis, ya que en estos casos el GC es el único ganglio afecto en aproximadamente el 70% de los pacientes, lo que conlleva un gran número de vaciamientos axilares (VAX) evitables10-12.
Existe, pues, la duda razonable de que al efectuar la LA se esté sobretratando un elevado número de pacientes con macrometástasis en el GC sin afectación del resto de la axila, con la morbilidad asociada que ello implica. Más aún, teniendo en cuenta el estudio de Giuliano et al.13,14. en el que se concluye que los pacientes con 1-2 GC afectos no precisan LA si son tratados con quimioterapia o radioterapia, pues tienen la misma supervivencia libre de enfermedad que aquellos a los que se les realiza VAX. Por este motivo, la comunidad científica intenta averiguar en la actualidad cuál es el método predictivo que permita definir en qué pacientes se puede evitar la LA.
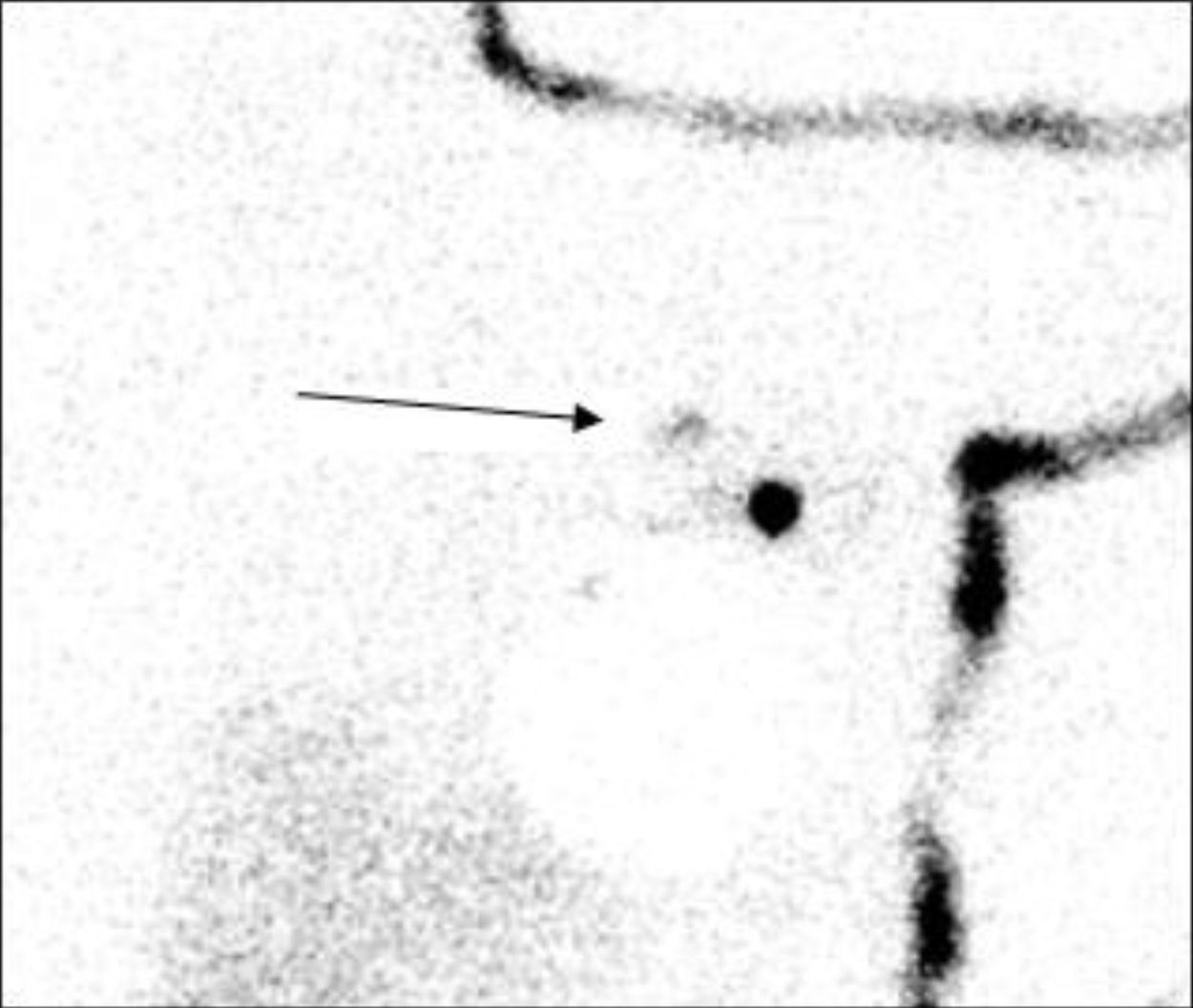
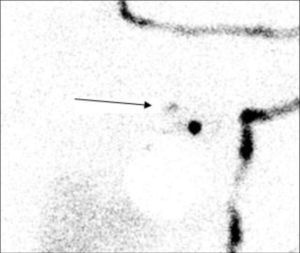
El objetivo de este trabajo fue analizar la utilidad del ganglio secundario (GS) como factor predictivo de afectación axilar para evitar VAX innecesarios. Se entiende como GS el siguiente ganglio a nivel anatómico y de drenaje linfático, en dirección centrípeta hacia el conducto torácico, que metastatiza tras el GC (fig. 1). Además, para definirse como GS debe presentar una captación del radiotrazador de entre el 10 y el 25% de la identificada en el GC mediante sonda portátil durante el acto operatorio.
MétodosCon la finalidad de determinar la validez del GS para predecir la afectación en el VAX se diseñó un estudio observacional, retrospectivo y multicéntrico (Hospital Universitari Germans Trias i Pujol de Badalona, Hospital de Mataró, Hospital Municipal de Badalona, Hospital Sant Joan de Déu de Martorell, Hospital de Calella, Clínica Sagrada Familia de Barcelona y Hospital del Esperit Sant de Santa Coloma de Gramenet). La recogida de datos se realizó en el periodo comprendido entre octubre de 1997 y octubre del 2010.
Sobre un total de 2.273 pacientes diagnosticadas de cáncer de mama, que conforman nuestra población de referencia y grupo control, se obtuvo una «n» válida de 285 y se calculó la probabilidad pretest de vaciamiento positivo en nuestra población. Los criterios de inclusión y exclusión se describen en la tabla 1.
Criterios de inclusión y exclusión
| Criterios de inclusión |
| Paciente mujer afecta de neoplasia de mama |
| T1-2 Nx M0 |
| Se ha realizado la técnica del GC |
| Se ha detectado y biopsiado adicionalmente el GS |
| Criterios de exclusión |
| Quimioterapia neoadyuvante |
| Recidivas o segundas neoplasias de mama con cirugía axilar previa |
Las variables principales del estudio fueron el estado histológico del GC, el del GS (variables independientes) y el del VAX (variable dependiente). Como variables secundarias se estudiaron a nivel clínico la edad, la palpabilidad del tumor, su localización y la presentación radiológica. A nivel histológico, el tamaño tumoral, el tipo histológico, la presencia de invasión linfática/vascular, el estado de los receptores hormonales de estrógenos y progesterona, y la presencia de HER-2.
Para el estudio del GC y del GS se utilizó como trazador un nanocoloide de albúmina marcada con Tc99m. Entre 3 y 20h antes de la cirugía se inyectó una dosis de 111 MBq del trazador peritumoral/intratumoral en un volumen total de 0,4ml. La linfogammagrafía preoperatoria se practicó según el protocolo vigente entre 14 y 16h antes de la cirugía (rango 2-24h, excepcionalmente, en caso de incidente).
Tras la extirpación del tumor se procedió a la biopsia del GC y del GS. Cuando el GC resultó positivo se realizó una LA convencional.
La indicación de extracción del GS se realizó de forma exploratoria mediante la misma sonda de detección gamma portátil (Navigator, USSC, EE. UU.) que el GC. Se definió como GS el siguiente ganglio a nivel anatómico y de drenaje linfático, en dirección centrípeta hacia el conducto torácico, que metastatiza tras el GC. Además, debe presentar una captación del radiotrazador de entre el 10 y el 25% de la identificada en el GC mediante sonda portátil durante el acto operatorio.
Las piezas de biopsia del GC, del GS y del VAX se procesaron siguiendo el procedimiento habitual del servicio de Anatomía Patológica de nuestro centro.
Análisis estadísticoEl tamaño de muestra necesario para el estudio fue de 226 para alcanzar una significación del 0,05 (grado de confianza del 95%), con una precisión del 6%.
El análisis estadístico se realizó mediante el programa informático SPSS® (versión 19.0) y el programa EPIDAT® (versión 3.1). Para la validación del GS como prueba predictiva de la diseminación tumoral ganglionar a nivel axilar, se valoró:
- a)
La capacidad del GS para detectar VAX patológicos.
- b)
La capacidad del GS para detectar VAX no patológicos.
- c)
La exactitud de la prueba del GS.
Para la evaluación del GS como prueba diagnóstica se diferenciaron 4 grupos de pacientes: pacientes con GC y GS positivos, pacientes con GC positivo y GS negativo, pacientes con GC negativo y GS positivo y pacientes con GC y GS negativos.
Posteriormente, se compararon los resultados obtenidos en el análisis histológico del GS con los obtenidos en los VAX.
ResultadosA partir de las historias clínicas de las 2.273 pacientes se estableció una prevalencia estimada de VAX positivo y, por tanto, de probabilidad pretest de vaciamiento en nuestra población del 8,8%.
Tal como se ha descrito previamente, se obtuvo una muestra válida de 285 casos.
Los resultados de las variables clínico-radiológicas de la muestra se describen en la tabla 2.
Resultados de las variables clínico-radiológicas de la muestra n (%)
| Edad (años) | 56,7 ± 12,6 |
| Diámetro tumoral (cm) | 1,84 ± 0,84 |
| Lesión palpable | 159 (55,8) |
| Foco tumoral único | 234 (82,1) |
| Invasión linfática/vascular | 45 (16,1) |
| Localización (CSE) | 108 (37,9) |
| Tipo histológico - carcinoma ductal infiltrante | 203 (71,2) |
| Receptores hormonales positivos | 199 (69,8) |
| HER-2 | 76 (26,7) |
| Drenaje linfático | |
| Axilar | 235 (82,5) |
| Mamaria interna | 41 (14,4) |
| Pacientes con GC positivo | 93 (32,6) |
| N.° de GC biopsiados | |
| 1 | 113 (39,6) |
| 2 | 134 (47,0) |
| >2 | 38 (13,4) |
| N.° de GS biopsiados | |
| 1 | 232 (81,4) |
| 2 | 38 (13,3) |
| >2 | 15 (5,3) |
CSE: cuadrante superior externo; GC: ganglio centinela; GS: ganglio secundario; HER-2: receptor 2 de factor de crecimiento epidérmico humano.
En ninguna de las variables estudiadas se encontraron diferencias significativas entre los valores de la muestra y los de la población de referencia.
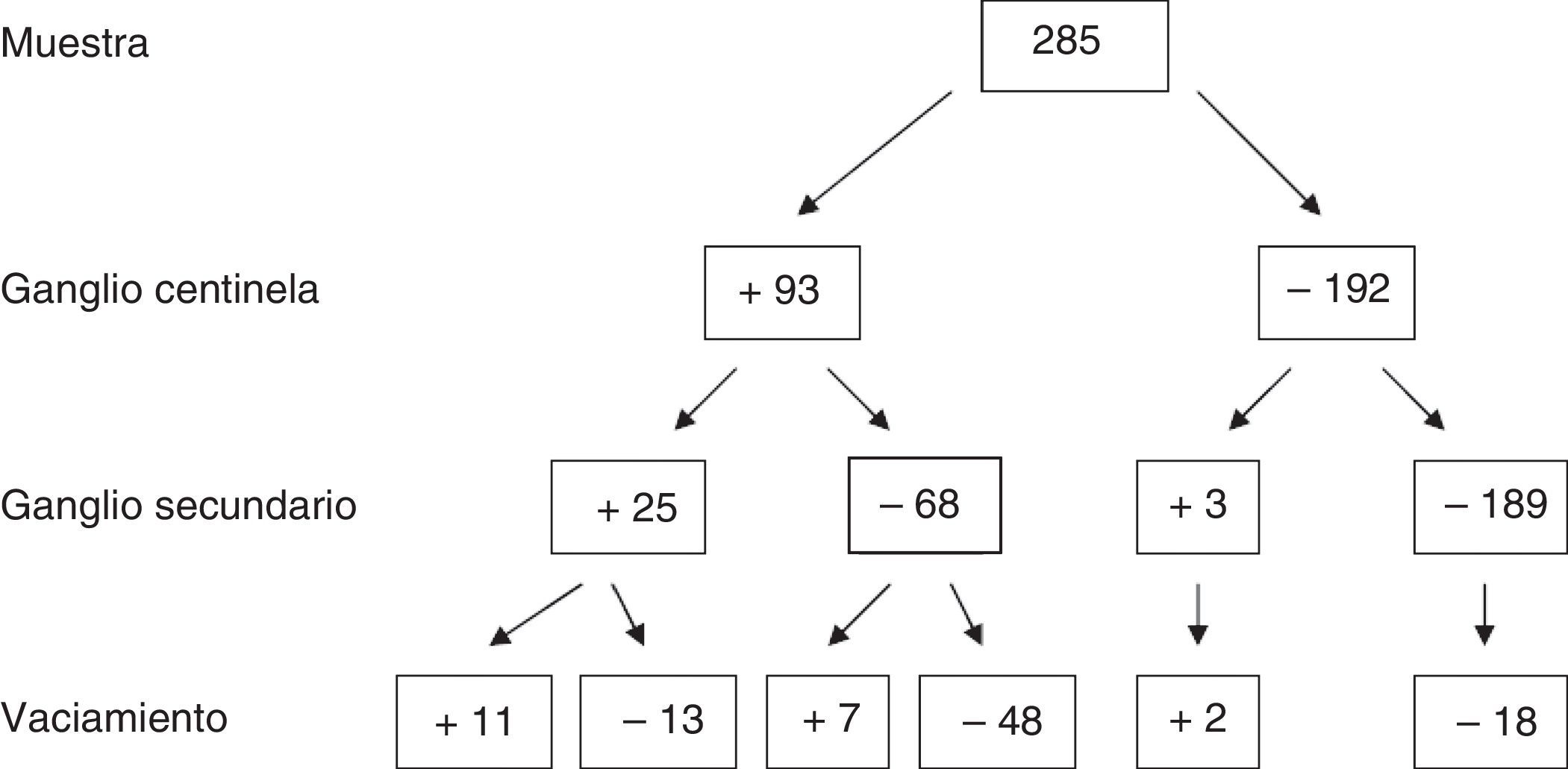
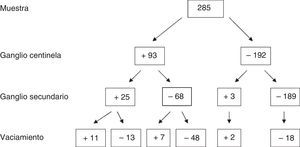
En cuanto a los resultados absolutos de la muestra para GC, GS y vaciamiento axilar, de los 285 pacientes se obtuvieron 93 casos con GC positivo, de los cuales, 25 presentaron GS afecto y 68 GS negativo. De los que tuvieron GS afecto, 10 presentaron afectación axilar (40%). Sin embargo, en el grupo con GS negativo, únicamente 7 tuvieron la axila infiltrada (10,3%).
Los resultados completos se detallan en la figura 2.
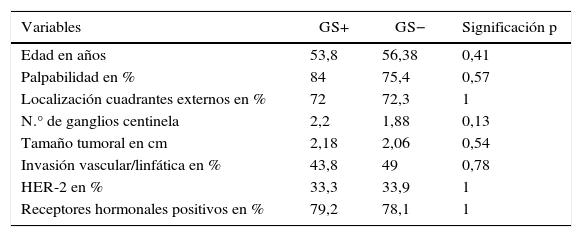
Respecto a la valoración de la homogeneidad entre los grupos con GS positivo y negativo, no se encontraron diferencias significativas entre GS positivo o negativo en relación con la edad, las variables secundarias clínicas o tumorales, en el n.° de GC analizados ni en el n.° de GS analizados (tabla 3).
Resultados de las variables secundarias clínico-radiológicas para el grupo GC positivo
| Variables | GS+ | GS− | Significación p |
|---|---|---|---|
| Edad en años | 53,8 | 56,38 | 0,41 |
| Palpabilidad en % | 84 | 75,4 | 0,57 |
| Localización cuadrantes externos en % | 72 | 72,3 | 1 |
| N.° de ganglios centinela | 2,2 | 1,88 | 0,13 |
| Tamaño tumoral en cm | 2,18 | 2,06 | 0,54 |
| Invasión vascular/linfática en % | 43,8 | 49 | 0,78 |
| HER-2 en % | 33,3 | 33,9 | 1 |
| Receptores hormonales positivos en % | 79,2 | 78,1 | 1 |
GS: ganglio secundario; HER-2: receptor 2 de factor de crecimiento epidérmico humano.
A partir de estos resultados se puede afirmar que existe homogeneidad entre los grupos con GS positivo y negativo, dentro de la muestra GC positivo.
Como prueba diagnóstica, el GS mostró:
Grupo 1: GC y GS positivos (n = 25), de los cuales se realizó VAX en aquellos que presentaron macrometástasis, es decir, en 24. La afectación del VAX fue del 44% (n = 11/24).
Grupo 2: GC positivo y GS negativo (n = 68), de los cuales se realizó VAX a 55, que fueron los que presentaron macrometástasis. El 12,7% de los casos presentó VAX positivo (n = 7/55).
Grupo 3: GC negativo y GS positivo (n = 3), de los cuales se realizó VAX a 2. El VAX fue positivo en el 66% de los casos (n = 2), detectando de esta manera posibles falsos negativos del GC.
Grupo 4: GC y GS negativos (n = 189). Todos los casos en los que se realizó VAX (n = 18), que fueron los primeros casos al inicio de la serie cuando la técnica del GC se encontraba en fase de validación, presentaron un VAX negativo.
Los resultados estratificados según el estado del GC y el GS se muestran en las tablas 4 y 5.
A raíz de estos resultados se determina que la prueba del GS, con GC positivo, presenta una sensibilidad del 61,1%, una especificidad del 78,7%, un VPP del 45,8% y VPN del 87,3%, con una exactitud del 74,7%. Cuando el GC resulta negativo el GS tiene una sensibilidad, especificidad, VPP, VPN y exactitud del 100%.
DiscusiónEn la actualidad se está poniendo en duda la necesidad de realizar LA en determinadas circunstancias con GC positivo8,15,16. El conflicto actual se plantea a raíz de la aparición de varios estudios en los que se objetiva que en más del 60% de los casos con GC positivo el resto de los ganglios del VAX son negativos, lo que conlleva una morbilidad innecesaria y evitable17-19. Varios han sido los métodos propuestos para discernir cuál debe ser la mejor actitud terapéutica en estos casos.
Giuliano et al., a raíz del estudio ACOSOG-Z0011, afirman que no se encontraron diferencias significativas en el tiempo de supervivencia libre de enfermedad entre realizar LA o no en pacientes con GC+ a los que se aplicaba radioterapia axilar13. Sin embargo, el estudio mencionado ha sufrido múltiples críticas metodológicas de cara a su aplicabilidad clínica9.
Otra opción propuesta es el uso de nomogramas que estratifiquen el riesgo de afectación axilar según las características de los pacientes y de la neoplasia. Uno de los que tiene mejores resultados, el Tenon 5, presenta una sensibilidad de 94% y una especificidad del 59% con un VPN del 97,5% y un VPP del 38%20. Estos valores son de los mejores entre todas las opciones analizadas hasta el momento10,21-26.
Alternativamente se ha postulado que el estudio molecular intraoperatorio del GC podría ser un indicador adecuado27,28. Tal como se describe en el artículo de Peg et al.29, partiendo de una carga tumoral superior a 15.000, se obtiene una sensibilidad del 77%, un VPN del 85%, un VPP del 41% y una especificidad del 55%. Estos valores no parecen suficientemente válidos para implementar dicha técnica como «gold standard».
Los resultados de nuestro estudio sobre el GS, con las limitaciones que implica el hecho de ser un estudio retrospectivo y la consecuente posibilidad de que exista un sesgo de selección, son prometedores, ya que prácticamente se equiparan con los resultados del Tenon 5 y superan al resto de las opciones.
La aplicación de esta técnica permitiría detectar gran parte de los casos en los que el GC resulta el único ganglio afecto, lo que podría evitar aproximadamente un 73% de los VAX innecesarios (68/93), con una tasa de falsos negativos algo mayor que la que tiene el GC (12 vs. 5-10%).
Además, un hecho destacable del análisis del GS es que permite, tal como se ha descrito en los resultados, detectar posibles falsos negativos del GC. Esto implica poder identificar y tratar de forma más adecuada a pacientes que, de lo contrario, estarían infratratados.
Por tanto, si se tienen en cuenta la buena sensibilidad, especificidad, VPP y VPN, el GS es una de las técnicas con mejores resultados de entre las opciones existentes y su análisis podría convertirse en una alternativa válida más precisa para el estudio del estado axilar. Es una técnica simple y segura que permitiría optimizar el tratamiento de la axila metastásica en la neoplasia de mama manteniendo los estándares de calidad.
Autoría/colaboracionesManel Cremades: análisis e interpretación de los resultados, redacción del artículo.
Mireia Torres: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados.
Montse Solà: análisis e interpretación de los resultados, redacción del artículo.
Jordi Navinés: diseño del estudio, análisis e interpretación de los resultados.
Icíar Pascual: diseño del estudio, análisis e interpretación de los resultados.
Antonio Mariscal: diseño del estudio, análisis e interpretación de los resultados.
Albert Caballero: redacción del artículo, revisión crítica y aprobación de la versión final.
Eva Castellà: diseño del estudio, análisis e interpretación de los resultados.
Miguel Ángel Luna: diseño del estudio, análisis e interpretación de los resultados.
Joan Francesc Julian: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, redacción del artículo, revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los Drs. Jaime Fernández Llamazares y David Parés por su contribución en el desarrollo del proyecto y su colaboración en su posterior publicación.