Introducción
La gastrectomía tubular (GT) es la parte restrictiva de la operación mixta que es el cruce duodenal (CD), en el que además se hace un bypass biliopancreático. Hess1,2 llevó a cabo el primer CD en marzo de 1988 (en una mujer con un índice de masa corporal [IMC] de 60 kg/m2 que, 17 años después, es de 29) y Marceau et al3 presenta la primera publicación. Rabkin et al4 hace el primer cruce duodenal laparoscópico (CDL) asistido con la mano en septiembre de 1999 y Gagner5,6 el primero totalmente laparoscópico en octubre del mismo año. Regan et al7 describen la primera gastrectomía tubular laparoscópica (GTL) como el primer estadio del CDL en pacientes superobesos (SO).
Material y método
Hemos tratado a 30 pacientes con GTL (seleccionados de un total de 791 pacientes de CD y, de ellos, 274 CDL) desde enero de 2003 hasta junio de 2005 con las siguientes indicaciones:
1. SO. Seis pacientes tenían un alto IMC, de 61 a 74 kg/m2 (65 de media) y se les llevó a cabo la GTL como primer estadio del CD. Un paciente tenía una fundoplicatura previa y el Nissen se desmontó en la operación de GTL.
2. Enfermedad médica grave e IMC > 40. Cuatro pacientes tenían cirrosis hepática (descubierta en la cirugía y luego confirmadas por biopsia); 1 con enfermedad de Crohn e IMC de 51 kg/m2 tenía ya una hemicolectomía derecha previa; 1 paciente con un IMC de 60 kg/m2 tenía el síndrome de Ardistyl (enfermedad pulmonar por fumigación venenosa), y otro con un IMC de 61 kg/2 es VIH+ sin sida.
3. IMC bajo. Dieciséis pacientes con IMC bajo, de 35 a 43 kg/m2, y al menos una comorbilidad.
4. Conversión de lap-band. Una paciente tenía una lap-band con muy mala calidad de vida y se convirtió a GTL.
Técnica
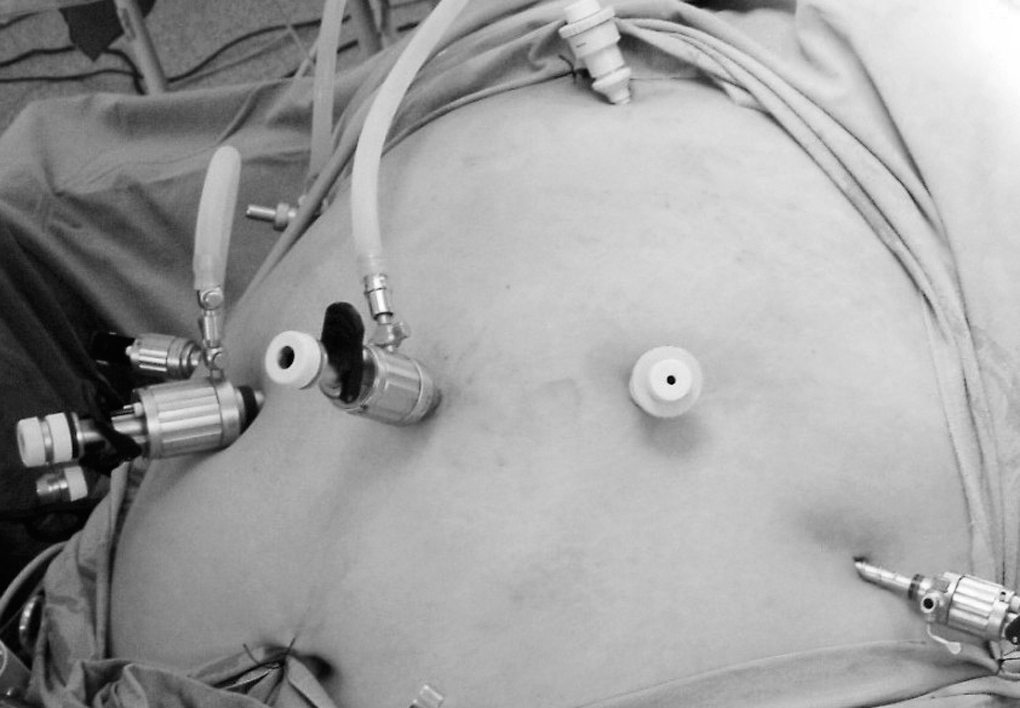
Se hace bajo anestesia general. El esquema de la operación se expone en la figura 1. Entramos con la técnica directa sin gas con un trocar de 12 mm en el lateral del recto anterior derecho en situación supraumbilical. Se utilizan otros 4 trocares de 5 mm: a) subxifoideo; b) reborde costal derecho; c) reborde costal izquierdo, y d) borde lateral del recto izquierdo y un trocar de 10 mm para la cámara en la línea media (fig. 2). Usamos bupivacaína como anestésico local en las entradas de los trocares.
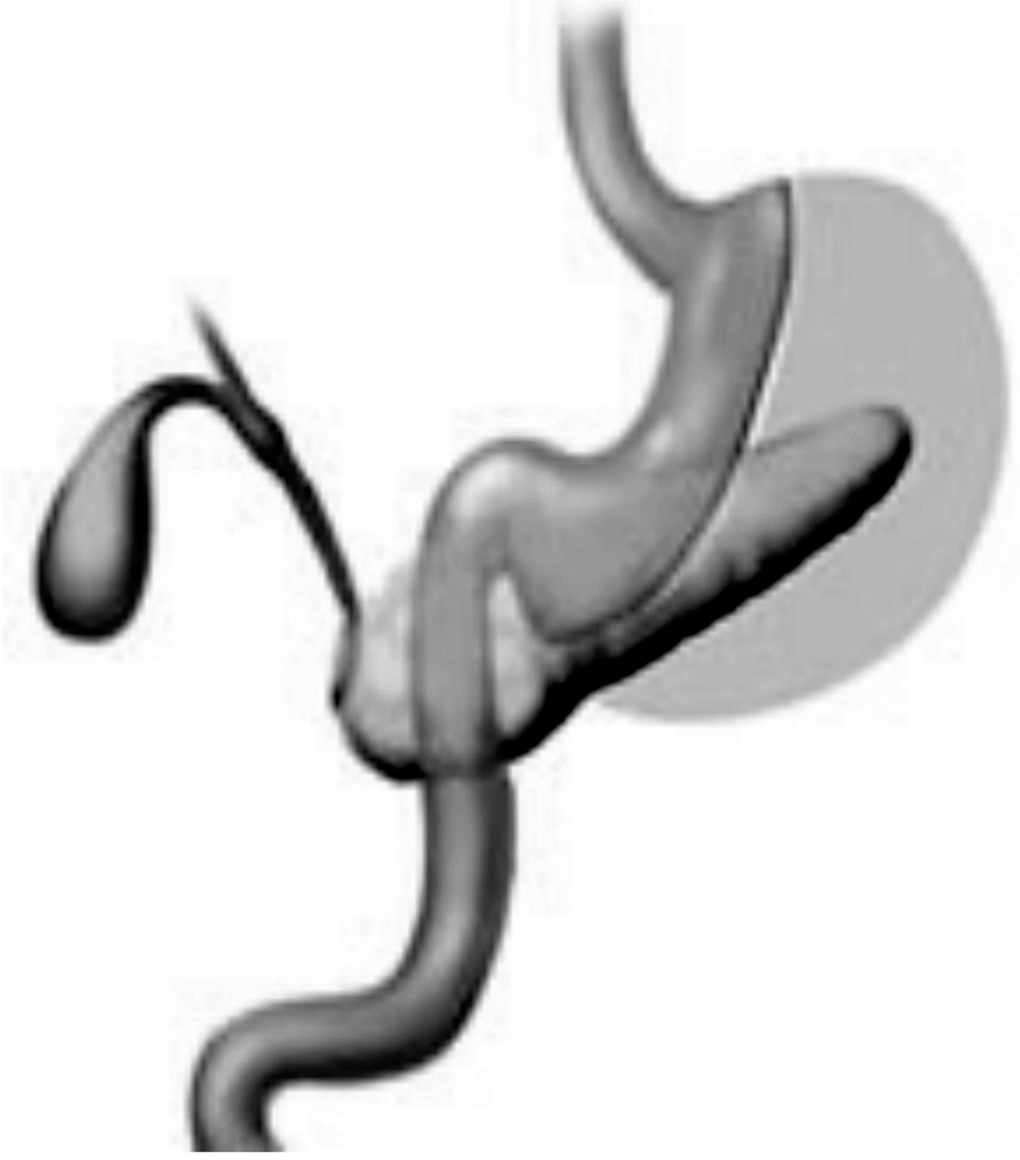
Fig. 1. Esquema de la gastrectomía tubular.
Fig. 2. Posición de los trocares.
La vascularización de toda la curvatura mayor se divide con el bisturí ultrasónico (BUS) desde el borde izquierdo del hiato hasta pasar el píloro. Hay que tener especial cuidado en el hilio esplénico, con sus vasos cortos, para evitar la hemorragia en la parte más alta y menos accesible a su control.
Se usan 2 disparos del USSC (Tyco Healthcare) de 45 mm, azules, empezando a 2 cm del píloro y muy próximos a una sonda tutora de 32 F hasta llegar a la incisura angularis, y a partir de ella, las grapas son de 60 mm (3-4) hasta alcanzar el ángulo de His. El tubo gástrico, de menos de 60 ml, se separa así del resto del 80% del estómago que se va a extirpar. Toda la línea de grapas se invierte con una sutura seroserosa de PDS desde al ángulo de His hasta la mitad y se utiliza una segunda sutura hasta el final.
Con 50 ml de azul de metileno diluido al 50% y con el duodeno ocluido se irriga el estómago hasta que se evidencia que no hay fugas.
El estómago se extrae ensanchando el orificio peritoneal y fascial del trócar de 12 mm y se retira el estómago, traccionando del antro sin el uso de una bolsa de extracción. El orificio se cierra con una sutura en "8" de Maxon® y dejamos un drenaje por un trocar de 5 mm, al menos 2 días. El tiempo operatorio medio es de 49 min (rango, 40-60) en pacientes con IMC < 60 kg/m2.
El primer día postoperatorio se descartan fugas utilizando azul de metileno oral y estudio radiológico de gastrografía; y el paciente es dado de alta el segundo día postoperatorio. Sólo se permite la toma de sorbitos de líquidos durante 2 semanas.
En cuanto a la dieta postoperatoria, es importante que los pacientes con GTL sigan una dieta estricta de 600-800 calorías a partir de la cuarta semana. Una vez que tengan el peso esperado, a los 1-2 años, la mayoría de los pacientes ingieren de 1.000 a 1.200 calorías al día.
Resultados
Para valorar el peso perdido usamos el porcentaje del sobrepeso perdido (PSP) = ([peso inicial peso actual]/sobrepeso inicial) x 100 y el porcentaje perdido del exceso de IMC (PPEIMC) = 100 ([IMC actual 25/IMC inicial 25] x 100).
1. Pacientes SO. Un varón con un IMC de 74 kg/m2 con múltiples comorbilidades murió debido a hemorragia (de menos de 400 ml) de la puerta de entrada y laparotomía. El resto de pacientes tiene un PSP del 6,1% (rango, 46-66) y un PPEIMC del 63,1% (rango, 57-72) de 4 a 27 meses.
2. Enfermedad médica grave e IMC > 40 kg/m2. El paciente con enfermedad de Crohn a los 16 meses tiene un PSP del 59,5% y un PPEIMC del 66%. La paciente con síndrome de Ardystil tiene a los 14 meses un PSP del 72,5% y un PPEIMC del 76%. El paciente VIH+ tiene a los 4 meses PSP de 33,6% y un PPEIMC del 36,8%. Los pacientes cirróticos, de 5 a 16 meses, su PSP es del 71% (rango, 64-90) y un PPEIMC del 76% (rango, 69-100) sin que en ninguno se haya agravado su enfermedad.
3. Bajo IMC. Una paciente necesitó relaparoscopia y aspiración de 400 ml por hemorragia del orificio del trocar de trabajo a pesar de haber sido cerrado. El PSP es del 62,3% (rango, 42-100) y un PPEIMC del 68,5% (rango, 58-123) a los 3-27 meses.
4. Conversión de la lap-band. La única paciente con un IMC de 28 kg/m2 sólo ha bajado a un IMC de 27 kg/m2, un PPEIMC del 13% porque su peso ya lo había perdido, pero su calidad de vida ha mejorado de forma significativa. Dos pacientes sufrieron complicaciones del trocar de trabajo con sangrado intraabdominal, 1 murió (el 3,2% de la mortalidad) y la otra necesitó relaparoscopia y lavado.
No ha habido episodios de trombosis, embolia, pulmonía o problemas respiratorios, esplenectomía, fugas, fístulas u obstrucción intestinal.
Todos los pacientes están bien en el período intermedio. Ninguno tuvo efecto secundario alguno excepto saciedad por restricción. La vitamina B12 y el ácido fólico son normales y ninguno sufre de anemia. Dos pacientes con hipertensión y diabetes no necesitan medicación.
Discusión
Hess1,2, después de 10 años de seguimiento, tiene un PSP del 7% en el 95% de sus pacientes y considera que el CD es la operación bariátrica más efectiva y que debiera ser la operación patrón, y nosotros, así como Rabkin8, estamos de acuerdo.
La idea de la GT aparece después de que fuera posible el CDL. La GTL se ha propuesto por diferentes autores como el primer paso del CDL9-12 en pacientes con IMC > 55 kg/m2 y con buenos resultados.
Estadificar permite disminuir la mortalidad y los riesgos asociados a la SO y más en sujetos varones, donde es más elevada13, pero incluso la GTL resultó en mortalidad en nuestro paciente SO, por lo que aparentemente era una hemorragia no profusa del orificio de trocar.
Para proteger la línea de sutura de hemorragias y fugas se están utilizando otros materiales (membranas polímeros, goretex, tiras de pericardio bovino, etc.) con resultados variables14-16. Nosotros utilizamos una sutura seroserosa, que invierte las grapas, controla la hemorragia en todos los casos, disminuye las fugas1, no aumenta el coste de la intervención y sólo toma 10 min.
La GTL produce pérdida de peso por restricción en la ingesta sin malabsorción. El tubo gástrico de la GTL es más pequeño que el del CDL porque, al no tener un bypass, la ganancia de peso puede ocurrir como en las gastroplastias de los años ochenta y noventa. Básicamente, la GT es una mejora de las gastroplastias, que hoy se hacen raramente, por los problemas de las fugas crónicas reservoriogástricas, y los cuerpos extraños (anillos de Silastic y mallas alrededor del estómago). En la GTL no hay cuerpo extraño como en las gastroplastias y sobre todo en las anillas ajustables.
No pensamos que la operación M&M (Magenstrasse and Mill, triturar) descrita por Johnston et al17 sea la misma que la GT. En la M&M, la Magenstrasse, el tubo es similar y se mantiene la bomba antropilórica. No hay resección gástrica y el antro (triturador) se mantiene, pero la secreción de ghrelina no se reduce y la comida puede entrar en el resto del estómago. Por otro lado, es más difícil llevarla a cabo por laparoscopia. Sin embargo, una aportación importante de Johnston et al es la observación de que la sonda ideal utilizada como fiador demostró ser de 32 F para mejorar las pérdidas de peso.
No hay consenso acerca del volumen del tubo gástrico. Gagner et al6 usan un fiador de 60 F y el tubo gástrico de 150-200 ml. Y ésta puede ser la razón por la que algunos pacientes han necesitado cirugía posterior por dilatación del tubo18.
En la GTL del Hospital Monte Sinai (Nueva York) se reseca el 60% del estómago y los pacientes consiguen un PSP de 30-50 en 6-12 meses. Lee et al10 resecan el 85% de estómago en 68 pacientes. Schauer11 usa una sonda de 48 F en sus 77 pacientes.
Tampoco hay consenso en la distancia a la que empieza la división gástrica desde el píloro. Gagner7 recomienda a 10 cm, Lee et al10 sólo a 6 cm. Nosotros iniciamos la división a 2 cm del píloro en la GTL y a 3-4 cm en el CD, porque en la GTL la restricción es el único mecanismo y en el CDL hay, además, malabsorción. Nuestro volumen gástrico es de menos de 50 ml (al irrigar ese volumen es muy frecuente que refluya hasta la boca), la ingesta es normal, tolerando las comidas en pequeña cantidad, y el vaciado es normal19,20.
La GT elimina la porción de estómago donde se produce la ghrelina, hormona que estimula el apetito. No hay síndrome de dumping porque el píloro está preservado y, con la resección gástrica, se minimiza la incidencia de úlceras pépticas. Al eliminar el bypass biliopancreático se eliminan todos sus efectos secundarios (obstrucción intestinal, osteoporosis por mala absorción del calcio, anemia, malnutrición proteínica y déficit de vitaminas liposolubles). Los pacientes muy obesos con IMC > 65 kg/m2 pueden ser operados.
La GTL es interesante también para los pacientes con alguna enfermedad médica grave, como anemia previa, los que toman antiinflamatorios, los que presentan enfermedad de Crohn u otras enfermedades en las que el CD pueda agravar su problema. Otro grupo de pacientes sin diagnóstico previo que nos podemos encontrar en la cirugía son los cirróticos; a ellos sólo se debe hacer la GTL, tomar una biopsia y confirmarlo con anatomía patológica.
En pacientes con un IMC bajo (35-43 kg/m2) los resultados tempranos son muy halagüeños, pero se necesitan resultados a largo plazo (> 5 años). Si los resultados a > 5 años se mantuviesen, ésta sería la operación ideal en vez de las anillas ajustables o no ajustables, al no utilizar material extraño, no necesitar ajustes, resecar el estómago en vez de dejarlo dentro, disminuir la producción de ghrelina y hacer que la sensación de hambre desaparezca en el obeso.
El paciente, además, tiene una segunda oportunidad de un segundo estadio, pasando al CDL si los resulta-dos de pérdida de peso no han sido suficientes sin la necesidad de que, al hacerlo por laparoscopia, haya que volver a un espacio supramesocólico, que puede ser problemático para retirar una anilla.
Hoy nos parece que la GTL es la mejor alternativa a las anillas ajustables en pacientes con un IMC bajo, precisamente aquéllos en los que las anillas tienen sus mejores indicaciones.
La GTL tiene también una buena indicación en pacientes en los que la anilla haya dado complicaciones, como poca pérdida de peso, perforación o mala calidad de vida, y en los que haya que retirarla, como en nuestra paciente cuya calidad de vida mejoró ostensiblemente.
Las desventajas de la GTL son varias. Hay que resecar el estómago y grapar la línea de sutura y, por ello, no está exenta de las complicaciones del grapado y fugas. Potencialmente, la pérdida de peso puede ser inadecuada o los pacientes pueden volver a ganar peso. Aunque esto puede ocurrir con todas las operaciones bariátricas, en teoría es más posible si no hay un bypass intestinal. Los pacientes con un alto IMC necesitarán un segundo estadio para perder el resto de su exceso de peso inicial, si éste supera un IMC > 45 kg/m2.
Al resecar el estómago, esta parte no es recuperable pero, por otro lado, la operación se puede convertir por laparoscopia a un bypass gástrico o a un CDL. Los resultados a largo plazo son hoy desconocidos, pero si un 70% de los pacientes con un IMC bajo obtuvieran un PSP > 50, ésta sería la operación ideal.
Correspondencia: Dr. A. Baltasar.
Cid, 61. 03803 Alcoy. Alicante. España.
Correo electrónico: abaltasar@seco.org; baltasar_ani@gva.es
Manuscrito recibido el 22-7-2005 y aceptado el 29-11-2005.