Introducción
Los hamartomas quísticos retrorrectales (tailgut cysts) son tumores congénitos poco frecuentes derivados de remanentes embrionarios postanales del intestino. Excluyendo las lesiones inflamatorias, los quistes relacionados con la alteración del desarrollo embrionario son la causa más común de tumores en el espacio retrorrectal e incluyen quistes epidermoides, quistes dermoides y quistes entéricos1.
La mayoría de los hamartomas quísticos son multiquísticos y aparecen como masas asintomáticas en mujeres de mediana edad. Las complicaciones más frecuentes, si no se extirpan precozmente, son infección y desarrollo de fístulas cutáneas y degeneración maligna.
El diagnóstico diferencial incluye una extensa variedad de afecciones que pueden existir en el espacio retrorrectal: teratoma quístico retrorrectal, meningocele sacro anterior, quistes ductales, leiomiosarcoma rectal, adenomucinosis extraperitoneal, linfangioma quístico, absceso piogénico, quiste neurogénico y cordoma sacro.
En este artículo presentamos 3 pacientes con hamartomas quísticos ilustrativos de las diferentes técnicas posibles para su abordaje quirúrgico. Asimismo, realizamos una revisión de su etiopatogenia, las manifestaciones clínicas, las técnicas de diagnóstico, sus complicaciones y los diagnósticos diferenciales.
Casos clínicos
Caso 1. Mujer de 37 años sin antecedentes personales ni familiares de interés, diagnosticada durante el embarazo de una tumoración retroperitoneal de características benignas, por lo que se decidió posponer el estudio y el tratamiento hasta después del parto.
En el tacto rectal se aprecia una tumoración de 6 cm a 5 cm del margen anal, que se rodea entera con el dedo, en cara lateral izquierda del recto, extrarrectal, no móvil. Asimismo, en la región perianal izquierda presenta una tumoración blanda de 4 cm ovoidea que protruye en la piel.
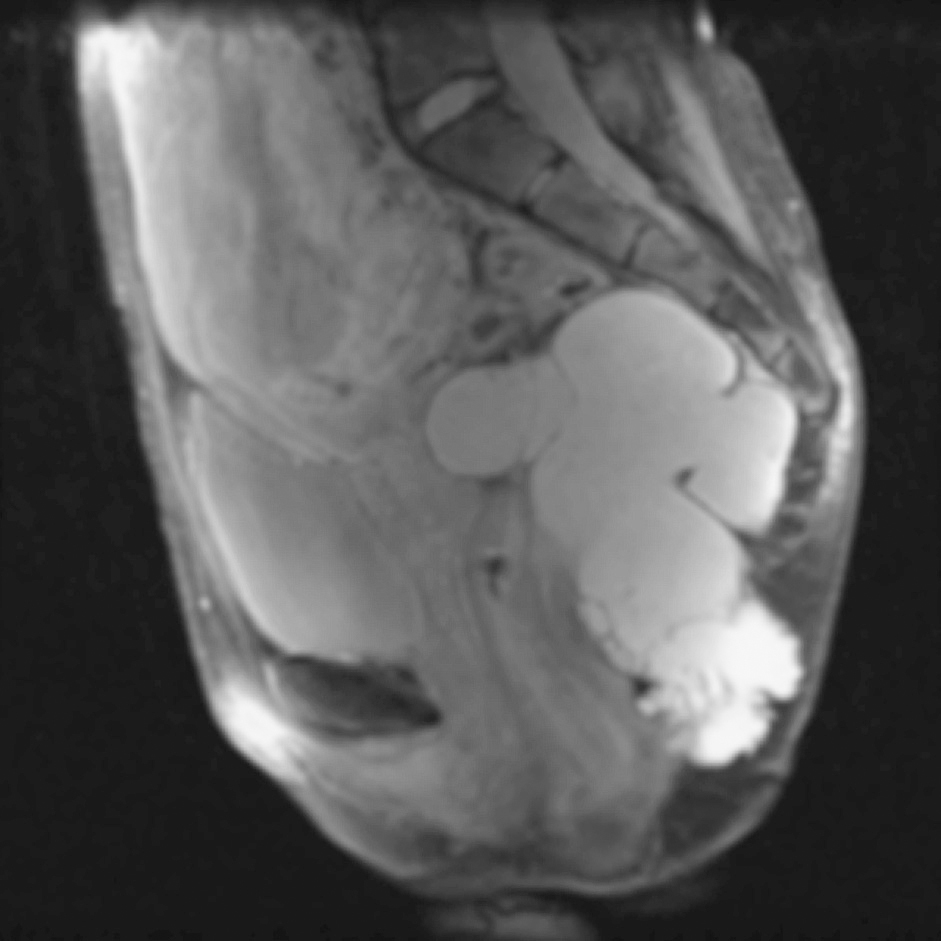
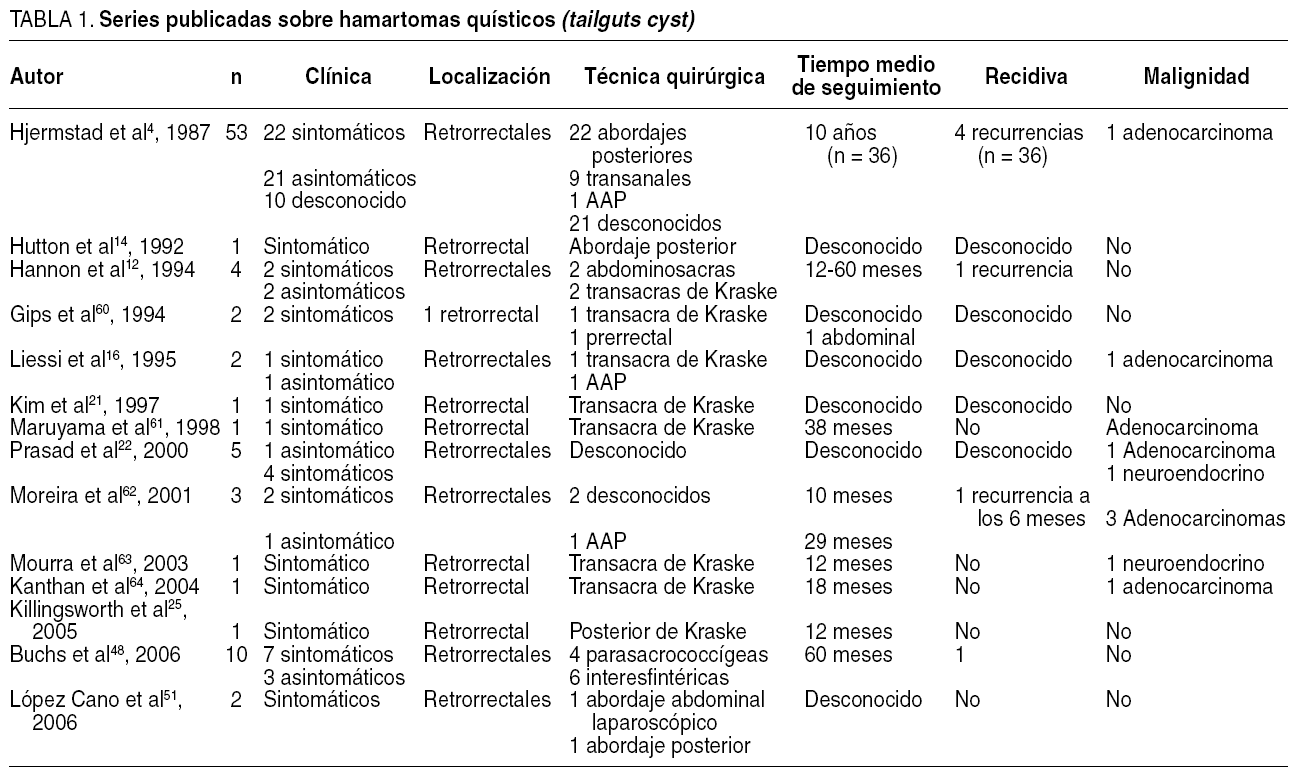
En la resonancia magnética (RM) se observa una tumoración quística presacra multiloculada de pared fina de 138 x 99 x 102 mm (fig. 1). La ecografía endorrectal muestra una tumoración extrarrectal de apariencia quística, con ecos hiperrefringentes en su interior y multitabicado en cara posterior y cara lateral izquierda, cuyo ápex está a 12 cm del margen anal y desciende hasta el periné por fuera del músculo puborrectal.
Fig. 1. Corte sagital de resonancia magnética donde se observa una gran tumoración quística presacra multiloculada de pared fina de 138 x99 x102 mm (caso 1).
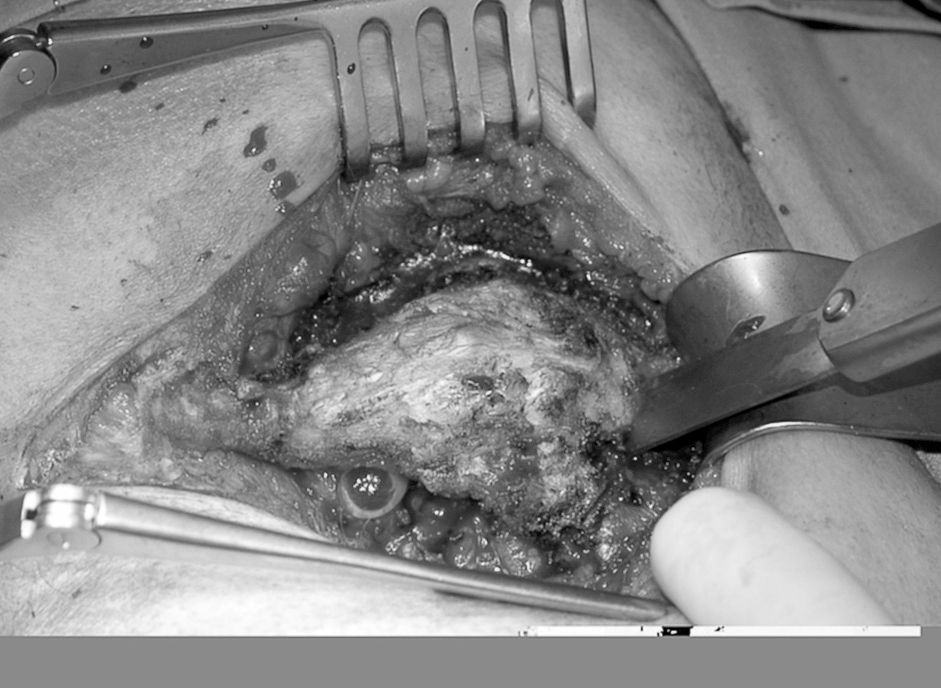
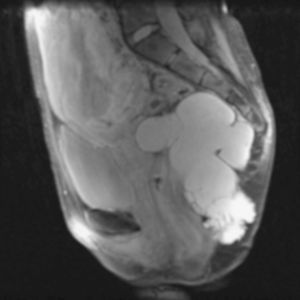
La paciente es intervenida por vía posterior con abordaje de Kraske, con la extirpación completa de la tumoración más sacrectomía distal (fig. 2). La anatomía patológica informa de hamartoma quístico retrorrectal.
Fig. 2. Abordaje de Kraske: se realiza extirpación completa de la tumoración más sacrectomía distal (caso 1).
En los 3 años de seguimiento no se ha observado recidiva.
Caso 2. Mujer de 39 años con antecedentes oncológicos familiares de primer grado (madre con cáncer de colon hereditario sin poliposis a los 43 años; prima fallecida de cáncer de colon a los 50 años; abuela con cáncer de colon a los 75 años), remitida desde Centro Nacional de Investigaciones Oncológicas para evaluación clínica, consejo genético y seguimiento. Es miembro de la familia 378 C, y se ha demostrado la mutación en el exón 15MLH1 (c1717 → 1718del GT).
Clínica al diagnóstico: asintomática. No han aparecido tumoraciones palpables ni lesiones cutáneas recientes. No hay sangrado rectal ni melenas, e inicialmente no ha perdido peso.
A la exploración física destaca, al tacto rectal, una tumoración extrínseca bien delimitada a las 7-9 h en posición genupectoral desde el canal anal hacia el recto medio que se sobrepasa con el dedo. No hay lesiones en la mucosa rectal.
En la analítica llama la atención una elevación del CA 19.9. Los demás marcadores tumorales resultaron negativos. En la ecografía endorrectal se objetiva la imagen de una masa extraluminal de unos 4 cm que llega hasta el canal anal superior con imágenes heterogéneas y quísticas en su interior sin adenopatías. Se realiza endoscopia alta y baja; no se objetiva afección, salvo la compresión extrínseca del recto inferior. En la tomografía computarizada (TC) y la RM se observa una lesión retrorrectal multiquística de 5 x 4 cm bien delimitada sin aparente infiltración de las estructuras vecinas. Se realiza core-biopsia guiada por TC y se obtiene escaso material mucoide insuficiente para determinar la estirpe histológica.
Se extirpa completamente la tumoración por vía posterior con abordaje parasacrococcígeo lateral derecho sin complicaciones durante el postoperatorio. La anatomía patológica nos confirma el diagnóstico de hamartoma quístico retrorrectal sin imágenes de atipias.
A los 6 meses, la paciente permanece asintomática. Se realiza una tomografía por emsión de positrones (PET) y TC de control sin hallazgos indicativos de tejido tumoral viable, y una analítica donde se observa una normalización del CA 19.9.
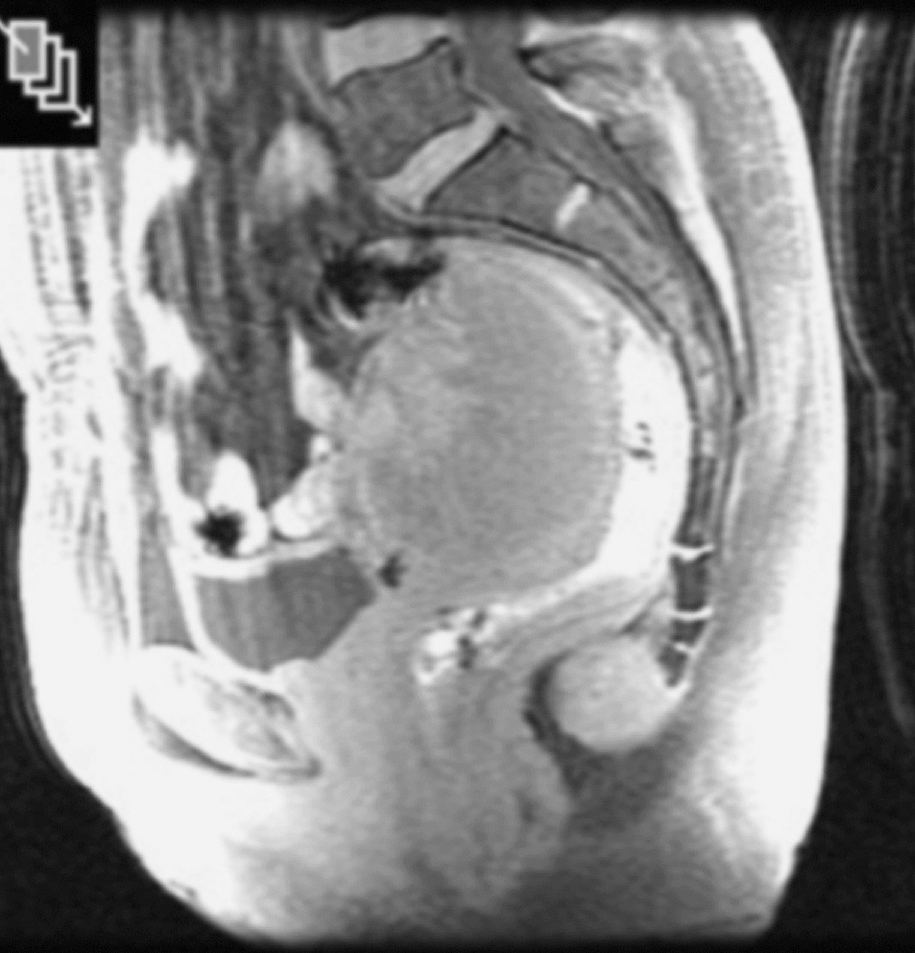
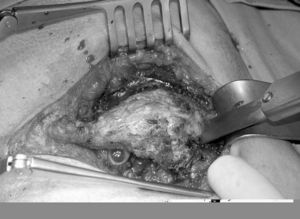
Caso 3. Mujer de 59 años sin antecedentes de interés que consulta con el servicio de ginecología por dolor hipogástrico. En la ecografía ginecológica, TC y RM (fig. 3) se observa una tumoración redondeada, de 83 x 56 x 70 mm, que ocupa el espacio de Douglas, de contorno lobulado y densidad heterogénea, predominantemente hipodensa con una pared bien definida en íntima relación con el cuerpo uterino y el recto sin claro plano graso de separación. Junto con el servicio de ginecología, se interviene a la paciente; se realiza una extirpación completa de la tumoración por vía abdominal más histerectomía y doble anerectomía. La anatomía patológica informa de hamartoma quístico. En los 2 años de seguimiento no se ha observado recidiva.
Fig. 3. Corte sagital de resonancia magnética. Tumoración de 83 x 56 x 70 mm, que ocupa el espacio de Douglas en íntima relación con el cuerpo uterino y el recto (caso 3).
Etiopatogenia
El verdadero origen del hamartoma quístico retrorrectal continúa siendo controvertido. En 1885, Middledorpf describió el primer quiste congénito presacro y postuló que su origen podría ser por remanentes embriológicos postanales del intestino2. En 1953, Hawkins et al3 introdujeron el término quiste del desarrollo para los tumores quísticos presacros secundarios a una alteración del desarrollo embrionario, atribuyendo un origen neuroentérico al hamartoma quístico.
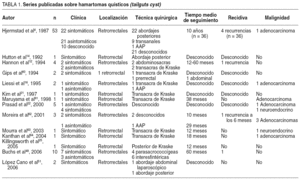
En 1988, Hjermstad et al4, con la revisión de los historiales desde 1950 a 1985 del Instituto de Patología de las Fuerzas Armadas Americanas, publicaron 53 casos de hamartomas quísticos retrorrectales, la serie más larga hasta el momento y utilizada como referencia desde entonces (tabla 1). Difieren de Hawkins y Jackman sobre su origen y postularon la teoría más aceptada en la actualidad. Hjermstad y Helwig creen que una alteración del desarrollo embrionario del extremo distal del intestino (tailgut) da lugar al hamartoma quístico retrorrectal. Durante las primeras semanas del desarrollo embrionario, el embrión posee una verdadera cola que contiene la continuación del intestino primitivo. El ano se forma a partir de una invaginación del ectodermo que se fusiona con el intestino primitivo unos centímetros por encima de su extremo distal, dando lugar a un remanente de intestino postanal con una estructura tubular linear formada por 2 a 4 líneas de epitelio cuboidal. Habitualmente, ésta involuciona hacia la octava semana del desarrollo embrionario y desaparece. Los remanentes del intestino primitivo que no regresan adecuadamente serían la causa de la formación del hamartoma quístico.
No se ha publicado ningún caso de antecedente familiar o hereditario4.
Clínica
La sintomatología de los pacientes es muy variable y está relacionada con el tamaño del quiste y el consiguiente efecto masa local y sobreinfección5,6. Se estima que el 50% de los pacientes no presentan ningún síntoma al diagnóstico, y la afección se descubre durante exámenes físicos sistemáticos o ecografías ginecológicas de control4.
El síntoma más frecuente es el estreñimiento de reciente aparición. También se ha descrito dolor pelviano, a veces relacionado con la deposición, disuria y polaquiuria debidos a la compresión local del sistema genitourinario inferior. En los quistes complicados, el primer síntoma se asocia con la presencia de una fístula perineal.
El examen físico puede demostrar una fístula crónica perineal próxima al rafe medio posterior que comunica con el quiste. El tacto rectal revelará un efecto masa en el espacio retrorrectal que comprime y desplaza la pared rectal sin infiltrarla, y se palpa la mucosa rectal íntegra.
Complicaciones
Las dos complicaciones más frecuentes asociadas a los hamartomas quísticos retrorrectales son la infección y la malignización. La primera es relativamente frecuente; se presenta hasta en el 30-50% de los pacientes. Puede manifestarse como un absceso pelviano, dolor hipogástrico y, más frecuentemente, con la aparición de una fístula perianal crónica. Se estima que el 7% de los pacientes presentan degeneración maligna7. La estirpe histológica más frecuente es el adenocarcinoma, aunque también se han descrito casos de tumor carcinoide8-11.
Diagnóstico
Debido a su localización, la mayoría de los hamartomas retrorrectales se puede diagnosticarlos como una masa palpable extraluminal al tacto rectal.
La rectoscopia permite descartar cualquier lesión endoluminal observando una lesión extrínseca que protruye hacia la luz rectal. El enema opaco no aporta información adicional, por lo que no es recomendable en la actualidad.
Estudios de imagen
Hay escasos estudios publicados sobre los hallazgos radiológicos típicos de esta afección, y en su mayoría son casos aislados.
Se debe realizar una serie radiológica simple para descartar defectos congénitos óseos y/o metástasis asociadas.
La ecografía endorrectal es de utilidad para caracterizar la lesión y determinar su naturaleza quística, así como para valorar la posible dependencia de estructuras vecinas, principalmente de la pared rectal. La imagen ecográfica característica es una lesión multiquística con ecos internos secundarios al contenido mucoso o inflamatorio12-15.
Las imágenes características de la TC corresponden a una masa retrorrectal quística multiloculada hipodensa con paredes finas y bien definida con compresión de la pared posterior rectal sin invadirla. En algunas publicaciones se han encontrado pequeñas calcificaciones en su pared; en estos casos es necesario establecer un diagnóstico diferencial con un teratoma16-18. Si hay sobreinfección y/o malignización, se observará que el margen no está bien definido de la pared quística y la invasión de estructuras vecinas.
Los hallazgos típicos en la RM se caracterizan por imágenes de baja intensidad en T1 y de alta intensidad en T2. En ocasiones puede ser hiperintenso en T1 por hemorragia intraquística19,20. Un engrosamiento focal irregular de la pared con señal intermedia en T1 y T2 que realza tras la administración de contraste intravenoso es indicativo de degeneración maligna20.
En la RM, el hamartoma quístico retrorrectal puede tener una apariencia de quiste único o multiquístico. Kim et al21 refieren que un quiste retrorrectal multilocular con septos internos en T2 es característico del hamartoma quístico. Es importante determinar la naturaleza unilocular o multilocular del quiste porque nos permitirá establecer un diagnóstico diferencial entre las posibles causas de masas presacras quísticas. Entre todas ellas, los quistes epidermoides, los quistes dermoides, los quistes de duplicación y el meningocele anterior habitualmente son uniloculares. Por el contrario, sólo el hamartoma quístico y el linfangioma quístico suelen ser multiloculares. La RM es superior a la TC para valorar las masas presacras porque permite visualizar con mayor nitidez si hay un quiste multilocular y sus relaciones con las estructuras vecinas, aspecto muy importante para planificar la cirugía.
El diagnóstico definitivo y su tratamiento requieren una extirpación completa de la tumoración. El estudio con biopsia previo a la cirugía no es aconsejable debido a la posibilidad de diseminación tumoral local a través de las finas paredes del quiste. Además, con la core-biopsia guiada por TC habitualmente no se consigue otro material que el contenido de los quistes, insuficiente para el diagnóstico histológico4,12,22,23.
Diagnóstico diferencial
El hamartoma quístico retrorrectal tiene un tamaño medio de 4 cm, aunque, como en el caso 1 que presentamos, puede alcanzar mayores dimensiones y extenderse por las paredes laterales del recto. Son lesiones bien definidas, formadas por quistes de paredes muy finas, que contienen un líquido de aspecto muy heterogéneo, que va desde el aspecto mucoide cristalino hasta el amarillo grisáceo, e incluso marrón y espeso similar a un quiste sebáceo. Microscópicamente, el 80% de los hamartomas quísticos retrorrectales son multiquísticos y pueden contener varios tipos de epitelio (escamoso, transicional, mucinoso y cuboideo secretor de mucina) en los diferentes quistes e incluso dentro del mismo quiste. El 75% de los quistes tienen epitelio escamoso que se relaciona con fenómenos de metaplasia intestinal secundaria a la presencia de sobreinfección.
A diferencia de los quistes de duplicación intestinal, los hamartomas quísticos se caracterizan por presentar fibras de músculo liso desorganizadas dentro de la pared del quiste y no contener plexos nerviosos ni doble capa muscular ni submucosa24.
La mayoría de los hamartomas quísticos se localizan en el espacio retrorrectal, pero pueden lateralizarse predominando en uno de los márgenes del recto (caso 1) e incluso abrazarlo por ambos lados. En raras ocasiones se han descrito casos aislados de situación prerrectal, como en nuestro caso 3 e incluso perirrenales25.
Las principales entidades con las que hay que hacer el diagnóstico diferencial son:
Teratoma sacrococcígeo26-28. Son tumores germinales que contienen elementos procedentes del endodermo, mesodermo y ectodermo. Son los tumores presacros más frecuentes en la edad infantil; se los diagnostica en el 90% de los casos en los neonatos y su comportamiento suele ser benigno. El riesgo de malignización se incrementa con la edad; sin embargo, son muy raros en la edad adulta. Son más frecuentes en la mujer y el 80% de los pacientes no presentan malformaciones óseas sacrococcígeas asociadas. En la TC y la RM, se caracterizan por presentar un aspecto de masa heterogénea, de pared bien definida con un contenido mixto en su interior. El 50% de ellos contienen calcificaciones y/o grasa.
Meningocele sacro anterior. Producido por la agenesia de la tabla anterior del sacro. Es una alteración congénita muy infrecuente que habitualmente no es hereditaria, aunque se han publicado casos hereditarios que forman parte del llamado síndrome de Currarino (agenesia sacra, masa presacra y estenosis anal)29,30. En el 50% de los casos se asocia a malformaciones como espina bífida, útero bicórneo y ano imperforado. La TC y la RM demuestran el defecto óseo asociado a un quiste único en el espacio retrorrectal.
Ducto anal o quiste glandular31. Son glándulas mucosecretoras formadas por epitelio escamoso, columnar y epitelio de transición. A menudo comunican con el canal anal o alguna cripta. La TC y la RM demuestran una lesión quística unilocular o multilocular próxima al esfínter anal en el espacio retrorrectal que puede incluir al cóccix y el espacio isquiorrectal.
Quistes de duplicación rectal32-34. Son muy infrecuentes, representan menos del 5% de todos los quistes del desarrollo embrionario. Se definen por tres criterios histológicos: continuidad o contigüidad con el recto, presencia de dos capas de músculo liso y una capa de mucosa intestinal que, a menudo, presenta islotes ectópicos de mucosa gástrica, tejido pancreático y/o epitelio urotelial.
Leiomiosarcoma rectal35. Los tumores del músculo liso rectales malignos son muy infrecuentes, son la causa de menos del 0,1% de los tumores malignos rectales. La mayoría de ellos ocurren en el tercio medio del recto y son más frecuentes en varones. La diseminación característica es local y hemática. En tumores de gran tamaño se produce rectorragia secundaria a la invasión de la mucosa rectal. En la TC y la RM se observa una lesión heterogénea bien delimitada con componentes necróticos en su interior.
Adenomucinosis subperitoneal pelviana36-38. Es una enfermedad muy infrecuente y los quistes están formados por epitelio cilíndrico productor de un material mucoide gelatinoso. La TC y la RM demuestran una masa homogénea quística con septos en su interior.
Linfangioma quístico pelviano39. Tumor benigno congénito de la edad infantil. Su localización más frecuente es cervical y la aparición pelviana es excepcional. Los quistes están recubiertos por endotelio y su contenido es seroso o quiloso. En la TC y la RM aparecen como un quiste multiloculado con finos septos y las complicaciones más frecuentes son la sobreinfección y la hemorragia.
Absceso piogénico retrorrectal40. Suele ser secundario al postoperatorio de una cirugía colorrectal. En caso contrario, nos debe hacer sospechar un hamartoma quístico retrorrectal abscesificado.
Tumor fibroso solitario. Son neoplasias mesenquimales raras, descritas por primera vez en la pleura en 1931, con posterior identificación en numerosas localizaciones. En el espacio retrorrectal, tan sólo se han publicado 3 casos, el último recientemente en nuestro país. La extirpación completa es el tratamiento de elección. Generalmente tienen un comportamiento benigno, pero pueden recurrir y metastatizar tras su resección41-43.
Lesiones quísticas sacras con extensión retrorrectal. Los neurilemomas son tumores benignos derivados de la mielina de los nervios periféricos sacros. La TC y la RM muestran un tumor bien definido, heterogéneo y con áreas de necrosis44. El cordoma sacro es el tumor primario sacro más frecuente. Es un tumor maligno de bajo grado que procede de remanentes de la notocorda embrionaria. Las imágenes de TC y RM suelen mostrar una lesión heterogénea que afecta al sacro y partes blandas28.
Tratamiento
El espacio retrorrectal, también llamado espacio presacro, está limitado posteriormente por la pared anterior del sacro, la reflexión peritoneal pelviana conforma su límite superior (a nivel de la segunda y la tercera vértebras sacras); en su cara anterior, por la pared posterior del recto, y en su límite inferior, por el elevador del ano. Los uréteres y vasos ilíacos forman los márgenes laterales.
Los hamartomas quísticos se caracterizan por su situación muy distal en este espacio, y habitualmente en su margen inferior están en íntima relación con el elevador y la parte superior de los esfínteres del ano. Aunque no tienen carácter invasivo, salvo cuando se malignizan, la disección roma no resulta muy útil, ya que el tumor está recubierto por una fina capa de músculo liso, con márgenes mal definidos y en íntimo contacto con la pared posterior rectal y su disección resulta tediosa y complicada al no haber planos de clivaje adecuados. Además, las paredes de los quistes son muy finas, se abren con facilidad y dificultan la identificación del plano anatómico de separación de la pared rectal, aun con una correcta exposición. En este punto, resulta de gran utilidad realizar un tacto rectal durante la disección para evitar la extirpación de la pared muscular del recto o su apertura innecesaria que, al nivel de los elevadores, puede ser una complicación grave. Debido a esta característica y a que es necesario garantizar la extirpación completa para prevenir la recidiva, la infección y la potencial malignización de la lesión, es imprescindible lograr una exposición lo más completa posible del recto distal.
Vía de abordaje laterosacra o parasacrococcígea
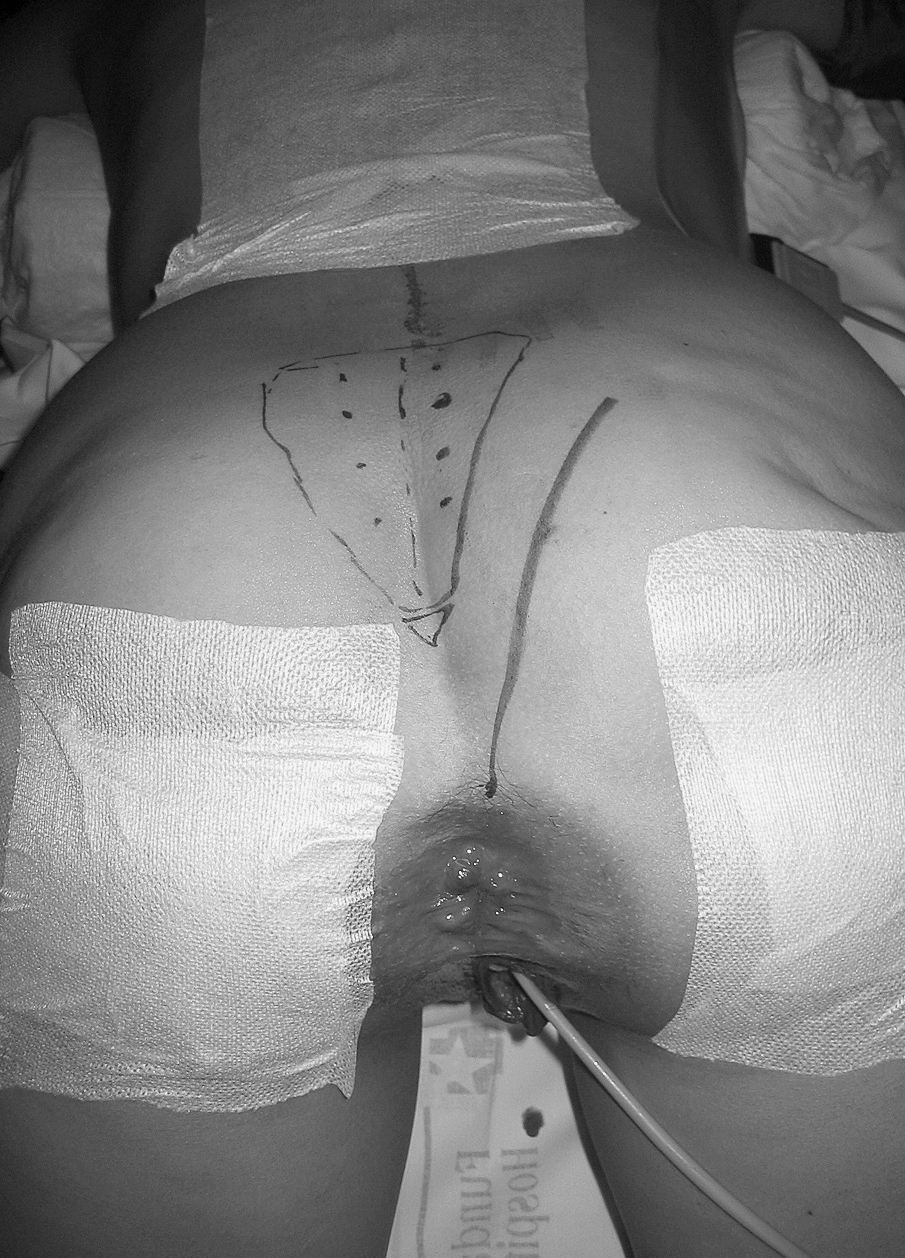
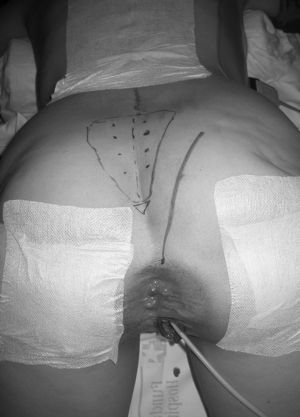
En nuestra opinión, la vía de abordaje recomendada es la parasacrococcígea (fig. 4) con el paciente en decúbito prono (posición en navaja). Esta vía posterior, basada en la vía transesfintérica de York Mason, se lleva a cabo con una incisión que, desde 3 cm por encima del margen anal, se prolonga por el margen derecho o izquierdo del sacro hasta las fibras inferiores del músculo glúteo mayor, dependiendo del lado en que predomine el tumor. Es esencial una exploración manual muy cuidadosa con el paciente dormido y en posición en la mesa quirúrgica que complemente la información obtenida en la RM.
Fig. 4. Vía de abordaje parasacrococcígea con el paciente en decúbito prono (jack-nife). Incisión desde 3 cm por encima del margen anal que se prolonga por el margen sacro lateral (caso 2).
A diferencia de la vía transesfintérica de York Mason, popularizada en 1970 para el tratamiento de los cánceres de recto medio e inferior45,46 (aunque ya había sido publicada por Bevan en 1917 "para el tratamiento de pequeños tumores de recto sin invasión local")47, la vía laterosacra respeta íntegramente el aparato esfintérico del ano al mismo tiempo que proporciona una excelente exposición del segmento anorrectal. Si es necesario, puede ampliarse en los tumores grandes resecando el cóccix e incluso alguna de las últimas vértebras sacras, como en el primer caso que presentamos. Aunque la amplitud del campo que proporciona este abordaje es generalmente suficiente, en algún caso podría ser necesario recurrir a un abordaje combinado abdominosacro para un mayor control de estructuras anteriores como los uréteres o los vasos hipogástricos. Buchs et al48 recientemente han publicado su serie de 8 pacientes intervenidos de tumoraciones retrorrectales (4 hamartomas quísticos, 3 teratomas y 1 schwannoma) con este abordaje sin presentar ninguna complicación local ni incontinencia. Recomiendan la posición de litotomía por tener mejor acceso en caso de un accidente vascular.
Aunque la vía transenfintérica de York Mason también se ha utilizado para tratar estos tumores, la necesidad de seccionar el ligamento ano-coccígeo, el plano de los elevadores y también los esfínteres anales externo e interno da lugar a una tasa de infecciones considerable y de incontinencia inaceptable por muy cuidadosamente que se reconstruya el aparato esfinteriano.
Vías de abordaje perineal
Resección interesfintérica. Procedimiento novedoso introducido por Pescatori et al49 en el 2005. Este tipo de abordaje utiliza el plano avascular entre ambos esfínteres del ano. Con el paciente en litotomía, se realiza una incisión perianal radial o en "V" (dependiendo de la extensión de la tumoración) entre el esfínter anal interno y el externo. Se separa el canal anal, junto con el esfínter interno, del esfínter externo con disección roma hasta llegar al sling puborrectal. La disección se progresa, posteriormente, hacia el espacio retrorrectal. En caso necesario se secciona la fascia de Waldeyer para exponer el borde superior del elevador del ano. Recientemente Buch et al48 han publicado su experiencia en esta vía en 8 pacientes intervenidos por tumoraciones retrorrectales (6 hamartomas quísticos, 1 quiste dermoide y 1 leiomioma) con excelentes resultados. Reservan este abordaje para tumores de pequeño tamaño, muy bajos y benignos; en los demás casos recurren a la vía parasacrococcígea. Como ventajas, señalan la ausencia de incontinencia porque se preserva la función de los esfínteres, la imposibilidad de lesión nerviosa sacra y la ausencia de retención urinaria postoperatoria.
Aunque no tenemos ninguna experiencia con esta vía, no creemos que pueda proporcionar más seguridad ni mejor exposición que la vía laterosacra. Quizá pueda ser útil en caso de tumores benignos muy pequeños y distales.
Abordaje perineal anterior y/o transvaginal. Algunos tumores prerrectales, localizados entre recto y vagina, se puede abordarlos a través de una incisión transversa o longitudinal en rafe medio anterior, similar a la utilizada para el tratamiento de los rectoceles, con el paciente en litotomía. Esta incisión puede ampliarse seccionando la pared posterior de la vagina, con lo que se obtiene una excelente exposición del espacio prerrectal50. Esta situación no es la más habitual en los hamartomas quísticos, tal como se ha comentado anteriormente.
Abordaje abdominal
Debido a su localización muy distal, no se puede abordar la mayoría de los hamartomas quísticos exclusivamente por esta vía con garantías. Incluso en aquellos de gran tamaño y que crecen más proximalmente, su margen inferior, íntimamente adherido a los esfínteres del ano, y sus prolongaciones anteriores (caso 1) dificultan o imposibilitan su extirpación por esta vía. La capacidad de la laparoscopia para abordar el recto muy distalmente permite pensar en la posibilidad de utilizarla en casos seleccionados, como recientemente se ha realizado en nuestro país51.
El abordaje abdominal estaría indicado en los tumores grandes que superan el promontorio sacro (caso 3). Su utilización sería obligada en los hamartomas quísticos en que por tamaño o malignidad sea necesario un mejor control de las estructuras vasculares y los uréteres. En estos casos puede optarse por una de las variantes de la vía combinada abdominosacra utilizada por Kraske en 1884 en el XIV Congreso de la Asociación de Cirujanos de Alemania para la extirpación de un tumor rectal52, 9 años después de que Theodor Kocher realizara la primera resección sacrococcígea53.
En los años sesenta, Donaldson et al54, Localio et al55 y Marks et al56 sentaron las bases de esta técnica para el tratamiento de los tumores rectales de tercio medio e inferior. En la actualidad, hay numerosos grupos que utilizan esta técnica o sus variantes para el tratamiento de tumores rectales localmente avanzados hacia el espacio presacro57-59, aunque creemos que su aplicación en los hamartomas quísticos no debe superar la esfera de lo anecdótico.
Seguimiento
La posibilidad de recidiva local se ha relacionado con la extirpación parcial de la tumoración, la cirugía previa o el carácter maligno de la tumoración. Los casos de recidiva publicados se han producido en los primeros 5 años desde la primera cirugía.
Correspondencia: Dr. D. Vega Menéndez.
Servicio de Cirugía General y del Aparato Digestivo. Fundación Hospital Alcorcón.
Budapest, 1. 28922 Alcorcón. Madrid. España.
Correo electrónico: dvega@fhalcorcon.es
Manuscrito recibido el 24-1-2007 y aceptado el 25-6-2007.