La hiperhidrosis primaria (HP) es un exceso de sudoración sin causa aparente. La HP es más frecuente en mujeres y en palmas, plantas y axilas. Los tratamientos médicos no son efectivos. La cirugía consiste en eliminar/desconectar los ganglios simpáticos T2 (HP craneofacial y rubor facial), T3 (HP palmar) y T3–T4 (HP axilar). Las técnicas quirúrgicas son la resección/transección, la ablación mediante electrocoagulación, la neuropresión con clip y la radiofrecuencia, fundamentalmente. La anhidrosis se consigue en el 95% de los pacientes. Menos del 5% presenta complicaciones y estas son menores. El efecto secundario más temido es la sudoración refleja, que se presenta en un 48% de los pacientes. La sudoración refleja es más frecuente en espalda, tórax y abdomen y aparece independientemente de la técnica utilizada. Un 90% de los pacientes están muy satisfechos tras la cirugía. Actualmente, la cirugía del simpático torácico es el gold estándar para la HP.
Primary hyperhidrosis-PH is an excessive sweating without known etiology. The PH is more frequent in women and in palms, soles and axillae. Medical treatment is not effective. The objective of the surgery is to remove or to disconnect sympathetic ganglia T2 (craniofacial PH or facial blushing), T3 (palmar PH) and T3–T4 (axillary PH). The surgical techniques are mainly resection/transection, ablation with electrocoagulation, sympathetic block by clipping and radiofrequency. Anhidrosis is achieved in 95% of the patients. The overall rate of complications is less than 5% and these are minor complications. The most important unwanted effect is reflex sweating, presented in 48% of the patients. Reflex sweating is more frequent in back, thorax and abdomen and it appears independently of the surgical technique. Ninety percent of the patients are very satisfied after surgery. Nowadays, thoracic sympathetic surgery is the gold standard for primary hyperhidrosis.
En condiciones normales, el sudor se produce de forma imperceptible para el individuo, estimándose unas pérdidas diarias por transpiración de 8 a 15mcl×cm2/min−1. Estas pérdidas de agua y electrolitos se llevan a cabo de forma activa mediante las glándulas sudoríparas ecrinas, las cuales están dispersas por todo el cuerpo (1,6–4×106gl) y en mayor densidad a nivel de la piel de las manos, axilas, y plantas de los pies (600–700gl×cm2).
La activación de las glándulas sudoríparas obedece a múltiples y variados estímulos (emociones, ejercicio físico, calor, fiebre, ansiedad), que son modulados por vía neurovegetativa, participando de forma específica el sistema simpático pero curiosamente a través de neurotransmisores y receptores colinérgicos.
Cuando este equilibrio se pierde de forma inexplicable, puede aparecer un exceso de sudoración superior al fisiológico conocido como hiperhidrosis primaria (HP), sin que exista una causa aparente que lo justifique. Este trastorno clínico que aparece en la primera infancia1 y se prolonga el resto de la vida, tiene un fondo hereditario con penetrancia variable no ligada al sexo en el 49% de los casos2, no pudiéndose atribuir una causa concreta en el resto, si bien la mayoría de autores coinciden en que el mecanismo de acción intermedio es una hiperactividad neurovegetativa mediada por vía simpática3–5.
Por otra parte, existe la hiperhidrosis secundaria, que está asociada a algún tipo de patología, ya sean infecciones, hipertiroidismo, feocromocitoma, tumor carcinoide, cardiopatía, obesidad, lesión estructural del sistema nervioso autónomo, tumores cerebrales, vasculopatías periféricas (síndrome de Raynaud, eritromelalgia, acrocianosis, etc.), ictus o enfermedades de la médula espinal. Dentro de la hiperhidrosis secundaria, hay que tener en cuenta que la menopausia también se puede asociar a exceso de sudoración.
Material y métodosPara confeccionar esta revisión hemos realizado una búsqueda exhaustiva en la literatura utilizando las bases de datos accesibles a través de la red. Hemos utilizado PubMed/Medline (http://www.pubmed.com): por una parte con búsqueda libre introduciendo las palabras «thoracic sympathectomy», «thoracic sympathicolysis», «primary hiperhidrosis», «compensatory sweating», «compensatory hiperhidrosis», «reflex sweating». Por otra parte, usando la base de datos MeSH introduciendo las palabras clave «hyperhidrosis/surgery OR sympathectomy/adverse effects». También se ha realizado búsqueda en la base de datos Cochrane (The Cochrane Library, http://www.wiley.com/cochrane). Para confeccionar la revisión hemos escogido las referencias más relevantes, además de tener en cuenta la experiencia de nuestro grupo.
Perfil clínico de la hiperhidrosis primariaLa incidencia6 es del 0,6–4% de la población, siendo 20 veces mayor en los japoneses que en caucasianos. La HP es más frecuente en mujeres y suele ser bilateral y simétrica7. La localización más frecuente de la hiperhidrosis es en palmas, plantas y axilas (30%), aunque también es frecuente la asociación de hiperhidrosis palmar y plantar (20%), palmar y axilar (15%) o únicamente palmar (29%). Hay que tener en cuenta también la hiperhidrosis craneal y facial (2,5%).
Aparte del sudor excesivo, y socialmente inconveniente, suelen asociarse8 palpitaciones, temblor intencional, epigastralgia, rubor facial y cefalalgia. Todo este cortejo sindrómico ocasiona ansiedad en mayor o menor grado, hasta el punto que no se puede asegurar si esta es causa o consecuencia. Esta situación presenta una repercusión negativa sobre las relaciones laborales y sociales7. Estas repercusiones negativas impulsarán al paciente a buscar un tratamiento, hasta llegar a la cirugía.
El diagnóstico de HP es clínico. Las pruebas de laboratorio habituales pueden ayudar a descartar patologías que producen hiperhidrosis secundaria.
Tratamiento médicoAl no existir una causa definida, el tratamiento es sintomático9:
Medidas higiénicas: polvos absorbentes, calcetines y ropa de algodón o lana, zapatos de piel, evitar el caucho y los materiales sintéticos, etc.
Agentes tópicos: de entrada suelen ser efectivos, como el hexacloruro de aluminio 2%, que es eficaz en 12–64% de los casos, mientras que el glutaraldehido 10%, el ácido tánico 2–5% o el permanganato potásico palían el sudor hasta el 25%. Tienen el inconveniente de generar obstrucción glandular e incluso atrofia, con la consiguiente irritación de la piel, coloración parda, sensibilización e incluso efecto rebote. Habitualmente, la eficacia del tratamiento va disminuyendo a medio plazo.
Anticolinérgicos sistémicos: su eficacia es temporal y, en cambio, tienen muchos efectos indeseables que desaconsejan su utilización, como: visión borrosa, sequedad ocular (xerostomia), sequedad bucal y vaginal y retención urinaria.
Iontoforesis: consiste en la electrocoagulación de las glándulas ecrinas mediante aplicación directa de corriente galvánica de 15–30mA, en sesiones de 20min, con frecuencia de unas 3 veces/semana. Se puede añadir al agua una asociación de anticolinérgicos, del tipo de metilsulfato de poldina, o bromuro de glucopirronio. Si bien es un procedimiento eficaz, crea una gran dependencia al paciente, que a menudo opta por abandonar su aplicación.
Toxina botulínica: la toxina botulínica tipo A es una neurotoxina que logra una mejoría temporal de la hiperhidrosis. Se administra de forma intradérmica en la zona de la hiperhidrosis en forma de varias inyecciones con una separación de 1–2cm. Debe repetirse el procedimiento cada 4–17 meses. Donde ha mostrado mayor eficacia es en la axila.
Psicoterapia o técnicas de biofeedback: son de efecto limitado, prolongadas en el tiempo, que requieren dedicación y constancia excesivas, con unos resultados de momento inciertos.
Un 78% de los pacientes han realizado algún tratamiento antes de la cirugía, sin éxito. Ante este panorama deplorable, los pacientes reclaman una solución a su trastorno y la cirugía de simpaticólisis torácica responde a sus demandas.
Cirugía del simpático torácicoLa cirugía del simpático torácico está indicada en la hiperhidrosis palmar, axilar y craneal y facial. Esta técnica también está indicada en trastornos vasculares como el rubor facial, el síndrome de Raynaud, la arteriopatía obstructiva periférica o la enfermedad de Buerger. La denervación simpática también se ha utilizado con éxito en algunos trastornos del ritmo cardíaco, como el síndrome del QT largo o la taquicardia ventricular polimorfa catecolaminérgica. En esta revisión nos centraremos en el tratamiento de la hiperhidrosis.
Recuerdo anatómico: cuando se explora la cavidad pleural por toracoscopia, el músculo más apical que se ve en la región posterolateral es el primer músculo intercostal íntimo con su inserción en la segunda costilla. El tronco simpático torácico se encuentra descansando sobre las cabezas costales, que están posteriores a la pleura parietal; los ganglios simpáticos torácicos que nos interesan se sitúan a nivel de los espacios intercostales y no sobre el arco costal. Los dermatomas simpáticos se solapan y son de difícil sistematización. No obstante, podemos decir que el ganglio simpático T2 está implicado en la inervación simpática de cabeza, cuello y extremidad superior. El ganglio simpático T3 está implicado en la inervación de extremidad superior y tercio superior de la axila y el ganglio simpático T4 inerva el tercio inferior de la axila y la extremidad superior. Existen proyecciones simpáticas de las extremidades superiores al ganglio cervicomediastínico–estrellado– y al ganglio cervical medio. Por otra parte, existen proyecciones simpáticas de las extremidades superiores incorporadas al plexo braquial. Esto explicará parte de algunos efectos secundarios10,11.
Técnica quirúrgica: para la HP, se intervienen ambos lados de forma secuencial mediante cirugía toracoscópica bajo anestesia general con intubación bronquial selectiva. Aunque existen algunas variantes técnicas, la más utilizada sitúa al paciente en decúbito supino, incorporado o sentado 25°, con abducción de las extremidades superiores y en ligera flexión de los antebrazos. La mesa de quirófano se lateraliza unos 10° hacia el hemitórax contrario al intervenido. A nivel del tercer espacio intercostal línea axilar media se realiza un portal para introducir un toracoscopio de 5 o 10mm7. Si no se dispone de un toracoscopio con canal para instrumental, es necesario realizar 2 portales. Si se realiza simpatectomía, en ocasiones, es necesario realizar hasta 3 portales.
La finalidad del método es eliminar/desconectar de forma total o parcial los ganglios simpáticos torácicos T2 (HP craneofacial y también rubor facial)12, T3 (HP palmar), T3-T4 (HP axilar)13, mediante aplicación de distintos sistemas: electrocoagulación monopolar14, bipolar, bisturí armónico15, neuropresión con clip16 o radiofrecuencia17, fundamentalmente. Desconectar un ganglio implica actuar como fuere sobre el tronco simpático a nivel de la costilla superior e inferior al espacio intercostal, donde se encuentra el ganglio. En este sentido, entendemos por simpatectomía la exéresis de un fragmento de tronco simpático, por transección se pretende la sección del nervio o tronco simpático, mientras que la simpaticólisis o ablación implica eliminar directamente el ganglio simpático. Asimismo, para una efectividad máxima de la cirugía, hay que eliminar posibles conexiones simpáticas accesorias o ramos comunicantes adicionales con los nervios intercostales (anteriormente llamados nervios de Kuntz, presentes en aproximadamente un 10% de los pacientes). Puede dejarse o no drenaje pleural, aunque es recomendable dejar un catéter de 10Fr conectado a un sistema de sellado habitual para evacuar completamente el neumotórax quirúrgico. Una vez comprobada la ausencia de neumotórax o derrame pleural, se puede retirar el drenaje a los pocos minutos u horas de la intervención. La estancia media postoperatoria es de 17h e, incluso, se puede llevar a cabo en régimen de cirugía mayor ambulatoria7.
Edad para la cirugía: la mayoría de los pacientes se interviene entre los 20–30 años. El mejor intervalo de edad para la cirugía es de los 18 a los 45 años. En los pacientes menores de 18 años se evaluará el estado del desarrollo corporal para indicar la cirugía; en los mayores de 45 años se seleccionarán cuidadosamente los casos, sobre todo en mujeres con climaterio o próximas a la menopausia.
Resultados generales: exceptuando algún caso de mortalidad aislada18, todas las series19–21 aportan una mortalidad nula con una morbilidad que no excede el 5%. El neumotórax es la complicación más frecuente (2% de los pacientes; del total de neumotórax, solo un 25–30% precisan drenaje torácico), seguida del enfisema subcutáneo 1% y derrame pleural 0,3–0,5%, este último muy pocas veces es tributario de drenaje22. Complicaciones como el quilotórax, el hemopericardio, la lesión de la vena intercostal superior, el edema pulmonar o la afectación del plexo braquial se reportan como casos aislados en la literatura. Se ha demostrado en la literatura que la simpaticólisis produce menos morbilidad y mejor tolerancia a largo plazo respecto a la simpatectomía.
El dolor postoperatorio a menos de un mes se registra en el 80% con un índice de incapacidad laboral transitoria del 2%. Entre el primer y el segundo mes, solo el 13% presentan dolor y, de forma excepcional, se registran casos con dolor neuropático prolongado que precisan tratamiento con gabapentina (0,25%).
Resultados sobre el sudor: a largo plazo7,23 la anhidrosis se obtiene en el 92–98%, hipohidrosis en 2,4–7%, con un fracaso de la técnica del 0,2–2% (3,4–5% utilizando neuropresión con clip). Los mejores resultados de la simpatectomía y la simpaticólisis se han obtenido para la hiperhidrosis palmar, seguida de la hiperhidrosis axilar y, finalmente, la craneofacial.
La recidiva de la hiperhidrosis tras la cirugía se ha documentado de un 1–2% de los pacientes y es más frecuente en la hiperhidrosis axilar. La reintervención en la persistencia o recidiva de la hiperhidrosis palmar presenta buenos resultados24.
Paradójicamente, se ha documentado a nivel de las plantas de los pies anhidrosis en el 30,3% de los pacientes e hipohidrosis en el 20,7%25 tras la simpaticólisis.
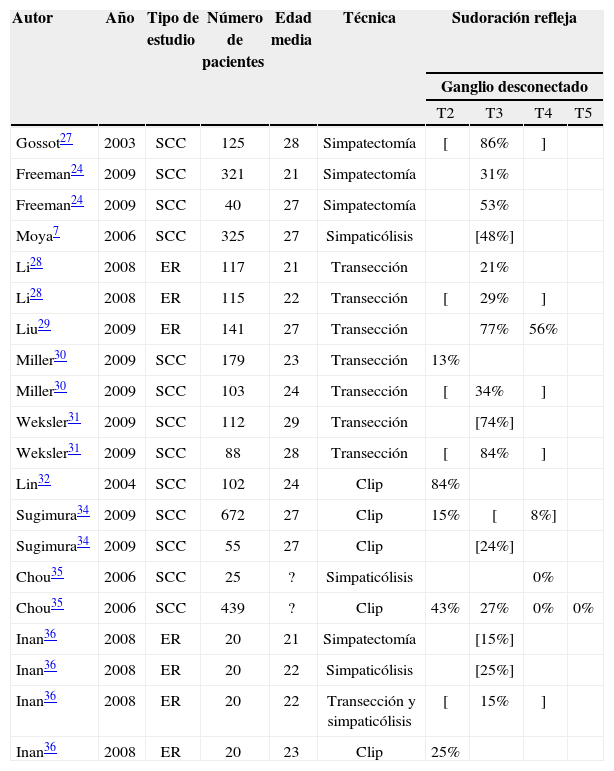
Consecuencias: la más frecuente y preocupante es la sudoración refleja o compensatoria (tabla 1), que presentan aproximadamente el 48% de los pacientes7,26, afectando sobre todo a la espalda, al abdomen y a la región anterior del tórax7,24,27–36. Esta sudoración no está relacionada con situaciones de estrés o ansiedad como en la HP, si no con la temperatura ambiental o el esfuerzo físico. Aparece poco después de la intervención quirúrgica y se manifiesta de forma leve en el 61%, moderada en un 31% y severa en un 8% de los pacientes con sudoración refleja27.
Sudoración refleja según ganglio desconectado/eliminado y técnica utilizada
| Autor | Año | Tipo de estudio | Número de pacientes | Edad media | Técnica | Sudoración refleja | |||
| Ganglio desconectado | |||||||||
| T2 | T3 | T4 | T5 | ||||||
| Gossot27 | 2003 | SCC | 125 | 28 | Simpatectomía | [ | 86% | ] | |
| Freeman24 | 2009 | SCC | 321 | 21 | Simpatectomía | 31% | |||
| Freeman24 | 2009 | SCC | 40 | 27 | Simpatectomía | 53% | |||
| Moya7 | 2006 | SCC | 325 | 27 | Simpaticólisis | [48%] | |||
| Li28 | 2008 | ER | 117 | 21 | Transección | 21% | |||
| Li28 | 2008 | ER | 115 | 22 | Transección | [ | 29% | ] | |
| Liu29 | 2009 | ER | 141 | 27 | Transección | 77% | 56% | ||
| Miller30 | 2009 | SCC | 179 | 23 | Transección | 13% | |||
| Miller30 | 2009 | SCC | 103 | 24 | Transección | [ | 34% | ] | |
| Weksler31 | 2009 | SCC | 112 | 29 | Transección | [74%] | |||
| Weksler31 | 2009 | SCC | 88 | 28 | Transección | [ | 84% | ] | |
| Lin32 | 2004 | SCC | 102 | 24 | Clip | 84% | |||
| Sugimura34 | 2009 | SCC | 672 | 27 | Clip | 15% | [ | 8%] | |
| Sugimura34 | 2009 | SCC | 55 | 27 | Clip | [24%] | |||
| Chou35 | 2006 | SCC | 25 | ? | Simpaticólisis | 0% | |||
| Chou35 | 2006 | SCC | 439 | ? | Clip | 43% | 27% | 0% | 0% |
| Inan36 | 2008 | ER | 20 | 21 | Simpatectomía | [15%] | |||
| Inan36 | 2008 | ER | 20 | 22 | Simpaticólisis | [25%] | |||
| Inan36 | 2008 | ER | 20 | 22 | Transección y simpaticólisis | [ | 15% | ] | |
| Inan36 | 2008 | ER | 20 | 23 | Clip | 25% | |||
ER: estudio analítico experimental randomizado; SCC: estudio observacional serie de casos clínicos.
El análisis de la literatura pone de manifiesto la poca homogeneidad en las técnicas quirúrgicas utilizadas y los niveles desconectados. Por otra parte, en ocasiones los resultados obtenidos en cuanto a la sudoración refleja son dispares, siendo difícil extraer conclusiones. No obstante, parece que la aparición de sudoración refleja es independiente de la técnica utilizada para la interrupción del tronco simpático (tabla 1). Diversos estudios han apoyado el uso de neuropresión con clips sobre el tronco simpático torácico como método para la resolución de la hiperhidrosis. La teórica ventaja de este método es la reversibilidad. La retirada de los clips en una segunda cirugía serviría para reducir la sudoración refleja en caso que fuera severa y mal tolerada. Esta segunda cirugía se realiza usando los mismos portales de la cirugía previa.
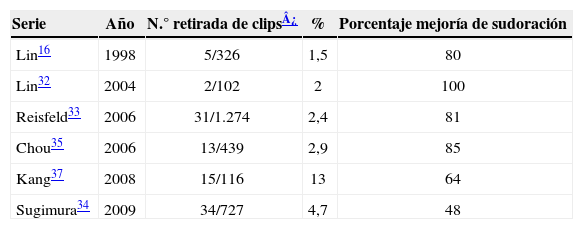
Las series que reportan mejoría de la sudoración refleja tras la retirada de los clips presentan una disminución de la sudoración refleja en aproximadamente el 60% de los pacientes35,37 (tabla 2). No obstante, en el análisis de estos resultados hay que tener en cuenta que las series reportan pocos casos donde se hayan retirado los clips, la mayoría no superan los 20 casos. Además, el seguimiento hasta la fecha es corto. En las series no existe acuerdo en el momento de retirar el clip ni uniformidad en el momento en el que la sudoración refleja mejora. El nivel de evidencia experimental al respecto es bajo, llegando a obtenerse regeneración nerviosa tras simpaticotomía en el 41% de los casos y no antes de 180 días38, lo cual no se correlaciona con los resultados clínicos presentados por algunos autores que defienden la técnica del clipping.
En esta búsqueda de minimizar el porcentaje de pacientes con sudoración refleja severa, Miller et al39 proponen un bloqueo anestésico (bupivacaína, Marcaína®) transitorio del ganglio o ganglios simpáticos a desconectar, para que el paciente evalúe el resultado sobre su hiperhidrosis y la posible sudoración refleja. Si el resultado le satisface, se procede en un segundo tiempo a la cirugía definitiva.
Otro aspecto analizado en relación con la técnica quirúrgica es la aparición de sudoración refleja en función del ganglio y el número de ganglios desconectados. Algunos autores describen menor porcentaje de sudoración refleja si la cirugía se realiza sobre ganglios más bajos (T3–T4)29,33–35. El análisis de la literatura no deja claro si un mayor número de ganglios eliminados está relacionado con más sudoración refleja; no obstante, los últimos estudios indican que hay menos sudoración refleja si se desconecta un único ganglio simpático28,30,31.
Hay estudios que han evidenciado una disminución de la intensidad de la sudoración refleja en los años siguientes a la cirugía, asociado esto a una aceptación por parte del paciente. Otros estudios solo reportan mejoría de la sudoración refleja en pocos pacientes, manteniéndose estable en la gran mayoría. De nuevo, la evidencia experimental anatómica pone de manifiesto que es la interrupción en mayor o menor grado de las fibras pregangliónicas, lo que condiciona la respuesta de sudoración refleja, ya que los niveles medulares donde se ubican los cuerpos neuronales de estas fibras pregangliónicas se extienden desde C8 hasta T7 y, en consecuencia, cuanto más craneal se practique el nivel de transección mayor interrupción del número de fibras pregangliónicas, con mayor respuesta de sudoración refleja10,11.
Los diversos tratamientos utilizados para la sudoración refleja, como los agentes tópicos, ansiolíticos, antidepresivos, anticolinérgicos vía oral o la toxina botulínica no han tenido éxito hasta la fecha. Los intentos de reconstrucción del tronco simpático lesionado usando nervio intercostal o sural se reportan como dudosamente exitosos. No obstante, son casos aislados y grabados con elevada morbilidad.
Otros efectos secundarios, como la sequedad excesiva de manos, la ptosis palpebral o síndrome de Horner parcial y la sudoración gustatoria no suelen llegar al 1% de los casos.
Finalmente, la simpatectomía/simpaticolisis torácica va seguida de una discreta disminución del volumen espiratorio máximo en un segundo y en la difusión pulmonar del monóxido de carbono, así como, de un discreto incremento en la resistencia de las vías aéreas. Sobre la función cardíaca, produce una discreta bradicardia y una discreta disminución de la fracción de eyección, todo ello sin repercusión clínica40.
Grado de satisfacción: en cuanto al grado de satisfacción medido mediante cuestionarios específicos, las series indican que están muy satisfechos el 89% de los pacientes, poco satisfechos el 9% e insatisfechos el 2%7,22,26. El índice de calidad de vida registrado por encuestas validadas en dermatología registra niveles muy elevados de calidad, con un descenso considerable del nivel de ansiedad y de la percepción incapacitante de este nivel41.
En resumen, basándonos en los todos los resultados expuestos, así como los obtenidos en cuanto a índice de calidad de vida y grado de satisfacción, permiten presentar este procedimiento como el gold estándar para la HP. En cuanto a la sudoración refleja, se necesitan métodos que permitan objetivar y medir fácilmente en los pacientes la cuantía o severidad de la sudoración. Esto permitiría homogeneizar los resultados y saber el impacto exacto de la sudoración refleja. Además, se necesitan estudios randomizados y aleatorizados con un número amplio de pacientes que nos permitan validar las últimas novedades en la técnica quirúrgica. Hay que proseguir en el estudio del sistema nervioso simpático. Finalmente, sería interesante estudiar la actividad simpática basal de los pacientes con HP, para diferenciar subgrupos que permitan predecir el efecto de la cirugía y poder ofrecer a cada paciente la variante técnica que más se adecue a su tipo de HP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.