Determinar la influencia del volumen quirúrgico en los resultados oncológicos del Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos.
MétodosSe incluyeron 2.910 pacientes consecutivos tratados con una operación curativa entre marzo de 2006 y marzo de 2010 en 36 hospitales. Los hospitales se clasificaron según el número de pacientes operados por año en: pequeños (12-23), intermedios (24-35) y grandes (≥ 36).
ResultadosCon un seguimiento de al menos cinco años la incidencia acumulada de recidiva local fue 6,6 (IC 95% 5,6-7,6), la de metástasis 20,3 (IC 95% 18,8-21,9) y la de supervivencia global 73,0 (IC 95% 74,7-71,3). En el análisis de regresión multinivel, la supervivencia global fue mayor en los hospitales que operaban 36 o más pacientes [HR 0,727 (IC 95% 0,556-0,951); p=0,02]. El riesgo de recidiva local y metástasis no se relacionó con el volumen quirúrgico. Además, hubo una variación significativa en las tasas de supervivencia global (mediana hazard ratio [MHR] 1,184 [IC 95% 1,071-1,333]), recidiva local (MHR 1,308 [IC 95% 1,010-1,668]) y metástasis (MHR 1,300 [IC 95% 1,181-1,476]) entre todos los hospitales.
ConclusionesEn los grupos multidisciplinares seleccionados e incluidos en el proyecto de la Asociación Española de Cirujanos, que incluye la enseñanza de la escisión total del mesorrecto y la realimentación de los resultados, la supervivencia global es mayor en los hospitales con mayor volumen quirúrgico, y la variabilidad interhospitalaria de la tasa de recidiva local no se explica por el volumen quirúrgico.
The purpose of this prospective multicentre multilevel study was to investigate the influence of hospital caseload on long-term outcomes following standardization of rectal cancer surgery in the Rectal Cancer Project of the Spanish Society of Surgeons.
MethodsData relating to 2910 consecutive patients with rectal cancer treated for cure between March 2006 and March 2010 were recorded in a prospective database. Hospitals were classified according to number of patients treated per year as low-volume, intermediate-volume, or high volume hospitals (12-23, 24-35, or ≥36 procedures per year).
ResultsAfter a median follow-up of 5 years, cumulative rates of local recurrence, metastatic recurrence and overall survival were 6.6 (CI95% 5.6–7.6), 20.3 (CI95% 18.8–21.9) and 73.0 (CI95% 74.7 - 71.3) respectively. In the multilevel regression analysis overall survival was higher for patients treated at hospitals with an annual caseload of 36 or more patients (HR 0,727 [CI95% 0,556-0,951]; P=.02). The risk of local recurrence and metastases were not related to the caseload. Moreover, there was a statistically significant variation in overall survival (median hazard ratio [MHR] 1.184 [CI95% 1.071-1,333]), local recurrence (MHR 1.308 [CI95% 1.010-1.668]) and metastases (MHR 1.300 [CI95% 1.181; 1.476]) between all hospitals.
ConclusionsOverall survival was higher for patients treated at hospitals with an annual caseload of 36 or more patients. However, local recurrence was not influenced by caseload.
La influencia del volumen quirúrgico del hospital y del cirujano, así como la especialización del cirujano, en los resultados oncológicos de la cirugía del cáncer de colon y recto ha sido el objetivo de múltiples estudios. El último metaanálisis1 editado sobre este aspecto, en el que se incluían 51 estudios europeos y americanos, puso de manifiesto que los hospitales con mayor volumen quirúrgico tenían mayor sobrevida a los 5 años. Sin embargo, los resultados también sugirieron una gran variabilidad entre los hospitales de los países incluidos. Los estudios realizados en países en los que se han establecido programas docentes de grupos multidisciplinares y registros de los resultados de la cirugía del cáncer de recto han mostrado la influencia del volumen quirúrgico en la supervivencia y en la recidiva local2,3. El objetivo de este estudio ha sido valorar la influencia del volumen quirúrgico en los resultados oncológicos en los hospitales participantes en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos (AEC).
MétodosEste estudio observacional multicéntrico se ha realizado con la base de datos prospectiva del Proyecto del Cáncer de Recto de la AEC. Esta iniciativa docente iniciada en 2006 tuvo por objetivo introducir inicialmente la cirugía de escisión del mesorrecto, y posteriormente la amputación abdominoperineal extendida, a los grupos multidisciplinares de los hospitales del Sistema Nacional de Salud que lo solicitaron y que cumplían las condiciones requeridas: disponer de unidades de coloproctología con los medios técnicos de diagnóstico imprescindibles, y que realizaran 12 o más resecciones de recto al año.
Los datos recogidos prospectivamente en los hospitales por los cirujanos responsables del proyecto se enviaban a un registro centralizado. Este, informaba anualmente a cada centro de los resultados de su actividad en relación con el conjunto de los hospitales participantes. Una descripción más detallada del proyecto ha sido publicada previamente4.
Criterios de inclusión y exclusión de los pacientesSe incluyeron los pacientes intervenidos de forma electiva con una de las tres operaciones siguientes: resección anterior (RA), resección abdominoperineal (APER) e intervención de Hartmann, realizada entre el 1 de marzo de 2006 y el 1 de marzo de 2010 en los primeros 36 hospitales integrados en el proyecto que cumplieron las condiciones requeridas.
Se excluyeron los pacientes operados de urgencia, los que no tenían los resultados de alguna de las variables de interés y aquellos en los que los resultados eran incongruentes.
Variables de estudioLas variables de resultado del estudio fueron: la recidiva local (RL), las metástasis aparecidas en el seguimiento (M) y la supervivencia global (OS). Las variables de confusión se dividieron en fijas y aleatorias. Se consideraron como variables de confusión fijas las siguientes: demográficas: edad, categorizada en tres grupos (< 65, 65-80, > 80 años), y género; la gravedad del riesgo quirúrgico (medida mediante el grado del riesgo anestésico ASA), la localización del tumor, que se categorizó en tres grupos (0-6, 7-12, 13-15cm), el tipo de escisión del mesorrecto (parcial o total), el tipo de resección practicado (RA, APER, operación de Hartmann), el estadio patológico del tumor y de las adenopatías, el estado del margen de resección circunferencial (CRM), la perforación intraoperatoria, la utilización de tratamiento neoadyuvante, y la casuística del hospital categorizada en tres grupos según la mediana del número de pacientes tratados anualmente con esas tres operaciones: 12-23, 24-35, y ≥36 pacientes. El centro hospitalario fue considerado como una variable de confusión aleatoria.
DefinicionesSe consideraron tumores de recto los situados en los últimos 15 cm medidos desde el margen anal mediante rectoscopia rígida en la retirada o mediante resonancia magnética5.
Una resección se consideró curativa cuando no había invasión o esta era microscópica en ambos márgenes distal y circunferencial (R0 y R1), en ausencia de metástasis.
El estadio tumoral patológico se clasificó con la quinta versión de la clasificación TNM (American Joint Committee on Cancer stages I–IV; 5.th edition)6. La perforación intraoperatoria se definió como cualquier defecto de la pared del recto que pusiera en contacto la luz del recto con la superficie. El CRM se consideró invadido si en el estudio patológico se encontraban células neoplásicas a ≤ 1mm del mismo.
La RL fue definida como la reaparición de la enfermedad en la pelvis, incluyendo: la anastomosis y la herida perineal, independientemente de que el paciente tuviera metástasis a distancia. La recidiva aislada en los ovarios se consideró como metástasis.
Dado el anonimato de hospitales y pacientes no se consideró necesaria la aprobación por los Comités de Ética de los centros incluidos, aunque el proyecto había sido avalado por estos comités.
Análisis estadísticoLas variables categóricas fueron analizadas mediante los test χ2 y la comparación de las variables cuantitativas se realizó mediante la prueba U-Mann Whitney. Los resultados relacionados con la incidencia acumulada de: RL, M y OS se presentaron como el número total de eventos (se consideró que los pacientes estaban en riesgo de experimentar los eventos indicados hasta: el fallecimiento, la pérdida de seguimiento por cambio de ciudad o país de residencia o la finalización del seguimiento a los 5 años). La incidencia de estos eventos se estimó mediante el método de Kaplan-Meier.
Para determinar la variación de las variables de resultado: RL, M y OS, entre los hospitales incluidos se realizó un análisis multinivel; para ello se construyeron tres modelos: un modelo de efectos fijos que incluía las variables de confusión fijas, un modelo completo que incluía las variables de confusión fijas y la variable aleatoria hospital, y un modelo nulo que incluía exclusivamente la variable aleatoria hospital. En el primero se realizó una regresión de Cox y en los dos últimos una regresión de Cox multinivel. Todas las variables se incluyeron en los estudios univariantes, multivariantes y multinivel.
Para cada modelo se calculó el criterio de información de Akaike (AIC)7 y el test de la deviancia. En los modelos multinivel se calcularon la varianza aleatoria (δ2) y los intervalos de confianza de la misma, la mediana de hazard ratio (MHR)8 y la hazard ratio entre el peor y el mejor excluyendo el 5% de los centros extremos. La MHR cuantifica la variación entre hospitales en mediana comparando pares de pacientes seleccionados al azar con los mismos valores de las variables confusoras9.
ResultadosEntre marzo de 2006 y marzo de 2010, 3.222 pacientes consecutivos diagnosticados de cáncer de recto fueron tratados con una resección rectal en los primeros 36 hospitales que cumplieron los requerimientos del Proyecto del Cáncer de Recto de la AEC. En 2.983 pacientes la operación se consideró curativa. De ellos 2.910 (97,6%) sobrevivieron a la operación y fueron incluidos en el análisis de los resultados oncológicos. Las características de esta cohorte de pacientes se muestran en la tabla 1. En 2.015 (69,2%) pacientes se realizó una RA, 655 (22,5%) fueron tratados con una APER, y 240 (8,2%) con una operación de Hartmann. En 1.233 (42,4%) pacientes se diagnosticó alguna complicación; la dehiscencia de la anastomosis ocurrió en 183 (6,1%) pacientes, y una reoperación fue necesaria en 216 (7,4%) pacientes.
Descripción de la muestra estudiada
| Variable | n (%) | n |
|---|---|---|
| Sexo | 2.910 | |
| Mujer | 996 (34,2) | |
| Hombre | 1.914 (65,8) | |
| Edad (años) | 2.910 | |
| < 65 | 1.068 (36,7) | |
| 65-80 | 1.439(49,4) | |
| > 80 | 403(13,8) | |
| ASA | 2.910 | |
| ASA I | 172 (5,9) | |
| ASA II | 1.589 (54,6) | |
| ASA III | 1.059 (36,4) | |
| ASA IV | 90 (3,1) | |
| Localización del tumor (cm) | 2.910 | |
| 15-13 | 334 (11,4) | |
| 12-7 | 1.420(48,7) | |
| 0-6 | 1.156(39,9) | |
| Técnica quirúrgica | 2.910 | |
| RA | 2.015 (69,2) | |
| APER | 655 (22,5) | |
| Hartmann | 240 (8,2) | |
| Exéresis del mesorrecto | 2.910 | |
| Parcial | 607 (20,9) | |
| Total | 2.303 (79,1) | |
| Perforación intraoperatoria | 2.910 | |
| No | 2.757 (94,7) | |
| Sí | 154 (5,2) | |
| Invasión del CRM | 2.910 | |
| Libre | 2.630 (90,3) | |
| Afecto | 280 (9,6) | |
| Tratamiento neoadyuvante | 2.910 | |
| No | 1.202 (41,3) | |
| Sí | 1.708 (58,7) | |
| Estadio T patológico | 2.910 | |
| pT1 | 292 (10,0) | |
| ypT0 | 221 (7, 5) | |
| pT2 | 811 (27.9) | |
| pT3 | 1.432 (49,2) | |
| pT4 | 154 (5,3) | |
| Estadio N patológico | 2.910 | |
| pN0-ypN0 | 1.974 (67,8) | |
| pN1–pN2 | 936 (32,1) | |
| Hospitales por operaciones año | 2.910 | |
| ≥ 1/mes (12-23) | 22 | |
| 2-3 mes (24-35) | 9 | |
| ≥ 3 mes (≥ 36) | 5 | |
| Pacientes incluidos | ||
| ≥ 1/mes (12-23) | 1.299 | |
| 2-3 mes (24-35) | 661 | |
| ≥ 3 mes (≥ 36) | 950 | |
RA: resección anterior de recto; APER: resección abdominoperineal; CRM: margen de resección circunferencial.
Con un seguimiento de al menos cinco años la incidencia acumulada de RL fue: 6,6 (IC 95% 5,6–7,6), la de M: 20,3 (IC 95% 18,7–21,8) y la OS: 72,9 (IC 95% 74,6–71, 2). Las tasas de los resultados oncológicos según el volumen del hospital, pequeño, intermedio y grande fueron las siguientes RL (7,8; 6,1; 5,2%), M (21,8; 22,7; 17,7%) y OS (69,6; 73,7; 76,1%).
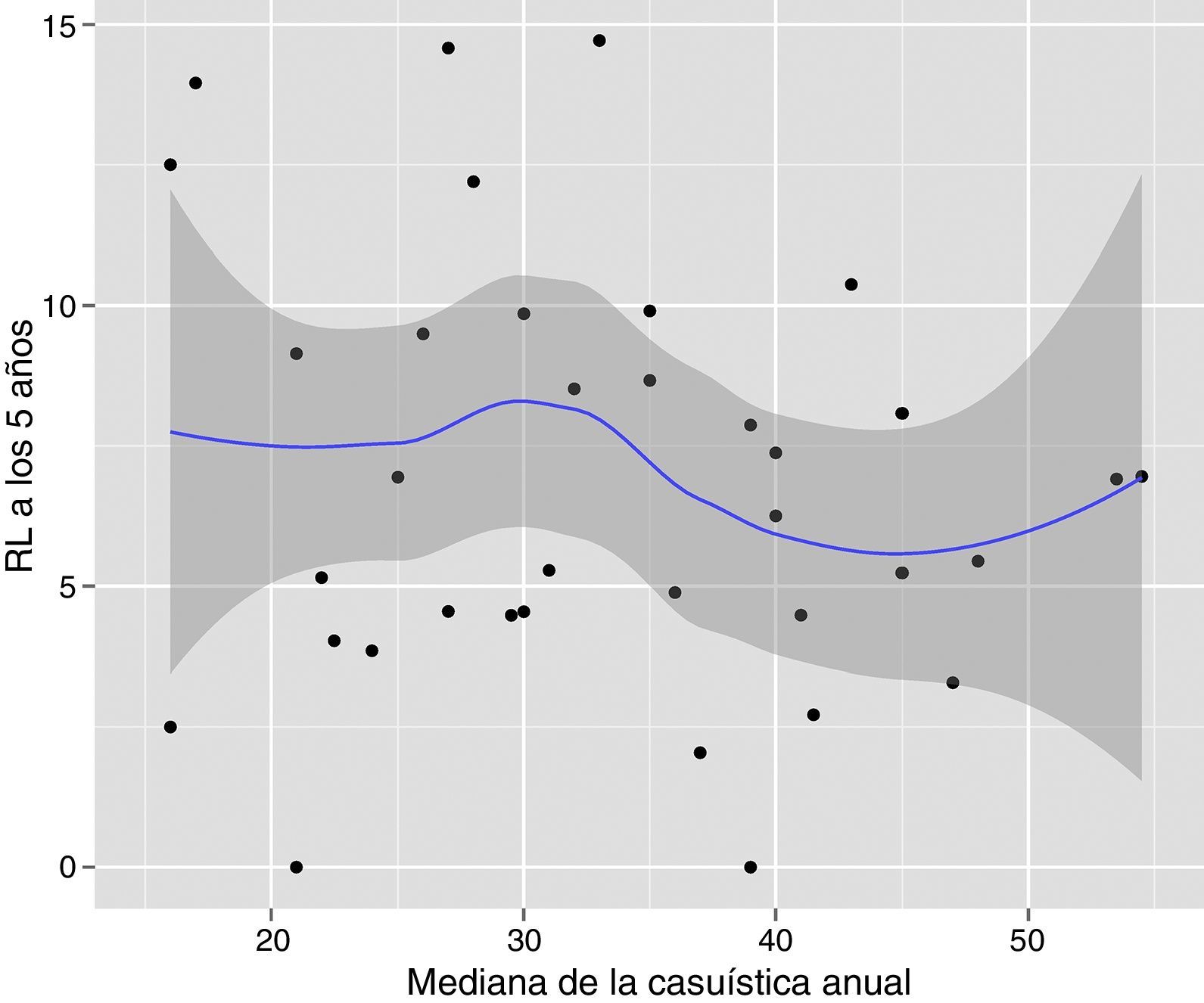
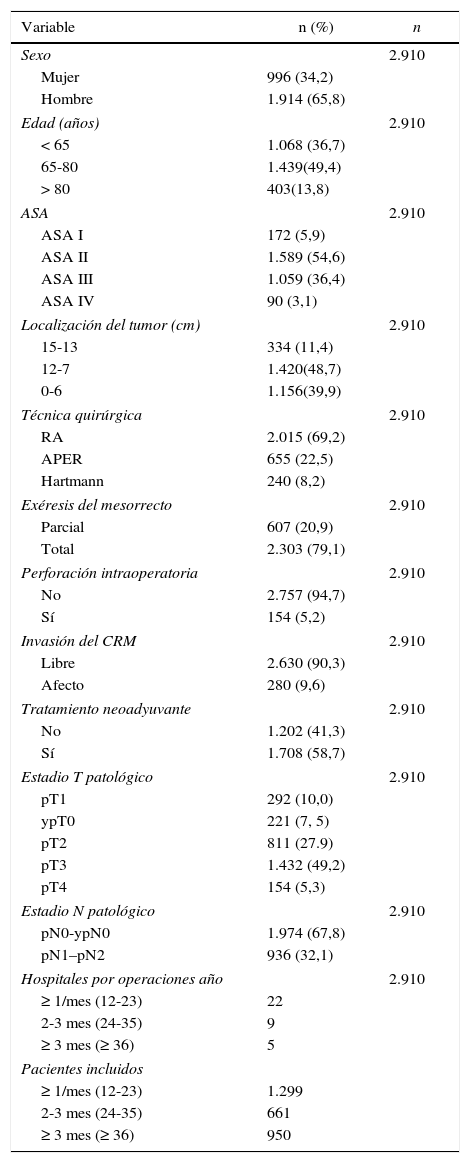
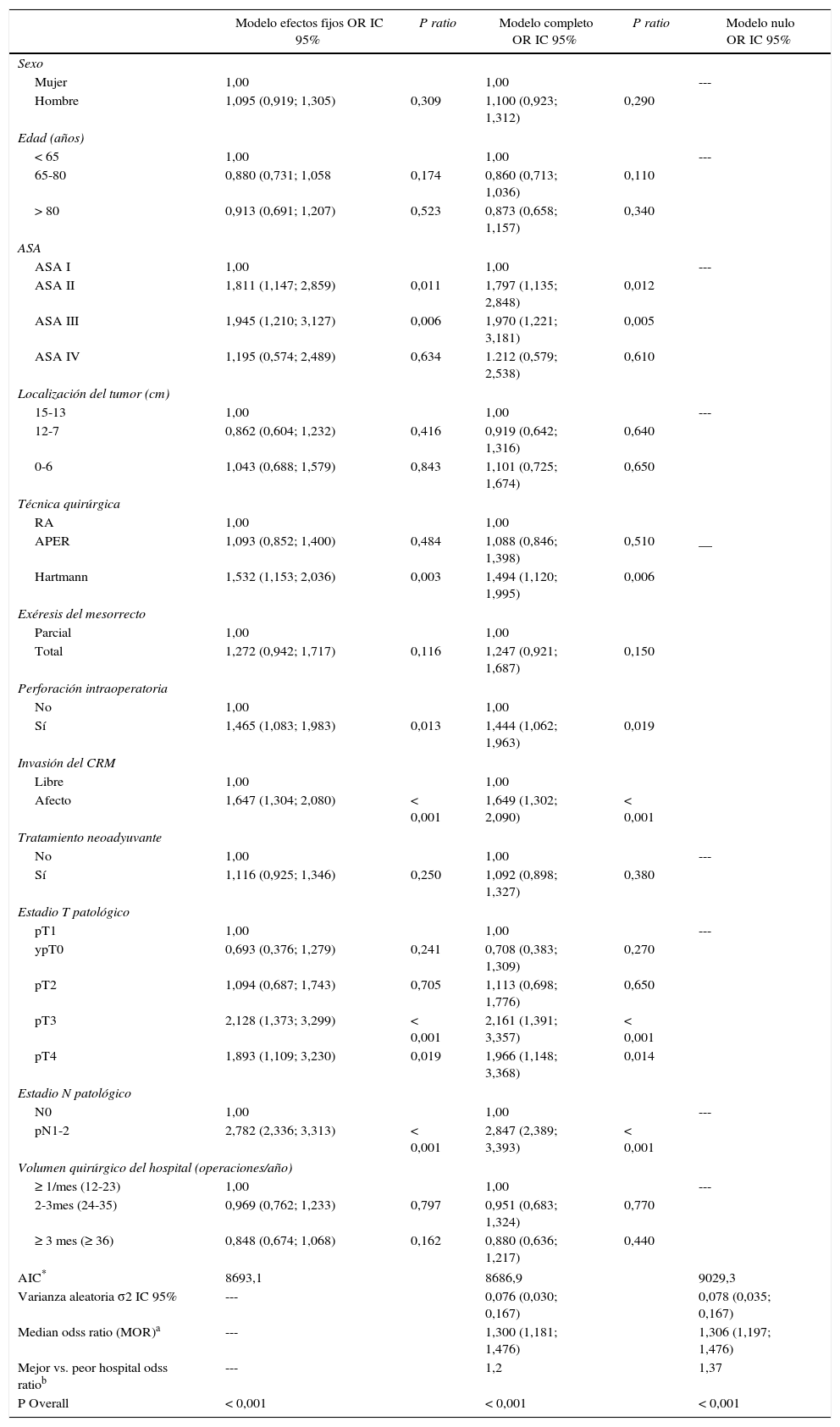
Los resultados de los análisis univariantes se muestran en la tabla 2. Los análisis multivariable y multinivel mostraron un efecto significativo del volumen quirúrgico anual en las tasas de OS entre los hospitales que operaban menos de 36 pacientes y los que trataban 36 o más (tabla 3). Ningún análisis puso de manifiesto la influencia del volumen quirúrgico en la RL (tabla 4) ni en la aparición de M (tabla 5). Además, se observó que la RL variaba entre hospitales independientemente del volumen quirúrgico anual (fig. 1).
Resultados del análisis univariante de la muestra de población estudiada (n = 2910)
| Recidiva local | Metástasis en seguimiento | Mortalidad en seguimiento | ||||
|---|---|---|---|---|---|---|
| Eventos n 175 | Eventos n 546 | Eventos n 810 | ||||
| n(%) | n(%) | n(%) | ||||
| Sexo | ||||||
| Mujer | 50 (5,0) | Ref. | 186 (18,7) | Ref. | 257 (25,8) | Ref. |
| Hombre | 125 (6,5) | 1,34 [0,96; 1,85] | 360 (18,8) | 1,03 [0,86;1,23] | 553 (28,9) | 1,15 [0,99;1,33] |
| Edad | ||||||
| < 65 | 64 (5,9) | Ref. | 209 (19,6) | Ref. | 189 (17,7) | Ref. |
| 65-80 | 82 (5,7) | 1,02 [0,73; 1,41] | 259 (18,0) | 0,97 [0,81;1,17] | 414 (28,8) | 1,79 [1,50;2,12]* |
| > 80 | 29 (7,2) | 1,50 [0,97; 2,34] | 78 (19,5) | 1,21 [0,93;1,57] | 207 (51,6) | 3,97 [3,26;4,84]* |
| ASA: | ||||||
| I | 5 (2,9) | Ref. | 20 (11,6) | Ref. | 18 (10,5) | Ref. |
| II | 86 (5,4) | 2,02 [0,82; 4,97] | 306 (19,2) | 1,79 [1,14; 2,82] * | 342 (21,5) | 2,28 [1,42; 3,66]* |
| III | 76 (7,1) | 2,95 [1,20; 7,31] * | 208 (19,6) | 2,00 [1,27; 3,17] * | 401 (37,9) | 4,62 [2,88; 7,40]* |
| IV | 8 (8,9) | 4.02 [1,31; 12,3] * | 12 (13,5) | 1,49 [0,73; 3,05] | 49 (55,1) | 7,51 [4,38; 12,9]* |
| Localización (cm) | ||||||
| 13-15 | 13 (3.89%) | Ref. | 59 (17,7) | Ref. | 79 (23.7%) | Ref. |
| 7-12 | 81 (5,7) | 1,53 [0,85;2,75] | 246 (17,3) | 1,00 [0,76;1,33] | 379 (26,7) | 1,20 [0,94;1,52] |
| 0-6 | 81 (7,0) | 1,93 [1,07;3,46]* | 241 (20,8) | 1,25 [0,94;1,67] | 352 (30,4) | 1,40 [1,10;1,79] * |
| Técnica quirúrgica | ||||||
| RA | 97 (4,8) | Ref. | 339 (16,8) | Ref. | 466 (23,1) | Ref. |
| APER | 44 (6,7) | 1,48 [1,04;2,11]* | 144 (22,0) | 1,42 [1,17;1,73] * | 214 (32,7) | 1,52 [1,29;1,79]* |
| Hartmann | 34 (14,2) | 3,95 [2,67;5,84]* | 63 (26,2) | 2,08 [1,59;2,72] * | 130 (54,2) | 3,26 [2,68;3,96]* |
| Exéresis mesorrecto | ||||||
| Parcial | 25 (4,1) | Ref. | 104 (17,1) | Ref. | 145 (23,9) | Ref. |
| Total | 150 (6,5) | 1,65 [1,08; 2,52] * | 442 (19,2) | 1,16 [0,94;1,44] | 665 (28,9) | 1,26 [1,05; 1,51]* |
| Perforación operatoria | ||||||
| No | 139 (5,0) | Ref. | 494 (17,9) | Ref. | 733 (26,6) | Ref. |
| Sí | 36 (23,4) | 5,59 [3,87; 8,07] * | 52 (33,8) | 2,34 [1,76; 3,11] * | 77 (50,0) | 2,24 [1,77; 2,84]* |
| Invasión CRM | ||||||
| Libre | 121 (69,1) | Ref. | 439 (80,4) | Ref. | 658 (81,2) | Ref. |
| Afecto | 54 (30,9) | 5,32 [3,86;7,35] * | 107 (19,6) | 2,98 [2,41; 3,69]* | 152 (18,8) | 2,83 [2,37; 3,37]* |
| Tratamiento neoadyuvante | ||||||
| No | 77 (6,4) | Ref. | 221 (18,4) | Ref. | 382 (31,8) | Ref. |
| Sí | 98 (5,7) | 0,85 [0,63;1,15] | 325 (19,0) | 0,99 [0,84;1,18] | 428 (25,1) | 0,74 [0,65;0,85]* |
| A p T | ||||||
| pT1 | 5 (2,1) | Ref. | 18 (7,76) | Ref. | 48 (20,7) | Ref. |
| ypT0 | 7 (2,4) | 1,12 [0,35;3,52]* | 19 (6,76) | 0,84 [0,44;1,61] | 32 (11,4) | 0,52 [0,33;0,81] |
| pT2 | 34 (4,1) | 1,96 [0,76;5,00] | 90 (11,1) | 1,44 [0,87;2,40] | 161 (19,9) | 0,95 [0,69;1,31] |
| pT3 | 101 (7,0) | 3,55 [1,45;8,72]* | 370 (25,8) | 3,82 [2,38;6,13]* | 489 (34,1) | 1,80 [1,34;2,43]* |
| pT4 | 28 (18,2) | 11,1 [4,29;28,8]* | 49 (31,8) | 5,57 [3,25;9,57]* | 80 (51,9) | 3,35 [2,34;4,79]* |
| ApN | ||||||
| pN0 | 84 (48) | Ref. | 226 (41,4) | Ref. | 399 (49,2) | Ref. |
| pN1–pN2 | 91 (52) | 1.95 [1,29;2,96] * | 320 (58,6) | 2,80 [2,19;3,56]* | 411 (50,7) | 2,03 [1,68;2,47]* |
| Volumen quirúrgico operaciones/año) | ||||||
| ≥ 1/mes (12-23) | 22 (5,9) | Ref. | 67 (18,1) | Ref. | 119 (32,2) | Ref. |
| 2-3mes (24-35) | 72 (7,0) | 1,17 [0,73;1,89] | 207 (20,3) | 1,09 [0,82;1,43] | 302 (29,6) | 0,90 [0,73; 1,11] |
| ≥ 3 mes (≥ 36) | 81 (5,3) | 0,85 [0,53;1,36] | 272 (17,9) | 0,93 [0,71;1,22] | 389 (25,6) | 0,74 [0,60;0,91]* |
RA: resección anterior de recto; APER; resección abdominoperineal; CRM: margen de resección circunferencial.
Supervivencia global. Resultados del análisis de los tres modelos
| Modelo efectos fijos OR IC 95% | P ratio | Modelo completo OR IC 95% | P ratio | Modelo nulo OR IC 95% | |
|---|---|---|---|---|---|
| Sexo | |||||
| Mujer | 1,00 | 1,00 | --- | ||
| Hombre | 1,255 (1,080; 1,459) | 0,003 | 1,262 (1,084; 1,468) | 0,003 | |
| Edad (años) | |||||
| < 65 | 1,00 | 1,00 | --- | ||
| 65-80 | 1,475 (1,232; 1,766) | < 0,001 | 1,465 (1,223; 1,756) | < 0,001 | |
| > 80 | 2,565 (2,058; 3,196) | < 0,001 | 2,558 (2,048; 3,194) | < 0,001 | |
| ASA | |||||
| ASA I | 1,00 | 1,00 | --- | ||
| ASA II | 1,850 (1,146; 2,988) | 0,012 | 1,846 (1,142; 2,984) | 0,012 | |
| ASA III | 2,863 (1,761; 4,655) | < 0,001 | 2,893 (1,777; 4,711) | < 0,001 | |
| ASA IV | 3,717 (2,122; 6,512) | < 0,001 | 3,766 (2,144; 6,615) | < 0,001 | |
| Localización del tumor (cm) | |||||
| 15-13 | 1,00 | 1,00 | --- | ||
| 12-7 | 1,061 (0,775; 1,451) | 0,713 | 1,093 (0,797; 1,499) | 0,580 | |
| 0-6 | 1,199 (0,833; 1,726) | 0,328 | 1,220 (0,845; 1,763) | 0,290 | |
| Técnica quirúrgica | |||||
| RA | 1,00 | 1,00 | |||
| APER | 1,071 (0,864; 1,328) | 0,532 | 1,057 (0,851; 1,313) | 0,620 | __ |
| Hartmann | 1,822 (1,476; 2,249) | < 0,001 | 1,818 (1,469; 2,250) | < 0,001 | |
| Exéresis del mesorrecto | |||||
| Parcial | 1,00 | 1,00 | |||
| Total | 1,304 (1,011; 1,682) | 0,041 | 1,299 (1,005; 1,679) | 0,046 | |
| Perforación intraoperatoria | |||||
| No | 1,00 | 1,00 | |||
| Sí | 1,478 (1,152; 1,895) | 0,002 | 1,438 (1,119; 1,848) | 0,005 | |
| Invasión del CRM | |||||
| Libre | 1,00 | 1,00 | |||
| Afecto | 1,574 (1,285; 1,928) | < 0,001 | 1,583 (1,290; 1,943) | < 0,001 | |
| Tratamiento neoadyuvante | |||||
| No | 1,00 | 1,00 | --- | ||
| Sí | 0,992 (0,849; 1,159) | 0,922 | 0,982 (0,835; 1,153) | 0,820 | |
| Estadio T patológico | |||||
| pT1 | 1,00 | 1,00 | --- | ||
| ypT0 | 0,621 (0,394; 0,979) | 0,040 | 0,616 (0,390; 0,972) | 0,037 | |
| pT2 | 0,862 (0,624; 1,192) | 0,370 | 0,854 (0,617; 1,182) | 0,340 | |
| pT3 | 1,242 (0,914; 1,688) | 0,166 | 1,229 (0,903; 1,673) | 0,190 | |
| pT4 | 1,638 (1,105; 2,430) | 0,014 | 1,662 (1,118; 2,470) | 0,012 | |
| Estadio N patológico | |||||
| N0 | 1,00 | 1,00 | --- | ||
| pN1-2 | 2,104 (1,813; 2,441) | < 0,001 | 2,120 (1,826; 2,461) | < 0,001 | |
| Volumen quirúrgico del hospital (operaciones/año) | |||||
| ≥ 1/mes (12-23) | 1,00 | 1,00 | --- | ||
| 2-3mes (24-35) | 0,856 (0,691; 1,060) | 0,155 | 0,858 (0,653; 1,126) | 0,270 | |
| ≥ 3 mes (≥ 36) | 0,711 (0,578; 0,875) | 0,001 | 0,727 (0,556; 0,951) | 0,020 | |
| AIC* | 11.883,1 | 11.886,2 | 12.431 | ||
| Varianza aleatoria σ2 IC 95% | --- | 0,031 (0,005; 0,091) | 0,044 (0,015; 0,101) | ||
| Median odss ratio (MOR)a | --- | 1,184 (1,071; 1,333) | 1,221 (1,125; 1,354) | ||
| Mejor vs. peor hospital odss ratiob | --- | 1,17 | 1,21 | ||
| P Overall | < 0,001 | < 0,001 | < 0,001 | ||
RA: resección anterior de recto; APER: resección abdomino perineal; CRM: margen de resección circunferencial.
Recidiva local. Resultados del análisis de los tres modelos
| Modelo efectos fijos OR IC 95% | P ratio | Modelo completo OR IC 95% | P ratio | Modelo nulo OR IC 95% | |
|---|---|---|---|---|---|
| Sexo | |||||
| Mujer | 1,00 | 1,00 | --- | ||
| Hombre | 1,496 (1,071; 2,089) | 0,018 | 1,495 (1,069; 2,091) | 0,019 | |
| Edad (años) | |||||
| < 65 | 1,00 | 1,00 | --- | ||
| 65-80 | 0,848 (0,600; 1,198) | 0,350 | 0,847 (0,598; 1,200) | 0,350 | |
| > 80 | 0,996 (0,613; 1,617) | 0,987 | 0,962 (0,591; 1,567) | 0,880 | |
| ASA | |||||
| ASA I | 1,00 | 1,00 | --- | ||
| ASA II | 1,800 (0,723; 4,479) | 0,207 | 1,807 (0,724; 4,510) | 0,210 | |
| ASA III | 2,431 (0,955; 6,190) | 0,062 | 2,459 (0,962; 6,283) | 0,060 | |
| ASA IV | 2,707 (0,848; 8,634) | 0,093 | 2,735 (0,852; 8,776) | 0,091 | |
| Localización del tumor (cm) | |||||
| 15-13 | 1,00 | 1,00 | --- | ||
| 12-7 | 1,262 (0,626; 2,543) | 0,515 | 1,325 (0,658; 2,668) | 0,430 | |
| 0-6 | 1,820 (0,839; 3,947) | 0,129 | 1,887 (0,869; 4,099) | 0,110 | |
| Técnica quirúrgica | |||||
| RA | 1,00 | 1,00 | |||
| APER | 0,734 (0,465; 1,156) | 0,182 | 0,740 (0,468; 1,173) | 0,200 | __ |
| Hartmann | 2,140 (1,390; 3,294) | < 0,001 | 2,189 (1,415; 3,385) | < 0,001 | |
| Exéresis del mesorrecto | |||||
| Parcial | 1,00 | 1,00 | |||
| Total | 1,601 (0,936; 2,739) | 0,086 | 1,634 (0,957; 2,789) | 0,072 | |
| Perforación intraoperatoria | |||||
| No | 1,00 | 1,00 | |||
| Sí | 2,799 (1,849; 4,237) | < 0,001 | 2,795 (1,836; 4,255) | < 0,001 | |
| Invasión del CRM | |||||
| Libre | 1,00 | 1,00 | |||
| Afecto | 2,733 (1,844; 4,052) | < 0,001 | 2,795 (1,878; 4,159) | < 0,001 | |
| Tratamiento neoadyuvante | |||||
| No | 1,00 | 1,00 | --- | ||
| Sí | 0,969 (0,698; 1,346) | 0,852 | 0,891 (0,636; 1,250) | 0,500 | |
| Estadio T patológico | |||||
| pT1 | 1,00 | 1,00 | --- | ||
| ypT0 | 1,187 (0,372; 3,788) | 0,773 | 1,210 (0,378; 3,870) | 0,750 | |
| pT2 | 1,718 (0,670; 4,408) | 0,260 | 1,751 (0,682; 4,497) | 0,240 | |
| pT3 | 2,191 (0,876; 5,481) | 0,094 | 2.211 (0,882; 5,541) | 0,091 | |
| pT4 | 3,321 (1,197; 9,216) | 0,021 | 3,411 (1,225; 9,497) | 0,019 | |
| Estadio N patológico | |||||
| N0 | 1,00 | 1,00 | --- | ||
| pN1-2 | 1,875 (1,366; 2,574) | < 0,001 | 1,889 (1,374; 2,596) | < 0,001 | |
| Volumen quirúrgico del hospital (operaciones/año) | |||||
| ≥ 1/mes (12-23) | 1,00 | 1,00 | --- | ||
| 2-3mes (24-35) | 1,044 (0,643; 1,693) | 0,863 | 1,098 (0,630; 1,916) | 0,740 | |
| ≥ 3 mes (≥ 36) | 0,803 (0,498; 1,294) | 0,367 | 0,835 (0,480; 1,452) | 0,520 | |
| AIC* | 2.573,3 | 2.577 | 2.723 | ||
| Varianza aleatoria σ2 IC 95% | --- | 0,079 (0,000; 0,288) | 0,045 (0,000; 0,222) | ||
| Median odss ratio (MOR)a | --- | 1,308 (1,010; 1,668) | 1,226 (1,010; 1,568) | ||
| Mejor vs. peor hospital odss ratiob | --- | 1,25 | 1,1 | ||
| P Overall | < 0,001 | < 0,001 | < 0,001 | ||
RA: resección anterior de recto; APER: resección abdominoperineal; CRM: margen de resección circunferencial.
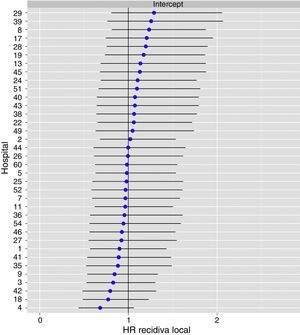
Metástasis en seguimiento. Resultados del análisis de los tres modelos
| Modelo efectos fijos OR IC 95% | P ratio | Modelo completo OR IC 95% | P ratio | Modelo nulo OR IC 95% | |
|---|---|---|---|---|---|
| Sexo | |||||
| Mujer | 1,00 | 1,00 | --- | ||
| Hombre | 1,095 (0,919; 1,305) | 0,309 | 1,100 (0,923; 1,312) | 0,290 | |
| Edad (años) | |||||
| < 65 | 1,00 | 1,00 | --- | ||
| 65-80 | 0,880 (0,731; 1,058 | 0,174 | 0,860 (0,713; 1,036) | 0,110 | |
| > 80 | 0,913 (0,691; 1,207) | 0,523 | 0,873 (0,658; 1,157) | 0,340 | |
| ASA | |||||
| ASA I | 1,00 | 1,00 | --- | ||
| ASA II | 1,811 (1,147; 2,859) | 0,011 | 1,797 (1,135; 2,848) | 0,012 | |
| ASA III | 1,945 (1,210; 3,127) | 0,006 | 1,970 (1,221; 3,181) | 0,005 | |
| ASA IV | 1,195 (0,574; 2,489) | 0,634 | 1.212 (0,579; 2,538) | 0,610 | |
| Localización del tumor (cm) | |||||
| 15-13 | 1,00 | 1,00 | --- | ||
| 12-7 | 0,862 (0,604; 1,232) | 0,416 | 0,919 (0,642; 1,316) | 0,640 | |
| 0-6 | 1,043 (0,688; 1,579) | 0,843 | 1,101 (0,725; 1,674) | 0,650 | |
| Técnica quirúrgica | |||||
| RA | 1,00 | 1,00 | |||
| APER | 1,093 (0,852; 1,400) | 0,484 | 1,088 (0,846; 1,398) | 0,510 | __ |
| Hartmann | 1,532 (1,153; 2,036) | 0,003 | 1,494 (1,120; 1,995) | 0,006 | |
| Exéresis del mesorrecto | |||||
| Parcial | 1,00 | 1,00 | |||
| Total | 1,272 (0,942; 1,717) | 0,116 | 1,247 (0,921; 1,687) | 0,150 | |
| Perforación intraoperatoria | |||||
| No | 1,00 | 1,00 | |||
| Sí | 1,465 (1,083; 1,983) | 0,013 | 1,444 (1,062; 1,963) | 0,019 | |
| Invasión del CRM | |||||
| Libre | 1,00 | 1,00 | |||
| Afecto | 1,647 (1,304; 2,080) | < 0,001 | 1,649 (1,302; 2,090) | < 0,001 | |
| Tratamiento neoadyuvante | |||||
| No | 1,00 | 1,00 | --- | ||
| Sí | 1,116 (0,925; 1,346) | 0,250 | 1,092 (0,898; 1,327) | 0,380 | |
| Estadio T patológico | |||||
| pT1 | 1,00 | 1,00 | --- | ||
| ypT0 | 0,693 (0,376; 1,279) | 0,241 | 0,708 (0,383; 1,309) | 0,270 | |
| pT2 | 1,094 (0,687; 1,743) | 0,705 | 1,113 (0,698; 1,776) | 0,650 | |
| pT3 | 2,128 (1,373; 3,299) | < 0,001 | 2,161 (1,391; 3,357) | < 0,001 | |
| pT4 | 1,893 (1,109; 3,230) | 0,019 | 1,966 (1,148; 3,368) | 0,014 | |
| Estadio N patológico | |||||
| N0 | 1,00 | 1,00 | --- | ||
| pN1-2 | 2,782 (2,336; 3,313) | < 0,001 | 2,847 (2,389; 3,393) | < 0,001 | |
| Volumen quirúrgico del hospital (operaciones/año) | |||||
| ≥ 1/mes (12-23) | 1,00 | 1,00 | --- | ||
| 2-3mes (24-35) | 0,969 (0,762; 1,233) | 0,797 | 0,951 (0,683; 1,324) | 0,770 | |
| ≥ 3 mes (≥ 36) | 0,848 (0,674; 1,068) | 0,162 | 0,880 (0,636; 1,217) | 0,440 | |
| AIC* | 8693,1 | 8686,9 | 9029,3 | ||
| Varianza aleatoria σ2 IC 95% | --- | 0,076 (0,030; 0,167) | 0,078 (0,035; 0,167) | ||
| Median odss ratio (MOR)a | --- | 1,300 (1,181; 1,476) | 1,306 (1,197; 1,476) | ||
| Mejor vs. peor hospital odss ratiob | --- | 1,2 | 1,37 | ||
| P Overall | < 0,001 | < 0,001 | < 0,001 | ||
RA: resección anterior d erecto; APER: resección abdominoperineal; CRM: margen de resección circunferencial.
Riesgo de recidiva local para cada uno de los centros. Cada punto es un hospital según su casuística en mediana de pacientes operados por año y el valor en porcentaje obtenido del Kaplan Meier. La línea es una regresión local para dibujar la tendencia de la relación entre la variable respuesta y el volumen quirúrgico. La zona sombreada representa los IC 95%.
La invasión del CRM, la perforación intraoperatoria, la intervención de Hartmann, el estadio pT4 y la presencia de metástasis ganglionares (pN1, pN2) estuvieron relacionadas con todas las variables de resultado (tablas 3–5). El sexo masculino se asoció con la OS (tabla 3) y la LR (tabla 4). El grado ASA se relacionó con la OS y la aparición de M (tablas 3 y 5). Por último, la edad se relacionó con la OS (tabla 3) y el estadio pT3 con la aparición de M (tabla 5).
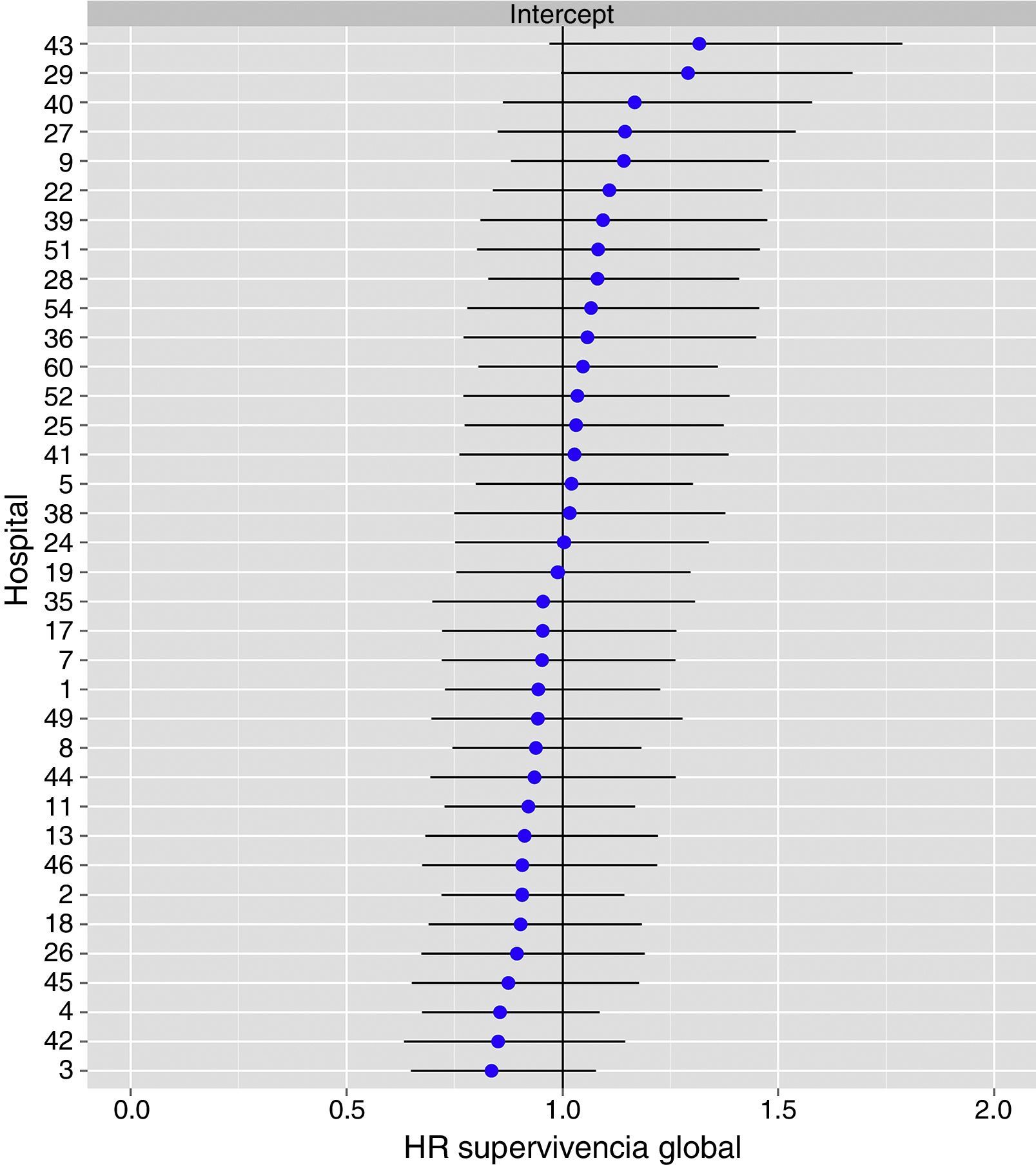
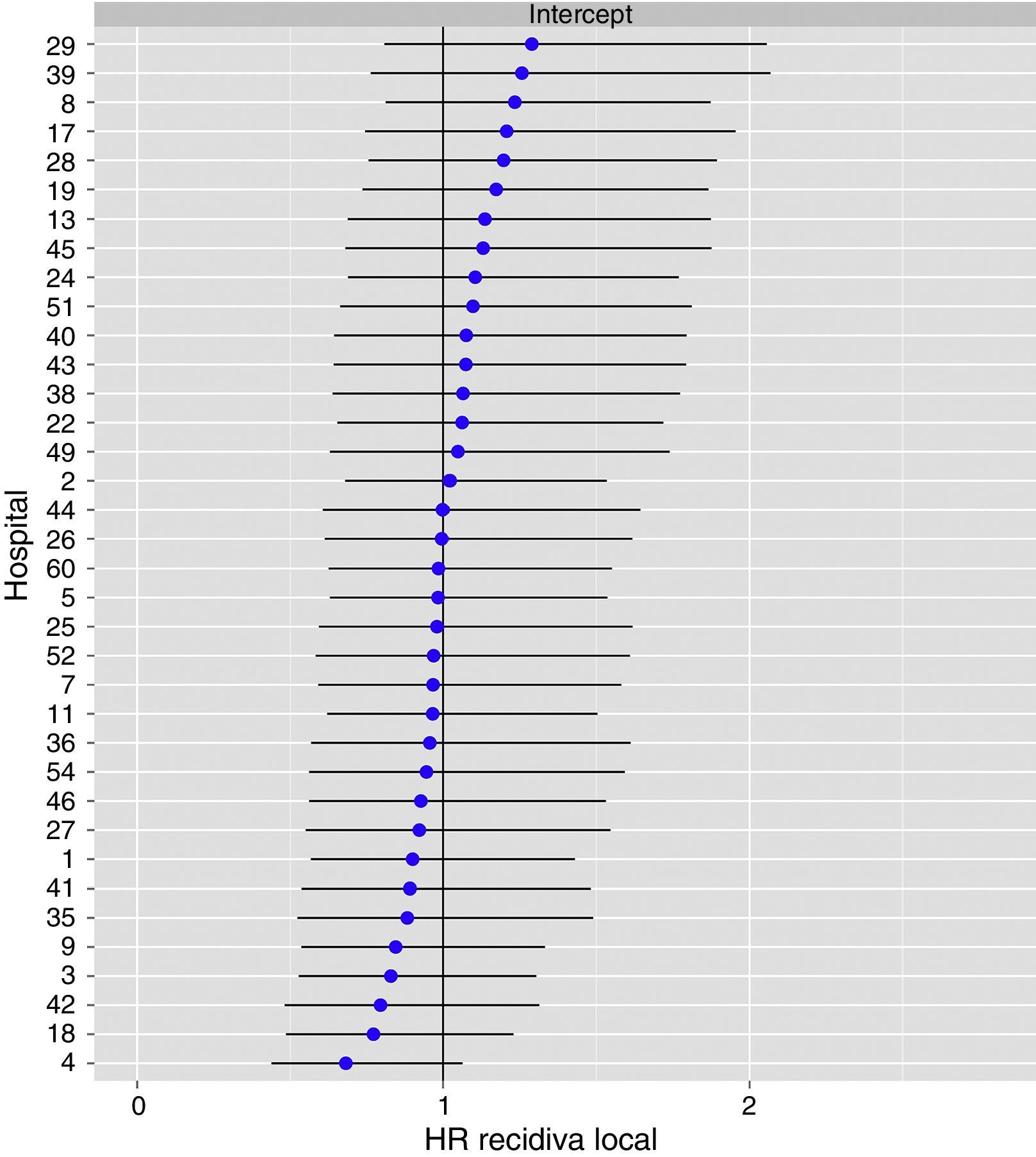
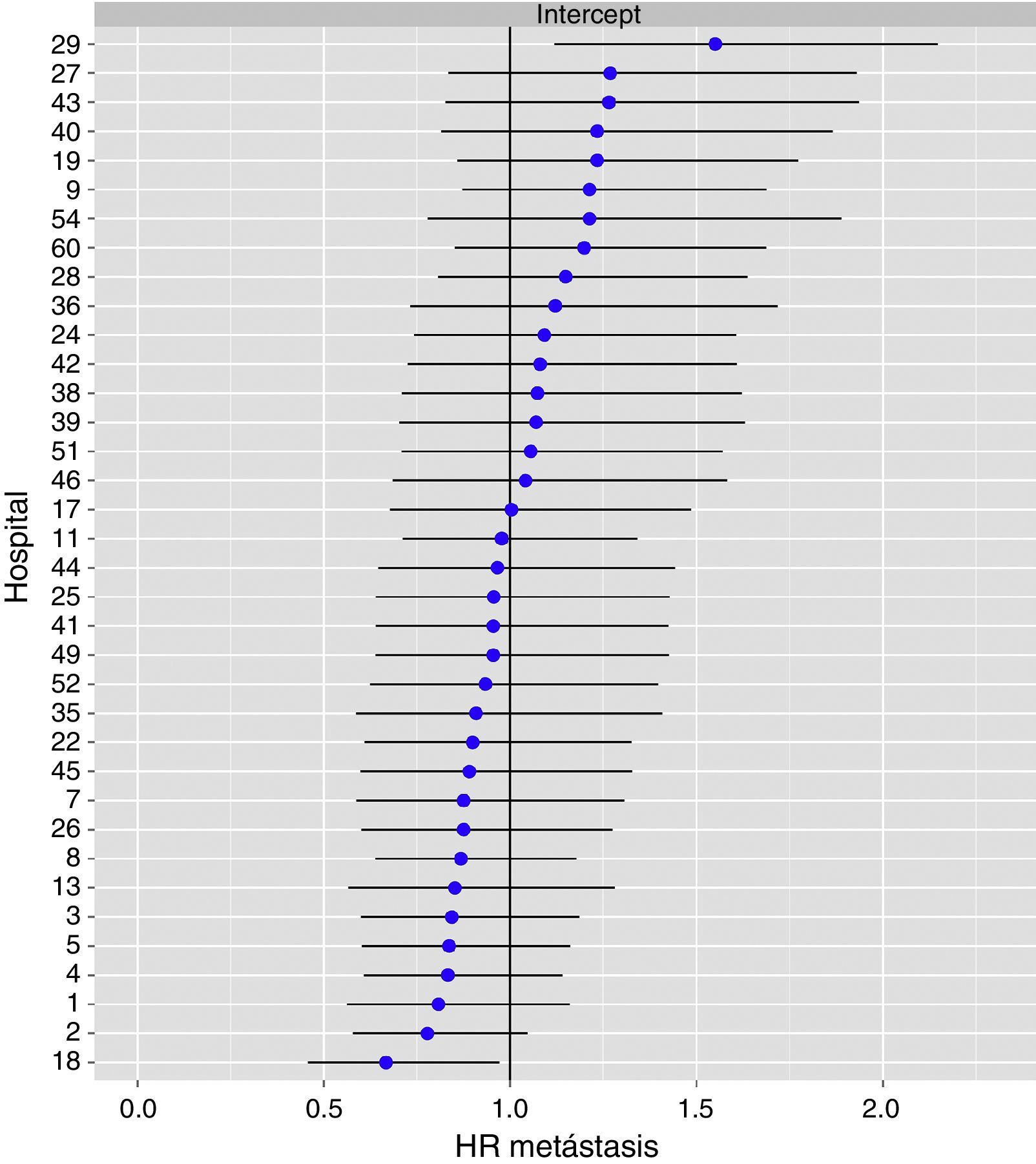
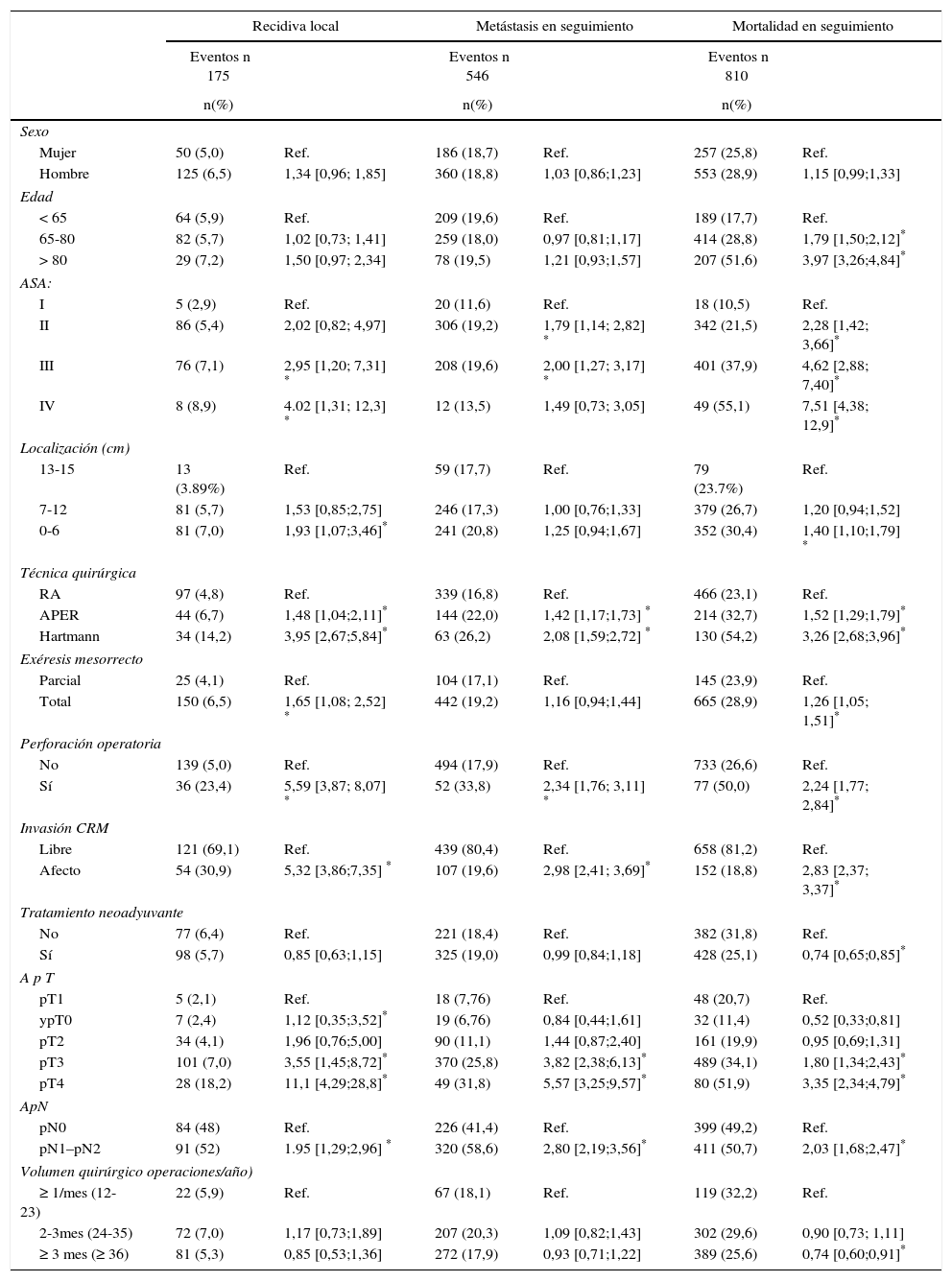
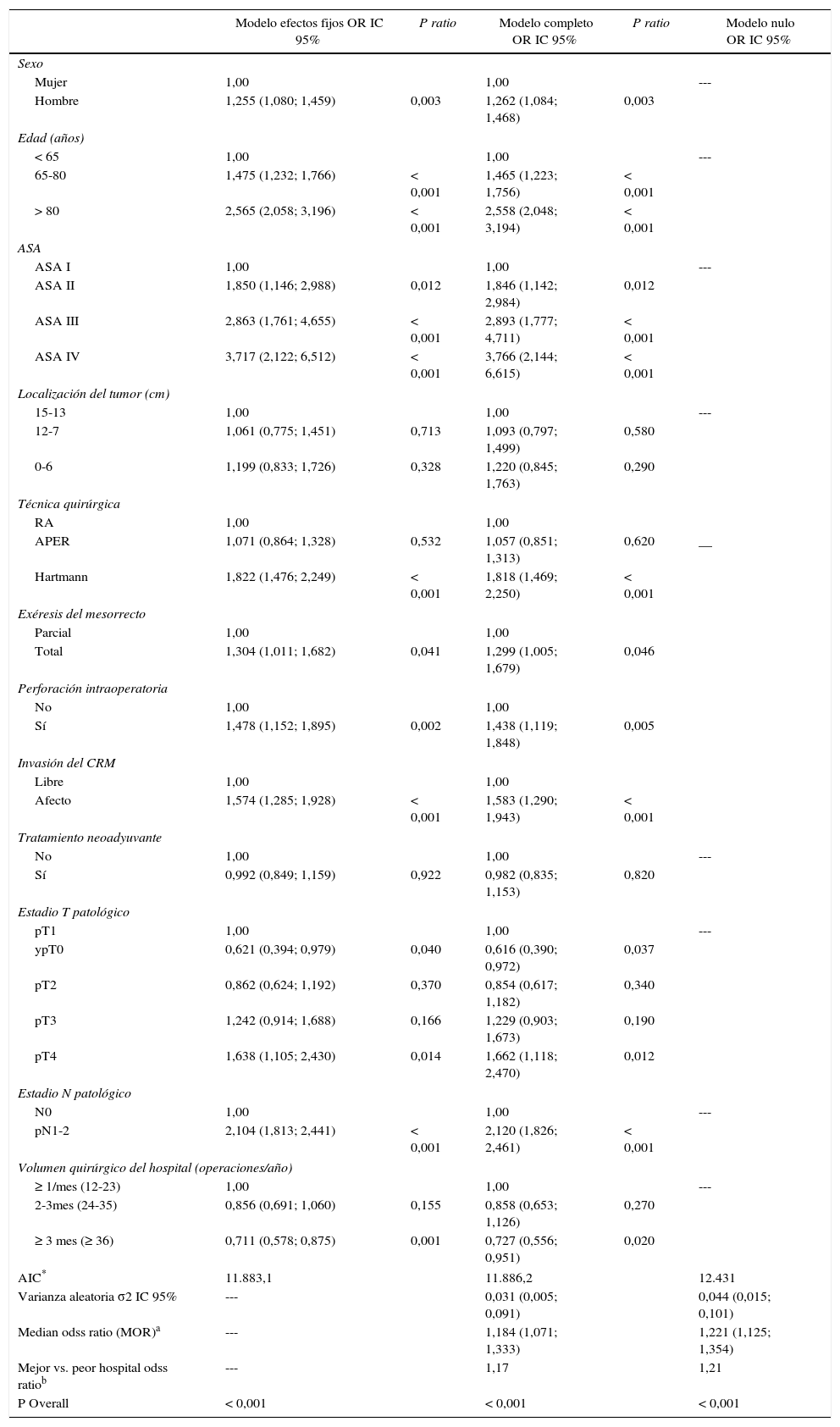
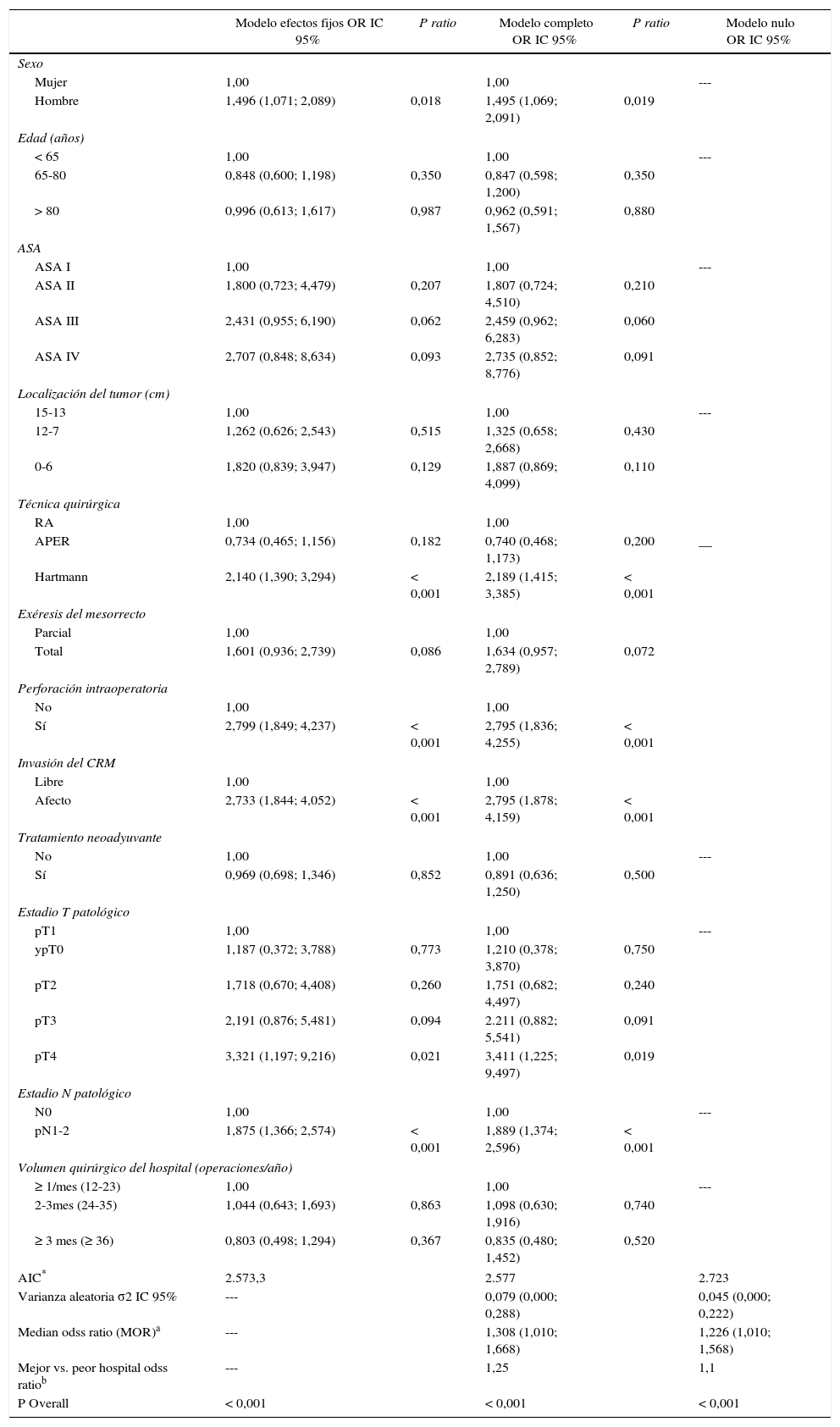
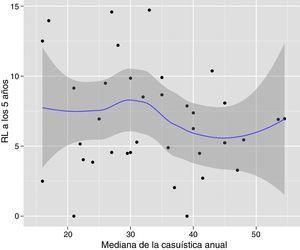
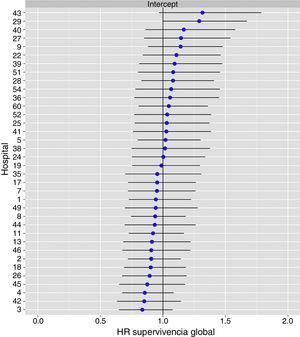
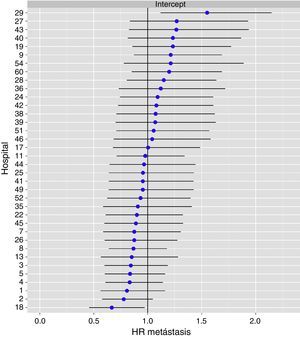
El análisis multinivel mostró una variación significativa entre los hospitales en las tasas de OS (MHR 1,184 [IC 95% 1,071; 1,333]), RL (MHR 1.308 [IC 95% 1,010; 1,668]), y metástasis (MHR 1,300 [IC 95% 1,181; 1,476]) (tablas 3, 4 y 5). La varianza (δ2) entre los hospitales participantes en el modelo logístico fue: OS 0,031 (IC 95% 0,005; 0,091) (fig. 2), RL 0,079 (IC 95% 0,000; 0,288) (fig. 3), y M: 0,065 (IC 95% 0,020; 0,152) (fig. 4).
Diferencias de supervivencia global en los hospitales, obtenido mediante una regresión logística multinivel, considerando la variable hospital como un efecto aleatorizado para corregir por la no independencia de los datos. Los hospitales están representados en el eje vertical con el número de código que tienen en el proyecto. Se muestra el valor del HR para cada hospital. Los hospitales están ordenados de menor a mayor valor de la constante, siendo los valores positivos de la constante los que indican peores resultados.
Diferencias de recidiva local en los hospitales, obtenido mediante una regresión logística multinivel, considerando la variable hospital como un efecto aleatorizado para corregir por la no independencia de los datos. Los hospitales están representados en el eje vertical con el número de código que tienen en el proyecto. Se muestra el valor del HR para cada hospital. Los hospitales están ordenados de menor a mayor valor de la constante, siendo los valores positivos de la constante los que indican peores resultados.
Diferencias de metástasis en los hospitales, obtenido mediante una regresión logística multinivel, considerando la variable hospital como un efecto aleatorizado para corregir por la no independencia de los datos. Los hospitales están representados en el eje vertical con el número de código que tienen en el proyecto. Se muestra el valor del HR para cada hospital. Los hospitales están ordenados de menor a mayor valor de la constante, siendo los valores positivos de la constante los que indican peores resultados.
Los resultados de este estudio indican que, en el Proyecto del Cáncer de Recto de la AEC, las tasas de supervivencia general fueron mayores en los hospitales que operaban 36 o más pacientes al año, y que el volumen quirúrgico no influyó en la tasas de recidiva local.
La mayor debilidad de este estudio tiene que ver con la naturaleza voluntaria de inclusión de los datos en el Proyecto del Cáncer de Recto de la AEC, sobre todo cuando se compara con los registros de los países escandinavos10–12, en los que la inclusión de datos en el registro es obligatoria. Sin embargo, como ya se indicó con más detalle4, se han tomado diversas iniciativas para evitar sesgos voluntarios o involuntarios de inclusión y de información. Desgraciadamente, debido al carácter anónimo de los datos y a la carencia de otras fuentes para contrastar la información de las que se carece en nuestro país, los datos de este estudio indican las tasas mínimas de recidiva local, metástasis y supervivencia general.
La tasa de RL observada a los cinco años del inicio de este proyecto, 6,6%, es similar a la observada en Noruega10 (8%), en el análisis del periodo 2004-2006 y a la comunicada por el registro de Suecia11 (7,2%) para el periodo 2001-2006. En el registro danés este indicador de resultado no se evalúa12. La tasa de OS en este proyecto (72,3%) se sitúa entre las publicadas por los registros de Noruega10 (76%) y Suecia11 (75,8%) y la observada en Dinamarca12 (68%).
No obstante estos resultados se han conseguido con diferentes tasas de utilización de tratamientos neoadyuvantes: 32% en Noruega10, 59% en España4 y 61% en Suecia11. Además, mientras en Suecia11 el tratamiento en este periodo era básicamente radioterapia de ciclo corto (57% radioterapia de ciclo corto y 4% radioquimioterapia) en España4 y Noruega10 era radioquimioterapia.
Además, es reseñable que las tasas de RL en este proyecto mejoran con el tiempo transcurrido desde el inicio del mismo; en el periodo 2006-2007 a los dos años del inicio del proyecto la tasa era del 8%. Este hecho también se ha observado en Noruega10 y en Suecia11, países en los que las tasas en los pacientes operados en los periodos 2007-2012 han disminuido hasta cifras del 4 y 5 por ciento respectivamente. Lo cual parece indicar que el hecho de que un hospital se concentre, mediante la auditoría de sus resultados y la formación continuada del equipo multidisciplinar, en el tratamiento de esta enfermedad hace que los resultados mejoren de forma progresiva.
Recientemente en Estados Unidos el Consortium for Optimizing the Treatment of Rectal Cancer (the OSTRiCh Consortium) ha publicado los resultados de una auditoría sobre 16.619 pacientes, que ha permitido comprobar que en 2.859 (17,2%) el CRM estaba invadido13, lo que ha llevado a editorializar sobre la necesidad de modificar la asistencia en ese país14. Para ello este consorcio OSTRiCh15 compuesto por varias asociaciones profesionales (American College of Pathologists, American College of Surgeons American College of Radiology, Society for Surgery of the Alimentary Tract, Society Surgery Oncology, Society of American Gastrointestinal and Endoscopic Surgeons) ha propuesto diversas iniciativas, similares a las de los proyectos europeos, para mejorar la calidad de la cirugía del cáncer de recto mediante la promoción, la enseñanza y la investigación.
En cuanto a la influencia del volumen quirúrgico anual en los resultados oncológicos de la operación, los datos de este estudio discrepan de los observados en el Norwegian ColoRectal Cancer Project2 y en el Swedish Rectal Cancer Registry3. En ambos se observó que el volumen quirúrgico anual influía en la RL, y además en el registro sueco el volumen quirúrgico tampoco influía en la OS. No obstante, la comparación de los resultados de este estudio con los de los registros poblacionales de Escandinavia tiene la limitación de que al iniciar el proyecto del cáncer de recto de la AEC se excluyeron del mismo los hospitales con volúmenes quirúrgicos anuales menores de 12 pacientes año; esta decisión se tomó debido a que en el Norwegian ColoRectal Cancer Project2 se puso de manifiesto que las tasas de RL de los hospitales que realizaban menos de 10 resecciones al año doblaban las de los hospitales que realizaban 30 o más, 17, y 9,6% respectivamente. Además, en el Stockholm TME Project16 se observó que los cirujanos que realizaban menos de 12 resecciones de recto al año tenían unas tasas de RL mayor del doble que los que realizaban más de 12: 10 y 4% respectivamente. Otra limitación para realizar la comparación de los resultados, especialmente con la supervivencia en Suecia, es que los intervalos de pacientes operados anualmente empleados para hacer las comparaciones son diferentes en los tres registros. En Suecia3: < 11, 11-25,>25, en Noruega2: < 10, 10-19, 20-29, ≥ 30; mientras que en este proyecto son: 12-23, 24-35, ≥ 36.
Este estudio muestra que cuanto mayor es la frecuencia con la que se realiza la cirugía del cáncer de recto en un hospital mejores son los resultados oncológicos, pero también indica que el volumen en sí mismo no es la explicación ya que en este proyecto hay hospitales con volúmenes pequeños con resultados mejores que los hospitales con volúmenes intermedios o grandes. Por tanto, el volumen quirúrgico es un indicador de la calidad fácil de entender pero imperfecto ya que en sí mismo no garantiza el resultado.
En conclusión, en los grupos multidisciplinares seleccionados e incluidos en el proyecto de la AEC, que incluye la enseñanza de la escisión total del mesorrecto y la realimentación de los resultados, la supervivencia global es mayor en los hospitales con mayor volumen quirúrgico, y la variabilidad interhospitalaria de la tasa de recidiva local no se explica por el volumen quirúrgico.
FinanciaciónEste proyecto ha sido financiado con las siguientes ayudas de investigación: FIS numero: PI11/00010 y Consejería de Sanidad, Gobierno de Navarra: 20/11.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Virgen de la Arrixaca (Juan Luján), Bellvitge (Doménico Fraccalvieri, Sebastiano Biondo), Complejo Hospitalario de Navarra (Miguel Á. Ciga), Clínico de Valencia (Alejandro Espí), Josep Trueta (Antonio Codina, Francesc Olivet), Sagunto (María D. Ruiz), Vall de Hebrón (Eloy Espin, F. Vallribera), La Fe (Pablo García Granero), Complejo Hospitalario Ourense (Alberto Parajo), Germans Trias i Pujol (Ignasi Camps, Marta Piñol), Lluis Alcanyis (Vicent Viciano), Complejo Asistencial Burgos (Evelio Alonso), del Mar (Miguel Pera), Complejo Asistencial Salamanca (Jacinto García), Gregorio Marañón (Marcos Rodríguez), Torrecárdenas (Ángel Reina), General de Valencia (Verónica Gumbau, Isabel Grifo), Txagorritxu (José Errasti), Donostia (José A. Múgica), Reina Sofía (José Gómez), Arnau de Vilanova de Valencia (Natalia Uribe), General de Jerez (Juan de Dios Franco), Arnau de Vilanova de Lleida (José Enrique Sierra), Santa Creu i Sant Pau (Pilar Hernández, Jesús Bollo, Carmen Martínez), Clínico de Santiago de Compostela (Jesús Paredes), Universitario de Jaén (Gabriel Martínez, Javier Gutiérrez), Clínico San Carlos (Mauricio García), Cabueñes (Guillermo Carreño), General de Albacete (Jesús Cifuentes), Miguel Servet (José Monzón), Xeral de Lugo (Olga Maseda), Clínico y Provincial de Barcelona (Luis Flores), Virgen de las Nieves (Inmaculada Segura, Pablo Palma), Nuestra Señora de la Candelaria (José G. Díaz), Clínico Universitario San Cecilio (Francisco Pérez, Benito Mirón), Xeral - Cies de Vigo (Nieves Cáceres).