Es bien aceptado por la comunidad quirúrgica que la colecistectomía laparoscópica (CL) es la técnica de elección en el tratamiento de la colelitiasis sintomática. Sin embargo, más controvertida es la estandarización de su realización en régimen de cirugía mayor ambulatoria (CMA) por las diversas connotaciones que presenta. Este artículo tiene por objeto actualizar los factores influyentes en la realización de la CL en régimen de cirugía sin ingreso, analizando estos 25 años desde su implantación, incidiendo en la calidad y aceptación del proceso por parte del paciente. Es fundamental la individualización del proceso: un estricto criterio de selección de pacientes y la realización por equipos con experiencia en CL, son factores que aseguran una alta garantía de éxito
It is accepted by the surgical community that laparoscopic cholecystectomy (LC) is the technique of choice in the treatment of symptomatic cholelithiasis. However, more controversial is the standardization of system implementation in Ambulatory Surgery because of its different different connotations. This article aims to update the factors that influence the performance of LC in day surgery, analyzing the 25 years since its implementation, focusing on the quality and acceptance by the patient. Individualization is essential: patient selection criteria and the implementation by experienced teams in LC, are factors that ensure high guarantee of success.
El postoperatorio de la colecistectomía laparoscópica (CL) sigue un curso muy breve permitiendo al paciente reiniciar rápidamente la tolerancia oral y comenzar la deambulación precozmente1. Así mismo, el tiempo intraoperatorio de esta técnica ha ido disminuyendo progresivamente, por lo que todas estas características hacen que actualmente gran parte de las CL por colelitiasis no complicada se realicen en régimen de corta estancia que ronda las 12-24 horas.
Esto indujo a algunos autores a principios de la década de los noventa a plantearse la posibilidad de realizar la CL en régimen ambulatorio (CLA) con el máximo de garantías. Ello aportaría una mejoría de la calidad asistencial, debido a la disminución de la tasa de infección nosocomial, mínimos cambios en los hábitos y estilo de vida del paciente, y la optimización de recursos, con disminución del número de camas necesarias, facilitando el incremento del volumen de procedimientos, y reduciendo las listas de espera quirúrgicas2. Se ha postulado que las implicaciones de la implementación de la CLA en nuestro país incluirían un ahorro de hasta 70 millones de euros (costes reducidos por estancia), sin considerar los costes eliminados de la atención sanitaria en régimen de ingreso3.
Pero la principal reticencia que ha presentado este enfoque ambulatorio es que muchos cirujanos prefieren períodos de tiempo de al menos 24 horas, con estancia nocturna hospitalaria, para detectar y evitar retrasos en la aparición de alguna complicación vital durante el postoperatorio inmediato. Por tanto, es necesario tener en cuenta una serie de principios básicos que marquen la realización de la CLA, para asegurar la más alta probabilidad de éxito con la máxima seguridad para el paciente:
- a)
criterios de selección del paciente, que tras una adecuada información preoperatoria acepten este tipo de cirugía sin ingreso;
- b)
técnica quirúrgica meticulosa por cirujanos adiestrados en este tipo de abordaje laparoscópico;
- c)
analizar las complicaciones postoperatorias tempranas y prevenir su aparición;
- d)
establecer criterios rigurosos al alta;
- e)
llevar a cabo un control postoperatorio inmediato estricto, estableciendo revisiones clínicas seriadas; y
- f)
evaluar el grado de satisfacción y la calidad percibida por el paciente intervenido.
Este artículo tiene por objeto revisar todos los factores que juegan en la actualidad un papel fundamental en la implementación de la CLA, incidiendo en la calidad y aceptación del proceso, y analizando con ello estos 25 años desde su implantación en la comunidad quirúrgica.
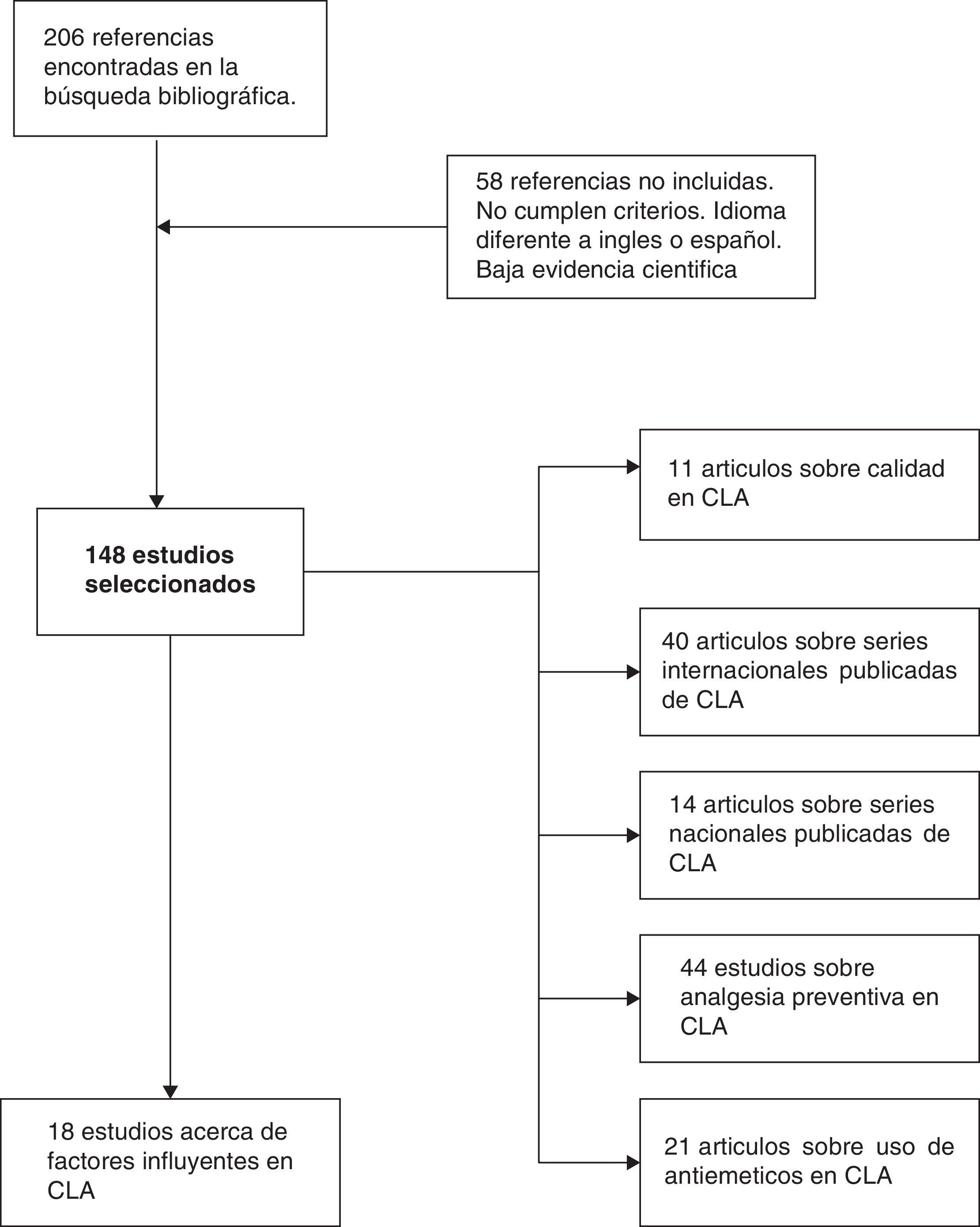
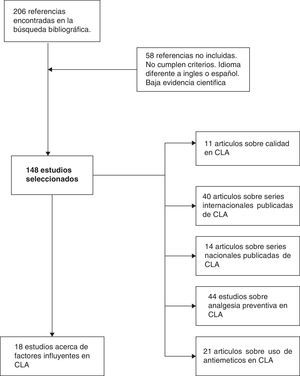
MétodoHemos efectuado una búsqueda electrónica en Pubmed y Cochrane Library (enero 1989-diciembre 2014) de artículos científicos (originales y revisiones) en inglés y español con los términos «laparoscopic cholecystectomy», «outpatient laparoscopic cholecystectomy», «ambulatory surgery», «day-case laparoscopic cholecystectomy» y «ambulatory laparoscopic cholecystectomy». Hemos encontrado 206 referencias en común a las diferentes combinaciones de «keywords». Descartamos 58 artículos por no cumplir adecuados niveles de evidencia, o estar escritos en otra lengua diferente al inglés o español. Finalmente hemos revisado un total de 148 artículos, valorando los abstracts de todos los estudios, y analizando en profundidad con lectura completa de cada uno en 54 casos (fig. 1). Nos hemos apoyado en los principios de medicina basada en la evidencia para establecer los niveles y categorías de las aseveraciones principales en determinados apartados de la revisión (tabla 1).
Niveles y categorías de las aseveraciones según los principios de medicina basada en la evidencia
| Nivel evidencia | |
| Nivel I Nivel II Nivel III | Evidencia de al menos un ensayo clínico randomizado o metaanálisis Evidencia de al menos un ensayo clínico no randomizado, estudios de cohortes o casos-control (preferentemente de un único centro), o estudios no controlados Evidencia de opiniones de autoridades científicas o de estudios observacionales |
| Categorías | |
| Cat. A Cat. B Cat. B | Recomendaciones aprobadas por consenso (al menos el 75% del panel experto) Recomendaciones controvertidas (aprobadas por 75-50% de expertos) Recomendaciones que causan desacuerdos entre los miembros del panel |
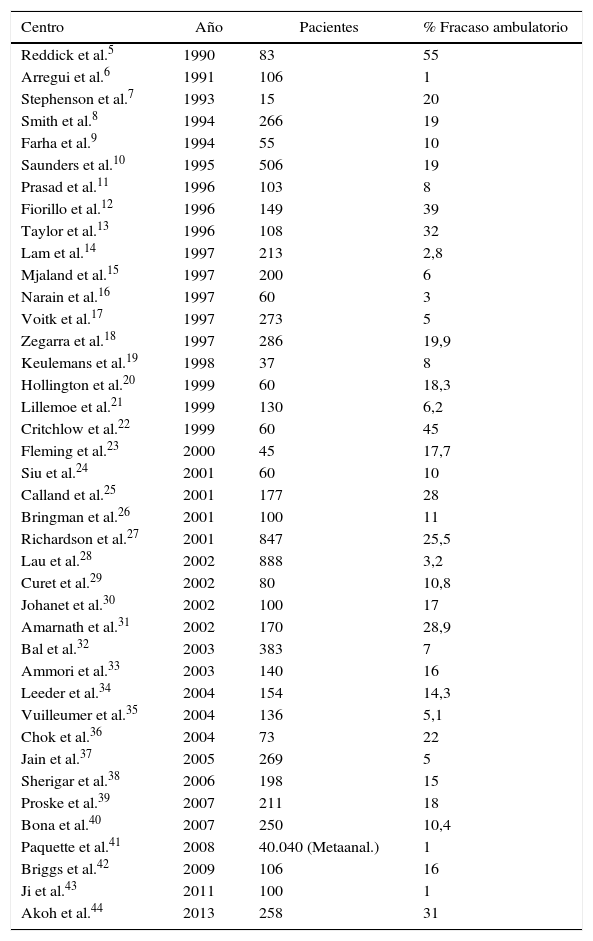
Aunque se considera que Muhe en Alemania fue el precursor de la CLA4, Reddick y Olsen inciden en este concepto en 1990 al publicar una serie de 83 CL, aportando la posibilidad de ambulatorización en un 45% con un porcentaje ínfimo de complicaciones5. En los años sucesivos, numerosos grupos han obtenido resultados aceptables en cuanto al índice de sustitución (65-99%), y con una elevada fiabilidad y seguridad para el paciente5–44 (tabla 2). Estos resultados, sin embargo, muestran una enorme sobredispersión, lo cual es claramente indicativo de que los protocolos de selección y de ejecución del proceso son muy variables entre los diversos autores.
Estudios internacionales publicados en lengua inglesa relacionados con la CLA
| Centro | Año | Pacientes | % Fracaso ambulatorio |
|---|---|---|---|
| Reddick et al.5 | 1990 | 83 | 55 |
| Arregui et al.6 | 1991 | 106 | 1 |
| Stephenson et al.7 | 1993 | 15 | 20 |
| Smith et al.8 | 1994 | 266 | 19 |
| Farha et al.9 | 1994 | 55 | 10 |
| Saunders et al.10 | 1995 | 506 | 19 |
| Prasad et al.11 | 1996 | 103 | 8 |
| Fiorillo et al.12 | 1996 | 149 | 39 |
| Taylor et al.13 | 1996 | 108 | 32 |
| Lam et al.14 | 1997 | 213 | 2,8 |
| Mjaland et al.15 | 1997 | 200 | 6 |
| Narain et al.16 | 1997 | 60 | 3 |
| Voitk et al.17 | 1997 | 273 | 5 |
| Zegarra et al.18 | 1997 | 286 | 19,9 |
| Keulemans et al.19 | 1998 | 37 | 8 |
| Hollington et al.20 | 1999 | 60 | 18,3 |
| Lillemoe et al.21 | 1999 | 130 | 6,2 |
| Critchlow et al.22 | 1999 | 60 | 45 |
| Fleming et al.23 | 2000 | 45 | 17,7 |
| Siu et al.24 | 2001 | 60 | 10 |
| Calland et al.25 | 2001 | 177 | 28 |
| Bringman et al.26 | 2001 | 100 | 11 |
| Richardson et al.27 | 2001 | 847 | 25,5 |
| Lau et al.28 | 2002 | 888 | 3,2 |
| Curet et al.29 | 2002 | 80 | 10,8 |
| Johanet et al.30 | 2002 | 100 | 17 |
| Amarnath et al.31 | 2002 | 170 | 28,9 |
| Bal et al.32 | 2003 | 383 | 7 |
| Ammori et al.33 | 2003 | 140 | 16 |
| Leeder et al.34 | 2004 | 154 | 14,3 |
| Vuilleumer et al.35 | 2004 | 136 | 5,1 |
| Chok et al.36 | 2004 | 73 | 22 |
| Jain et al.37 | 2005 | 269 | 5 |
| Sherigar et al.38 | 2006 | 198 | 15 |
| Proske et al.39 | 2007 | 211 | 18 |
| Bona et al.40 | 2007 | 250 | 10,4 |
| Paquette et al.41 | 2008 | 40.040 (Metaanal.) | 1 |
| Briggs et al.42 | 2009 | 106 | 16 |
| Ji et al.43 | 2011 | 100 | 1 |
| Akoh et al.44 | 2013 | 258 | 31 |
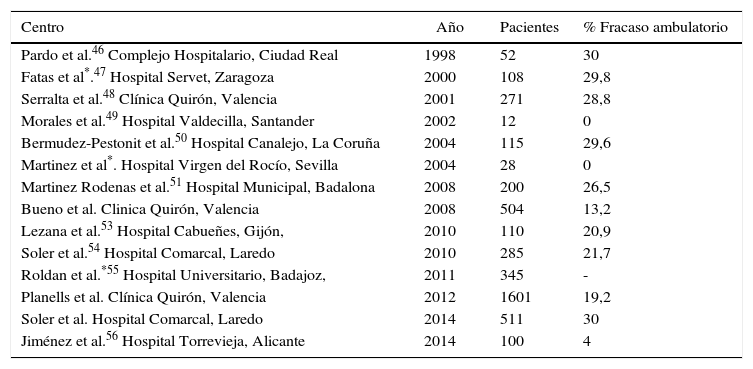
En nuestro país, el estudio multicéntrico realizado en 2006 por la Asociación Española de Cirujanos para desarrollar la vía clínica de la CL45 obtuvo datos de 37 hospitales y 426 pacientes, de los cuales únicamente 16 (3,8%) habían sido operados en régimen de cirugía mayor ambulatoria (CMA), lo cual, sin tener el valor de una encuesta nacional, era bastante indicativo de la escasa implantación de la CLA. A pesar de estos datos, determinados grupos (tabla 3) han obteniendo buenos resultados en las series iniciales1,3,46–57.
Estudios nacionales publicados en relación con la CLA y fracaso de ambulatorización de las series
| Centro | Año | Pacientes | % Fracaso ambulatorio |
|---|---|---|---|
| Pardo et al.46 Complejo Hospitalario, Ciudad Real | 1998 | 52 | 30 |
| Fatas et al*.47 Hospital Servet, Zaragoza | 2000 | 108 | 29,8 |
| Serralta et al.48 Clínica Quirón, Valencia | 2001 | 271 | 28,8 |
| Morales et al.49 Hospital Valdecilla, Santander | 2002 | 12 | 0 |
| Bermudez-Pestonit et al.50 Hospital Canalejo, La Coruña | 2004 | 115 | 29,6 |
| Martinez et al*. Hospital Virgen del Rocío, Sevilla | 2004 | 28 | 0 |
| Martinez Rodenas et al.51 Hospital Municipal, Badalona | 2008 | 200 | 26,5 |
| Bueno et al. Clinica Quirón, Valencia | 2008 | 504 | 13,2 |
| Lezana et al.53 Hospital Cabueñes, Gijón, | 2010 | 110 | 20,9 |
| Soler et al.54 Hospital Comarcal, Laredo | 2010 | 285 | 21,7 |
| Roldan et al.*55 Hospital Universitario, Badajoz, | 2011 | 345 | - |
| Planells et al. Clínica Quirón, Valencia | 2012 | 1601 | 19,2 |
| Soler et al. Hospital Comarcal, Laredo | 2014 | 511 | 30 |
| Jiménez et al.56 Hospital Torrevieja, Alicante | 2014 | 100 | 4 |
Analizando las tablas 1 y 2, observamos que el porcentaje medio ponderado de fracasos se sitúa en el 15,10% a nivel internacional, y en un 20,27% en nuestro ámbito: cualquier desviación significativa sobre estas cifras indicarían una mala indicación o inadecuados criterios de selección del proceso, o por el contrario, situarían los resultados en el terreno de la excelencia.
Estos 3 últimos años se han presentado estudios evaluando la posibilidad de ambulatorización en la CL por puerto único (SILS), aunque estos se han interpretado con base en estancias nocturnas58,59.
Criterios de selección para la inclusión de la CLA. Factores influyentes en la ambulatorizaciónLa tasa de ingreso no esperado en la CLA oscila entre un 6-25%, debido principalmente a la aparición de síntomas postoperatorios (vómitos y dolor abdominal), la conversión a cirugía abierta y la inseguridad del paciente al alta precoz33,60–62. Se han identificado determinados factores preoperatorios e intraoperatorios que influyen en la posibilidad de dicha ambulatorización, y que exponemos a continuación.
Factores predictivos preoperatoriosEdad del pacienteUna de las variables independientes más importantes del éxito de ambulatorización: la edad superior a 65 años representa un factor predictivo de fracaso en la CLA3,19,63,64. Conlleva una mayor probabilidad de aumentar el tiempo intraoperatorio debido a los hallazgos de vesícula complicada, aparición de complicaciones derivadas de su patología de base, y aumento de negativas al alta hospitalaria por inseguridad a pesar de la información recibida (denominada también «causa social»)19,65,66.
Dos artículos recientes rebaten estas aseveraciones, exponiendo un aceptable índice de sustitución (hasta del 70%) en pacientes mayores de 65 años67,68.
Hallazgo de colecistitis agudaEl hallazgo de un engrosamiento de la pared vesicular en la ecografía hepatobiliar multiplica por 3 la probabilidad de ingreso tras CL61.
Historia previa de patología biliar complicadaEl antecedente de episodio de coledocolitiasis y la necesidad de realización preoperatoria de colangiopancreatografía retrograda endoscópica (CPRE) no representa un factor influyente negativo. Sin embargo, el antecedente de colecistitis o de pancreatitis aguda previo a la colecistectomía se ha relacionado con el fracaso en la CLA5,19,66,69. Esta aseveración estaría en relación con la disección dificultosa por adherencias densas o por vesícula hidrópica, aumentando la posibilidad de complicaciones intra y postoperatorias, e interfiriendo en el alta precoz.
Obesidad mórbidaAunque la existencia de obesidad (IMC superior a 30) fue considerada criterio de exclusión33, en la actualidad no representa una contraindicación absoluta, aunque se han atribuido inconvenientes relacionados con las características de estos pacientes.
Cirugía previa abdominal supramesocólicaRepresenta criterio de exclusión en un programa de CLA, ocasionado por la posibilidad de encontrar adherencias intraabdominales, y conllevando un aumento del tiempo intraoperatorio o la necesidad de conversión5,10,47,64,70.
Clasificación de riesgo anestésico (ASA)Mientras diversos autores delimitan dichos criterios únicamente a los grados ASA I y II, en la actualidad se abre el abanico de oferta a los grados ASA III en situación estable19,23,26,33–36,61.
Anticoagulación oralEn líneas generales, no son pacientes ideales a incluir en CLA, donde debe existir un estricto control de la hemostasia quirúrgica. Por el contrario, la antiagregación oral no se considera criterio de exclusión, al existir un mejor manejo ambulatorio, una menor morbilidad y un mejor control posológico que los dicumarínicos71.
Factores predictivos intraoperatoriosTiempo quirúrgicoRepresenta en algunas series, el factor predictivo más importante de ambulatorización61. Se ha establecido que una duración de la colecistectomía superior a 60 minutos conlleva asociada una alta probabilidad de estancia nocturna o ingreso10,17. Es, por tanto, una función multifactorial que incluiría factores como la dificultad quirúrgica de disección, la presencia de alguna complicación intraoperatoria o hallazgo de adherencias al acceder a la cavidad abdominal.
Una cirugía de larga duración desemboca en un tiempo anestésico prolongado, aparición de náuseas y vómitos (N/V), e inseguridad en el propio cirujano debido a la cirugía «compleja», lo que también influye en el retraso del alta hospitalaria12.
Equipo quirúrgico: aportación de un «score» de dificultad quirúrgicaLa experiencia del equipo quirúrgico en el abordaje laparoscópico es vital para conseguir no alargar innecesariamente el tiempo intraoperatorio. Se ha creado un score de «dificultad» de la disección quirúrgica, que permite diferenciar y clasificar las variables que juegan un papel clave durante la CL: la disección del triángulo de Calot, la identificación del conducto cístico y de la arteria cística, y, por último, la disección del lecho hepático72,73. Así mismo, se describió el término de CL «técnicamente dificultosa», donde en los pacientes del sexo femenino, historia previa de cólicos hepáticos simples y ecografía sin engrosamiento de pared vesicular, cabe esperar una colecistectomía técnicamente más sencilla69.
Perforación vesicularInfluye en el aumento del tiempo quirúrgico, aunque no en el resultado final ambulatorio74.
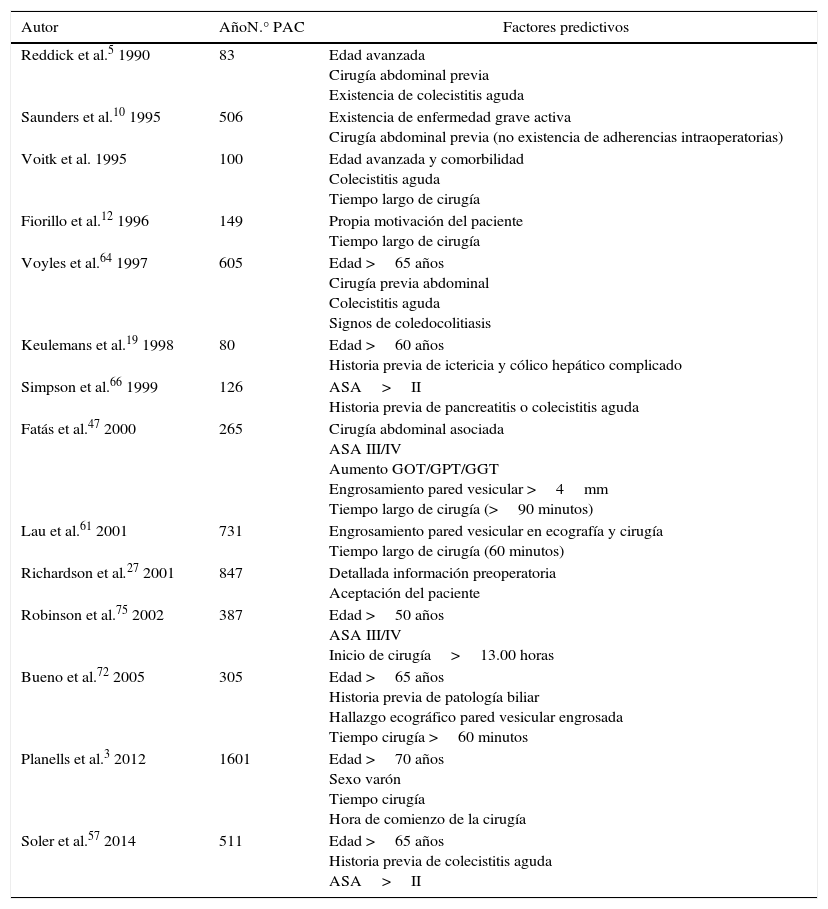
Modelo predictivo de fracaso de CLAExisten scores predictivos basados en variables preoperatorias analizadas anteriormente59,64,68,75; en líneas generales, los pacientes por debajo de 65 años, con clasificación ASA grado I o II, sin cirugía previa abdominal asociada, sin antecedentes de colecistitis aguda, y con una duración de intervención menor a 60 minutos, son los mejores candidatos para incluirse en un programa de CLA (tabla 4).
Factores predictivos que influyen negativamente en el éxito de un programa de CL en régimen ambulatorio
| Autor | AñoN.° PAC | Factores predictivos |
|---|---|---|
| Reddick et al.5 1990 | 83 | Edad avanzada Cirugía abdominal previa Existencia de colecistitis aguda |
| Saunders et al.10 1995 | 506 | Existencia de enfermedad grave activa Cirugía abdominal previa (no existencia de adherencias intraoperatorias) |
| Voitk et al. 1995 | 100 | Edad avanzada y comorbilidad Colecistitis aguda Tiempo largo de cirugía |
| Fiorillo et al.12 1996 | 149 | Propia motivación del paciente Tiempo largo de cirugía |
| Voyles et al.64 1997 | 605 | Edad >65 años Cirugía previa abdominal Colecistitis aguda Signos de coledocolitiasis |
| Keulemans et al.19 1998 | 80 | Edad >60 años Historia previa de ictericia y cólico hepático complicado |
| Simpson et al.66 1999 | 126 | ASA>II Historia previa de pancreatitis o colecistitis aguda |
| Fatás et al.47 2000 | 265 | Cirugía abdominal asociada ASA III/IV Aumento GOT/GPT/GGT Engrosamiento pared vesicular >4mm Tiempo largo de cirugía (>90 minutos) |
| Lau et al.61 2001 | 731 | Engrosamiento pared vesicular en ecografía y cirugía Tiempo largo de cirugía (60 minutos) |
| Richardson et al.27 2001 | 847 | Detallada información preoperatoria Aceptación del paciente |
| Robinson et al.75 2002 | 387 | Edad >50 años ASA III/IV Inicio de cirugía>13.00 horas |
| Bueno et al.72 2005 | 305 | Edad >65 años Historia previa de patología biliar Hallazgo ecográfico pared vesicular engrosada Tiempo cirugía >60 minutos |
| Planells et al.3 2012 | 1601 | Edad >70 años Sexo varón Tiempo cirugía Hora de comienzo de la cirugía |
| Soler et al.57 2014 | 511 | Edad >65 años Historia previa de colecistitis aguda ASA>II |
Hoy en día aún se cuestiona la seguridad del abordaje ambulatorio argumentando el posible retraso en la detección y en la solución de estas complicaciones. Sin embargo, la incidencia de una complicación vital que necesite de una actuación emergente, como un sangrado arterial, es muy baja, y se hace sintomática en las primeras horas del postoperatorio, pudiéndose detectar mientras el paciente está aún en el hospital76,77. Tras este pico de escasa incidencia las primeras horas, posteriormente a las primeras 24-48 horas postoperatorias son detectadas la mayoría de las complicaciones no emergentes descritas22.
Uno de los estudios multicéntricos más amplios norteamericanos evalúa 77.604 CL realizadas en 4.292 hospitales, observando muy bajas tasas de complicaciones postoperatorias vitales, y detectándolas durante las primeras 8 horas; pero se hace hincapié en un contacto próximo y comunicación obligatoria entre médico y paciente con la intención de no pasar desapercibido ningún síntoma postoperatorio78. Por tanto, un período de observación prudente de 6-8 horas podría ser suficiente, debido a que una estancia nocturna no reduciría la detección de complicaciones vitales.
CLA y aceptación del pacienteLa individualización es fundamental en el planteamiento preoperatorio de la CLA. La aceptación del procedimiento ambulatorio presenta diferencias existentes entre el grado de información demandada con la edad, sexo y nivel cultural del paciente. La información debe asegurar el automanejo domiciliario del postoperatorio por el paciente o su entorno familiar y ser exhaustiva, al objeto de asegurar que la calidad asistencial del proceso es máxima, evitando los efectos indeseables de la desinformación, y que origina un porcentaje nada despreciable de complicaciones no detectadas por el equipo quirúrgico79,80.
Algunos pacientes, sin referir realmente ningún motivo clínico, optan por permanecer ingresados 24 horas, a pesar de haber aceptado la ambulatorización en la información preoperatoria. Esta causa denominada «social», es un factor que incrementa significativamente el porcentaje de ingresos no esperados en un programa de CMA, debido a que puede no ser previsible a pesar de la información suministrada1.
CLA y presencia de vómitos postoperatoriosLas N/V tras la CL presentan una incidencia global cercana al 12-52%, y pueden prolongar la estancia en una unidad de cuidados intermedios hasta en un 56%, con el consiguiente retraso o imposibilidad del alta ambulatoria81,82. Este problema es multifactorial, influyendo las características y enfermedades de base del paciente, así como la susceptibilidad individual de cada enfermo. Se han descrito varios factores asociados a la aparición de N/V tras la CL83:
- a)
factores anestésicos: el uso de derivados opiáceos, así como la utilización de agentes anestésicos inhalados en la inducción anestésica favorecen la aparición de N/V tras la cirugía. El uso del propofol, la administración de oxígeno suplementario 2 horas tras la intervención, el mantenimiento de una correcta hidratación, la reducción en la utilización de neostigmina y de compuestos opioides, reducen la aparición de N/V postoperatorios (Nivel de evidencia I, cat. A)84.
- b)
factores quirúrgicos: conviene destacar el efecto negativo de la presión de insuflación de CO2 por encima de 13mm Hg, así como el gas residual atrapado una vez concluida la intervención85.
- c)
factores postoperatorios: la presencia de dolor postoperatorio o la movilización temprana podrían actuar como estimuladores de la emesis tras la CL86.
La variabilidad interindividual tan marcada del dolor abdominal postoperatorio es característica tras la CL. Entre un 33-50% de los pacientes sufren severo dolor el mismo día de la intervención que obliga a la toma de analgésicos y es responsable de estancia nocturna el día de la intervención en un 24-41% de los pacientes12,87,88.
Se ha demostrado que la herida del trocar umbilical representa la localización más frecuente del dolor de tipo parietal, aunque el componente visceral es el más importante durante las primeras 48 horas postoperatorias89. La tabla 5 expone varias medidas para reducir el dolor postoperatorio tras la realización de la CL, según criterios de medicina basada en la evidencia.
Prevención del dolor abdominal tras la laparoscopia. Recomendaciones basadas en los principios de la medicina basada en la evidencia
| Procedimientos | Recomendaciones | NE |
|---|---|---|
| Procedimientos quirúrgicos - Trocares - Técnica «gasless» - Presión gas - Tipo de gas - Evacuación del gas - Temperatura del gas y humedad | Reducción del tamaño o número de los trocares puede reducir el dolor postoperatorio. Pero se necesitan más estudios randomizados No se recomienda Debe mantenerse lo más baja posible A largo plazo el NO2 debería reemplazar al CO2 si se asegura su utilización Se recomienda la evacuación activa por compresión manual o succión o ambas al final de la cirugía Gas húmedo y precalentado es preferible al gas frío y seco | I (A) I (A) I (A) I (A) I (A) (B)* |
| Procedimientos analgésicos - Anestésicos locales - AINES - Analgesia epidural - Analgesia multimodal | Se recomiendan los utilizados en la incisión quirúrgica. Se requiere más evidencia en los utilizados por vía intraperitoneal. Se recomienda el uso de AINES No recomendada rutinariamente debido a su alta relación costo-beneficio Se recomienda la asociación de única dosis preoperatoria de dexametasona, uso de anestésico local incisional intraoperatoria y durante los primeras 24-72 horas postoperatorias tratamiento con AINES | I (A) I (A) I (A) I (A) |
| Convalecencia - Restricciones | Todos los pacientes deberían ser informados que la incorporación a las actividades diarias y el trabajo pueden reanudarse a los 2-4 días de la cirugía | III (C) |
El característico dolor de hombro (shoulder-tip pain) varia su incidencia entre un 30-50% tras la CL. Suele ser de corta duración y no suele ser intenso, con un pico de entre 24-48 horas tras la laparoscopia90,91. Se ha demostrado que la presión de insuflación por debajo de 10mm Hg, la evacuación del gas residual y la instilación de anestésicos locales en el área de trabajo, disminuye significativamente su intensidad y su frecuencia (Nivel de evidencia I, cat. A)92,93.
CLA y curva de aprendizajeEs estrictamente necesario que la técnica quirúrgica se realice por cirujanos expertos, involucrados en el manejo del abordaje laparoscópico y en la cirugía ambulatoria94. Esta experiencia se ve reflejada en la disminución del tiempo intraoperatorio y anestésico, la menor probabilidad conversión a cirugía abierta y del desarrollo de complicaciones intraoperatorias, o si aparecen, la capacidad de solucionarlas con plena seguridad sin la necesidad de la conversión a cirugía convencional95.
Factores que favorecen la ambulatorización de la CLLa realización de la CLA se ha visto impulsada por el descubrimiento del régimen anestésico «fast track» o de rápida recuperación, y la analgesia multimodal, que permiten anestesias e intervenciones con una rápida recuperación de los pacientes.
Técnica anestésica «fast track»El papel de dicha técnica anestésica se observa en series publicadas a finales de la década de los 90, donde evidencian el papel fundamental del propofol como agente anestésico (Nivel de evidencia I, cat. A)96. También han contribuido los compuestos como el desflurane, isoflurane o sevoflurane, favoreciendo sobre todo este último, la rápida recuperación postanestésica y una más fácil regresión del estado de la sedación97,98.
Hoy por hoy una de las claves de la anestesia multimodal balanceada es la mínima utilización de analgesia con opiáceos. La reciente irrupción de compuestos opiáceos de similares características farmacocinéticas, como el alfentanilo y remifentanilo, e incluso la asociación con ketamina, permite analgesias de acción corta (Nivel de evidencia I, cat. A)99,100.
Es conocido que fármacos despolarizantes como la neostigmina o prostigmina aumentan la incidencia de N/V postoperatorios. En este sentido, el rocuronio, relajante muscular no despolarizante de duración de acción intermedia, representa el agente de elección, aportando buenas condiciones de intubación, gran estabilidad hemodinámica y rápida recuperación101.
Analgesia preventivaLa infiltración o instilación de anestésicos locales antes y durante la exploración laparoscópica aporta al paciente menos dolor postoperatorio, requiriendo menor dosis de analgesia y una más rápida recuperación a la actividad diaria que aquellos pacientes que no la han recibido (Nivel de evidencia I, cat. A)94,102.
Aunque existen resultados contradictorios en relación con el efecto analgésico de la instilación intraperitoneal del agente anestésico, 2 recientes metaanálisis se inclinan en aconsejar sistemáticamente la utilización de bupivacaína al 0,5% en el lecho hepático tras la disección y antes de extraer el neumoperitoneo (Nivel de evidencia I, cat. B)90,91,96,103,104. Las necesidades analgésicas son significativamente menores en pacientes con administración de anestésico en las heridas de los trocares de la CL, y más eficaz en la administración preincisional que la postincisional (Nivel de evidencia I, cat. A)105–109.
Utilización de fármacos antiinflamatorios no esteroideos (AINES)Los fármacos AINES administrados por vía endovenosa reducen significativamente el dolor tras CL comparados con un grupo control110. El ibuprofeno, dexketoprofeno trometamol y el ketorolaco pueden mostrarse durante el procedimiento como alternativas útiles al fentanilo, conllevando la reducción de los efectos indeseables en comparación con el opiáceo y utilizándose en la terapia postoperatoria de las primeras 24-72 horas tras la CL (Nivel de evidencia I, cat. A)111–113.
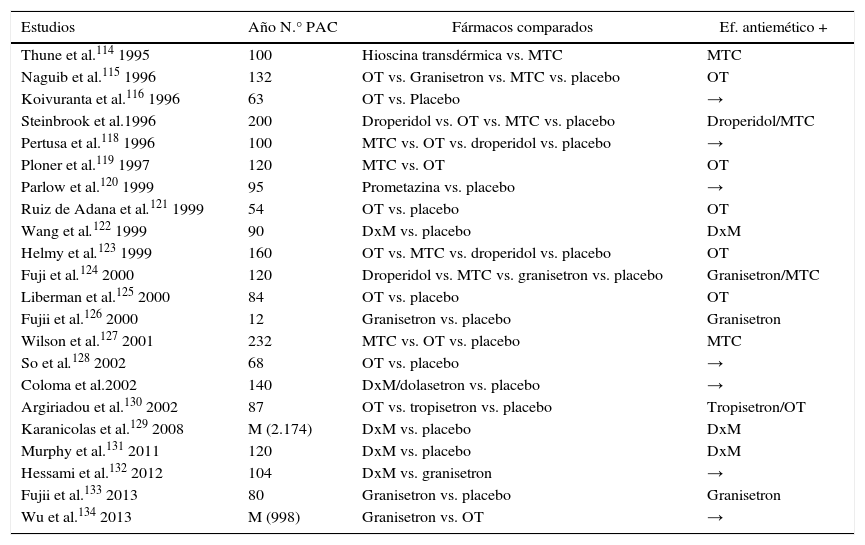
Terapia antieméticaAunque se han publicado ensayos clínicos con gran variabilidad y disparidad en sus resultados, la introducción hace años del ondansetron (OT) ha supuesto una revolución en el manejo anestésico y postoperatorio de la CLA114–134 (tabla 6).
Ensayos clínicos que comparan la tasa de éxito de determinados compuestos utilizados en la profilaxis antiemética tras CL
| Estudios | Año N.° PAC | Fármacos comparados | Ef. antiemético + |
|---|---|---|---|
| Thune et al.114 1995 | 100 | Hioscina transdérmica vs. MTC | MTC |
| Naguib et al.115 1996 | 132 | OT vs. Granisetron vs. MTC vs. placebo | OT |
| Koivuranta et al.116 1996 | 63 | OT vs. Placebo | → |
| Steinbrook et al.1996 | 200 | Droperidol vs. OT vs. MTC vs. placebo | Droperidol/MTC |
| Pertusa et al.118 1996 | 100 | MTC vs. OT vs. droperidol vs. placebo | → |
| Ploner et al.119 1997 | 120 | MTC vs. OT | OT |
| Parlow et al.120 1999 | 95 | Prometazina vs. placebo | → |
| Ruiz de Adana et al.121 1999 | 54 | OT vs. placebo | OT |
| Wang et al.122 1999 | 90 | DxM vs. placebo | DxM |
| Helmy et al.123 1999 | 160 | OT vs. MTC vs. droperidol vs. placebo | OT |
| Fuji et al.124 2000 | 120 | Droperidol vs. MTC vs. granisetron vs. placebo | Granisetron/MTC |
| Liberman et al.125 2000 | 84 | OT vs. placebo | OT |
| Fujii et al.126 2000 | 12 | Granisetron vs. placebo | Granisetron |
| Wilson et al.127 2001 | 232 | MTC vs. OT vs. placebo | MTC |
| So et al.128 2002 | 68 | OT vs. placebo | → |
| Coloma et al.2002 | 140 | DxM/dolasetron vs. placebo | → |
| Argiriadou et al.130 2002 | 87 | OT vs. tropisetron vs. placebo | Tropisetron/OT |
| Karanicolas et al.129 2008 | M (2.174) | DxM vs. placebo | DxM |
| Murphy et al.131 2011 | 120 | DxM vs. placebo | DxM |
| Hessami et al.132 2012 | 104 | DxM vs. granisetron | → |
| Fujii et al.133 2013 | 80 | Granisetron vs. placebo | Granisetron |
| Wu et al.134 2013 | M (998) | Granisetron vs. OT | → |
DxM: dexametasona; Ef: efecto: M: metaanálisis; MTC: metoclopramida; OT: ondansetron; PAC: pacientes; vs.: versus; →: no diferencia significativa entre compuestos.
Grupos de trabajo aportan excelentes resultados con la administración del OT y granisetron para disminuir las N/V tras la CLA (Nivel de evidencia I, cat. A). Se recomienda la administración sistemática de la dexametasona (8mg i.v.) antes de la inducción como medida más eficaz para disminuir la incidencia de N/V (Nivel de evidencia I, cat. A)125–130.
Calidad percibida en CLALa evaluación de la calidad en la asistencia asociada a la posibilidad de la ambulatorización debe incluir el análisis de la seguridad, eficacia y satisfacción del paciente en relación con este81,135,136.
Necesidad de encuestas de satisfacciónRepresenta una condición indispensable para evaluar los objetivos marcados durante estos 25 años, analizar el resultado del proceso ambulatorio al objeto de poder dar respuesta a las necesidades y expectativas de los pacientes, y conocer cuál es su grado de satisfacción percibida. El grado de aceptación manifestado por el paciente en la CLA varía entre el 60-95%15,19,21,24,25,27,137.
La insatisfacción demostrada por el paciente, aunque escasa según las series, se puede correlacionar con variables como el tiempo de espera entre la admisión en el hospital y la intervención, el tiempo transcurrido entre la intervención y el alta, y la cantidad de dolor padecido138. Por tanto, cuestiones importantes que aún se debaten son el período de tiempo más acertado para la realización de la encuesta de calidad percibida, y si esta, debe realizarse de modo anónimo o no20,21,33,35.
Se ha observado una disminución significativa del porcentaje de fracasos en un programa de CLA estableciendo protocolos preoperatorios de información al paciente, en el que este contesta varios aspectos en relación con la aceptación del alta temprana tras la cirugía27,139–141. En nuestro país, escasas series han publicado resultados relacionados con la aceptación del proceso tras la realización de una encuesta postoperatoria. Este porcentaje oscila entre el 85-98%, aunque debemos añadir que hasta un 19% de pacientes indicaron que les pareció demasiado pronto el momento del alta o se sintieron inseguros por no ingresar3,51,63,142.
Seguimiento postoperatorioExisten diversas modalidades de actuación durante el seguimiento postoperatorio de la CLA: desde grupos que establecen visitas al domicilio del paciente ante molestias persistentes los primeros días de la cirugía20,143 hasta controles seriados únicamente telefónicos las 3 primeras semanas de la cirugía 23,31. La mayoría de trabajos coinciden en que el manejo postoperatorio ideal es aquel realizado mediante un primer contacto la misma noche o a la mañana siguiente de la intervención, apoyado fundamentalmente en el servicio que presta la hospitalización domiciliaria, y posteriormente protocolización de las visitas postoperatorias en consultas externas entre la primera y segunda semana, y al mes tras la colecistectomía12,21,26,35,48.
ConclusionesLa CLA supone el presente y futuro del tratamiento de la colelitiasis no complicada, pudiéndose realizar con buenos resultados, de forma segura, con baja morbilidad y alto nivel de satisfacción del paciente. Es fundamental la individualización del proceso: un estricto criterio de selección de pacientes y la realización por equipos con experiencia en CL, son factores que aseguran una alta garantía de éxito. Así mismo, creemos que el liderazgo y las decisiones, además de la realización del procedimiento, debe ser organizado por grupos quirúrgicos y no político-económicos, evitando con ello que puedan ser tomadas fuera del ámbito quirúrgico que modifique aspectos fundamentales del proceso.
La CLA debiera constituir un objetivo clave en las unidades quirúrgicas cuando hoy en día se plantean múltiples medidas de dudosa eficacia para la sostenibilidad del sistema sanitario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.