Están entre las lesiones más letales sufridas por los pacientes politraumatizados, así como también, se encuentran entre las más difíciles y desafiantes para los cirujanos de politrauma. Raramente son aisladas, lo habitual es encontrar múltiples lesiones asociadas, lo que aumenta su gravedad y el tiempo necesario para repararlas, lo que conlleva una morbimortalidad significativa. El manejo correcto implica un diagnóstico y abordaje quirúrgico precoces.
Abdominal vascular lesions are amongst the most lethal lesions suffered by patients with multiple injuries, as well as being among the most difficult and challenging for the surgeon. They are rarely isolated, they are usually found with associated multiple injuries, which increases its seriousness and the time required to repair them and may lead to a significant morbidity and mortality. The correct management involves an early diagnosis and surgical approach.
Mayoritariamente los pacientes que padecen lesiones vasculares abdominales llegan en shock, secundario a la pérdida masiva de sangre, que a menudo es inexorable; representando el mejor ejemplo del letal círculo vicioso: shock, acidosis, hipotermia y coagulopatía.
Muchos llegan en paro cardiorrespiratorio requiriendo medidas drásticas, como la toracotomía de urgencias con pinzamiento de la aorta torácica y reanimación cardiopulmonar abierta. Para agravar el problema, la exposición de los vasos retroperitoneales es dificultosa, precisando una disección extensa y la movilización de órganos intraabdominales. Además, requiere tiempo y puede presentar complicaciones, como la disección rápida a través de grandes hematomas retroperitoneales produciendo lesiones iatrogénicas en pacientes que no pueden permitirse más hemorragia incontrolada.
También se necesitan grandes cantidades de cristaloides, sangre y productos hemoderivados para el reemplazo del volumen intravascular. Todo ello, junto con la frecuente necesidad de pinzamiento de la aorta u otros grandes vasos, predispone a estos pacientes al desarrollo de lesiones de reperfusión y, si sobreviven, a sus secuelas.
El concepto de «control de daños» se aplica en muchos de estos pacientes, así como, cierres dificultosos de la pared abdominal, con material protésico, que inician un ciclo de reintervenciones que producen múltiples agresiones fisiológicas e inmunológicas a un paciente ya comprometido.
Uno de los retos más difíciles es cómo reparar estas lesiones en un medio contaminado, evitando las infecciones del injerto y dehiscencias vasculares. La sepsis y fallo multiorgánico son complicaciones frecuentes, así como: shock refractario, hipoperfusión tisular, transfusión sanguínea masiva, edema generalizado e infecciones prolongadas que difícultan su manejo; todo ello determina altas tasas de morbilidad. Una intervención quirúrgica oportuna y precisa en manos de cirujanos experimentados produce generalmente mejores resultados en el manejo de las mismas.
A continuación, exponemos la metodología para un tratamiento apropiado de las lesiones vasculares abdominales.
DesarrolloLocalización anatómicaLas lesiones asociadas a traumatismos cerrados afectan principalmente al hemiabdomen superior, mientras que las lesiones penetrantes pueden dañar cualquier zona, como ejemplo, la trayectoria impredecible de una bala que con frecuencia afecta a varios vasos. El riesgo de mortalidad se incrementa drásticamente cuando se lesionan variosvasos.
La lesión de la aorta abdominal puede estar localizada, suprarrenal o infrarrenalmente. La vena cava inferior (VCI), suprarrenal, infrarrenal o retrohepáticamente, siendo esta última una de las lesiones más letales para el hombre. La arteria mesentérica superior (AMS), en cualquiera de sus cuatro zonas, y la vena mesentérica superior (VMS) a nivel infra- o retropancreático. La vena porta (VP), en su origen, o bien, dentro de los confines de la tríada portal. La arteria renal (AR), en una de sus tres partes, mientras que, las venas renales (VR), en su confluencia con la vena cava inferior o en el hilio renal.
Exposición e incisionesDeben abordarse a través de una incisión en la línea media desde el xifoides hasta el pubis. El objetivo inicial es el control inmediato de la hemorragia, seguido del control de las fuentes de fugas gastrointestinales. El siguiente paso consiste en una completa exploración de la cavidad abdominal, desde los vasos del retroperitoneo, utilizando un enfoque sistemático de la anatomía, ya que la exploración del retroperitoneo es un reto y exige que el cirujano de trauma esté totalmente familiarizado con la misma.
Técnicas quirúrgicasEl primer y más importante objetivo del manejo de estas lesiones es controlar la hemorragia. Como en todas las lesiones vasculares, se requiere el control proximal y distal de los vasos. Sin embargo, lograr este objetivo en lesiones exanguinantes de forma rápida puede ser difícultoso. Desafortunadamente, un número significativo de pacientes claudican sin lograr este paso.
Frecuentemente, estos pacientes desarrollan hipotensión severa, por lo que, el pinzamiento de la aorta es la primera maniobra a realizar para detener la hemorragia. Si el paciente llega a quirófano en hipotensión severa, o presenta parada cardiorrespiratoria, inmediatamente hay que realizar una toracotomía izquierda anterolateral, con pinzamiento aórtico y reanimación cardiopulmonar abierta, antes de proceder con la laparotomía.
Para los pacientes que se descompensan durante la laparotomía, se debe controlar la aorta abdominal en el hiato aórtico, ya sea digitalmente, con el uso de un compresor de Conn en la raíz de la aorta, o mediante una pinza de Crafoord-DeBakey. La colocación de una pinza es difícil, ya que la aorta se encuentra rodeada por los pilares diafragmáticos, que a menudo hay que disecar para poder colocarla.
Una vez controlada la hemorragia, el cirujano debe clasificarla dentro de las tres zonas del retroperitoneo. Todos los cirujanos de trauma deben conocer la compleja anatomía y los límites anatómicos de estas zonas. La zona I comienza en el hiato aórtico y termina en el promontorio, se ubica en la línea media. Esta zona se divide en supramesocólica e inframesocólica. Hay dos zonas II, derecha e izquierda, que se localizan sobre ambas gotieras paracólicas. La zona III comienza en el promontorio y contiene los principales vasos pélvicos.
La zona I supramesocólica contiene la aorta abdominal suprarrenal, el tronco celíaco y las dos primeras partes de la AMS; la cual se divide en cuatro partes. La 1ª se origina en la aorta y termina cuando da en la arteria pancreaticoduodenal inferior; la 2ª parte abarca desde aquí hasta el origen de la arteria cólica media; la 3ª es el tronco distal a la cólica media y la 4ª comprende ramas yeyunales, ileales o cólicas. La zona I supramesocólica también contiene la porción suprarrenal de la VCI infrahepática, así como la porción proximal de la VMS. La zona I inframesocólica contiene las dos últimas partes de la AMS, la AMI, la aorta y la vena cava infrarrenal, así como la porción distal de la VMS.
La zona II se divide en derecha e izquierda, cada una con su pedículo vascular renal. La zona III contiene la bifurcación hacia los vasos ilíacos comunes, desde los cuales se originan los iíiacos internos y externos. También contiene el plexo venoso retroperitoneal de Batson. El área retrohepática-portal es un área especial, que contiene la VP, la arteria hepática y la vena cava retrohepática. Una vez clasificadas las lesiones hay que abordar dicha zona del retroperitoneo, exponer el vaso lesionado e intentar una reparación definitiva y/o colocar una ligadura.
Generalmente, la zona I supramesocólica se aborda mediante una maniobra que rota las vísceras del lado izquierdo medialmente. Esto requiere la sección de la línea avascular de Toldt del colon izquierdo junto con el ligamento espleno-diafragmático, rotando el colon izquierdo, el bazo, cola y cuerpo del páncreas, así como el estómago hacia la línea media. Esto expone la aorta desde el hiato aórtico, el tronco celíaco, las dos primeras zonas de la AMS y el pedículo vascular renal izquierdo. El riñón izquierdo puede movilizarse en sentido medial, aunque no suele hacerse.
Una alternativa es realizar una maniobra de Kocher ampliada con movilización medial del colon derecho, ángulo hepático, duodeno y cabeza del páncreas hasta el origen de los vasos mesentéricos superiores; elevar estas estructuras en dirección cefálica y acceder a través del tejido retroperitoneal situado a la izquierda de la VCI. Se expone la aorta suprarrenal entre el tronco celíaco y la AMS, teniendo la desventaja de que no se expone la aorta desde el hiato hasta el tronco celíaco.
Las maniobras utilizadas en la zona I inframesocólica incluyen desplazar el colon transverso y el mesocolon en sentido craneal, movilizar el intestino delgado hacia la derecha, localizar el ligamento de Treitz y acceder a través del tejido retroperitoneal a la izquierda de la aorta dirigiéndonos hasta la vena renal izquierda. Esto consigue exponer la aorta infrarrenal, debiendo prestar especial atención para evitar lesiones de la VMI. Para exponer la VCI infrarrenal, se realiza una amplia maniobra de Kocher barriendo páncreas y duodeno hacia la izquierda, accediendo a través del tejido retroperitoneal que la recubre.
La exposición de las zonas II, depende de si el hematoma perirrenal está sangrando activamente, y si se encuentra en posición lateral o medial. Si el sangrado activo se localiza medialmente, o hay un hematoma en expansión, el control de la arteria y la vena renal es necesario; mediante vessel-loops, o bien, mediante una pinza de Henley. Cuando se localiza lateralmente, en el lado derecho, la exposición se logra movilizando el colon derecho y el ángulo hepático, así como una maniobra de Kocher, exponiendo así la VCI infrarrenal, continuando con la disección en dirección cefálica hasta la vena renal. Posterior y superiormente a la vena renal derecha se localiza la arteria renal derecha.
En el lado izquierdo, movilizamos el colon izquierdo y el ángulo esplénico, desplazando el intestino delgado hacia la derecha. Localizamos el ligamento de Treitz y movilizamos el colon transverso y el mesocolon en sentido cefálico; esto sirve para localizar la aorta infrarrenal. La disección craneal localizará la vena renal izquierda en su paso sobre la aorta; encontrando también la arteria superior y posterior a la vena. Por otra parte, si la localización es lateral y no existe extensión al hilio renal, podemos acceder sobre la fascia de Gerota, elevando y desplazando medialmente el riñón, para localizar el punto de sangrado.
La exposición de la zona III, se consigue a través de la línea de Toldt, derecha e izquierda, realizando un desplazamiento en sentido medial, encontrándonos los vasos ilíacos comunes. Debemos localizar y preservar el uréter al cruzarse con la arteria ilíaca común. Posteriormente, continuamos la disección en dirección caudal abriendo el retroperitoneo sobre los vasos.
Las estructuras del área portal-retrohepática son muy difíciles de exponer y requieren disecciones extensas. La VP se forma por la confluencia de la VMS y la vena esplénica, por detrás del cuello del páncreas. Esta confluencia se encuentra justo a la derecha del cuerpo de la segunda vértebra lumbar (L2) y por delante del borde izquierdo de la VCI. La VMI es el tercer afluente principal de la VCI, contribuyendo indirectamente a su flujo, mediante su desembocadura en la vena esplénica, generalmente, o en la VMS, en raras ocasiones. A diferencia de la porción suprapancreática, la zona retropancreática de la porta no está íntimamente relacionada con la vía biliar ni la arteria hepática.
Desde su origen, la VP se dirige craneal y ligeramente hacia la derecha, aproximadamente de 7,5 a 10cm, para llegar al hilio hepático, donde se divide en ramas derecha e izquierda. Durante su curso, pasa sucesivamente por detrás de la parte superior del cuello pancreático y primera porción del duodeno. Al entrar en el ligamento hepatoduodenal, forma relación con la arteria hepática y el conducto biliar, por detrás de estas estructuras, formando el borde anterior del foramen de Winslow. A lo largo de su trayecto, la VP se encuentra por delante del segmento suprarrenal de la VCI. Recibe, además de sus afluentes principales, la vena pilórica, desde el páncreas y el duodeno, la gástrica izquierda (coronaria) y la pancreaticoduodenal superior. La vena cística, si está presente, también drena en la VP.
La VP suprapancreática podemos exponerla realizando una maniobra de Kocher, con movilización y rotación del ángulo hepático del colon. La oclusión previa del flujo hepático y la división del conducto cístico facilitaran la exposición. Las lesiones retropancreáticas con participación de la confluencia portal, o de sus afluentes principales, y las lesiones suprapancreáticas con sospecha de lesión adicional de la VCI u otros vasos, son expuestos mediante combinación de una maniobra de Kocher y la movilización del colon derecho y la raíz mesentérica, desde el ciego hasta la curvatura duodeno-yeyunal. Cuando se combina con la movilización del ángulo hepático, proporciona acceso a toda la VP y porciones proximales de sus ramas principales. También expone toda la vena cava infrahepática y la aorta hasta el origen de la AMS.
La transección quirúrgica del cuello del páncreas también puede utilizarse para exponer la VP retropancreática, mediante un plano avascular existente entre el cuello pancreático y la superficie anterior de la porta. Se recomienda cuando hay una lesión pancreática asociada que conlleve la realización de una pancreatectomía distal, o como terminación de una pancreatectomía casi total. También puede utilizarse como último recurso, si no podemos lograr contener la hemorragia de otra forma.
Una de las estructuras vasculares más difícil de exponer es la vena cava retrohepática, que tiene sus propias características anatómicas, como múltiples ramas que drenan hacia el lóbulo caudado. Esta porción mide aproximadamente de 7 a 12 cm y discurre por un surco en la cara posterior del hígado. La cava retrohepática se une a las venas suprahepáticas: derecha, media e izquierda. Con frecuencia, la media y la izquierda forman un tronco común de 1-2cm antes de unirse a la cava retrohepática. La exposición de este territorio es difícultosa y llena de escollos. Antes de cualquier intento directo de exposición, se precisa levantar el colon derecho y realizar una maniobra de Kocher, exponiendo así toda la vena cava infrahepática. Igualmente, seccionamos el ligamento falciforme hacia su origen, donde la disección de los ligamentos coronarios expondrá 1-2 cm de la cava retrohepática.
La sección del ligamento triangular derecho con movilización hacia la izquierda del lóbulo hepático derecho consigue exponer la vena suprahepática derecha, así como la cava retrohepática; otra manera es acceder directamente a través de una extensa hepatotomía a través del plano interlobular, en la línea de Cantlie; con frecuencia se hace para completar una rotura masiva. Por otra parte, la vena suprahepática izquierda podemos exponerla seccionando el ligamento triangular izquierdo y movilizando el segmento lateral del lóbulo hepático izquierdo. En ocasiones, es necesario realizar una esternotomía media para controlar la porción infrapericárdica de la cava inferior, en el espacio de Gibbons.
Las lesiones vasculares abdominales se deben clasificar según la Escala de Lesiones Vasculares Abdominales de la Asociación Americana de la Cirugía del Trauma (AAST) (tabla 1). Una exposición adecuada, control proximal y distal, desbridamiento de la pared de los vasos, prevención de embolismos, irrigación con solución heparinizada, uso racional de los catéteres de Fogarty, arteriorrafias o venorrafias meticulosas con suturas vasculares monofilamento, la colocación de injertos y el uso de la angiografía intraoperatoria cuando esté disponible, son los pilares de una reparación con éxito. En ocasiones, el uso de derivaciones vasculares temporales puede que sea necesario, como parte del control de daños.
Organ Injury Scale de la Asociación Americana de la Cirugía del Traumatismo. Escala de lesiones vasculares abdominales
| Grado I |
| Ramas innominadas de la arteria y vena mesentérica superior |
| Ramas innominadas de la arteria y vena mesentérica inferior |
| Arteria y/o vena frénica |
| Arteria y/o vena lumbar |
| Arteria y/o vena gonadal |
| Arteria y/o vena ovárica |
| Arterias o venas innominadas que requieran ligadura |
| Grado II |
| Arteria hepática común, derecha e izquierda |
| Arteria y/o vena esplénica |
| Arteria gástrica derecha e izquierda |
| Arteria gastroduodenal |
| Arteria y/o vena mesentérica inferior |
| Ramas principales de arteria mesentérica superior y vena mesentérica inferior |
| Otros vasos abdominales con nombre propio que requieran reparación o ligadura |
| Grado III |
| Vena mesentérica superior |
| Arteria y/o vena renal |
| Arteria y/o vena ilíaca |
| Arteria y/o vena hipogástrica |
| Vena cava infrarrenal |
| Grado IV |
| Arteria mesentérica superior |
| Tronco celíaco |
| Vena cava suprarrenal e infrahepática |
| Aorta infrarrenal |
| Grado V |
| Vena porta |
| Venas hepáticas extraparenquimatosas |
| Vena cava retrohepática o suprahepática |
| Aorta suprarrenal, subdiafragmática |
Esta clasificación se aplica a las lesiones vasculares extraparenquimatosas. Si la lesión se encuentra a menos de 2cm del parénquima, se debe acudir a la Organ Injury Scale específica para este órgano. Aumentar un grado para lesiones múltiples de grado III o IV que afecten>50% de la circunferencia del vaso. Disminuir un grado para lesiones múltiples lacerantes de grado IV o V, que afecten a<25% de la circunferencia.
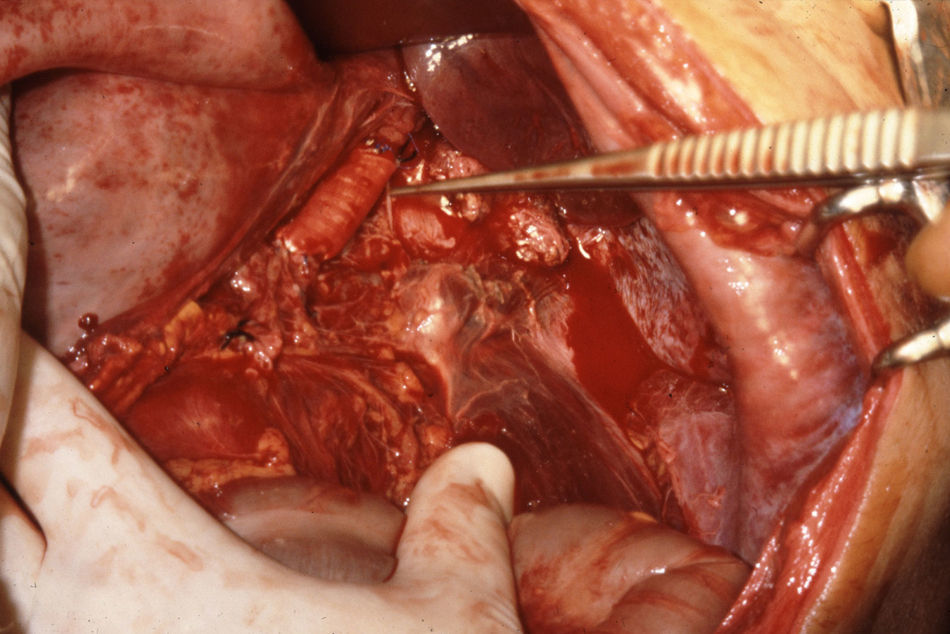
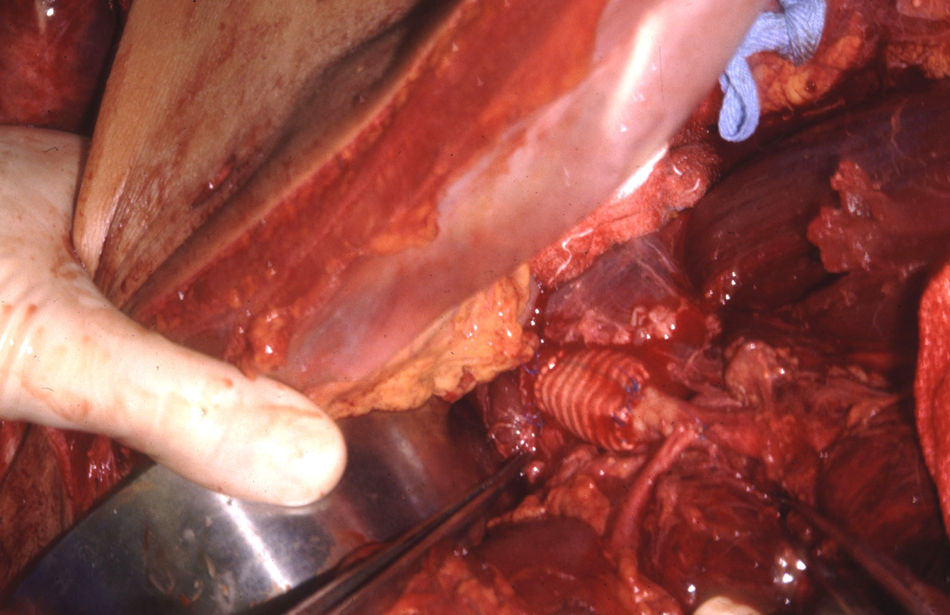
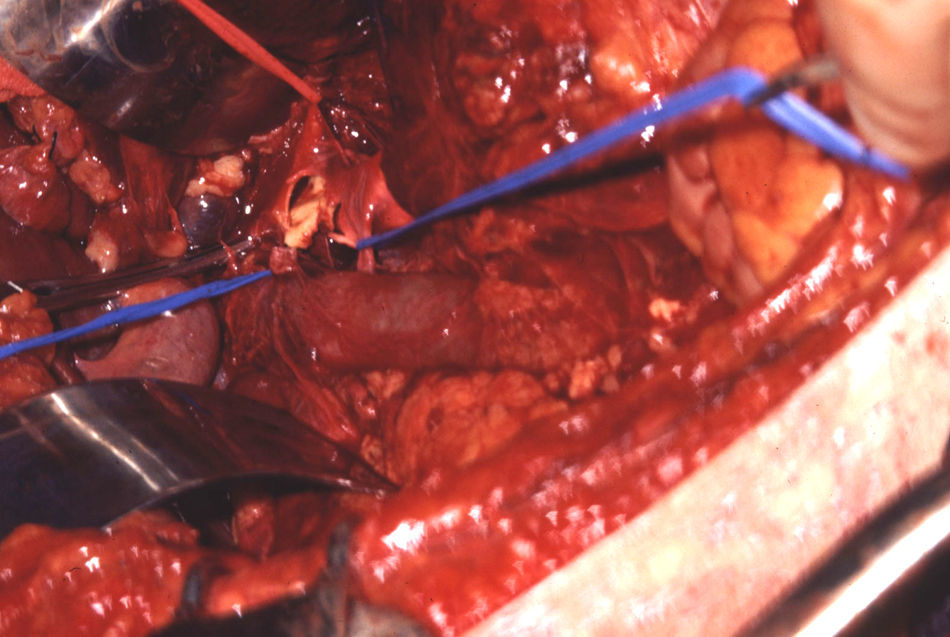
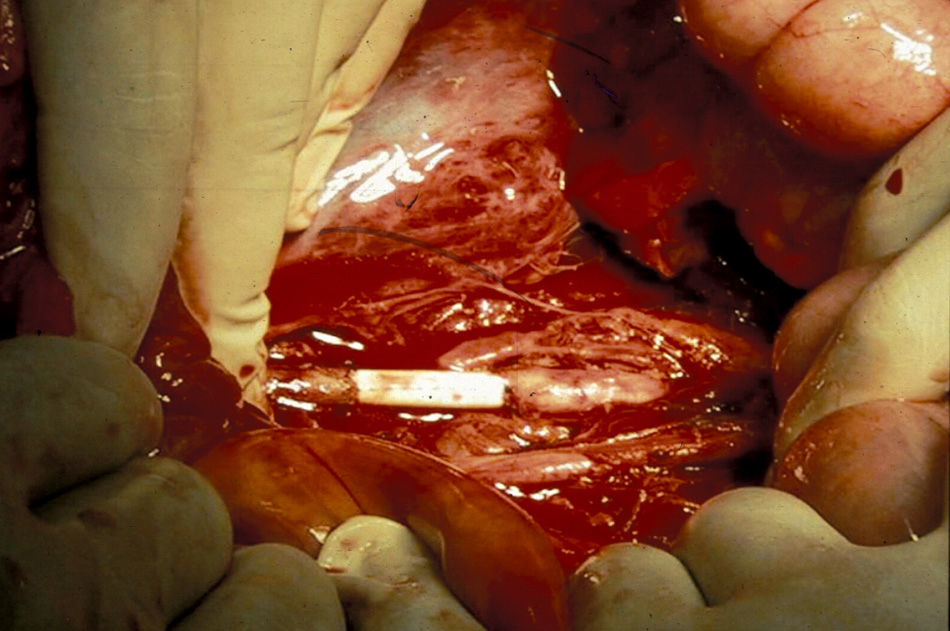
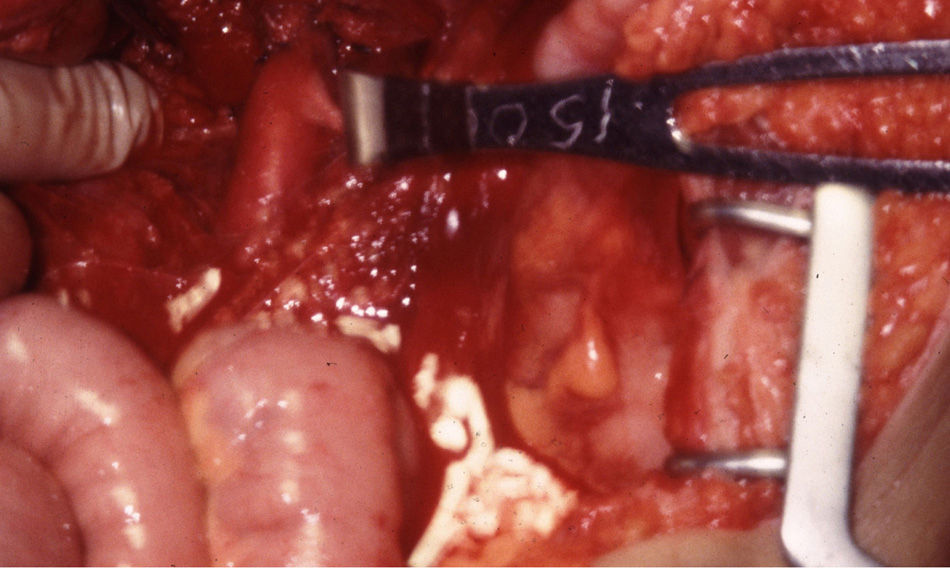
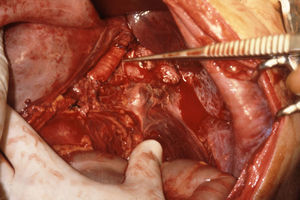
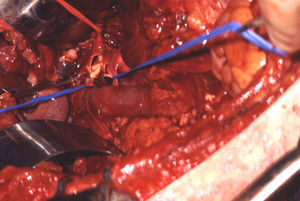
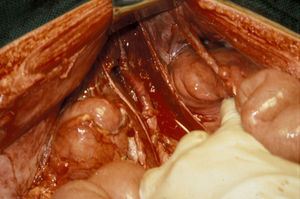
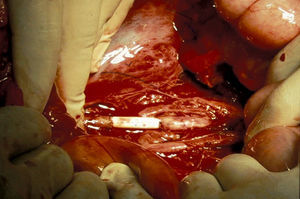
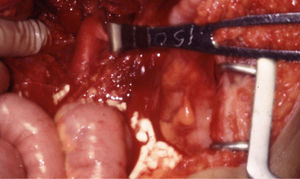
El manejo de las lesiones en la zona I supramesocólica consistirá en una arteriorrafia primaria de la aorta suprarrenal cuando sea posible (figs. 1 y 2), y ocasionalmente la colocación de un injerto de Dacron o PTFE. Las lesiones en el tronco celíaco suelen tratarse con reparación primaria, si son simples, o bien, colocando una ligadura si son complejas. Cuando se ubica en las dos primeras partes de la AMS debemos realizar reparación primaria siempre que podamos, aunque la intensa vasoconstricción hace que sea bastante difícil (fig. 3). También pueden utilizarse ligaduras en estos casos (fig. 4), ya que teóricamente existen suficientes colaterales para preservar la viabilidad de los intestinos delgado y grueso, sin embargo, el vasoespasmo profundo puede conducir a isquemia intensa y necrosis intestinal; otra posibilidad es recurrir a un injerto autólogo o protésico.
En la zona I inframesocólica se emplean las mismas técnicas que en la supramesocólica. La 3ª y 4ª partes de la AMS también deben repararse, aunque las ramas yeyunales, ileales y cólicas, en la 4ª parte pueden ser ligadas. Las lesiones de la AMI generalmente suelen ligarse, rara vez requieren reconstrucción. En la VCI, tanto suprarrenal como infrarrenal, consistirá en venorrafias laterales cuando sea posible. En lesiones que la atraviesen debemos reparar ambas caras, anterior y posterior; lo cual puede resultar bastante difícil. Las lesiones complejas de la VCI, sin posibilidad de reparación, requerirán de ligadura.
Aunque la VCI suprarrenal no tiene ramas es muy difícil de movilizar. Generalmente, se realiza la extensión de la lesión hacia la pared anterior reparando la pared posterior desde el interior del vaso. Podemos lograr su movilización rotando el riñón derecho, fuera de la fosa renal, sin embargo, esta maniobra es muy traicionera y no está recomendada. Cuando hay una destrucción masiva de la cava suprarrenal, puede considerarse la ligadura de la misma, sin embargo, las tasas de supervivencia son muy bajas. Rara vez se han utilizado injertos protésicos en esta posición.
El manejo de la cava infrarrenal consiste generalmente en venorrafia lateral después de una oclusión parcial, mediante la colocación de una pinza de Satinsky o una pinza de Derra. En caso de lesiones que la atraviesen, la reparación primaria puede lograrse mediante la ampliación de la lesión o la rotación del vaso. Esto último implica la ligadura de ramas lumbares, por lo que se recomienda la reparación desde el interior del vaso. La cava infrarrenal puede ligarse en casos de destrucción masiva, siendo bien tolerada.
Las lesiones de la VMS deben ser reparadas principalmente, aunque también pueden ligarse, pudiendo resultar en este caso secuelas graves para los intestinos delgado y grueso.
Las lesiones de las zonas II son un gran desafío. Las de la arteria renal pueden repararse primariamente, o bien, resecarlas y utilizar un injerto. Raramente podemos realizar un bypass aortorrenal utilizando un lugar distal en la pared anterior de la aorta. En general, la ligadura de la arteria renal se realiza con nefrectomía posterior. Las lesiones de las venas renales también pueden ser reparadas con venorrafia primaria o ligadura. Una lesión de la vena renal derecha que no pueda ser reparada con éxito requiere ligadura y nefrectomía secundaria debido a la falta de colaterales venosas. Sin embargo, la ligadura de la vena renal izquierda es generalmente bien tolerada, si se lleva a cabo de forma proximal y cerca de la vena cava inferior, ya que existen colaterales venosas como las venas gonadales, suprarrenales y renolumbares que mantienen el flujo venoso.
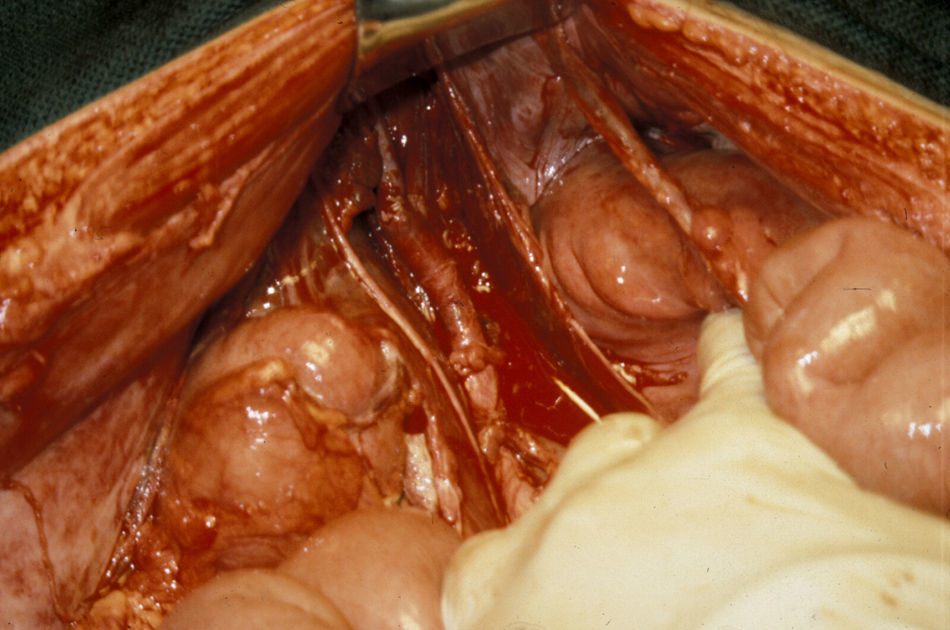
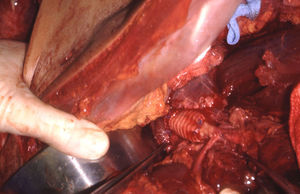
Las lesiones de la zona III se asocian a menudo a lesiones del colon y genitourinarias con contaminación simultánea. La lesión de la arteria ilíaca común puede repararse mediante arteriorrafia, aunque en ocasiones, puede emplearse resección y anastomosis primaria. Raramente, se utilizan injertos autólogos o prótesis para reparar las arterias ilíacas comunes (figs. 5 y 6). En la arteria ilíaca interna generalmente se utilizan ligaduras y en la ilíaca externa podemos realizar arteriorrafia y, ocasionalmente, resección y anastomosis primaria. En presencia de contaminación masiva se recomienda encarecidamente que todos los injertos sean recubiertos por tejido peritoneal para evitar fugas vasculares.
Lesión de la arteria ilíaca externa izquierda asociada a lesiones del colon y de la vejiga secundarias a herida por arma de fuego. Bypass ileofemoral con injerto autógeno de safena (extremadamente raro, ya que no suelen utilizarse injertos de safena para realizar bypass en esta localización).
Ante una destrucción masiva de la ilíaca común o interna procederemos a su ligadura. El flujo arterial puede restaurarse utilizando un bypass fémoro-femoral cruzado o un axilo-femoral. Estos bypass tienen la desventaja de involucrar a vasos no lesionados, presentando alta incidencia de trombosis. Las lesiones de la vena ilíaca común, externa o interna, pueden tratarse por ligadura, ya que con frecuencia es bien tolerada, aunque también puede realizarse una venorrafia lateral.
Las lesiones de la VP deben repararse cuando sea posible. La venorrafia lateral, aunque es técnicamente difícil, debe intentarse. Alternativamente, si el paciente está acidótico, hipotérmico y coagulopático, puede ser ligada. Esto frecuentemente produce como resultado hipervolemia esplácnica y el síndrome de hipovolemia sistémica. Otras técnicas empleadas con escaso éxito han sido la resección del segmento lesionado con: anastomosis primarias termino-terminales, colocación de injertos autólogos y prótesis, shunts portocava termino-laterales y la transposición de la vena esplénica a la mesentérica superior. La arteria hepática puede ser reparada primariamente, o bien, ser ligada.
En las heridas de la cava retrohepática haremos venorrafia primaria, siendo la única oportunidad de supervivencia en estos pacientes. La ligadura no es una opción ya que los pacientes no sobrevivirán. En muy pocos casos encontrados en la literatura, se ha extraído el hígado y colocado un tubo de tórax de 36 o 40 Fr, a modo de shunt a la espera de trasplante hepático. Las venas suprahepáticas deben repararse primariamente; la ligadura, a menudo, dará lugar a necrosis hepática, ya que no hay literalmente ramas colaterales entre los lóbulos hepáticos.
Al realizar una reparación vascular abdominal deben tenerse en cuenta consideraciones importantes de cara a un second look’para evaluar la viabilidad del intestino. Esto es particularmente importante en el caso de la AMS, VP y VMS. La contaminación que producen las lesiones intestinales plantean grandes riesgos para el desarrollo de infecciones en prótesis o en bypass. Siempre que sea posible todos los injertos deben recubrirse con peritoneo. Igualmente, en todas las reparaciones vasculares adyacentes a suturas gastrointestinales debe interponerse tejido viable, generalmente epiplón entre las líneas de sutura, para evitar fístulas entéricas-vasculares, dehiscencias anastomóticas o fugas.
ConclusiónLas lesiones vasculares abdominales son tan letales para el paciente politraumatizado como desafiantes para el cirujano de trauma. Por tanto, el manejo correcto de las mismas implica un diagnóstico y una intervención quirúrgica precoces en manos de un cirujano experimentado, con la exposición inmediata de los vasos sangrantes, a pesar del complejo abordaje y anatomía de los grandes vasos retroperitoneales, para detener la rápida pérdida de sangre que experimentan estos pacientes, que es clave para su supervivencia.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.