El linfoma anaplásico de células grandes (LACG) corresponde a una variante infrecuente de linfoma T, caracterizado por la fuerte expresión del antígeno de activación CD30 (Ki-1). Afecta preferentemente a los ganglios linfáticos con un comportamiento biológico altamente agresivo. La afectación extranodal primaria es infrecuente y, en el caso particular de la localización gástrica, solo se han descrito 22 casos en la literatura. Esta patología presenta un desafío diagnóstico y terapéutico, donde el enfoque multidisciplinario es fundamental. La inmunohistoquímica es actualmente el recurso diagnóstico y pronóstico más importante. El tratamiento quirúrgico es crítico para el diagnóstico definitivo y prevenir las complicaciones en la evolución de la enfermedad o durante el tratamiento adyuvante1–4.
Presentamos un caso de linfoma gástrico anaplásico de células grandes y revisamos la literatura.
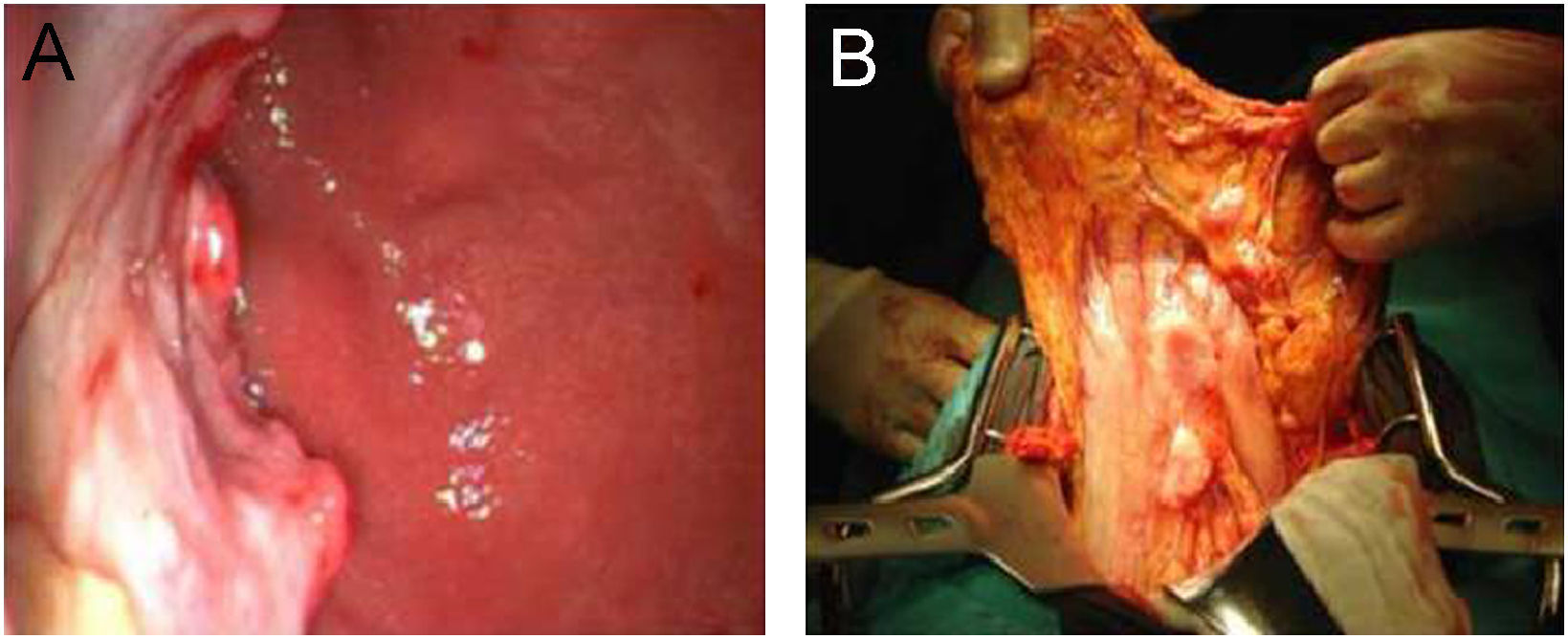
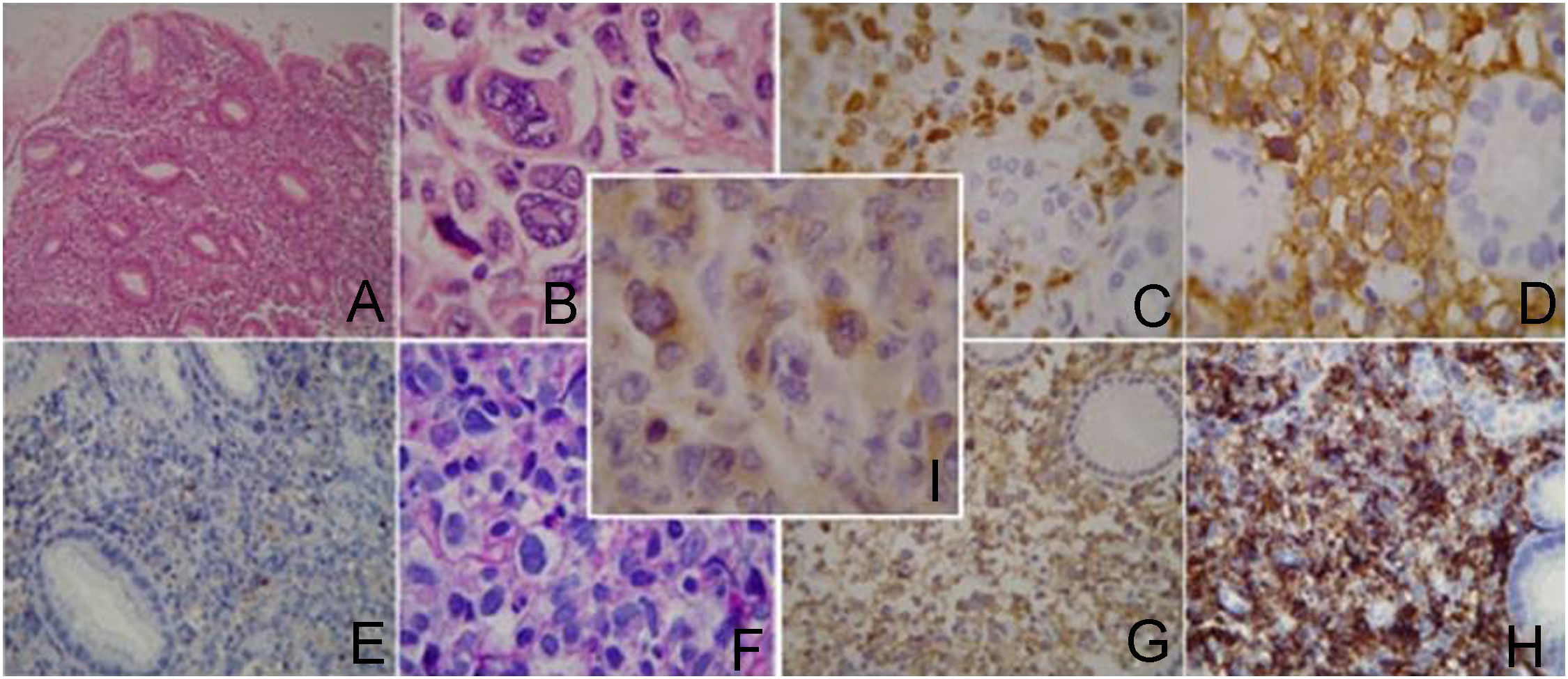
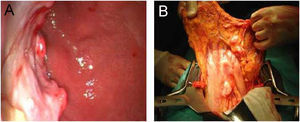
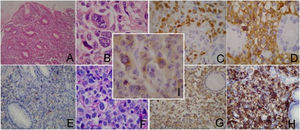
Se trata de una mujer de 47 años que consultó por epigastralgia y pérdida de peso de 7kg en 2 meses. No presentaba alteraciones en el examen físico abdominal, orofaringeo, ni de los principales territorios linfáticos. Se le realizó una videoendoscopia alta que mostró lesión ulceroinfiltrante de 8cm de diámetro en cuerpo gástrico (fig. 1a). La biopsia evidenció tumor maligno indiferenciado de estirpe linfoide y ausencia de Helicobacter pylori. La tomografía computarizada (TC) mostró engrosamiento localizado en la pared gástrica y conglomerados adenomegálicos en tronco celíaco, epiplones gastroesplénicos y mayores. No se constató evidencia de extensión a otras estructuras abdominopélvicas, torácicas o sistémicas. La biopsia de médula ósea no evidenció alteraciones celulares. El inmunofenotipo resultó LACG tipo «T» CD30+. Se realizó una gastrectomía total con linfadenectomía D1 y reconstrucción en Y de Roux, donde se objetivó invasión marginal del páncreas (fig. 1b). No se presentaron complicaciones tras el procedimiento quirúrgico. El estudio histológico confirmó el LACG primario gástrico fenotipo T con expresión de la proteína Anaplasic lymphoma kinase (ALK) y afectación de 5 ganglios linfáticos perigástricos. (fig. 2). El estadio clínico, según la clasificación de Ann Arbor, fue IIE.
A las 4 semanas de la intervención quirúrgica se iniciaron 6 ciclos con ciclofosfamida, adriamicina, vincristina y prednisona (CHOP). Actualmente lleva un año de evolución postoperatoria sin que existan evidencias de recurrencia.
El LACG es una variante infrecuente y agresiva de linfomas T. Habitualmente afecta a los ganglios linfáticos. Han sido descritas formas extranodales que afectan la piel (15–30%), hueso (5–20%), hígado (5–10%), pulmón (5–15%), partes blandas (10–20%), músculo (<5%) y, más raramente, otros órganos (<1%)4.
Los linfomas «T» representan menos del 10% de los linfomas gástricos. El LACG primario gástrico CD30+ representa un desafío diagnóstico debido a la dificultad para diferenciarlo de otras proliferaciones de células grandes CD30+, infecciones virales, reacciones adversas a drogas, otros linfomas (Hodgkin, B, T y natural killer), carcinomas indiferenciados, melanomas y sarcomas granulocíticos. Solamente el estudio histopatológico e inmunohistoquímico permite su diferenciación1,4.
Se manifiesta en niños y adultos jóvenes con un segundo pico de frecuencia entre los 60 y 80 años, con una media de edad de 55 años (17–82). Presenta leve predilección por el sexo masculino (F:M-10:13). La sintomatología incluye astenia, pérdida ponderal y epigastralgia y la presencia de linfadenopatías superficiales a la exploración física. El 77% de los casos presentan metástasis ganglionares en el momento del diagnostico. El examen endoscópico muestra patrones variados. Lo más frecuente es la presencia de un tumor ulcerado. La biopsia endoscópica es fundamental para obtener el diagnóstico preoperatorio.
El estudio histopatológico se compone de histología e inmunohistoquímica. La histología muestra proliferación de células linfoides atípicas con citoplasma abundante y núcleos excéntricos en forma de huso, pleomórficos o múltiples rodeados de inclusiones eosinofílicas (células en anillo de sello)5–9. Se subclasifica como: clásico (70%), linfohistiocítico (10%), células pequeñas (5–10%) y otras variantes raras. La característica distintiva es la constante expresión inmunohistoquímica del antígeno de activación CD30, una citokina transmembrana de la familia de receptores del factor de necrosis tumoral (FNT), que se expresa en linfomas de Hodgkin y LACG. La ALK es positiva en el 50–75% de los casos. El 40–80% de estos presenta una desregulación en el gen ALK9, que se localiza en el cromosoma 2, habitualmente la t(2;5)(p23;35). La presencia o ausencia de esta característica diferencia el comportamiento biológico y pronóstico de estos linfomas. Por ello, actualmente se los clasifica como ALK+ y ALK−4. La expresión de citokeratinas y CD45 no es específica1–4.
Para valorar el grado de extensión de la enfermedad se utiliza la clasificación de Ann Arbor, la cual distingue localización linfática o extralinfática y la presencia o no de enfermedad a ambos lados del diafragma4.
No existe un tratamiento consensuado para el LACG gástrico. En las publicaciones disponibles, solo en un caso se utilizó la quimioterapia como única estrategia, mientras que en el resto de los casos se realizó tratamiento quirúrgico con o sin quimioterapia adyuvante. La cirugía permite el diagnóstico definitivo y previene complicaciones durante la evolución natural de la enfermedad o durante el tratamiento quimioterápico. Dichas complicaciones son fundamentalmente la perforación y la fistulización. La estrategia quirúrgica en los casos de LACG primario gástrico es la gastrectomía total con linfadenectomía D1, la cual permite un adecuado control local, dado que linfadenectomías extensas no mejoran el pronóstico. Los protocolos de quimioterapia incluyen CHOP. El pronóstico de los pacientes con LACG es extremadamente pobre. La sobrevida global oscila entre 6 semanas y 8 años. Se ha visto que la expresión inmunohistoquímica de ALK muestra diferencias marcadas en términos de sobrevida a 5 años ([ALK+] 93 vs. [ALK−] 33%). Por otro lado, las variantes linfohistiocíticas muestran mejores respuestas a la quimioterapia4–8.
En conclusión, el tratamiento de los LACG primarios gástricos CD30+ no está estandarizado. Sin embargo, la estrategia óptima debería incluir un diagnóstico precoz que incorpore un adecuado estudio inmunopatológico, una valoración del tratamiento quirúrgico individualizado y la administración de regímenes de quimioterapia, que incluyan antraciclinas.