la exéresis local del adenocarcinoma de recto T2N0M0 (ADC-T2), mediante microcirugía endoscópica transanal (TEM), se beneficia en conseguir una menor morbilidad con mejor calidad de vida. Sin embargo, la recidiva local de la exéresis local es superior al 20%, inaceptable en estos momentos.
Pacientes y métodoestudio observacional de seguimiento prospectivo. Los pacientes ADC-T2 son consensuados en el comité de tumores a las actuaciones terapéuticas: escisión total del mesorrecto (ETM), TEM simple, TEM con quimiorradioterapia (Qt-Rt) postoperatoria, Qt-Rt preoperatoria con posterior TEM y rescate a cirugía radical (ETM) en menos de 4 semanas.
Resultadosse ha intervenido a 146 pacientes mediante TEM; 75 adenocarcinomas, 59 adenomas, 6 lesiones cicatriciales, 5 carcinoides y 1 GIST. De los adenocarcinomas, 22 fueron ADC-T2. Seguimiento: mediana, 16 (intervalo, 3-32) meses. La recidiva local total ha sido del 18% (4/22). Según la estrategia terapéutica la recidiva local fue: TEM como único procedimiento en el 20% (2/10). Se realizó en 3 pacientes rescate a cirugía radical tras TEM, sin recidiva local ni sistémica. TEM con Qt-Rt posterior a la cirugía se realizó en 6, con una recidiva local del 33% (2/6). Se practicó Qt-Rt y posteriormente TEM en 3 pacientes, sin recidiva local ni sistémica.
Conclusionesel tratamiento del ADC-T2 mediante TEM simple no es razonable. La asociación de Qt-Rt tras TEM, no consigue mejorar los resultados a la ETM. Es factible rescatar a los pacientes sin que altere la supervivencia total. La Qt-Rt preoperatoria y TEM parece ser la línea cuando se consiga una respuesta histológica y clínica, aunque es necesaria la respuesta por parte de ensayos clínicos.
The local exeresis adenocarcinoma of the rectum T2N0M0 (ADC-T2), using transanal endoscopic microsurgery (TEM), has the benefit of achieving lower morbidity with a better quality of life. However, local occurrence of the local exeresis is greater than 20%, which is unacceptable these days.
Patients and methodsProspective, observational follow up study. The tumours committee agreed that those ADC-T2 patients could have the following treatments: total mesorectal excision (TME), simple TEM, TEM with postoperative chemo- and radiotherapy (Ct-Rt), preoperative Ct-Rt with subsequent TEM and radical surgical rescue (TME) within at least 4 weeks.
ResultsOf the 146 patients operated on using TEM, 75 had adenocarcinomas, 59 adenomas, 6 scarring wounds, 5 carcinoids and 1 GIST. Of the adenocarcinomas 22 were ADC-T2. Follow up: median of 16 months (range, 3–32 months). The overall local recurrence was 18% (4/22). According to the treatment strategy the local occurrence was: TEM as the only procedure, 20% (2/10). Radical surgical rescue was performed on 3 patients after TEM, with no local or systemic recurrences. TEM with Qt-Rt after surgery was performed on 6 patients, with a local recurrence of 33% (2/6). Ct-Rt and subsequent TEM in 3 patients, with no local or systemic recurrences.
ConclusionsTreatment of ADC-T2 using simple TEM is not effective. The combination of Ct-Rt after TEM, does not improve the results of TME. It is possible to rescue those patients without changing the overall survival. Preoperative Ct-Rt and TEM appears to be the approach that obtains a clinical and histological response, although a response is needed by clinical trials.
El tratamiento del adenocarcinoma de recto T2N0M0 (ADC-T2)1, según la NCCN-20082, es la escisión total del mesorrecto (ETM) sin adyuvancia. Esa guía propone como alternativa, con un grado de evidencia 2B, la posibilidad en casos de T2NX realizar cirugía local y depués quimiorradioterapia.
La ETM es el tratamiento más eficaz en estas situaciones, con unos resultados de recidiva local que oscilan entre el 2 y el 11% y una recidiva sistémica de un 2–13%3. El precio de esta cirugía no es despreciable, con morbilidad y mortalidad postoperatorias de un 30–40% y un 2% respectivamente4. Sin olvidar los trastornos derivados de las alteraciones genitourinarias elevadas (>30%) y las secundarias de llevar una ostomía temporal o permanente5.
La exéresis local del ADC-T2 mediante microcirugía endoscópica transanal (TEM) tiene el beneficio de una baja morbilidad postoperatoria (10–15%), mortalidad prácticamente nula y sin producir alteraciones genitourinarias6. El gran problema del ADC-T2 es que se asocia a una posible afección ganglionar que llega a ser de un 12–28%7.
Las diversas experiencias terapéuticas de cirugía local del ADC-T2 descritas en la literatura son la exéresis local simple, ya sea mediante exéresis endoanal o TEM, cirugía local (TEM o endoanal) con quimiorradioterapia (Qt-Rt) postoperatoria y la Qt-Rt preoperatoria y exéresis local (TEM o endoanal)8–13.
Ante una cirugía local de adenocarcinoma de recto con estadio preoperatorio de T1 y tras el informe anatomopatológico se aprecia que es un tumor con alto riesgo de recidiva14 o en estadio superior, el rescate a cirugía radical (ETM) en un tiempo inferior a 4 semanas no altera el pronóstico oncológico15.
Presentamos nuestra experiencia con el ADC-T2 mediante TEM, tras un protocolo de estudio preoperatorio, técnica quirúrgica y seguimiento prospectivo.
Pacientes y métodoEstudio observacional de seguimiento prospectivo. El protocolo de estudio de cirugía local de los tumores rectales mediante TEM en la Corporación Sanitaria del Parc Taulí es: historia clínica completa, exploración perianal con tacto rectal. Se les solicita colonoscopia total con biopsia multifocal de la lesión, escala de severidad de incontinencia de Wexner16 y manometría anorrectal. La estadificación de la tumoración se realiza mediante ecografía endorrectal y resonancia pelviana (u,rm). Cuando haya divergencia diagnóstica entre estas exploraciones, se considerará la más alta. En el caso de tumores con biopsia de adenocarcinoma se les solicita TC abdominal y marcadores tumorales CEA y CA 19.9. Se han clasificado los tumores en relación con la altura respecto al margen anal en tumoraciones de recto bajo (<8cm), medio (8–<12cm) y superior (12–16cm)8. Tras estos estudios, clasificamos a los pacientes en cuatro grupos de indicación terapéutica preoperatoria: I, con intención curativa, en adenomas con estadificación u,rmT0, u,rmN0 (tumores benignos); II, intención curativa, en adenocarcinomas con estadios u,rmT0−1, u,rmN0; III, indicación consensuada, en adenocarcinomas: estadios u,rmT2, u,rmN0, y IV, indicación paliativa, en adenocarcinomas con cualquier estadio6.
La preparación preoperatoria y los cuidados postoperatorios se realizan como hemos descrito previamente6. La técnica de exéresis local es mediante la TEM17, con la variante de realizar siempre exéresis de pared completa mediante el bisturí ultrasónico (Ultracision, Ethicon, Endo-Surgery, Cincinnati, Ohio, Estados Unidos), disecando sobre la grasa perirrectal para abordar la lesión con un margen superior de 15mm6. Los tumores, una vez extirpados, se preparan sobre un corcho fijando los bordes de resección con agujas para evitar su retracción.
El informe de anatomía patológica siempre lo realizó un mismo patólogo especializado. Éste describe las características de la resección por la presencia de márgenes libres con la distancia mínima al borde lateral y profundo. Diferencia los tipos de resección en: R0, exéresis con margen más cercano >1mm; R⩽1, márgen⩽1mm; Rx, fragmentación de la pieza con márgenes no definidos, y R1, afección de márgenes8. Informa del diagnóstico de la pieza con sus características de alto o bajo riesgo14.
Los casos, tras la intervención y con el informe de anatomía patológica, se discuten en el comité de tumores TEM formado por endoscopistas digestólogos, radiólogos, anestesiólogos, anatomopatólogos, oncólogos médicos y cirujanos colorrectales. En el caso de los pacientes con estadio pT1 de alto riesgo y pT2, se toma una decisión consensuada en el comité, valorando las características y la voluntad del paciente respecto a las siguientes opciones: TEM simple, TEM con quimiorradioterapia (Qt-Rt) postoperatoria, y rescate a cirugía radical (ETM) en un tiempo inferior a 4 semanas.
A los pacientes sometidos a Qt-Rt, la quimioterapia aplicada fue en infusión continua de 5-fluorouracilo a dosis de entre 225 y 300mg/m2 al día, 5 días a la semana durante 5 semanas. La radioterapia aplicada fue de 50,4Gy.
Hasta finales de 2006, la intención terapéutica ha sido que, para los pacientes que no aceptaron de entrada la cirugía radical (ETM), se consensuó realizar Qt-Rt postoperatoria tras confirmación anatomopatológica. Sin embargo, se realizó simplemente TEM cuando había contraindicación de la Qt-Rt por comorbilidad del paciente.
Desde finales de 2006, en relación con los malos resultados con la Qt-Rt tras la TEM, se consensuó, para los pacientes que se niegan a la ETM, iniciar protocolo de tratamiento de Qt-Rt preoperatoria en las dosis comentadas previamente y TEM entre las 7 y 8 semanas. Se realizó también simplemente TEM durante este periodo cuando había contraindicación de la Qt-Rt por comorbilidad del paciente.
El seguimiento de estos pacientes ha sido de forma exhaustiva mediante ecografía endorrectal y rectosigmoidoscopia con biopsia multifocal de la cicatriz cada 4 meses durante los primeros 2 años. Del tercer año hasta el quinto, dichos controles se realizan cada 6 meses y después los controles habituales. Tomografía computarizada abdominal y marcadores tumorales cada 6 meses y colonoscopia total anual.
Para la descripción de variables, se ha utilizado el programa SPSS versión 12. La descripción de las variables cuantitativas se ha realizado dando valores de media y desviación estándar siempre que las distribuciones estuvieran consideradas normales. En caso contrario, se determinaron la mediana y el intervalo. Las variables categóricas se han descrito en números absolutos y porcentajes.
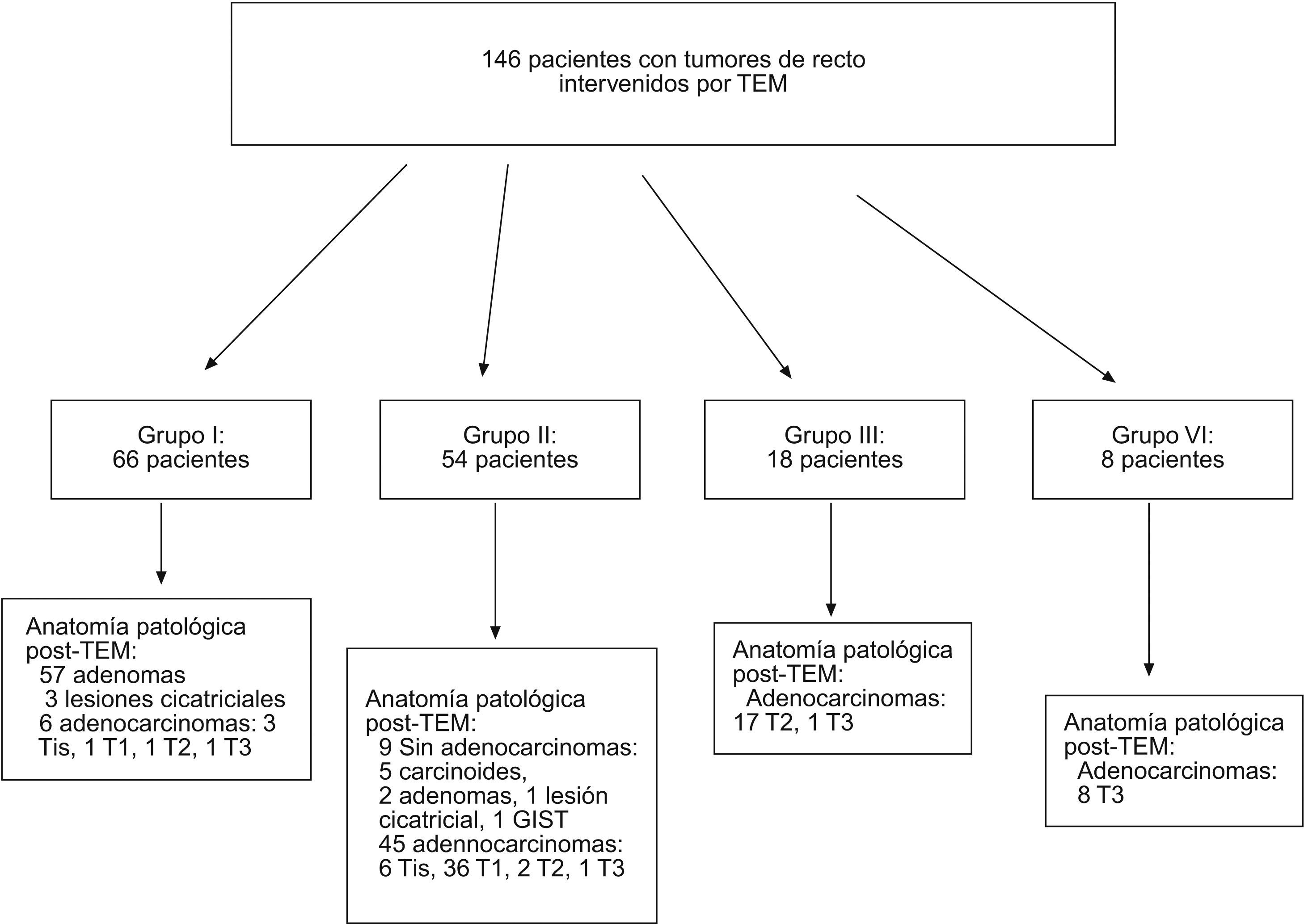
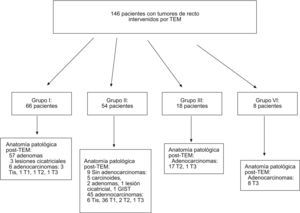
ResultadosDesde julio de 2004 hasta febrero de 2008, se ha intervenido en nuestro centro a 146 pacientes con tumores rectales intervenidos por TEM, procedentes de 37 hospitales; 47 eran de nuestro entorno (31,8%). En la figura 1 se muestra la distribución de pacientes con tumores de recto candidatos a TEM por grupos de indicación terapéutica preoperatoria.
Es importante conocer de forma autocrítica el acierto diagnóstico de la serie, así en la figura 1 se puede apreciar que en el grupo I, cuando el objetivo era intervenir tumores de recto benignos y considerando los adenocarcinomas in situ como no invasivos, se obtuvo error diagnóstico preoperatorio en 3/66 (4,5%). En el grupo II, se alcanzó error diagnóstico preoperatorio en 3/54 (5,5%), 2 pacientes con un T2 y 1 con T3. Si consideramos como finalidad de los pacientes candidatos a ser intervenidos mediante TEM el grupo I y II de forma conjunta, sobre 120 (66+54) pacientes, se erró en 5 (4,2%) pacientes.
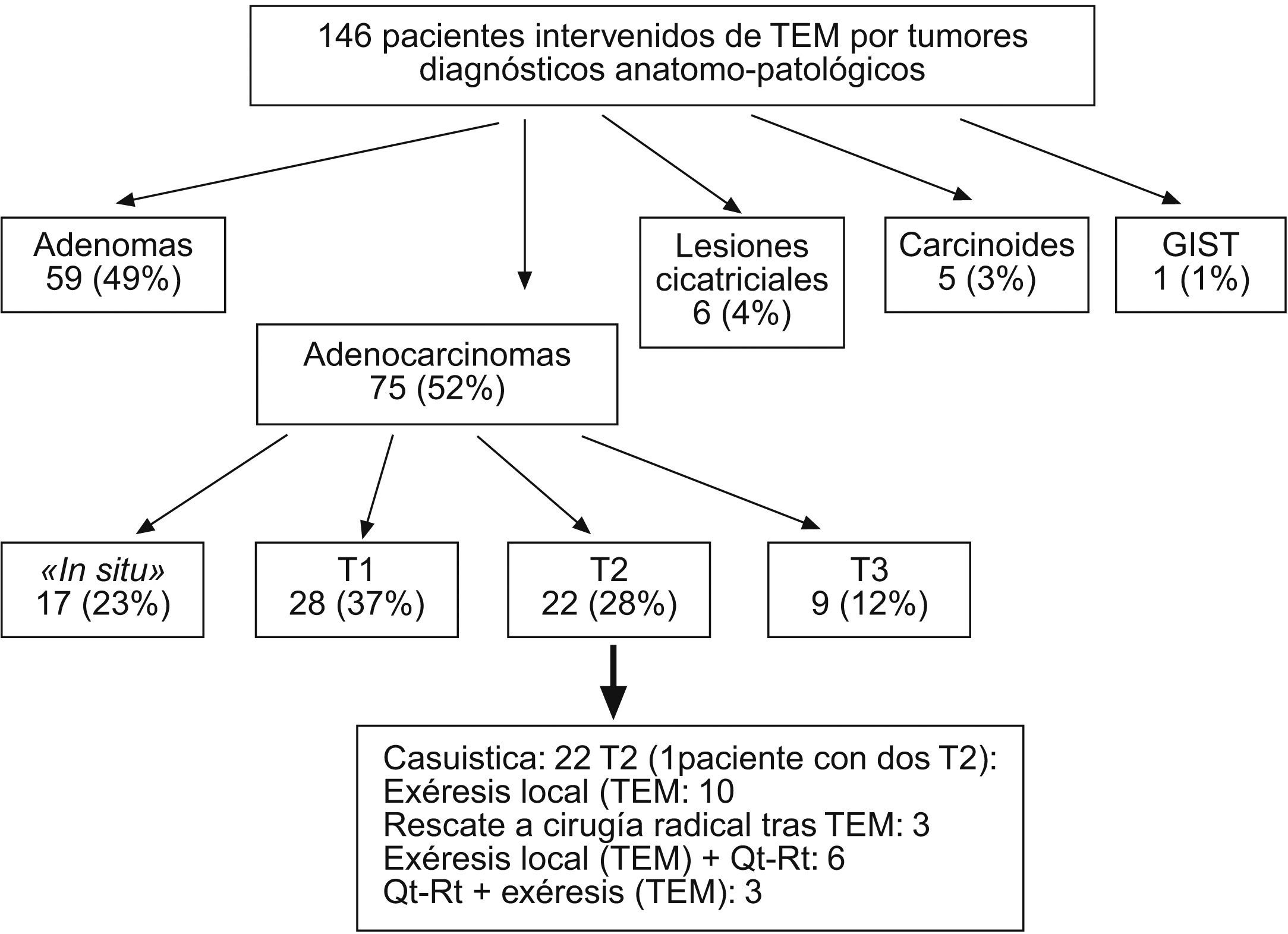
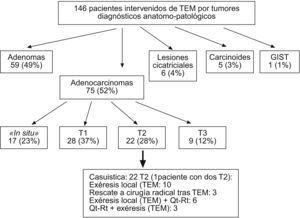
En la figura 2 se ilustra la clasificación por enfermedades tras diagnóstico anatomopatológico. De los 21 pacientes ADC-T2, 17 procedían del grupo III, 1 procedía del grupo I y 3, del grupo II. Un paciente presentó dos tumoraciones de recto a 2,5 y 10cm del margen anal, que fueron ambas ADC-T2, por lo que nuestra casuística consta de 22 ADC-T2.
De los 21 pacientes con ADC-T2, 15 (71,4%) eran varones y 6 (28,6%) mujeres con una mediana de edad de 77 (55-87) años. El tamaño mediano de las lesiones fue de 4 (2,5–12)cm. La localización mediana respecto al margen anal fue de 8 (2–18)cm. La distribución de las tumoraciones respecto a la altura del margen anal ha sido 12 en recto inferior, 6 en recto medio y 4 en recto superior.
La mortalidad postoperatoria fue de 0 y la morbilidad, del 4,7% (1/21), un absceso perianal postoperatorio. La estancia mediana fue de 4 (2–15) días. El tipo de estrategia terapéutica realizada en estos pacientes se ilustra en la figura 2.
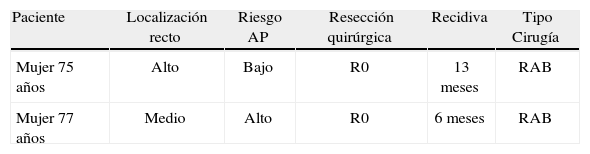
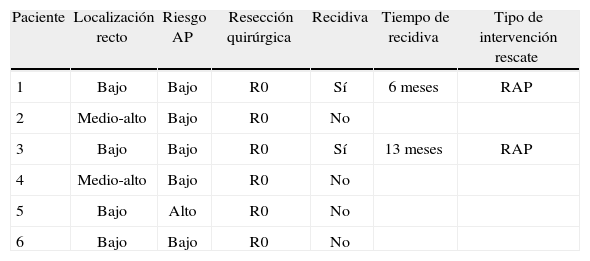
El seguimiento ha sido una mediana de 16 (3–32) meses), la recidiva local total del ADC-T2 ha sido del 18% (4/22). En el grupo donde se realizó simplemente TEM la recidiva local fue del 20% (2/10), con 1 muerte durante el seguimiento por otro tipo de enfermedad. En la tabla 1 se detallan las características de estos 2 pacientes con recidiva local. Los 3 pacientes que tras TEM se rescataron a cirugía radical antes de las 4 semanas no han presentado hasta la fecha recidiva local ni sistémica. En la tabla 2 se describen las características de los 6 pacientes sometidos a TEM y posterior Qt-Rt, donde obtuvimos 2 recidivas (33%), que se rescataron con resecciones abdominoperineales y actualmente están todos libres de enfermedad.
Recidiva local tras TEM como único procedimiento (2/10 pacientes)
| Paciente | Localización recto | Riesgo AP | Resección quirúrgica | Recidiva | Tipo Cirugía |
| Mujer 75 años | Alto | Bajo | R0 | 13 meses | RAB |
| Mujer 77 años | Medio | Alto | R0 | 6 meses | RAB |
RAB: resección anterior baja; Riesgo AP: riesgo anatomopatológico de recidiva14.
Exéresis local (TEM) y posteriormente Qt-Rt
| Paciente | Localización recto | Riesgo AP | Resección quirúrgica | Recidiva | Tiempo de recidiva | Tipo de intervención rescate |
| 1 | Bajo | Bajo | R0 | Sí | 6 meses | RAP |
| 2 | Medio-alto | Bajo | R0 | No | ||
| 3 | Bajo | Bajo | R0 | Sí | 13 meses | RAP |
| 4 | Medio-alto | Bajo | R0 | No | ||
| 5 | Bajo | Alto | R0 | No | ||
| 6 | Bajo | Bajo | R0 | No |
RAP: resección abdomino-perineal; Riesgo AP: riesgo anatomopatológico de recidiva14.
Tres pacientes entraron en el grupo de Qt-Rt y TEM. En la tabla 3 se describen las características de los 3 pacientes; destaca como complicación tras la Qt-Rt la presencia de dermatitis perianal en un paciente. Hasta la fecha se encuentran libres de enfermedad y sin recidiva local ni sistémica.
Qt-Rt+exéresis local (TEM)
| Estadio preoperatorio | Localización recto | Valoración respuesta clínica | Resección quirúrgica | Complicaciones tras Qt-Rt | ypT | Riesgo AP | Recidiva local | Recidiva sistémica |
| u,rm T2N0 | Bajo | >50%* | R0 | No | ypT2 | Bajo | No | No |
| u,rm T2N0 | Bajo | >50%* | R0 | Dermatitis perianal | ypT2 | Bajo | No | No |
| u,rm T3N0 | Medio | >50%* | Rx | No | ypT3 | Bajo | No | No |
u,rm: estadificación por ecografía y resonancia pelviana; yPT: estadificación ananatomopatológica tras Qt-Rt y TEM.
La tentación de practicar opciones terapéuticas con baja morbimortalidad postoperatoria y escaso deterioro de la calidad de vida puede conllevar el precio de no controlar la enfermedad y puede costar la vida del paciente18. Sin embargo, también hay que tener en cuenta las condiciones particulares de cada paciente, muchos de ellos son de edad avanzada con múltiples comorbilidades y el beneficio de curarlos oncológicamente puede ocasionar elevar la mortalidad por causas no relacionadas con el cáncer y una gran disminución de su calidad de vida19. Por tal motivo es importante conocer los resultados actuales que tenemos en cada situación del adenocarcinoma de recto y establecer el balance más adecuado.
En los adenocarcinomas T1 de bajo riesgo, los últimos estudios publicados consideran la exéresis local mediante la TEM como técnica de elección20–23.
Respecto al ADC-T2, la respuesta es más compleja debido a que las opciones terapéuticas asociadas a la cirugía local dan resultados diversos. Así, en la literatura podemos observar que existen referencias de recidiva local que oscilan entre 0 y el 67%8. La discrepancia es consecuencia de la falta de homogeneidad en el diseño, ser estudios retrospectivos sin seguimiento, utilizar diversos conceptos terapéuticos en el tratamiento local y la divergencia en la selección de los pacientes.
Centrándonos en la exéresis del ADC-T2 como único procedimiento mediante TEM, Borschitz et al8 describen su experiencia sobre 20 pacientes, analizando su experiencia general de recidiva local del 35%. En una serie nuestra sobre 11 pacientes ADC-T29, publicada conjuntamente con otro centro, y seguimiento medio de 59 meses y mínimo de 24, se apreció una recidiva local del 22,2%, con una probabilidad de no recidivar del 81,8%. En nuestra experiencia actual, la recidiva local ha sido del 20% a pesar de tratarse de lesiones con resecciones con márgenes negativos y con un tiempo de seguimiento relativamente corto. Por todos estos datos, pensamos que la simple cirugía local sea por TEM o exéresis endoanal, obtiene resultados no aceptables comparados con la cirugía radical (ETM). No es una terapia curativa independientemente de la localización, riesgo histológico y tipo de resección (R0).
Ante la incómoda situación de realizar una TEM con una estadificación preoperatoria de un grupo I o II y en la que el informe anatomopatológico revela un ADC-T2 o un T1 de alto riesgo, el rescate a cirugía radical convencional ofrece resultados de recidiva y supervivencia aceptables desde el punto de vista oncológico8,15. Nuestra experiencia actual y previa va también en este sentido9, y no se observó peor pronóstico en estos pacientes tras el rescate. Pensamos que ante adenocarcinomas de recto con difícil valoración preoperatoria en T1−2, con N0 mediante ecografía endorrectal y resonancia pelviana, la opción de realizar una TEM en espera del resultado definitivo histológico puede comportar un enorme beneficio para el paciente en caso de obtener resultados favorables. En la situación contraria, el rescate no empeora su probabilidad de supervivencia.
En los últimos años se ha creado una gran expectativa respecto a la adyuvancia postoperatoria. Esta situación tenía su lógica debido a que se podía tener un diagnóstico anatomopatológico correcto de la lesión (sin problemas de infraestadificación o supraestadificación) y en relación a ello la adyuvancia acabaría de controlar la enfermedad a un precio inferior de la cirugía radical.
La revisión de la literatura de la Qt-Rt tras la cirugía local, también da resultados de recidiva local desconcertantes que oscilan entre 0 y el 45%24. Nuestra experiencia ha sido desfavorable en 2 de los 6 pacientes. A pesar de realizarse una resección quirúrgica correcta (R0) y que eran tumores de bajo riesgo histológico, recidivaron a los 6 y 13 meses, lo que representa un 33% de recidiva local. Pensamos, de acuerdo con Baxter et al24, que aunque los resultados de los distintos estudios indican que hay una mejora del control de la recidiva local cuando se compara con la excisión local única, ésta todavía permanece en porcentajes elevados.
Para hablar de la experiencia de la Qt-Rt previa al ADC-T2, hay que mencionar el estudio de Habr-Gama et al25. Describe que la Qt-Rt preoperatoria conduce a un elevado porcentaje de repuesta clínica e histológica (26,8%) para el adenocarcinoma distal de recto a estadio 0 (con respuesta completa clínica e histológica). Este estadio 0 se asocia a un excelente resultado de control de la recidiva local y supervivencia a largo plazo.
El único estudio prospectivo sobre Qt-Rt preoperatoria y TEM en adenocarcinomas de recto T2−3N0 ha sido realizado por Lezoche et al12. Concluyen que el TEM combinado con Qt-Rt preoperatoria pude ser considerado como un procedimiento eficaz mínimamente invasivo para el manejo de pequeños tumores de recto T2 y T3 N0.
Recientemente, Borschitz et al13 han publicado una revisión de la literatura sobre la experiencia publicada mediante Qt-Rt preoperatoria y cirugía local en ADC T2−3. Observan que cuando se consigue una infraestadificación tras la Qt-Rt en las piezas de resección a ypT0 la recidiva local es 0 y la sistémica, el 4%. Cuando es un ypT1, la recidiva local es del 2% y la sistémica del 7%. En ypT2 se asciende a una RL del 7% y la sistémica también de 7%. Sin embargo, cuando no hay infraestadificación, en ypT3, los resultados son de una recidiva local del 21% y una sistémica del 12%. En nuestros casos, aplicamos la misma pauta de neoadyuvancia con resultados de respuesta clínica superiores al 50%, pero sin conseguir infraestadificación histológica.
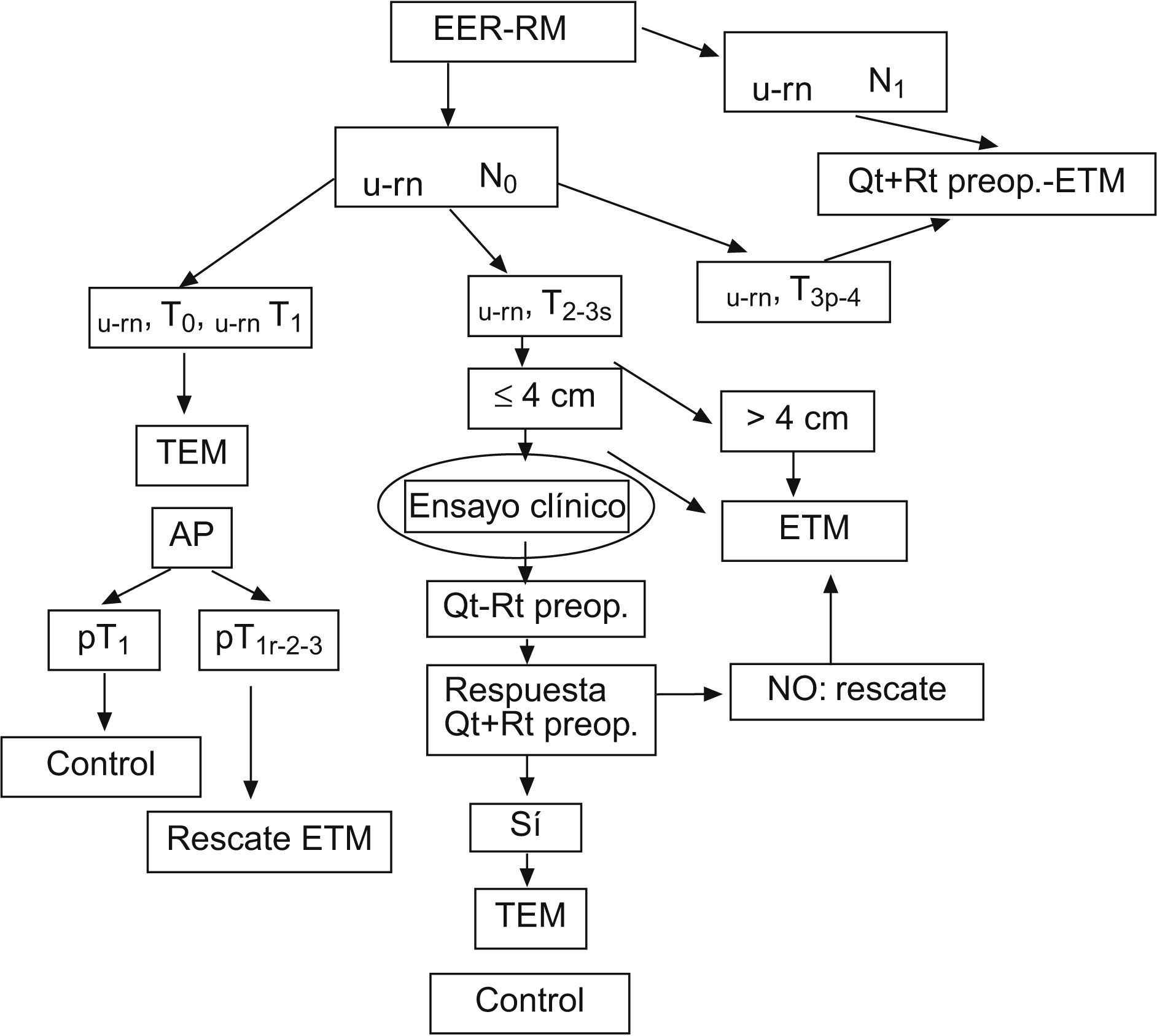
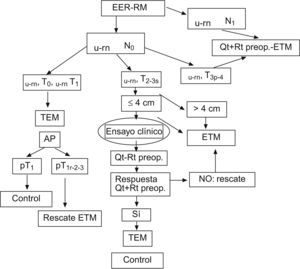
Con la experiencia actual publicada la única forma de dar respuesta definitiva es a través de ensayos clínicos, según recientemente indicaban Suppiah et al19. Nuestro grupo está actualmente en fase de desarrollo de este tipo de estudio prospectivo, controlado y aleatorizado, de forma multicéntrica, para aportar las soluciones a las cuestiones antes mencionadas. En la situación actual, nuestra actitud terapéutica ante el adenocarcinoma de recto se resume en el organigrama de la figura 3, tras descartar metástasis a distancia. Diferenciamos dentro del estadio preoperatorio del ADC-T3 mediante ecografía endorrectal y resonancia pelviana una forma superficial y otra profunda, por observar que la primera se comporta desde un punto de vista oncológico como un ADC-T226,27.
En el caso de demostrarse que esta línea es eficaz, hemos de conocer el precio de morbimortalidad y calidad de vida que condiciona la Qt-Rt preoperatoria, intentar conocer e identificar el porcentaje de pacientes que se benefician de una infraestadificación clínica e histológica por separado y su relación con la recidiva local y sistémica. En el futuro, la incorporación de los nuevos quimioterápicos seguro que también ayudarán a favorecer los resultados en esta línea.