Introducción
Han pasado más de 20 años desde que Soler et al1 describieran la asociación entre la diabetes mellitus de larga evolución y las lesiones fibrosas mamarias, y Byrd et al2 fueron los primeros, en 1987, en acuñar el término mastopatía diabética para la asociación de sobrecrecimiento de tejido conectivo e infiltrado perivascular de la mama. Sin embargo, a pesar de los años, esta entidad continúa siendo poco conocida por la comunidad quirúrgica, incluso todavía hoy algunos autores cuestionan su existencia3.
La mastopatía diabética, también llamada mastitis linfocítica, mastopatía fibrosa, lobulitis linfocítica o enfermedad mamaria diabética fibrosa, es una enfermedad benigna de la mama que ocurre, característicamente, en mujeres con diabetes mellitus tipo 1 y mal control glucémico.
Las manifestaciones clínicas y radiológicas de esta enfermedad hacen difícil el diagnóstico diferencial con el carcinoma mamario, por lo que el diagnóstico de certeza únicamente puede establecerse con la biopsia. Debido al alto índice de recidiva de la enfermedad, su conocimiento y diagnóstico podrían evitar repetidas biopsias en estas pacientes.
Presentamos nuestra experiencia en el diagnóstico y tratamiento de cuatro pacientes con mastopatía diabética.
Casos clínicos
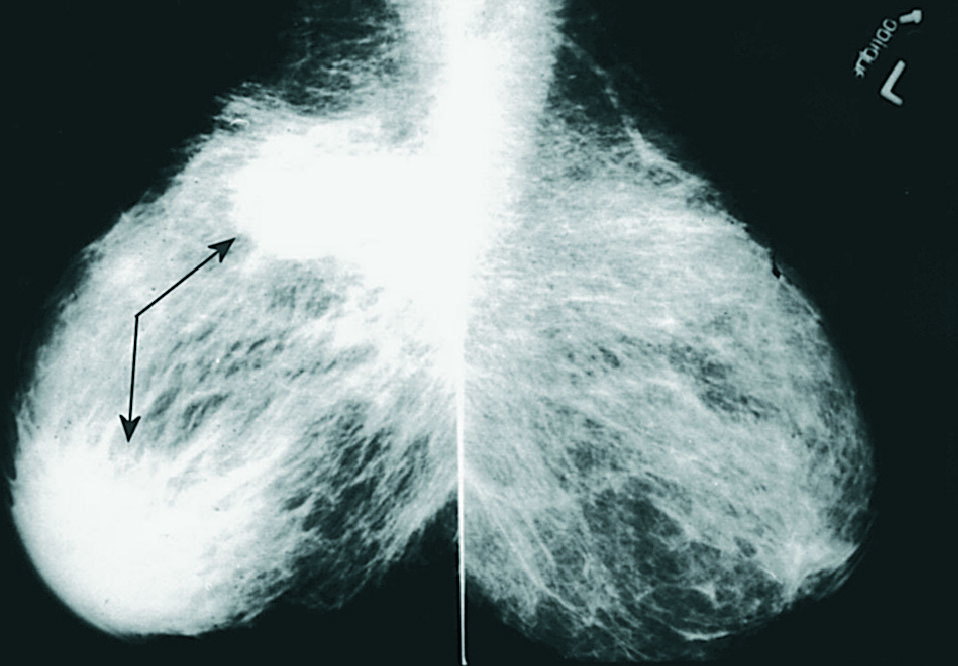
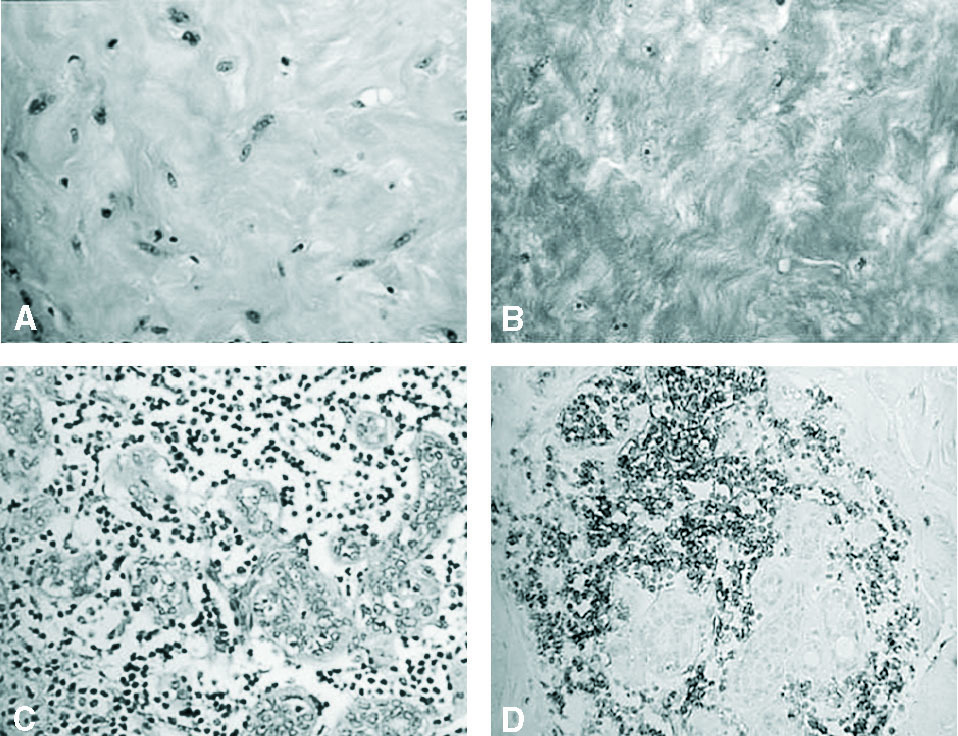
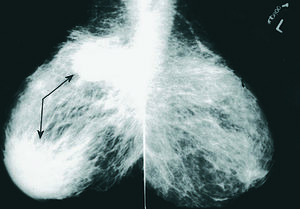
Cuatro pacientes de 29, 42, 47 y 60 años de edad fueron remitidas a nuestro servicio por presentar tumoraciones mamarias palpables, de límites bien definidos y consistencia dura, 3 en la mama derecha y 1 en la mama izquierda (tabla 1). Una de ellas presentaba, asimismo, edema cutáneo, con lesión en "piel de naranja", indicativa de carcinoma inflamatorio. Como antecedentes de interés, todas menos una estaban diagnosticadas de diabetes mellitus tipo 1 (DM1), de años de evolución y de difícil control metabólico. No presentaban, sin embargo, otras complicaciones sistémicas por su enfermedad. En los 4 casos se efectuó una mamografía, y en 2 de ellas se observaron cambios inespecíficos, en 1 caso una masa de densidad irregular retroareolar y, en el último, un nódulo estrellado microcalcificado (fig. 1). La punción de las lesiones no obtuvo material suficiente para citología. Ante la imposibilidad de descartar malignidad, se realizó la extirpación de todas las lesiones, con sedación y anestesia local, sin complicaciones. En los 4 casos se trató de lesiones fibrosas, blanquecinas, de consistencia dura y bien delimitadas. El tamaño osciló entre 1,3 y 3,2 cm. En el estudio anatomopatológico de las 4 piezas se observaron amplias áreas de fibrosis queloide; 2 presentaron ductitis, 1 vasculitis mononuclear y 1 fibroblastos epitelioides (positivos a vimentina) entre las bandas de fibrosis. Todos ellos presentaron lobulitis con infiltrado linfocítico, que en 2 mostró fuerte inmunorreactividad para CD20 (fig. 2). Tras el estudio microscópico, la paciente sin antecedentes de diabetes fue estudiada y diagnosticada de diabetes mellitus dependiente de insulina. Ninguna de las pacientes ha presentado, hasta la fecha, recidiva de las tumoraciones.
Fig. 1. Mamografía. Imagen en espejo en la que se observa, en la mama derecha, un nódulo hiperdenso, de contornos lisos, localizado en cuadrantes superiores, así como un aumento de densidad radiológica en región retroareolar.
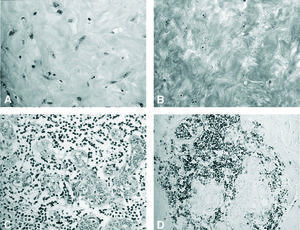
Fig. 2. Imágenes del estudio histopatológico. A: fibrosis queloide del caso 2 (H-E). B: fibrosis queloide del caso 3 (tricrómico de Masson). C: lobulitis con infiltrado linfocítico (caso 4). D: estudio inmunohistoquímico con fuerte inmunorreactividad para CD20 en el infiltrado linfocítico (caso 1).
Discusión
La mastopatía diabética puede ser considerada como una complicación poco frecuente de la diabetes mellitus que afecta, de forma característica, a mujeres con mal control metabólico y larga evolución de la enfermedad. Aunque se han descrito algunos casos aislados, es excepcional su aparición en el varón4.
Esta entidad representa menos del 1% de las lesiones benignas de la mama5, y aunque su patogenia no es del todo conocida, parece ser que la lesión se originaría por una reacción autoinmunitaria secundaria a una acumulación anormal de matriz extracelular, como consecuencia del efecto de la hiperglucemia en el tejido conectivo. La glucosilación y el aumento de las uniones intermoleculares produciría la acumulación de un colágeno resistente a la degradación. Al tratarse de una reacción autoinmunitaria, la mayoría del infiltrado inflamatorio correspondería, como en nuestros casos, a linfocitos tipo B6. Esta teoría se apoya también en la frecuente asociación de esta afección con otras lesiones de tipo autoinmunitario, como la enfermedad articular o tiroidea5. Ninguna de nuestras 4 pacientes presentaba enfermedades autoinmunitarias asociadas. Los hallazgos característicos de la mastopatía diabética son los infiltrados linfoplasmocitarios perivasculares, perilobulares y periductales, células inflamatorias en el epitelio, marcada fibrosis tipo queloide y fibloblastos epitelioides intersticiales6. Aunque algunos autores consideran que la fibrosis queloide y los fibroblastos epitelioides son necesarios para el diagnóstico6, otros consideran que estos hallazgos no son específicos y pueden verse, por ejemplo, en la tiroiditis de Hashimoto, la miastenia grave o incluso en pacientes sin enfermedades autoinmunitarias7. En nuestra opinión, la fibrosis queloide y el infiltrado linfocitario con células B, en un contexto clínico-radiológico apropiado, serían suficientes para establecer el diagnóstico.
La manifestación clínica más habitual de la mastopatía diabética es como nódulos no dolorosos, de bordes irregulares, duros, únicos o múltiples, móviles y bien delimitados, cuyo tamaño puede variar entre los 5 mm y los 6 cm5,7. Habitualmente no hay afección de la piel, pero, como ocurrió en una de nuestras pacientes, el edema localizado en la mama, frecuente en los diabéticos, puede semejar un carcinoma inflamatorio, con la típica lesión en piel de naranja y/o signos flogóticos.
Habitualmente, los hallazgos de la mamografía son inespecíficos: mamas de tejido glandular denso, masas irregulares mal definidas, asimetrías, nódulos estrellados, microcalcificaciones o incluso la mamografía puede ser normal. En la ecografía puede verse típicamente una marcada sombra acústica, más intensa que en la mayoría de los cánceres7. Por otro lado, la ultrasonografía Doppler en color y la resonancia magnética pueden servir de ayuda en el diagnóstico diferencial con el carcinoma, ya que las lesiones vasculares en la eco-Doppler y que muestran captación en la resonancia magnética serán más probablemente malignas4. En nuestras pacientes no se pudo realizar ninguna de estas dos técnicas porque no se disponía de ellas años atrás. Aunque las exploraciones radiológicas orientan en el diagnóstico no son, en absoluto, específicas, por lo que se requiere el estudio histopatológico para el diagnóstico. La punción con aguja fina no suele ser útil, ya que la fibrosis mamaria impide, como en nuestros casos, la obtención de material suficiente5. A pesar de que el tratamiento quirúrgico ha sido el procedimiento diagnóstico habitual durante años, en la actualidad, la punción con aguja gruesa (core biopsy) se acepta como método menos invasivo que la cirugía y podría tener incluso menos recurrencia que ésta4,8.
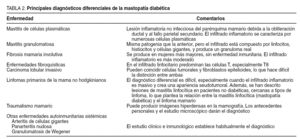
En el diagnóstico diferencial de la mastopatía diabética deben incluirse algunas lesiones importantes de la mama, entre las que se encuentran las citadas en la tabla 2.
A pesar de no haberse demostrado la capacidad de malignizar9, el índice de recidivas en esta enfermedad puede ser hasta del 60%5, y puede aparecer en la misma mama, en la contralateral o en ambas, sobre todo durante los primeros 5 años. Por ello, algunos autores10, con el objetivo de evitar repetidas biopsias, proponen realizar tras la primera biopsia diagnóstica un seguimiento mediante mamografía o ecografía anual, y si crece la lesión o aumenta su número, realizar una biopsia o una punción. En nuestros casos no hubo necesidad de nuevas biopsias porque no se detectaron recidivas.
Por lo tanto, la mastopatía diabética es una entidad poco frecuente, pero que se debe tener en cuenta ante tumoraciones mamarias en pacientes con DM1 de largo tiempo de evolución y mal control glucémico. Su conocimiento y diagnóstico pueden evitar sucesivas y mutilantes biopsias en estas pacientes.
Correspondencia:
Dr. D. Martínez-Ramos.
Servicio de Cirugía General y del Aparato Digestivo. Hospital
General de Castellón.
Avda. Benicàssim, s/n. 12004 Castellón. España.
Correo electrónico: davidmartinez@comcas.es
Manuscrito recibido el 17-2-2006 y aceptado el 19-4-2006.