Evaluar la morbimortalidad postoperatoria, el estado funcional y la supervivencia a largo plazo de pacientes con tumores de páncreas o periampulares a los que se intervino quirúrgicamente.
Pacientes y métodosCohorte de 160 pacientes a los que se intervino consecutivamente: 80 duodenopancreatectomías cefálicas (DPC), 30 resecciones corporocaudales (RCC), 7 duodenopancreatectomías totales, 4 resecciones centrales y 3 ampulectomías; en 36 pacientes no se realizó resección. La función pancreática se evaluó mediante test de sobrecarga oral a la glucosa, grasas en heces y elastasa fecal.
ResultadosLa tasa de resecabilidad fue del 77,5%. En los pacientes resecados (n = 124) la morbilidad fue del 38,7% (con una tasa de fístulas pancreáticas del 6,4%) y la mortalidad del 4%. En las DPC la función endocrina pancreática ha empeorado en el 41%, con esteatorrea en el 58,6% de los casos; en las RCC estos valores fueron del 53,6 y del 21,7%. En los 36 pacientes no resecados la morbilidad fue del 27,7% y la mortalidad del 8,3%. La supervivencia a 2 a 5 años en los pacientes resecados por adenocarcinoma ductal fue del 42 y del 9%; en los ampulomas del 71 y del 53%; en los adenocarcinomas mucinosos, del 83 y del 33%; en los adenocarcinomas duodenales, del 100 y del 75%, y en el colangiocarcinoma distal, del 50 y del 50%.
ConclusionesLa morbilidad de la cirugía resectiva pancreática continúa siendo alta, aunque la mortalidad perioperatoria es baja. Las alteraciones de la función exocrina y endocrina son muy frecuentes y dependen del tipo de resección. A pesar de estar gravada con frecuentes complicaciones y alteraciones funcionales, la cirugía resectiva ofrece una posibilidad de supervivencia a largo plazo en determinados casos.
To evaluate postoperative morbidity and mortality, pancreatic function and long-term survival in patients with surgically treated pancreatic or periampullar tumours.
Patients and methodsCohort study including 160 patients consecutively operated on: 80 pancreaticoduodenectomies (PD), 30 distal pancreatectomies (DP), 7 total pancreatectomies, 4 central pancreatic resections and 3 ampullectomies. The tumour was not resected in 36 patients. Pancreatic function was evaluated by oral glucose tolerance test, faecal fat excretion and elastase.
ResultsResectability rate was 77.5%. In resected patients (n=124), 38.7% had complications with a pancreatic fistula rate of 6.4% and a mortality rate of 4%. In PD, endocrine function worsened in 41% and 58.6% had steatorrhoea; these figures in DP were 53.6% and 21.7% respectively. In the 36 non-resected patients, postoperative morbidity was 27.7% and mortality 8.3%. Two and five-year survival rates in resected patients with pancreatic cancer were 42% and 9% respectively; in malignant ampulloma 71% and 53%; in mucinous adenocarcinomas 83% and 33%; in duodenal adenocarcinoma 100% and 75%; and in distal cholangiocarcinoma 50% and 50%.
ConclusionsMorbidity associated with resective pancreatic surgery is still high, but perioperative mortality is low. Endocrine and exocrine disturbances are very common depending on the type of resection. Despite the associated morbidity and functional disorders, surgery provides long-term survival in selected cases.
El tratamiento de los tumores de páncreas y periampulares continúa siendo un gran reto médico y quirúrgico por presentar dificultades en todas las etapas de su proceso diagnóstico y terapéutico: clínico, por la ictericia grave, el dolor, la caquexia y el decaimiento general que ocasionan, que requieren un alivio rápido; diagnóstico, pues en muchos casos no se consigue tener un diagnóstico de certeza hasta la intervención; terapéutico, ya que el mejor tratamiento sigue siendo la resección quirúrgica, intervenciones gravadas aun con elevadas cifras de morbilidad y no exentas de mortalidad, y finalmente, porque en algunos tipos de tumores (especialmente el adenocarcinoma ductal de páncreas) los resultados de supervivencia a largo plazo continúan siendo desalentadores1.
Un aspecto escasamente evaluado son las alteraciones de la función exocrina y endocrina secundarias a la cirugía resectiva del páncreas2. Éstas repercuten notablemente en el estado metabólico y general de estos enfermos, por lo que su adecuada monitorización y tratamiento resultan de gran importancia.
Los avances de las últimas décadas en la evaluación preoperatoria, en la técnica quirúrgica y en los cuidados postoperatorios han supuesto una mejora en los resultados de morbimortalidad perioperatoria, lo que ha llevado a definir estándares óptimos de calidad3.
En España son escasas las series publicadas con experiencias amplias, tanto en el diagnóstico como en el tratamiento, y resultados de los pacientes con tumores de páncreas y periampulares. El objetivo de este estudio es analizar los resultados de morbimortalidad, el funcionalismo tras resección y la supervivencia a largo plazo de los pacientes con neoplasias pancreáticas y periampulares a los que se intervino quirúrgicamente en este centro. Como objetivo secundario se ha establecido comparar los resultados funcionales entre las resecciones cefálicas frente a las resecciones de cuerpo y cola de páncreas.
Pacientes y métodosEstudio de cohortes en el que se incluyeron 160 pacientes a los que se intervino consecutivamente por neoplasias de páncreas o periampulares entre febrero de 1998 y febrero de 2008. Los datos se recogieron prospectivamente en una base de datos diseñada específicamente al inicio del estudio y se analizaron en mayo de 2008.
La indicación quirúrgica y la evaluación de la resecabilidad se llevaron a cabo en un comité de tumores multidisciplinario que integran cirujanos, oncólogos, digestólogos, radiólogos y patólogos. Todos los pacientes incluidos se consideraron preoperatoriamente resecables con intención radical y se desestimaron intraoperatoriamente ante metástasis hepáticas o implantes peritoneales no sospechados preoperatoriamente. En estos casos se optó por doble derivación biliar y gastrointestinal, derivación únicamente biliar o sólo biopsia para confirmación histopatológica.
En los pacientes con tumores de páncreas el diagnóstico se realizó mediante tomografía computarizada (TC) con contraste oral e intravenoso, complementada con resonancia magnética (RM) o ecoendoscopia cuando surgieron dudas acerca de la afectación vascular. En estos pacientes no se realizó punción diagnóstica y en los que presentaban ictericia se realizó drenaje preoperatorio de la vía biliar. En las neoplasias ampulares o duodenales el diagnóstico se realizó mediante colangioRM y TC, y se confirmó histológicamente en biopsias obtenidas por colangiopancreatografía retrógrada endoscópica (CPRE), colocando prótesis preoperatoria si presentaba ictericia.
Se evaluaron datos demográficos, métodos diagnósticos, resecabilidad, técnica quirúrgica, morbimortalidad, tiempo de ingreso, requerimientos transfusionales, variación del índice de masa corporal (IMC), drenaje preoperatorio, funcionalismo pancreático posquirúrgico, tratamiento adyuvante y supervivencia a largo plazo.
Técnica quirúrgica Duodenopancreatectomía cefálicaSe inicia con el abordaje de la vena mesentérica superior (VMS) al separar el peritoneo que cubre el mesocolon transverso en continuidad con el epiplón mayor hasta llegar al tronco gastrocólico que se secciona. Colecistectomía, disección del hilio hepático, sección de arteria gastroduodenal y linfadenectomía, desde la bifurcación biliar hasta el duodeno, y del territorio de la arteria hepática. No se realiza en ese momento maniobra de Kocher, ya que se intenta no manipular la tumoración hasta el momento de la extracción de la pieza quirúrgica (non touch technique). Resección gástrica o preservación pilórica en función de la distancia entre éste y la neoplasia (al menos 2 o 3cm de duodeno libre) y el tipo de tumor (en ninguna neoplasia duodenal se realizó preservación pilórica). Sección del asa yeyunal a unos 15cm del ligamento de Treitz. Sección del páncreas a la altura del cuello, tomando biopsia intraoperatoria del borde pancreático. Maniobra de Kocher y separación de la VMS del retroperitoneo que se secciona. Reconstrucción mediante pancreático–gastrostomía (PG) si se había realizado preservación pilórica o mediante pancreático–yeyunostomía (PY) si se había realizado el Whipple clásico (en ambos casos ductomucosa tutorizada al exterior), anastomosis hepaticoyeyunal terminolateral y, finalmente, gastro–yeyunostomía o duodeno–yeyunostomía antecólica asociando una omega de Braun.
Resección corporocaudalSe inicia también por el abordaje mesentérico vascular, pero sin cortar el tronco gastrocólico. Linfadenectomía del tronco celíaco y arteria esplénica seccionando ésta en su origen. Según el tipo tumoral y su distancia al bazo se realiza preservación esplénica. Separación de la cara posterior del páncreas del retroperitoneo y sección de la vena esplénica en su unión con la VMS. Sección del parénquima pancreático en «boca de pez», suturándose el conducto de Wirsung y el parénquima pancreático. Ocasionalmente el páncreas se secciona con sutura mecánica.
Resecciones centralesSe siguen los mismos pasos iniciales que en la duodenopancreatectomía cefálica (DPC) y la resección corporocaudal (RCC), una vez tunelizada la VMS se van disecando los bordes superior e inferior del páncreas y se aísla la tumoración hasta que quede enmarcada entre 2 vessel-loops. Tras la resección, el muñón proximal del páncreas se cierra con sutura mecánica o manual y el muñón distal se anastomosa al estómago mediante PG ductomucosa. Ambos márgenes se analizan intraoperatoriamente para descartar afectación tumoral.
Duodenopancreatectomía totalSe realiza igual que la DPC, pero se extirpa la totalidad del páncreas en continuidad con el bazo. En esta serie se ha indicado de elección en los tumores difusos, en las DPC cuando el margen de resección está afectado y tras sucesivas ampliaciones no se consigue un margen libre analizado intraoperatoriamente y finalmente, cuando se identifica afectación del margen pancreático en la anatomía patológica definitiva.
AmpulectomíaSe accede a través de una duodenotomía longitudinal. Se infiltra la mucosa duodenal peripapilar con una solución de adrenalina y se incide la mucosa con electrobisturí. Se tracciona la papila y se diseca hasta identificar el conducto biliar y el pancreático que se seccionan, suturándose ambos a la pared posterior duodenal.
Funcionalismo pancreáticoSe evaluó en los casos en los que se ha realizado resección de parénquima pancreático (DPC, RCC, resección central [RC] y duodenopancreatectomía total [DPT]), a los 2 meses de la intervención y una vez retirado el tutor intrapancreático. Hasta una semana antes del estudio funcional, todos los pacientes reciben enzimas pancreáticas supletorias por vía oral y se monitorizan las glucemias y las necesidades de insulina según requerimientos durante el ingreso.
Función exocrinaSe evaluó mediante la determinación de grasas totales en heces de 3 días y con el test fecal de la elastasa 1 (E1) pancreática. Las grasas en heces se han determinado mediante el método de Van de Kamer et al4 y se ha considerado esteatorrea cuando la eliminación de grasas en heces es superior a 7g/24h. La E1 fecal se ha determinado mediante enzimoinmunoanálisis (Schebo-Biotech, Alemania) y se han considerado valores normales los superiores o iguales a 200μg/g de heces5,6.
Función endocrinaSe valoró de acuerdo con los criterios de la Organización Mundial de la Salud (OMS)7 mediante la determinación de la glucemia plasmática basal y la realización del test de sobrecarga oral a la glucosa. En los resultados se ha englobado como disfunción endocrina la diabetes mellitus y la intolerancia hidrocarbonada.
MorbimortalidadSe evaluó la morbimortalidad postoperatoria, el tiempo de ingreso y el volumen de transfusión perioperatoria. Se consideró fístula pancreática la presencia de amilasa en una concentración 3 veces superior a la plasmática en el líquido recogido por los drenajes abdominales o en cualquier colección abdominal a partir del décimo día postoperatorio o bien cuando se ha demostrado la dehiscencia radiológicamente.
Tratamiento adyuvanteEn los pacientes con cáncer de páncreas la quimioterapia adyuvante se ha realizado con gemcitabina y el tratamiento combinado mediante radioterapia en una dosis total de 50,4Gy y 5-fluorouracilo. En los pacientes con cáncer de duodeno se administró oxaliplatino y capecitabina.
Presentación de datos y análisis estadísticoLos resultados se presentan como media y desviación estándar, mediana e intervalo y en forma de porcentajes e intervalo de confianza (IC) del 95%. Se ha empleado la prueba de la χ2 para la comparación de variables dicotómicas y el test de la U de Mann-Whitney para las variables continuas; se considera significativo un valor de p<0,05. La supervivencia se calculó según el método actuarial y las comparaciones mediante la prueba de Gehan-Wilcoxon.
Resultados Datos demográficos y preoperatoriosLa serie incluyó a 160 pacientes, el 53,8% eran varones y el 46,3% eran mujeres, con una edad media de 61,7 ± 13 años (rango de 14 a 83) y un IMC prequirúrgico de 27 ± 4. En 28 casos (17,5%) el diagnóstico y la resecabilidad prequirúrgica se evaluaron únicamente mediante TC o RM, en 87 casos (54,3%) se realizaron ambas, en 43 casos (27%) se complementaron con CPRE y en 2 casos (1,2%) se complementaron con ultrasonografía endoscópica. En 75 pacientes (47%) se realizó drenaje biliar preoperatorio, el 56% por vía endoscópica y el 44% por vía percutánea. La localización preoperatoria del tumor se distribuía de la forma siguiente: cabeza del páncreas (46,9%), papila Vater (16,3%), cuerpo del páncreas (17,5%), cola del páncreas (8,8%), duodeno (5%), difuso (3,8%) y colangiocarcinoma distal (1,9%).
Intervención y morbimortalidadDe los 160 pacientes a los que se intervino, la resección se consiguió en 124 y el índice de resecabilidad fue del 77,5%. Se realizaron 80 DPC (60 con derivación pancreático gástrica y 20 con Whipple clásico), 30 RCC, 7 DPT, 4 RC y 3 ampulectomías. En 3 casos hubo que realizar resección vascular. La morbilidad, el tiempo de ingreso y la mortalidad de los pacientes con resección se muestran en la tabla 1. En los casos no resecados se hizo doble derivación en 22 casos, derivación biliar en 5 casos y laparotomía exploradora en 9. Su morbilidad, su tiempo de ingreso y su mortalidad se muestran en la tabla 2.
Tabla 1. Morbimortalidad en las intervenciones con resección
| DPC (n=80) | RCC (n=30) | DPT (n=7) | RC de páncreas (n=4) | AMP (n=3) | Total (n=124) | |
| Morbilidad, n (%) | 34 (42,5) | 8 (26,7) | 2 (28,6) | 2 (50) | 2 (66,7) | 48 (38,7) |
| Fístula pancreática, n (%) | 5 (6,25) | 3 (10) | – | 0 (0) | 0 (0) | 8 (6,4) |
| Con anastomosis pancreaticogástrica, n (%) (n = 60) | 4 (6,6) | |||||
| Con anastomosis pancreaticoyeyunal, n (%) (n = 20) | 1 (5) | |||||
| Fístula biliar, n (%) | 5 (6,3) | – | 0 (0) | – | 0 (0) | 5 (5,5) |
| Fístula gastroyeyunal, n (%) | 3 (3,8) | – | 1 (14,3) | – | – | 4 (4,6) |
| Absceso/colección, n (%) | 7 (8,8) | 3 (10) | 0 (0) | 2 (50) | 1 (33) | 13 (10,5) |
| VGR, n (%) | 7 (8,8) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 7 (5,6) |
| HDA, n (%) | 4 (5) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 4 (3,2) |
| Hemoperitoneo, n (%) | 4 (5) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 4 (3,2) |
| Infección herida, n (%) | 6 (7,5) | 2 (6,7) | 0 (0) | 0 (0) | 1 (33) | 9 (7,2) |
| Reintervenciones, n (%) | 3 (3,8) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 3 (2,4) |
| Días ingreso, mediana (amplitud) | 18 (8–81) | 12 (7–46) | 19 (13–60) | 11 (7–21) | 18 (16–25) | 17 (7–81) |
| Mortalidad, n (%) | 3 (3,8) | 2 (6,7) | 0 (0) | 0 (0) | 0 (0) | 5 (4) |
AMP: ampulectomía; DPC: duodenopancreatectomía cefálica; DPT: duodenopancreatectomía total; HDA: hemorragia digestiva alta; RC: resección central; RCC: resección corporocaudal; VGR: vaciamiento gástrico retardado.
Tabla 2. Morbimortalidad en las intervenciones sin resección
| Doble derivación (n=22) | Derivación biliar (n=5) | Laparotomía (n=9) | Total (n=36) | |
| Morbilidad, n (%) | 7 (32) | 0 (0) | 3 (33) | 10 (27,7) |
| Fístula pancreática, n (%) | 0 (0) | 0 (0) | 1 (11) | 1 (2,8) |
| Fístula biliar, n (%) | 1 (4,5) | 0 (0) | 0 (0) | 1 (2,8) |
| Fístula gastroyeyunal, n (%) | 0 (0) | – | – | 0 (0) |
| Absceso/colección, n (%) | 2 (9,1) | 0 (0) | 1 (11) | 3 (8,3) |
| VGR, n (%) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| HDA, n (%) | 2 (9,1) | 0 (0) | 0 (0) | 2 (5,5) |
| Hemoperitoneo, n (%) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Infección herida, n (%) | 2 (9,1) | 0 (0) | 1 (11) | 3 (8,3) |
| Reintervenciones, n (%) | 1 (4,5) | 0 (0) | 0 (0) | 1 (2,8) |
| Días ingreso, mediana (amplitud) | 10 (3–30) | 8 (7–18) | 13 (5–91) | 10 (3–91) |
| Mortalidad, n (%) | 3 (13,6) | 0 (0) | 0 (0) | 3 (8,3) |
HDA: hemorragia digestiva alta; VGR: vaciamiento gástrico retardado.
Se transfundió a 99 pacientes (62%), la mitad intraoperatoriamente y el resto durante el postoperatorio con una mediana de requerimientos de concentrados de hematíes de 2.
Estudio funcionalEl 25% de los pacientes presentaba algún tipo de disfunción endocrina preoperatoria, incluido un 9,4% que presentaba diabetes mellitus dependiente de la insulina. Los resultados del estudio funcional con las alteraciones exocrinas y endocrinas tras la resección, así como el descenso del IMC, se muestran en la tabla 3.
Tabla 3. Resultados de la función exocrina y endocrina tras resección
| DPC (n=77) | RCC (n=23) | DPT (n=7) | RC de páncreas (n=4) | DPC frente a RCC, p | |
| Esteatorrea (%) | 58,6 | 21,7 | 100 | 0 | <0,05 |
| Grasas en heces (g/24h), mediana (amplitud) | 10 (0,7–59) | 5 (0,6–54) | 40 (40–50) | 3 (0,7–4) | <0,05 |
| Elastasa, mediana (amplitud) (VN >200μg/g) | 4,3 (0–227) | 172 (0,1–538) | 0 | 271 (200–438) | <0,05 |
| Empeoramiento de la disfunción endocrina (%) | 41 | 53,6 | 85,7 | 25 | ns |
| DMID (%) | 38,5 | 25 | 100 | 25 | ns |
| Descenso del IMC (%) (amplitud) | 14 (0–35) | 9,8 (0–23) | 12 (3–20) | 4 (1,4–6,4) | <0,05 |
DMID: diabetes mellitus dependiente de la insulina; DPC: duodenopancreatectomía cefálica; DPT: duodenopancreatectomía total; IMC: índice de masa corporal; ns: no significativo estadísticamente; RC: resección central; RCC: resección corporocaudal; VN: valor normal.
La distribución de los tipos de tumores identificados en el estudio anatomopatológico se muestra en la tabla 4.
Tabla 4. Resultados histológicos
| Tipo de tumor | n | % |
| Adenocarcinoma ductal de páncreas | 89 | 55,6 |
| Ampuloma | 25 | 15,6 |
| Adenocarcinoma duodenal | 8 | 5 |
| Adenocarcinoma mucinoso | 6 | 3,8 |
| Tumor solidoquístico | 6 | 3,8 |
| Colangiocarcinoma distal | 6 | 3,8 |
| Cistoadenoma | 5 | 3,1 |
| Tumor carcinoide | 5 | 3,1 |
| Metástasis de varios orígenes | 4 | 2,5 |
| Infiltración de otros tumores | 2 | 1,3 |
| Sarcoma | 2 | 1,3 |
| Neuroendocrino | 1 | 0,6 |
| Hiperplasia adenomiomatosa | 1 | 0,6 |
De los pacientes resecados, recibieron tratamiento adyuvante 28 pacientes con cáncer de páncreas (32%) y 6 pacientes con cáncer duodenal (75%).
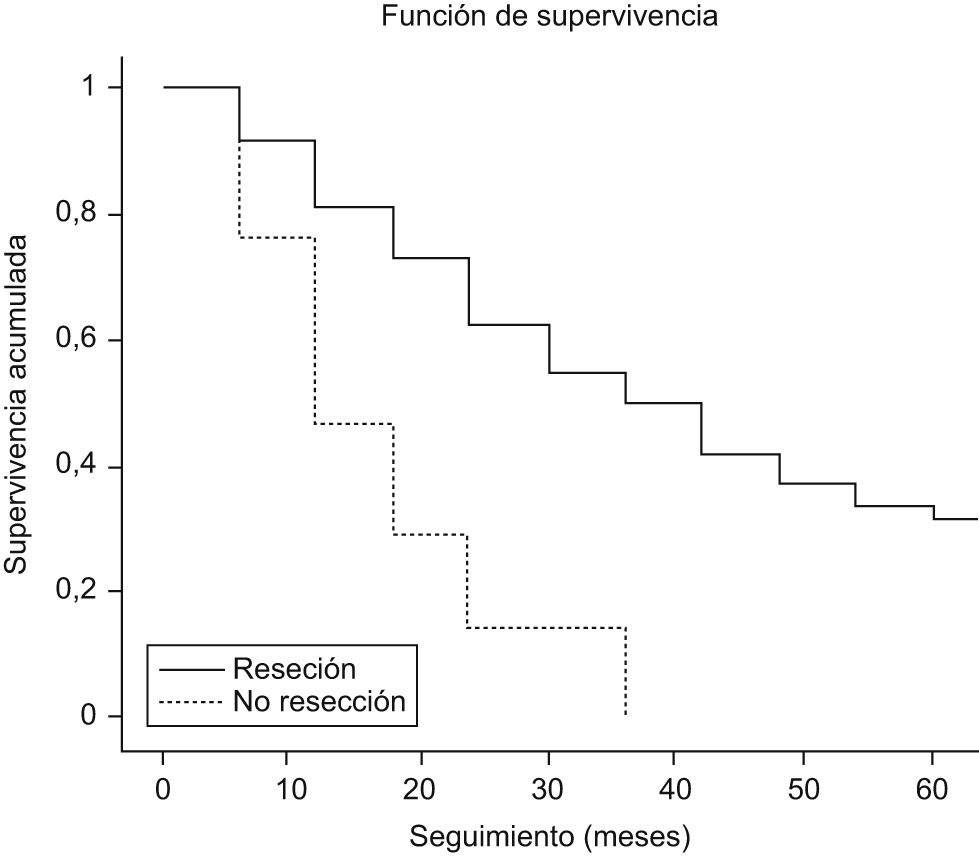
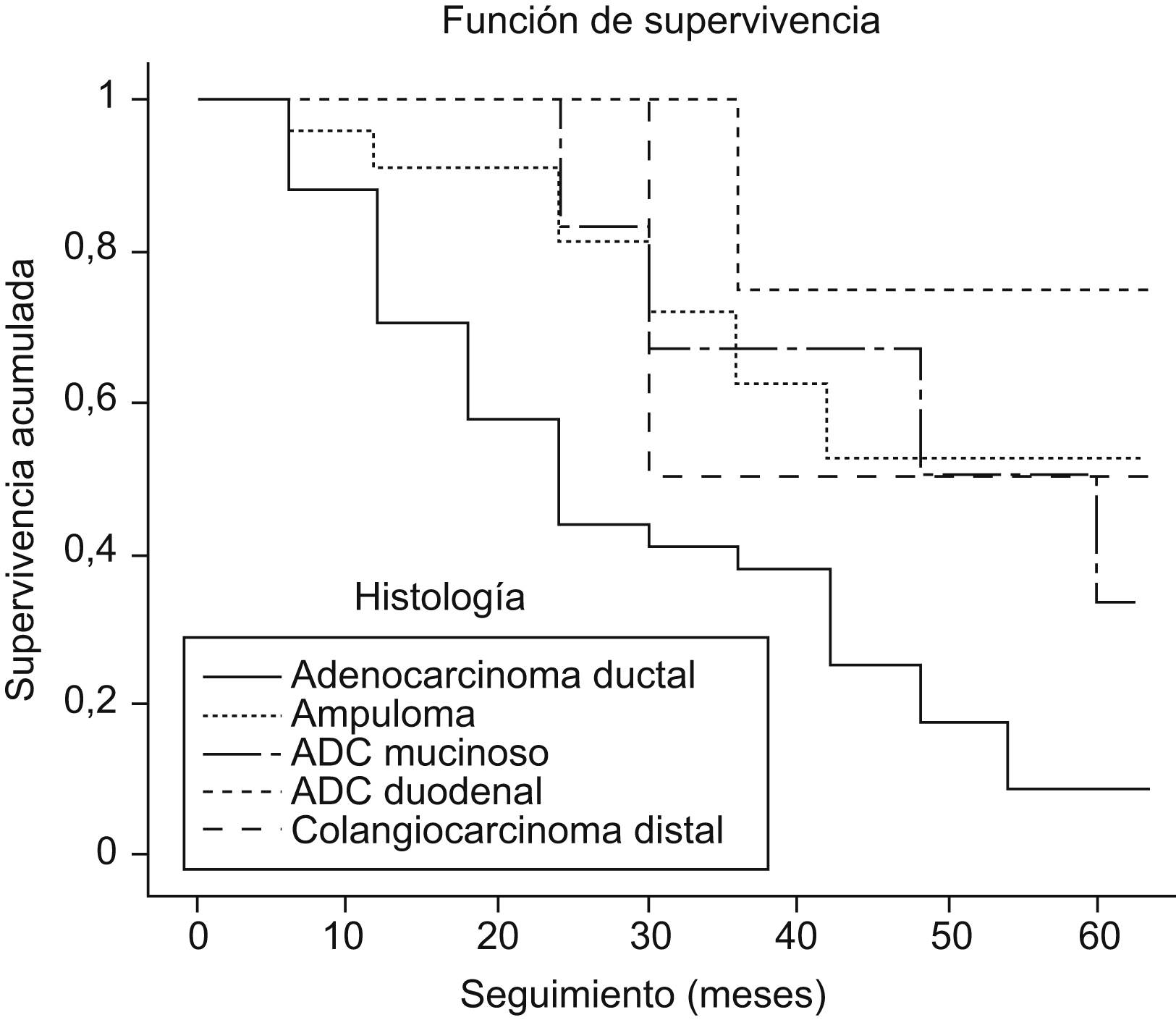
La mediana de seguimiento fue de 21,5 meses. En los tumores malignos la resección consiguió una supervivencia a uno, a 2, y a 5 años del 73% (IC del 95%: 81 a 65), del 55% (IC del 95%: 64 a 46) y del 32% (IC del 95%: 40 a 23), respectivamente, con una mediana de supervivencia de 35,6 meses. En los tumores que no se consiguió resecar, la supervivencia a uno, a 2 y a 3 años fue del 26% (IC del 95%: 45 a 13), del 14% (IC del 95%: 26 a 2) y del 0%, respectivamente, con una mediana de supervivencia de 11,3 meses (p<0,05) (figura 1). La supervivencia mediana y a 2 y 5 años, tras resección, según el tipo histológico más frecuente y de mayor interés, resultó de la siguiente manera: adenocarcinoma ductal de páncreas 21 meses, 42% (IC del 95%: 55 a 29) y 9% (IC del 95%: 16 a 1), y ampuloma 60 meses, 71% (IC del 95%: 89 a 53) y 53% (IC del 95%: 73 a 33) (figura 2).
Figura 1. Tumores malignos: supervivencia a largo plazo según se haya efectuado la resección tumoral o no.
Figura 2. Supervivencia tras resección según los principales tipos histológicos.
DiscusiónLos tumores de páncreas y periampulares son una enfermedad en continuo aumento, lo que demanda una alta calidad y dedicación de los equipos médicos. Para optimizar los resultados terapéuticos es necesario un abordaje multidisciplinar enmarcado en los comités de tumores o en unidades funcionales. La cirugía sigue siendo el pilar fundamental en el tratamiento y la resección debe intentarse porque es el único tratamiento que permite alcanzar supervivencias a largo plazo. Además, la histología definitiva puede ser diferente de la sospechada preoperatoriamente y tener un pronóstico radicalmente distinto. La resección, incluso en los casos desfavorables con una corta expectativa de vida, puede ofrecer también una mejor calidad de vida8,9.
La mayoría de los autores está de acuerdo con que auditar los resultados de la cirugía debe formar parte de los procedimientos de control de calidad de las unidades especializadas. A falta de auditorías externas, los propios grupos implicados deben llevar a cabo este control, imprescindible para el conocimiento de los propios resultados y para el contraste con otros grupos con el fin de lograr una mejor eficiencia. Actualmente se consideran estándares de calidad en la DPC una mortalidad inferior al 10%, una morbilidad inferior al 50% y una supervivencia a 5 años superior al 30%3. En esta serie la mortalidad total es de un 5% (un 3,8% corresponde a las DPC y un 6,7% a las RCC). Aunque se haya conseguido reducir la mortalidad en las últimas décadas en los centros experimentados, la morbilidad continúa siendo alta. Así, el grupo del Johns Hopkins10 en una de sus últimas revisiones asume una morbilidad del 38%, similar al 43% de la Universidad de Indiana11, al 46% del Memorial Sloan-Kettering Cancer Center12 y al 36% del equipo de Büchler et al13.
Entre las complicaciones más importantes hay que hacer referencia en primer lugar a la fístula pancreática, ya que suele ser la de mayor trascendencia. En nuestra serie se ha conseguido una tasa de fístulas pancreáticas en las DPC notablemente baja (6,25%) y más alta en las resecciones de cuerpo y cola (10%) de acuerdo con el criterio de fístula de la Universidad Johns Hopkins14, puesto que las definiciones consensuadas son de reciente aparición15. Resulta llamativo que al analizar las numerosas series que presentan resultados con PG, la mayoría ofrece unas tasas de fístulas cercanas al 5%, mientras que cuando se comparan la PG y la PY en estudios aleatorizados, la diferencia entre ambas no resulta significativa, con cifras en torno al 10 y al 20%14,16,17,18,19,20,21,22,23,24. Aunque un metaanálisis indica un menor número de complicaciones con la PG25, en nuestra opinión una técnica meticulosa de reconstrucción puede ser más segura que la propia técnica en sí misma. Con respecto al funcionalismo pancreático, la DPC provoca insuficiencia exocrina en el 58,6% de los casos frente a sólo un 21,7% en las RCC, diferencia estadísticamente significativa. Este alto porcentaje de alteración exocrina en las DPC coincide con las cifras aportadas por Matsumoto y Traverso26 y Fang et al27 que encuentran valores del 50 y del 52,4%, respectivamente, pero inferiores a otras en las que se detecta en la práctica totalidad de los pacientes28 y refuerzan la necesidad de aportar suplementos enzimáticos. Por el contrario, las alteraciones del metabolismo hidrocarbonado empeoran de forma similar tanto si la intervención es una DPC como una RCC, con valores del 41 y del 53,6%, similares a los encontrados en otras series para la DPC29. Las cifras de disfunción endocrina tras RCC de nuestro trabajo resultan notablemente elevadas al compararlas con los valores más habitualmente encontrados en la literatura médica (alrededor del 10%)27,30, pero coinciden con las series en las que estas alteraciones se investigan, como en ésta, mediante el test de sobrecarga oral a la glucosa (entre el 37 y el 42%)31,32.
Finalmente, nos gustaría insistir, junto con otros autores33, en que el nihilismo terapéutico frente a los tumores de páncreas y periampulares no es aceptable hoy en día. El mejor tratamiento posible es la resección y debe ofrecerse con unas garantías de morbimortalidad que ya están bien establecidas. Es la única posibilidad para conseguir supervivencias a largo plazo, sobre todo cuando la anatomía patológica no es de adenocarcinoma ductal de páncreas. Pero incluso en esos casos, aunque sean muy pocos los que con un diagnóstico confirmado de adenocarcinoma ductal de páncreas consigan sobrepasar la barrera de los 5 años34, la resección va a conseguir prolongar la supervivencia muy claramente —en esta serie un 42 y un 29% a los 2 y a los 3 años, respectivamente— frente a los que no se consiguen resecar y lo que es más importante, como ya han demostrado otros investigadores35, con una calidad de vida muy superior.
Agradecimientos
A los miembros del Comité de Tumores Hepatobiliopancreáticos del Hospital Clínico Universitario de Valencia y que no figuran como coautores del presente trabajo: I. Pascual y P. Almela (Gastroenterología), P. Lluch (Hepatología), M. Rausell (TC), R. Aliaga (RM), J. Guijarro (R. Intervencionista) y A. Ferrández (Anatomía Patológica).