La pancreatitis autoinmune (PAI) es una etiología poco habitual de presentación de pancreatitis crónica, aproximadamente el 6% de todas ellas1. Se trata de una enfermedad sistémica con afectación pancreática, así como de otros órganos como vía biliar, glándulas salivales, ganglios linfáticos, riñón o retroperitoneo.
Fue descrita por primera vez en el año 1961 por Sarles et al.2. Desde entonces se ha producido un gran desarrollo en el conocimiento de esta entidad aunque aún a día de hoy persisten algunas controversias en cuanto a los criterios diagnósticos y terapéuticos tal y como demuestra la Conferencia de Consenso de 2010 celebrada en Honolulu3.
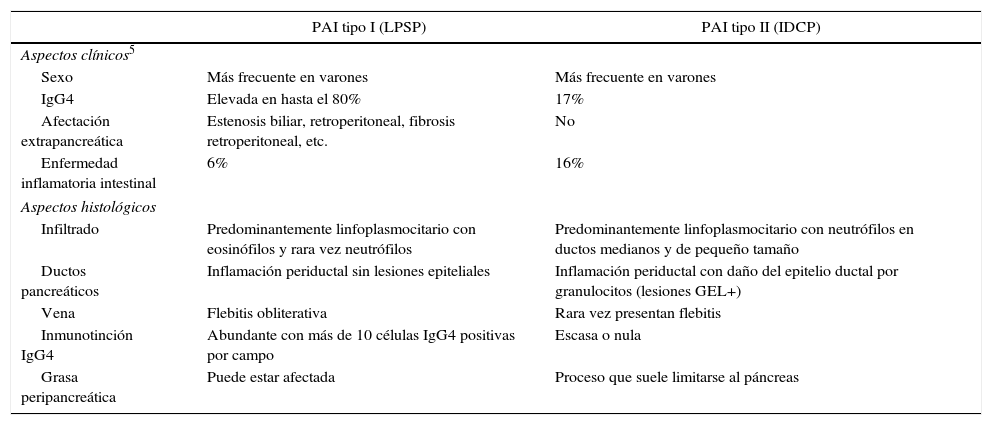
La PAI se divide en 2 formas clínico-patológicas. La tipo I o lymphoplasmocytic sclerosing pancreatitis (LPSP, por sus siglas en inglés) y la tipo II o idiopathic duct centric pancreatitis (IDCP, por sus siglas en inglés). La diferencia histológica fundamental es la presencia de infiltrado por células IgG4 por encima de 10 células/campo en la tipo I siendo muy escaso o nulo en la tipo II. Otra diferencia importante es la presencia de lesiones granulocíticas epiteliales en la tipo II (GEL). Clínicamente ambas se suelen manifestar como ictericia obstructiva asociada a masa en la cabeza pancreática (tabla 1). Es fundamental por lo tanto realizar un diagnóstico diferencial con el adenocarcinoma de cabeza de páncreas. El porcentaje de pacientes con PAI demostrada por anatomía patológica en resecciones por sospecha de adenocarcinoma de páncreas es del 2,4% según los datos del Johns Hopkins Hospital4.
Aspectos clínico histológicos de la PAI tipo I y II
| PAI tipo I (LPSP) | PAI tipo II (IDCP) | |
|---|---|---|
| Aspectos clínicos5 | ||
| Sexo | Más frecuente en varones | Más frecuente en varones |
| IgG4 | Elevada en hasta el 80% | 17% |
| Afectación extrapancreática | Estenosis biliar, retroperitoneal, fibrosis retroperitoneal, etc. | No |
| Enfermedad inflamatoria intestinal | 6% | 16% |
| Aspectos histológicos | ||
| Infiltrado | Predominantemente linfoplasmocitario con eosinófilos y rara vez neutrófilos | Predominantemente linfoplasmocitario con neutrófilos en ductos medianos y de pequeño tamaño |
| Ductos pancreáticos | Inflamación periductal sin lesiones epiteliales | Inflamación periductal con daño del epitelio ductal por granulocitos (lesiones GEL+) |
| Vena | Flebitis obliterativa | Rara vez presentan flebitis |
| Inmunotinción IgG4 | Abundante con más de 10 células IgG4 positivas por campo | Escasa o nula |
| Grasa peripancreática | Puede estar afectada | Proceso que suele limitarse al páncreas |
IDCP: idiopathic duct centric pancreatitis; LPSP: lymphoplasmocytic sclerosing pancreatitis; PAI: pancreatitis autoinmune.
La PAI es una enfermedad que responde al tratamiento con corticoides, la precisión en el diagnóstico es crucial para evitar cirugías mayores innecesarias.
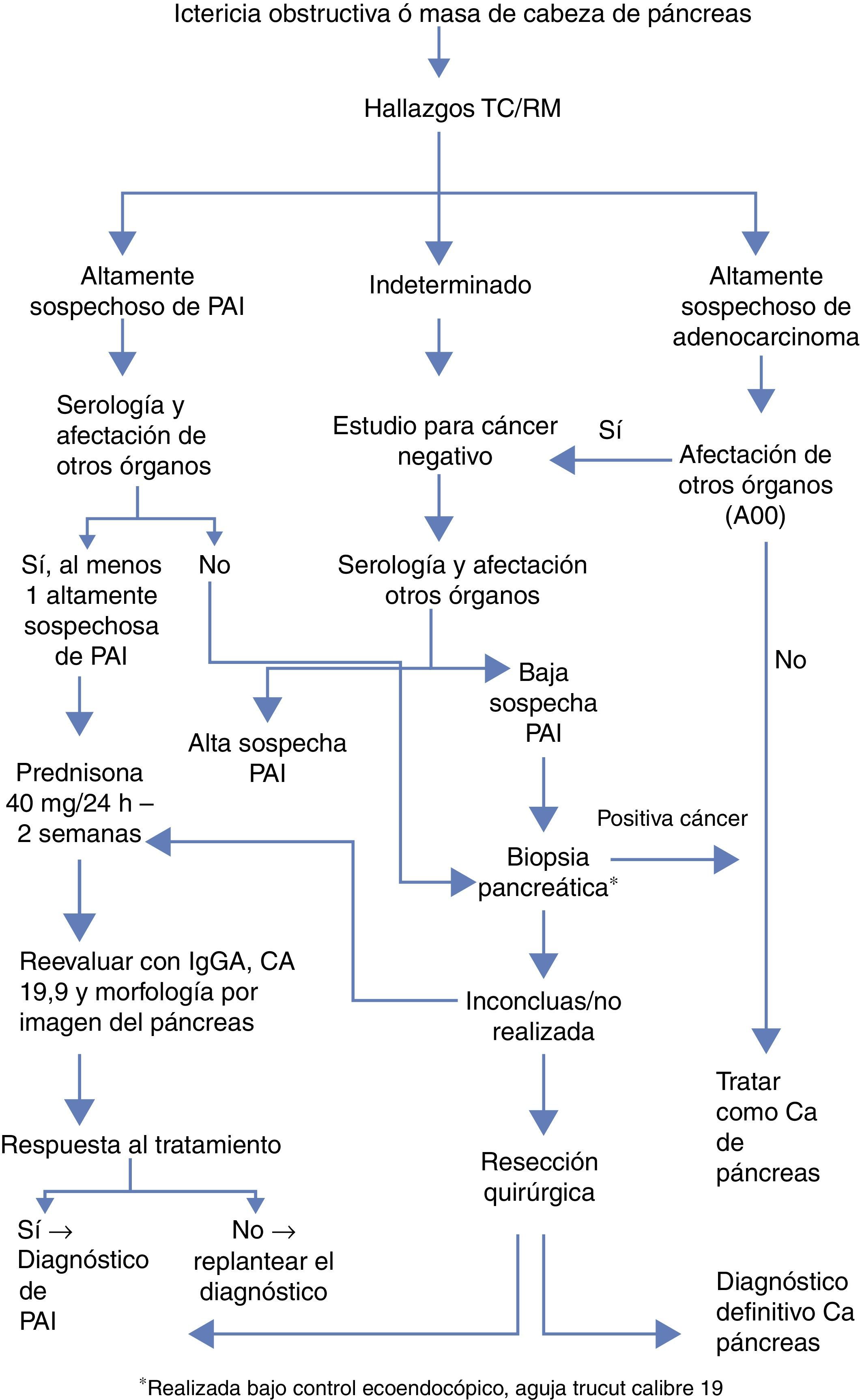
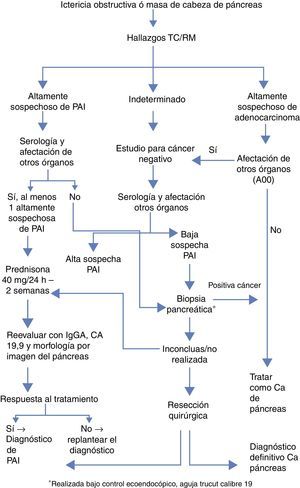
Para el diagnóstico es precio apoyarse en 5 pilares: histología, imagen, serología, afectación de otros órganos y respuesta al tratamiento corticoideo (criterios HISORt)6. En función de estos criterios se ha establecido un algoritmo propuesto por la Clínica Mayo para optimizar el manejo diagnóstico terapéutico de estos pacientes (fig. 1).
Algoritmo diagnóstico simplificado de la Clínica Mayo para diferenciar adenocarcinoma de páncreas vs. PAI4.
Las características radiológicas pueden ser determinantes en el diagnóstico diferencial. Las pruebas complementarias que mejor orientan hacia el diagnóstico definitivo son la tomografía axial computarizada (TAC) y la colangiopancreatografía retrógrada endoscópica (CPRE). Los hallazgos característicos de la TAC son engrosamiento difuso pancreático en forma de salchicha con hipoatenuación periférica, así como pérdida de lobularidad e involución de la cola. Los criterios establecidos por Sugumar et al.7 en el pancreatograma tras la CPRE son: estenosis larga del conducto principal (más de un tercio de la longitud), ausencia de dilatación preestenótica (menos de 5mm), estenosis múltiples y ramificaciones procedentes de la estenosis segmentaria principal.
La elevación en suero de IgG4 (inmunoglobulina G4) por encima de su valor normal (mayor de 140mg/dl) es otro de los criterios diagnósticos fundamentales. El grupo de la Clínica Mayo le otorga una sensibilidad, especificidad y valor predictivo positivo del 76, 93 y 36%, respectivamente8.
El tratamiento con corticoides solo debería iniciarse tras descartar adenocarcinoma. La dosis propuesta es de 40mg de prednisona cada 24h. Se debe evaluar la respuesta al tratamiento con niveles de IgG4, Ca 19.9 y prueba de imagen a las 2 semanas. Se mantienen 5mg por semana en caso de respuesta, mientras que en ausencia de la misma, definida por falta de mejoría radiológica hay que replantear el diagnóstico e incluso recurrir a la cirugía.
A continuación presentamos nuestra experiencia con esta enfermedad aplicando el algoritmo propuesto por la Clínica Mayo con la salvedad de que no disponemos de biopsia ecoguiada habiéndose sustituido por punción aspiración con aguja fina (PAAF).
Caso 1Varón de 46 años que ingresa para estudio de ictericia asociada a masa de cabeza de páncreas. Clínicamente destacaba un incremento en el número de deposiciones diarias de características esteatorreicas. La determinación analítica mostraba los siguientes hallazgos: bilirrubina total 10,4mg/dl, GGT 673UI/l (gamma-glutamil transferasa) y PA 638UI/l (fosfatasa alcalina), IgG 1.410mg/dl (valores normales: 700-1.600mg/dl) y Ca 19.9 38. La TAC demostró una dilatación de la vía biliar intra y extrahepática con una masa en cabeza de páncreas. La CPRE y la ecoendoscopia identificaron una lesión de 35mm que condicionaba estenosis del conducto pancreático principal. La PAAF mostraba atipia glandular de significado indeterminado. Ante la sospecha de adenocarcinoma de páncreas se realizó duodenopancreatectomía cefálica siendo el diagnóstico anatomopatológico definitivo compatible con pancreatitis autoinmune tipo I (esclero-linfocítica).
Caso 2Mujer de 57 años con antecedentes de colitis ulcerosa que debuta con coluria, acolia y dolor abdominal irradiado en cinturón. En la exploración física destacaba ictericia conjuntival. El perfil bioquímico demostró: bilirrubina total: 9,1mg/dl, GGT 897UI/l, PA 347UI/l. Tanto los marcadores tumorales (CEA, Ca 19.9) como la IgG4 fueron normales. La TAC y la ecoendoscopia describían una lesión en cabeza de páncreas y proceso uncinado sugerente adenocarcinoma versus tumor neuroendocrino, dadas las características de captación de contraste. La PAAF no fue diagnóstica decidiéndose en comité de tumores la intervención quirúrgica. Se procedió a la realización de duodenopancreatectomía cefálica ampliando la resección a pancreatectomía total, ya que la biopsia intraoperatoria del borde de sección presentaba afectación por tumor de posible origen neuroendocrino. El diagnóstico anatomopatológico definitivo fue de PAI tipo II (idiopática centroductal).