Introducción
La extirpación quirúrgica o la disminución en la función del bazo (hipoesplenismo) producen déficit de aclaramiento del torrente sanguíneo de antígenos tanto intracelulares como extracelulares, déficit de la función macrofágica y alteración de producción de IgM, con pérdida de la respuesta específica a antígenos polisacáridos; esto es, un déficit inmunitario tanto específico como inespecífico, con una especial predisposición a la infección bacteriémica grave por agentes encapsulados. No está demostrada la mayor susceptibilidad a agentes virales en pacientes esplenectomizados1-3.
El período de máximo riesgo de infección grave es los primeros 3-5 años tras esplenectomía, y se mantiene durante el resto de la vida del paciente un riesgo del 5%1,5,6.
En esos primeros años ocurren un 50-80% de las infecciones graves y un 60-92% de los fallecimientos4.
El riesgo de infeccion grave tras la esplenectomía es mayor en menores de 16 años y pacientes cuya enfermedad subyacente comporte imnunodeficiencia o enfermedad hemática maligna o que reciban tratamientos que alteran el estado inmunitario.
En una serie escocesa4 siguieron durante 11 años, entre 1988 y 1999, a 1.648 pacientes esplenectomizados por diferentes motivos. Encontraron una tasa general de infección grave (sepsis o meningitis) de 0,89 casos anuales cada 100 personas.
El 21,2% requirió ingreso por algún tipo de infección relacionada con la esplenectomía durante el período de seguimiento, con una supervivencia acumulada a los 5 años del 54%.
Los pacientes esplenectomizados por traumatismo abdominal presentaban 3,12 ingresos por infección/100 personas/año (riesgo relativo [RR] = 1) y aquellos en los que el motivo de la esplenectomia fue enfermedad hemática maligna presentaban 13,26 ingresos por infección/100 personas/año (RR = 4,07; intervalo de confianza [IC] del 95%, 2,61-6,34)4.
Método
Se realizó una búsqueda bibliográfica en las bases de datos siguientes: Cochrane Collaboration, UptoDate on line, Clinical Evidence, Bandolier, TRIP Database Free, SUMSearch, National Guideline Clearinghouse, US Preventive Services Task Force (USPTF) Recomendations, The York Database of Abstracts of Reviews of Effects (DARE) y PubMed, utilizando como palabras clave: "splenectomy", "asplenia", "asplenic patient", "vaccination", "pneumococcal vaccination", "meningococcal vaccination", "immunization", "antibiotic prophylaxis", "post-splenectomy infections", "protective strategies", "sepsis", "risk infection" y "overwhelming infection".
La mayor parte de la literatura hallada, correspondiente a este período, se trata de revisiones, trabajos descriptivos y documentos de consenso de sociedades científicas. Únicamente se encontró 2 ensayos clínicos aleatorizados y a doble ciego, que en realidad podría decirse que se trata de uno solo realizado en dos partes7,8 y un metaanálisis sobre la eficacia de la vacuna antineumocócica9, por lo que, en general, la bibliografía hallada adolece de un débil nivel de evidencia.
Agentes infecciosos
Las bacterias más frecuentemente observadas en las infecciones graves de los pacientes sin bazo son las encapsuladas, con una incidencia de 15 a 20 veces superior que en la población general2,4.
Streptococcus pneumoniae
Es el agente más frecuentemente aislado en hemocultivos (50-90%) de los pacientes que presentan sepsis tras la esplenectomía, con tendencia aumentar con la edad del paciente1,5 y en niños con hipofunción esplénica por la enfermedad de las células falciformes; en general son los serotipos 6, 14, 18, 19 y 23 los más frecuentemente aislados en Estados Unidos10, con tendencia al desarrollo de bacteriemia o meningitis con alta tasa de mortalidad, superior al 50%1,10,11.
Haemophylus influenzae tipo b (Hib)
Es el segundo agente implicado, con una tasa de sepsis letal de un 2-7%, lo que supone un riesgo 540 veces superior que en la población general11, con especial incidencia en menores de 15 años5. Actualmente tiende a la disminución debido a la vacunación sistemática de la población infantil con anti-Hib.
Neisseria meningitidis
Aunque es el tercer agente en frecuencia en producir sepsis en esplenectomizados, no está del todo demostrado que la sepsis por este agente sea más frecuente en estos pacientes que en la población general1,6.
Otros agentes implicados en infección sistémica grave en pacientes esplenectomizados son: Salmonella sp., Staphylococcus aureus, Escherichia coli y otros coliformes, Capnocytophaga canimosus, también denominado bacilo-DF 2, asociado a mordedura de perro y otras heridas. Especial mención merecen agentes intracelulares como Plasmodium falciparum y el género Babessia, frecuente en zonas templadas y tropicales10,11.
Profilaxis antimicrobiana
La profilaxis de la sepsis tras la esplenectomía se basa en tres ejes: vacunación, profilaxis antibiótica y educación del paciente y sus familiares.
Vacunación
Los sujetos sometidos a esplenectomía no presentan ninguna contraindicación a las vacunas, tanto de agentes vivos atenuados como antígenos capsulares; es más, por su condición de pacientes sin bazo, está recomendada la administración adicional de determinadas vacunas, como la antigripal en niños. Los niños esplenectomizados tampoco tienen ninguna contraindicación para seguir el calendario vacunal que establezcan las autoridades sanitarias correspondientes, aunque el grado de contraindicación debe decidirlo el médico en cada caso12,13. Todos los pacientes esplenectomizados deben ser vacunados con una dosis de vacuna antineumocócica (polisacárida 23-valente [VP23] en mayores de 2 años de edad y con conjugada heptavalente [PCV7] en menores de 23 meses), una única dosis de anti-Hib, una dosis de vacuna antimeningocócica y anualmente de la gripe (tabla 1). Se precisa reinmunización cada 5 años en el caso de la vacuna antineumocócica y cada 4-10 años en el caso de la antimeningocócica, dependiendo del tipo de vacuna. Estas vacunas son aplicables a pacientes con asplenia o hipoesplenia funcional (hepatopatía crónica, hipertensión portal, etc.)10,13,14.
Por regla general, no existe contraindicación para la vacunación simultánea, siempre que se haga con distinta jeringuilla y en lugares del cuerpo separados. La administración simultánea de 2 o más vacunas, en distintas regiones anatómicas, no resta su eficacia ni aumenta sus efectos secundarios12,14.
En la mujer embarazada no se ha estudiado los efectos de la vacunación; probablemente es segura, pero se debe valorar el beneficio-riesgo. Tampoco existe contraindicación formal para la vacunación de pacientes VIH positivos asintomáticos salvo con virus o bacterias vivas, si bien hay que tener en cuenta que no alcanzarán inmunidad con las dosis habituales o será más difícil que la consigan14,15.
En la esplenectomía electiva, la vacunación simultánea debería hacerse, como mínimo, antes de los 15 días de la intervención, para llegar al postoperatorio con cantidades protectoras de anticuerpos IgG3,16,17.
En los casos de esplenectomía urgente, se ha demostrado mediante ensayo clínico para la VP23 que se alcanza mayores cifras de anticuerpos IgG y mayor capacidad de opsonización cuando se administra la vacuna a los 14 días de la esplenectomía que con la vacunación en el día de la cirugía, a los 7 o a los 28 días7,8. No hay datos semejantes sobre las otras vacunas, por lo que por analogía se podría aplicar este criterio temporal al resto de las vacunas.
En caso de administrar tratamiento inmunosupresor como radioterapia o quimioterapia, la administración de las vacunas debería retrasarse, al menos, 314 a 616,17 meses después de haber concluido el tratamiento; mientras tanto, se procede a la quimioprofilaxis hasta completar la vacunación10. Los pacientes con enfermedad de Hodgkin deberían ser vacunados, como mínimo, 2 semanas antes del inicio de la quimioterapia14.
En el caso de tratamiento con corticoides, si éste es a altas dosis (> 2 mg/kg/día o > 20 mg/día durante más de 2 semanas)19, debe retrasarse la vacunación hasta un mes después de finalizar el tratamiento, puesto que las dosis suprafisiológicas de corticoides reducen la respuesta inmunitaria a las vacunas, y durante este período se debe administrar profilaxis antibiótica a todos los pacientes. No existe contraindicación para la vacunación, incluso con virus vivos, en aquellos que reciben dosis bajas de corticoides (< 2 mg/kg/día o < 20 mg/día), se tratan con terapia corticoidea en días alternos o tuvieron tratamiento durante menos de 2 semanas14,15.
Vacuna antineumocócica
Existen dos tipos de vacunas antineumocócicas: una eficaz en adultos (VP23) y otra aplicable en niños menores de 24 meses (PCV7), puesto que éstos no son capaces de crear inmunidad contra antígenos polisacáridos3,16,17. Asimismo, por lo mencionado anteriormente, los niños esplenectomizados deben completar el calendario vacunal vigente, así como vacunados anualmente de la gripe3,11,13,16-19.
La eficacia de la vacuna VP23 contra la infección bacteriémica en pacientes inmunodeficientes es de un 68-84%; esta vacuna no protege de la infección no bacteriémica (neumonía, infección del tracto respiratorio superior, etc.), pero sí disminuye su letalidad10,19.
En las tablas 1 y 2 se puede apreciar cómo se realiza la vacunación según la edad de los sujetos (mayores de 2 años esplenectomizados y menores de 24 meses).
Vacunación anti-Hib
Es una vacuna de alta eficacia, con un 95% de protección3. Actualmente está incluida en el calendario vacunal infantil, y se administra sistemáticamente antes de los 5 años.
En caso de que un niño mayor de 5 años o un adulto no vacunados sean esplenectomizados, recibirán una sola dosis de vacuna anti-Hib, sin que se haya establecido la necesidad de administrar dosis de refuerzo posteriores16,17.
Se administrará como mínimo 15 días antes de la esplenectomía o 14 días después de la cirugía si Ésta es de carácter urgente19.
Vacunación antimeningocócica
Las cepas más frecuentemente aisladas en enfermedad meningocócica invasiva pertenecen al serogrupo B (60%), y no se dispone de vacuna contra ellas. Los serogrupos A y C se aíslan en el 2 y el 10% de los casos respectivamente, si bien el serogrupo C está en aumento en los últimos años17, progresión que ha sido frenada gracias a las tres campañas consecutivas de vacunación que se han realizado en nuestro país20.
Las personas esplenectomizadas, de todas las edades, incluso los menores de 24 meses, deben recibir una dosis de vacuna antimeningocócica, como mínimo 15 días antes de la esplenectomía o 14 días después de ésta. En nuestro país sería suficiente administrar la vacuna conjugada bivalente A+C, pues los serogrupos Y y W135 son anecdóticos19, y la vacuna conjugada ofrece mayor inmunogenicidad, unido todo ello a que la vacuna tetravalente sólo está disponible como fármaco extranjero, con la complejidad administrativa inherente a esta situación.
Los sujetos esplenectomizados que habitan áreas endémicas o en situación de epidemia o viajen a ellas deben recibir dosis de recuerdo a los 3-5 años de la primera dosis3,6,10-17,19. En las zonas de endemia de las cepas Y y W135 (África central, Oriente Medio, península arábiga) sí deberían recibir la vacuna polisacárida tetravalente (A, C, Y, W135).
Vacunación antigripal
Está recomendada a los pacientes de todas las edades, y debe administrarse anualmente, pues reduce el riesgo de infecciones secundarias10,19. El período de administración previo a la esplenectomía es entre 6 semanas y 15 días; posteriormente a la esplenectomía debe administrarse al mes de la intervención10,11.
Profilaxis antibiótica
No hay acuerdo sobre la utilización generalizada de la profilaxis antibiótica en todos los pacientes esplenectomizados, incluso se sabe que, al igual que la vacunación, la profilaxis antibiótica de forma continuada no elimina por completo el riesgo de sepsis tras la esplenectomía. Esta falta de acuerdo se da por la heterogeneidad de los pacientes esplenectomizados, pues aquellos en que la indicación de la esplenectomía tiene que ver con enfermedades hemáticas malignas u oncológicas en general presentan distinto estado inmunitario que aquellos cuya indicación de esplenectomía fue por traumatismo abdominal. También es cierto que la edad del paciente influye en el riesgo de infección grave tras la esplenectomía, pues los niños y los adolescentes tienen mayor riesgo que los adultos, por lo que sí disponemos de unas pautas claras en la profilaxis en niños hasta los 14 años de edad10.
En lo que sí parece haber acuerdo unánime es en que la profilaxis a largo plazo contribuye a seleccionar cepas resistentes, es difícil de cumplir y confiere una falsa expectativa de seguridad, por lo que una de las medidas profilácticas importantes es también la educación del paciente, para tomar medidas de protección en situaciones especiales de riesgo como viajes y contacto con animales10.
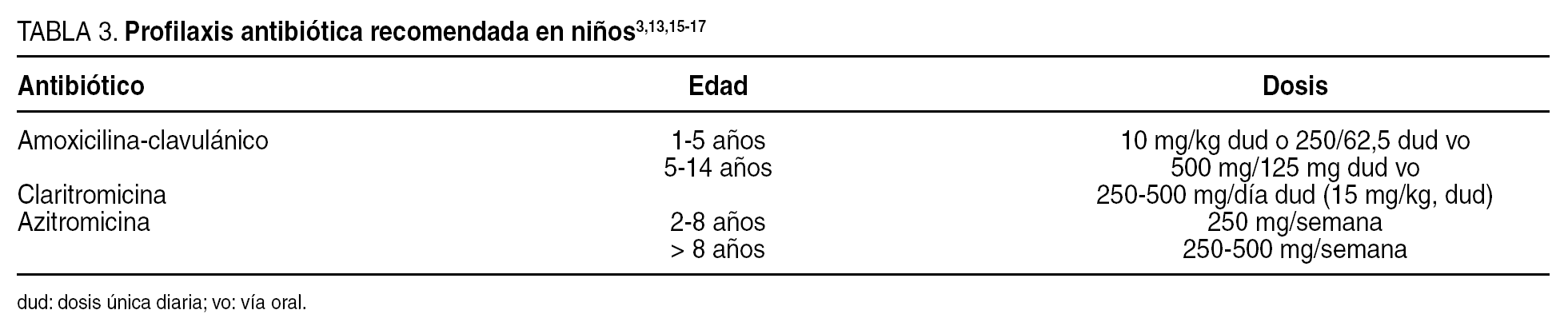
Recomendaciones de profilaxis antibiótica en niños (tabla 3)
A pesar de todas las controversias, en niños son claras las recomendaciones de profilaxis antibiótica diaria a largo plazo, hasta los 5 años de edad o al menos durante 2 años tras la esplenectomía, si están correctamente vacunados y no han presentado ningún episodio de infección invasiva. A pesar de que las recomendaciones internacionales recomiendan penicilina V o amoxicilina sola o macrólidos en caso de alergia a betalactámicos3,6,13,16, atendiendo al patrón de resistencias antimicrobianas de nuestro entorno, ésta debería hacerse con amoxicilina 250 mg + ácido clavulánico 62,5 mg (10 mg/kg) una vez al día en niños menores de 5 años o amoxicilina 500 mg + ácido clavulánico 125 mg una vez al día en mayores de 5 años durante los 2-3 años posteriores a la esplenectomía13. En caso de alergia a betalactámicos, aunque los macrólidos no ofrecen una buena cobertura contra neumococos resistentes a la penicilina, constituyen la única alternativa: azitromicina 250 mg en dosis única semanal en niños menores de 5 años; azitromicina 500 mg una vez por semana en mayores de 5 años, y claritromicina 250-500 mg/día, ambos por vía oral. La telitromicina sería una alternativa mejor, pero su uso en pediatría no permite garantizar su inocuidad. En caso de que la causa de la esplenectomía sea por enfermedad hemática maligna o haya inmunodeficiencia (quimioterapia, radioterapia o corticoides en dosis altas [≥ 2 mg/kg/día o > 2 mg/día durante más de 2 semanas]), se recomienda extender la quimioprofilaxis hasta los 14 años3,6,15-17.
Recomendaciones de profilaxis antibiótica en adultos
Como ya se ha dicho, en adultos no hay recomendaciones generales de quimioprofilaxis antibiótica continuada, incluso las recomendaciones de la Sociedad Británica de Hematología señalan como "no indicada" la profilaxis oral con antibióticos en adultos correctamente vacunados10,16. Lo que sí parece juicioso es instaurar quimioprofilaxis con amoxicilina 500 mg + ácido clavulánico 125 mg o telitromicina 800, ambos en dosis única diaria, en situaciones especiales en que el paciente aún no está vacunado (postoperatorio inmediato y mientras dura el tratamiento inmunosupresor) hasta que el paciente pueda ser vacunado con garantía de éxito16,17.
Antibioticoterapia empírica (tabla 4)
Parece haber cierto consenso en la recomendación de automedicación empírica ante el inicio de clínica de infección bacteriana (fiebre, tiritona, mareo, etc.), tanto si reciben profilaxis antibiótica como si no; sin embargo, deben acudir a un centro médico adecuado para su valoración: amoxicilina/ácido clavulánico 875/125 mg/8 h vía oral, cefuroxima 1 g/12 h vía oral, en alérgicos a betalactámicos con una fluoroquinolona con actividad contra microorganismos grampositivos como levofloxacino 500 mg/24 h vía oral, moxifloxacino 400 mg/24 h vía oral6,16,17 o telitromicina 800 mg/12 h vía oral. Este último antibiótico cetólido en caso de que no puedan utilizarse quinolonas flouradas, como por ejemplo en embarazadas.
Educación del paciente y sus familiares
Otra de las medidas profilácticas importantes es la educación del paciente y su entorno, haciéndole conocedor del riesgo de adquisición de infecciones graves para que sea capaz de identificar y evitar situaciones especiales de riesgo, como viajes y contacto con animales, y tomar medidas de protección.
El paciente debe tener presente que cualquier episodio de fiebre o escalofríos puede ser un signo inminente de sepsis fulminante y debe automedicarse con una dosis única del fármaco seleccionado previamente (cuya prescripción debe custodiar el paciente y renovar periódicamente) y, a continuación, acudir inmediatamente a Urgencias. Incluso siendo portadores de dispositivos (medallas, brazaletes...) que alerten del antecedente de esplenectomía.
Los pacientes esplenectomizados deben seguir escrupulosamente, al igual que los sujetos immunocompetentes, la profilaxis antimalárica correspondiente al área endémica a la que viajen1,5.
Correspondencia:
Dra. E. Membrilla-Fernández.
Puigcerdà, 273-275, 8.o, 1.a.
08020 Barcelona. España.
Correo electrónico: estelabe@hotmail.com
Manuscrito recibido el 31-8-2006 y aceptado el 24-1-2007.