La paratiroidectomía mínimamente invasiva, de elección en la mayoría de casos de hiperparatiroidismo primario, muestra una elevada tasa de detección, fundamentada en una precisa localización preoperatoria mediante gammagrafía con MIBI (SPECT/TC) y ecografía cervical. La paratiroidectomía mínimamente invasiva radioguiada es una técnica aún más efectiva, acorta los tiempos quirúrgicos y mantiene una mínima incisión y escasas complicaciones; permite además la comprobación inmediata de la exéresis de la lesión paratiroidea y es especialmente interesante en pacientes con adenomas ectópicos o antecedentes quirúrgicos cervicales. En el presente trabajo se exponen las indicaciones, los protocolos y las diferencias entre los dos procedimientos disponibles de cirugía radioguiada mínimamente invasiva de paratiroides (MIBI y ROLL).
Minimally invasive parathyroidectomy, of choice in most cases of primary hyperparathyroidism, shows a high detection rate, based on precise preoperative localization by MIBI scintigraphy (SPECT/CT) and neck ultrasound. Radio-guided minimally invasive parathyroidectomy is an even more effective technique, which shortens surgical times, maintains minimal incision and few complications, allows immediate verification of parathyroid adenoma removal and is especially interesting in patients with ectopic lesions or cervical surgical history. In this paper, the indications, protocols and differences between the two available radio-guided parathyroid surgery procedures (MIBI and ROLL) are exposed.
El hiperparatiroidismo primario (HPP) es un trastorno endocrino frecuente cuya prevalencia está en aumento1 por el incremento de la determinación rutinaria de calcemia. La incidencia ronda 0,4-82 casos por 100.000 habitantes2.
En el 80-85% de los casos de HPP la causa es un adenoma solitario, y en los restantes, un adenoma múltiple, hiperplasia o carcinoma paratiroideo3. En los pacientes que cumplen criterios quirúrgicos1, la escisión de la(s) glándula(s) causante(s) del HPP es el tratamiento estándar, único definitivo.
La paratiroidectomía mínimamente invasiva (PMI) es la técnica quirúrgica de elección en los pacientes que presentan adenoma único (la mayoría), mientras que la indicación de cirugía bilateral se limita a los casos de afectación multiglandular, indicación quirúrgica concomitante de patología tiroidea y paratiroidea o carcinoma paratiroideo4.
En este sentido, el avance tecnológico de las pruebas de localización preoperatoria, sobre todo la incorporación de la técnica tomogammagráfica (SPECT/TC)5 en el estudio con 99mTc-MIBI (MIBI), permite precisar la ubicación anatómica de la lesión paratiroidea y diferenciar entre adenoma único y enfermedad múltiple y, en consecuencia, establecer la indicación de PMI. Al asociar ecografía preoperatoria y gammagrafía con MIBI SPECT/TC, la sensibilidad de detección preoperatoria del adenoma alcanza del 85 al 95%5-7. En consecuencia directa, se describen altas tasas de éxito de la PMI para la localización intraoperatoria del adenoma y la curación del HPP (95-96,9%)8, directamente dependiente de la exhaustiva evaluación preoperatoria de las imágenes. Por tanto, el pequeño porcentaje de pacientes en que el procedimiento falla, por afectación de más de una glándula o más frecuentemente por localización ectópica de la lesión, podría beneficiarse del radiomarcaje prequirúrgico de la lesión paratiroidea9. En este sentido, con la intención de incrementar aún más el éxito de la cirugía selectiva de paratiroides, se ha difundido el procedimiento mínimamente invasivo radioguiado.
Norman y Chheda10 describieron en 1997 la primera cirugía de paratiroides mínimamente invasiva radioguiada (PMIR) mediante la administración preoperatoria de 99mTc-MIBI, con el interés original de evitar el fallo de la intervención en los casos en que existiera más de una glándula patológica. Además de incorporar las ventajas de la PMI respecto a la cervicotomía, la PMIR acorta el tiempo quirúrgico (duración media: 32-37min)11-13, manteniendo escasas complicaciones11-13, mínima incisión y baja estancia hospitalaria11, habiéndose propuesto incluso su realización con anestesia locorregional11,14, con la consecuente reducción de costes15.
Al aplicar el procedimiento radioguiado se dispone durante la intervención de confirmación inmediata del éxito de la resección, lo que disminuye el riesgo de HPP persistente/recurrente16, y en este contexto se propone obviar la biopsia o la determinación de PTH intraoperatorias17,18, lo que disminuiría a su vez el tiempo quirúrgico y los costes15.
La PMIR es efectiva y segura y ofrece ventajas respecto a la PMI convencional19, especialmente en escenarios clínicos más comprometidos, como los pacientes con antecedentes quirúrgicos cervicales11,20-22 o con lesiones ectópicas11,13,23-26, ya que en ambas circunstancias clínicas posibilita un abordaje quirúrgico selectivo y reduce también el riesgo de HPP persistente o recurrente al asegurar la exéresis completa de la lesión causante del HPP16. En este contexto, en los pacientes re-operados se han descrito tasas de detección del 68-96%11-13,20, sin aumentar las complicaciones inherentes a una re-intervención cervical20. Respecto al abordaje selectivo de las glándulas ectópicas13,23,24,26,27, se ha logrado su exéresis hasta en el 90% de los casos, e incluso un 60% con acceso mínimamente invasivo25.
Existen dos modelos bien diferenciados de marcaje preoperatorio de la glándula paratiroidea patológica para su extirpación radioguiada. Aparte del descrito en primer lugar y referido anteriormente que consiste en la administración intravenosa de un radiotrazador con afinidad por las glándulas paratiroideas patológicas (99mTc-MIBI), se puede realizar también inyección intralesional ecoguiada de un radiotrazador no difusible: 99mTc-macroagregados de albúmina humana (MAA). Este último es un procedimiento habitual en medicina nuclear para la localización radioisotópica de lesiones no palpables (técnica ROLL [radioguided occult lesion localization]).
A continuación se exponen las distintas técnicas disponibles para el procedimiento radioguiado.
Técnicas de localización preoperatoriaEs fundamental una exhaustiva valoración de imagen prequirúrgica (diagnóstica) del paciente, lo más próxima temporalmente al día de la intervención. Permite determinar preoperatoriamente el número y la localización de lesiones paratiroideas y, en consecuencia, la posibilidad de realizar un abordaje mínimamente invasivo. Además, es un requisito ineludible para establecer la indicación del procedimiento radioguiado y, en su caso, del trazador más apropiado.
La valoración preoperatoria se ha de hacer según el protocolo convencional, incluyendo como primera línea gammagrafía paratiroidea en dos fases con MIBI y ecografía cervical5,7.
Respecto a la gammagrafía, consideramos necesaria siempre la adquisición de SPECT/TC, que añade información precisa de la localización anatómica de la lesión paratiroidea28, siendo de especial interés en lesiones ectópicas, además de demostrar la intensidad de captación y el grado de retención del 99mTc-MIBI. El estudio gammagráfico determina en consecuencia el intervalo de tiempo adecuado entre la administración del MIBI y la cirugía, evitando la pérdida de adenomas de «lavado» rápido, de manera que en el momento de la cirugía se disponga de la máxima relación de captación de la lesión paratiroidea respecto al fondo29,30.
Por su parte, la ecografía determina el tamaño de la lesión y, en función de este y de su relación con las estructuras vecinas (vasculares, tiroides), la accesibilidad para la inyección ecográfica intralesional del radiotrazador (99mTc-MAA).
Cuando coexista patología tiroidea nodular que dificulte la valoración de la exploración gammagráfica por fijación de MIBI en dichos nódulos, puede ser de utilidad la realización de gammagrafía tiroidea convencional con 99mTc. A su vez, en los casos en que ecografía y MIBI sean discordantes, se indicará estudio complementario con PET, preferentemente PET-Colina31.
Indicaciones de la cirugía radioguiadaPMIR-MIBIEs un isonitrilo que se administra por vía sistémica y es captado por la lesión paratiroidea dependiendo del flujo sanguíneo y de la actividad mitocondrial. Gracias a la diferente cinética del MIBI entre tejido paratiroideo y tiroideo, en las imágenes tardías persiste actividad aumentada en el adenoma paratiroideo, mientras que disminuye en tiroides, lo que permite la detección de la lesión paratiroidea. No obstante, puede haber adenomas paratiroideos con disminución más rápida de la actividad («lavado rápido»), y a su vez patología tiroidea inflamatoria (tiroiditis) y/o nódulos tiroideos que pueden retener el radiotrazador más tiempo que el tejido tiroideo normal.
Se indica paratiroidectomía radioguiada con MIBI cuando en la imagen diagnóstica preoperatoria se identifica un adenoma solitario que presenta suficiente captación de este radiotrazador y preferentemente en ausencia de patología tiroidea subyacente11. Estas premisas se cumplen hasta en el 70% de HPP11.
En la enfermedad multiglandular (hiperplasia)32 o cuando coexiste patología tiroidea27,33 la indicación es más controvertida, dada la menor eficiencia de localización de lesiones múltiples, por un lado13, y el riesgo de falsos positivos debido a nódulos tiroideos MIBI-positivos, por otro16,27. Incluso coexistiendo nodularidad tiroidea, el beneficio de la cirugía radioguiada con MIBI es indudable en los adenomas de localización ectópica11,23 (tabla 1).
PMIR-MAA (ROLL)99mTc-MAA es un radiotrazador que se administra dentro de la paratiroides patológica bajo control ecográfico; dado su tamaño relativamente grande (más del 95% de partículas entre 10 y 100 micrómetros), permanece fijo dentro de la lesión22.
Para la realización de este procedimiento el adenoma paratiroideo ha de ser único, visible y accesible en la ecografía. Por tanto, su utilidad está limitada en casos ectópicos, que no se suelen identificar ecográficamente (tabla 1).
Sin embargo, presenta, en principio, algunas ventajas respecto al MIBI. No depende de la avidez del adenoma por el MIBI: se puede realizar también en adenomas que no captan MIBI, lo que puede suceder hasta en el 40% de los casos34. Además, se evitan los falsos positivos por nódulos tiroideos.
Elección del procedimiento radioguiadoHabitualmente se requieren dos técnicas de localización preoperatoria, positivas y estrictamente coincidentes, para indicar una PMI. A su vez, la indicación de PMIR y la elección del procedimiento más adecuado se determinarán en valoración multidisciplinar en función de la accesibilidad ecográfica de la lesión y de su capacidad de fijar MIBI, en primer lugar, y en segunda línea, en caso de que alguna de estas sea negativa, dependiendo de la imagen PET. El esquema que aparece en la figura 1 recoge los distintos escenarios posibles.
Así pues, se puede realizar PMIR-MIBI en las lesiones no visibles en la ecografía pero con MIBI y PET/TC positivas y congruentes, y en las MIBI positivas, ecográficamente visibles pero inaccesibles. Las lesiones ectópicas corresponden generalmente a alguno de los dos grupos anteriores.
Se indica PMIR-MAA en los casos MIBI negativos, ecográficamente accesibles y concordantes con PET.
Por último, en los adenomas captantes de MIBI y aptos en la ecografía para la inyección del MAA puede realizarse cualquiera de los dos procedimientos.
Procedimiento gammagráficoPMIR-MIBILa captación de MIBI por parte de las glándulas paratiroideas es un proceso dinámico, lo que constituye un aspecto muy importante a tener en cuenta: precisa una estricta coordinación entre el servicio de medicina nuclear y el equipo quirúrgico.
El procedimiento propuesto inicialmente por Murphy and Norman10,17, idéntico al de la gammagrafía diagnóstica clásica, consiste en la administración intravenosa de 740MBq (20mCi) de 99mTc-MIBI, con adquisición de imágenes convencionales precoz y tardía y posterior cirugía radioguiada a las 2,5-3,5horas. En ese momento habría «lavado» ya la captación tiroidea, persistiendo solo fijación paratiroidea del MIBI, lo que supone adecuada tasa de captación paratiroides-tiroides. Se puede realizar únicamente en adenomas que retienen el radiotrazador, no en aquellos de lavado rápido16. Se ha propuesto la posibilidad de prescindir del estudio diagnóstico preoperatorio en estos protocolos «largos», aunque esto implicaría la imposibilidad de planificar previamente la cirugía, lo cual puede ser arriesgado en zonas endémicas de bocio, con riesgo alto de indicación concomitante de cirugía tiroidea (tabla 2).
Protocolos MIBI
| Alta dosis | Baja dosis | |
|---|---|---|
| Actividad administrada (mCi) | 20 | 1-3 |
| Tiempo inyección-cirugía | 2-3 h | 10-30min |
| Gammagrafía día intervención | Sí | No |
| Gammagrafía diagnóstica previa | Opcionala | Sí |
| Indicación adenomas «lavado rápido» | No | Sí |
| Tasa captación lesión/fondo | Adecuada | Desfavorable |
a Si no se realiza gammagrafía diagnóstica previa, no se puede prever la indicación concomitante de cirugía tiroidea, cuando exista, dificultando la planificación quirúrgica.
Estos protocolos «largos», con elevada tasa de éxito (93,7-99,1%)10,14,16, emplean como criterio intraoperatorio «la regla del 20%»17 (cualquier tejido con tasa de contaje ex vivo superior en un 20% al fondo se considera adenoma paratiroideo).
Posteriormente, Casara et al.23 describen un protocolo de «baja dosis»: 37-111MBq (1-3mCi) de 99mTc-MIBI administrada 10-30min antes de la intervención. Estos protocolos «cortos» han mostrado también tasas de detección paratiroidea óptimas (93-100%)11,23,24,26,35, suponen obviamente menor radiación para el paciente y para el equipo quirúrgico y evitan falsos negativos en adenomas de «lavado rápido»12. Sin embargo, debido al breve tiempo disponible entre la inyección del MIBI y la cirugía, no es factible la adquisición de imagen gammagráfica el día de la intervención, por lo que se insiste en que la gammagrafía previa (diagnóstica) sea reciente12, asumiendo la ausencia de cambios significativos entre ambas. Además, en el momento de la cirugía la fijación tiroidea del MIBI será aún elevada, lo que puede dificultar la detección con sonda del adenoma paratiroideo y su discriminación respecto al tiroides (tabla 2). Por ello, en estos protocolos cortos se usa como criterio intraoperatorio de adenoma el hecho de que presente contaje in vivo 2,5 veces superior al fondo y 1,5 al tiroides.
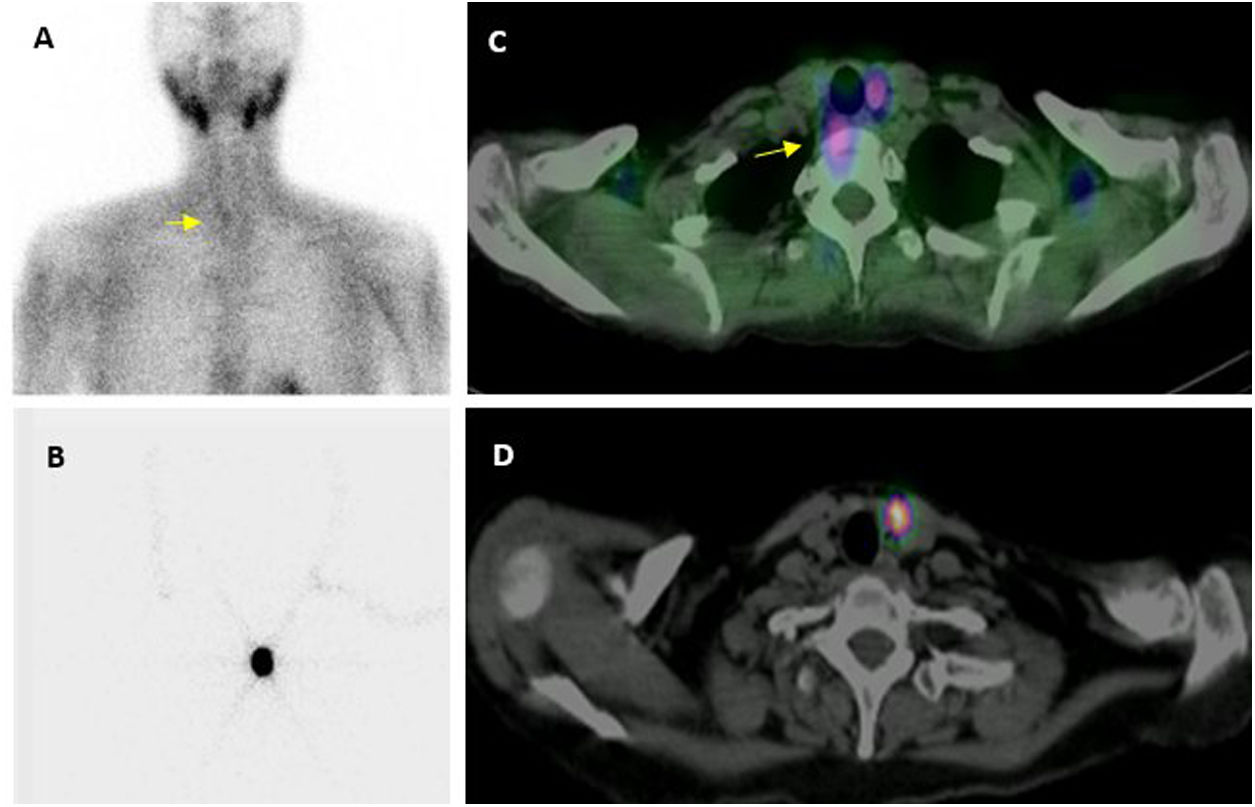
Se han propuesto procedimientos intermedios entre los anteriores para aprovechar las ventajas de ambos, con dosis de 111-370MBq (3-10mCi)20,24,29,32, 60-120min18,29,32 antes de la cirugía. Estos protocolos dan un margen de tiempo suficiente para la desaparición o «lavado» de la captación tiroidea (y en consecuencia buen contraste paratiroides-fondo), sin llegar a perder adenomas de «lavado rápido», y permite además la realización de gammagrafía, incluso SPECT/TC si es necesario (fig. 2), y en todos los casos marcaje cutáneo con tinta indeleble de la localización del adenoma.
Imagen preoperatoria. Localización con MIBI: adquisición planar (A) en que se intuye un pequeño adenoma inferior derecho (flecha), que la imagen de fusión SPECT/TC (C) confirma y localiza en situación ectópica, prevertebral derecha.
Localización preoperatoria de adenoma paratiroideo inferior izquierdo mediante técnica ROLL: imágenes planar (B) y transaxial de SPECT/TC (D), tras la administración intralesional de MAA.
En cualquier caso, no parece que existan diferencias significativas en el éxito de la PMIR en función del protocolo de MIBI empleado36.
PMIR-MAA (ROLL)La administración del 99mTc-MAA es intralesional guiada por ecografía (tabla 1). El tamaño del radiotrazador hace que la actividad inoculada permanezca fija en el interior de la lesión, lo cual flexibiliza la planificación de la intervención quirúrgica. Así pues, solo se requiere ajustar la actividad administrada al propio decay del 99mTc y el tiempo previsto hasta la intervención, que puede realizarse en el mismo día o al día siguiente: 0,5-2mCi (185-74MBq), respectivamente, en un pequeño volumen ajustado al tamaño de la lesión (0,1-0,2ml).
Por tanto, en este procedimiento la limitación no es el tiempo desde la administración del radiotrazador, sino que esta sea certera dentro de la lesión, evitando la dispersión del mismo y, en consecuencia, la contaminación de los tejidos adyacentes o la fuga por el trayecto de la aguja de inyección.
Se realiza también gammagrafía SPECT/TC para confirmar la correcta inoculación en el adenoma, es decir, la localización intralesional (concéntrica) de la actividad y la ausencia de dispersión o de contaminación, así como para realizar la correspondiente marca cutánea (fig. 2).
A su vez, el procedimiento intraoperatorio es técnicamente más sencillo, pues la tasa de contaje o actividad lesión/fondo es más favorable en comparación con el MIBI, dado que este último también es captado fisiológicamente por otros tejidos (glándulas salivares, músculos, ganglios).
En este contexto, la PMIR-MAA es radiológicamente más favorable (menor actividad administrada en protocolo de un día, menos captación en otros tejidos).
En cualquier caso, la cirugía radioguiada de paratiroides es un procedimiento seguro en términos de protección radiológica, con tasas de exposición para el cirujano de 1,2μSv/h en protocolos de baja dosis, significativamente inferior al límite de dosis permitido12.
Procedimiento quirúrgico radioguiadoPara la localización intraoperatoria del adenoma «marcado» se recomienda la utilización de dos dispositivos portátiles de detección: una gammasonda (con cabezal detector de 9mm de diámetro, preferiblemente) y, si es posible, una gammacámara intraoperatoria. La gammasonda es fundamental para dirigir la disección radioguiada. Por su parte, las cámaras portátiles aportan imagen en tiempo real, lo cual, además de incrementar la eficacia de la detección quirúrgica radiodirigida de los adenomas paratiroideos37, facilita la confirmación inmediata de su exéresis completa y la constatación de ausencia de actividad residual en el lecho quirúrgico, lo que se traduce en menor tasa de HPP persistente/recurrente por fallo de la intervención frente a la cirugía no radioguiada16.
En este sentido, la imagen intraoperatoria aumenta la seguridad de la resección, especialmente en la PMIR-MIBI, dada la fijación fisiológica de este radiotrazador en otros tejidos próximos (músculos, glándulas salivares, miocardio), que hace que la tasa de cuentas paratiroides-fondo no sea óptima.
Como hemos señalado anteriormente, en la técnica ROLL la localización quirúrgica se puede realizar a lo largo del día de la inyección o al día siguiente, ajustando la dosis, mientras que en la PMIR-MIBI la cirugía se ha de realizar en el mismo día, inmediatamente después de la inyección o hasta 3horas después, según el protocolo elegido.
El procedimiento quirúrgico incluye, en todos los casos (fig. 3):
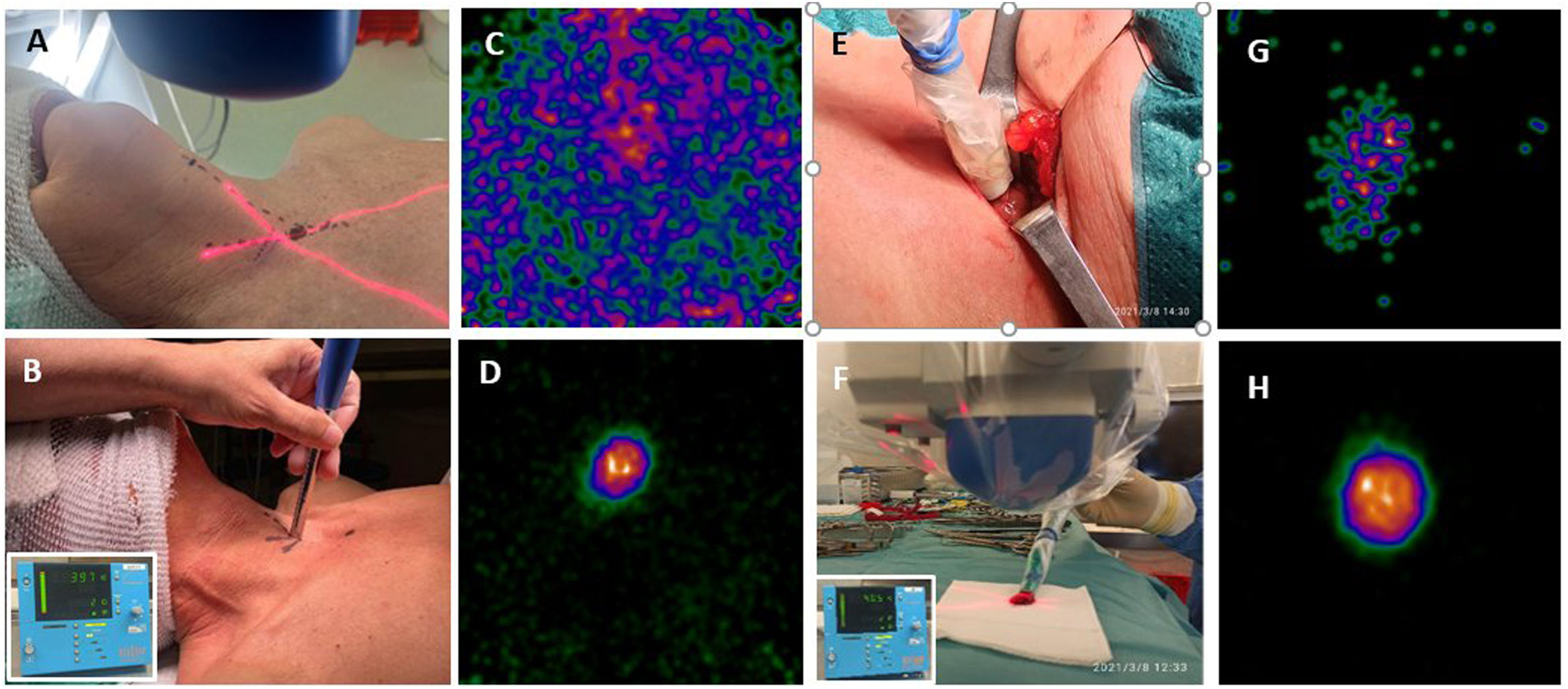
Procedimiento quirúrgico radioguiado. Localización cutánea del acceso más directo, mediante gammacámara portátil (A) y sonda detectora gamma (B). Imagen in vivo con cámara portátil de la lesión marcada con MIBI (C) y con MAA (D). Disección radioguiada (E) y exéresis del adenoma paratiroideo, confirmado ex vivo mediante sonda (F) e imagen del MIBI (G) y del MAA (H).
Antes de la incisión: contaje externo (sonda gamma) e imagen con cámara intraoperatoria (adquisición centrada sobre el lecho tiroideo o zona de interés, a unos 10cm, durante 1-2min), para determinar el punto exacto de máxima actividad en el que se realizará la incisión.
Incisión: aproximadamente 1-1,5cm.
Disección por planos dirigida por sonda hasta identificar la glándula anómala.
Registro de contaje in vivo de la actividad (cuentas por segundo [cps]) del adenoma paratiroideo y del lecho tiroideo (istmo/lóbulo contralateral) y fondo.
Contaje ex vivo de la lesión paratiroidea e imagen de la misma.
Comprobación de la ausencia de actividad significativa residual en el lecho quirúrgico. Contaje con sonda e imagen del lecho con la cámara.
Cuando existe concordancia del contaje con sonda y de la imagen intraoperatoria con la glándula de aspecto patológico en el análisis visual, se da por finalizado el procedimiento quirúrgico. Se ha propuesto, en este sentido, que la PMIR permita obviar la espera de la confirmación de la exéresis mediante biopsia intraoperatoria o determinación de PTH intraoperatoria17,18.
Consideraciones especiales. LimitacionesLa PMIR-MIBI suele ser la técnica más indicada en adenomas ectópicos y pacientes reintervenidos, pero su uso puede estar limitado en los adenomas que muestran baja captación de este radiotrazador en el estudio diagnóstico preoperatorio, lo cual sucede en un porcentaje no despreciable de casos11, y también en los pacientes en los que coexiste patología nodular tiroidea11. No obstante, se ha descrito la utilidad del procedimiento PMIR-MIBI incluso en el 23% de lesiones consideradas MIBI negativas en el estudio preoperatorio38. Requiere además cierta curva de aprendizaje inicial debido a la actividad de fondo elevada durante el proceso intraoperatorio de detección con gammasonda, aspecto muy diferente a otros escenarios habituales de cirugía radioguiada (detección del ganglio centinela, etc.) y que puede ser más acusada aún cuando coexiste patología nodular tiroidea. En este sentido, la valoración exhaustiva de las imágenes preoperatorias por el equipo multidisciplinar parece ineludible.
Por otro lado, la PMIR-MIBI requiere una estricta organización, coordinación y control de los tiempos entre inyección y cirugía, para evitar la desaparición de la actividad en el momento de la resección. Este aspecto puede ser una limitación en algunas unidades de cirugía endocrina.
Respecto a la PMIR-MAA, es un procedimiento común en medicina nuclear para la localización de lesiones no palpables (técnica ROLL), con pocas publicaciones en cirugía de paratiroides22,34 pero con muy buenos resultados. La limitación en este caso es su aplicación a lesiones ectópicas, causa frecuente de fallo de la intervención selectiva, y que pocas veces se identifican ecográficamente (sobre todo prevertebrales o mediastínicas).
Por otra parte, aunque el procedimiento PMIR-MAA es temporalmente más flexible y la detección intraoperatoria a priori técnicamente más sencilla, ya que la actividad permanece fija dentro de la lesión, es muy dependiente de la precisión en la administración ecoguiada. Especialmente en lesiones paratiroideas de acceso ecográfico más comprometido, por su profundidad y/o su pequeño tamaño, al tratarse de un compuesto líquido, no es rara su dispersión por el propio trayecto de la aguja, con la consiguiente contaminación de los tejidos adyacentes e incluso de la piel, que pueden dificultar el proceso de detección con sonda. Incluso podría existir un riesgo, no reportado hasta el momento, de implantación de la enfermedad paratiroidea.
En este contexto, se ha propuesto la cirugía radioguiada mediante la implantación ecográfica intralesional de semillas de I-12539,40, dispositivo sólido, milimétrico, sin riesgo de dispersión. Esta técnica ha adquirido gran difusión en otros campos de la cirugía radioguiada, dado que se puede implantar días o incluso semanas antes de la intervención. Sin embargo, en su aplicación a la paratiroidectomía se ha descrito mayor riesgo de desplazamiento y complicaciones en el territorio cervical40.
Tras la introducción de la autofluorescencia en la cirugía endocrina41, se ha sugerido también el empleo de la técnica híbrida (verde indocianina-ICG junto al Tc-MIBI), que podría tener indicación para la localización de adenomas en cuellos de difícil acceso, en pacientes obesos, en glándulas de baja captación, en localizaciones ectópicas o en el abordaje endoscópico cervical vía subpectoral42.
ConclusionesLa PMIR puede aumentar la tasa de detección de la lesión paratiroidea respecto a la ya elevada tasa de éxito quirúrgico que se consigue con la PMI, añadiendo además algunas ventajas.
En primer lugar, la PMIR aporta la confirmación inmediata, intraoperatoria, de la extirpación de la glándula patológica, aspecto que consideramos que permite prescindir del estudio histopatológico o la determinación de PTH intraoperatorios, con la consiguiente optimización del tiempo quirúrgico.
En segundo lugar, el abordaje radioguiado con MIBI está especialmente indicado en lesiones ectópicas, en las que facilita la resección mediante un acceso mínimamente invasivo. Asimismo, la PMIR es de gran ayuda en los pacientes con antecedentes quirúrgicos cervicales. En ambas circunstancias la dificultad de localización quirúrgica es mayor, y más elevado el riesgo de fallo de la intervención y de complicaciones.
En la PMIR-99mTc-MAA (ROLL) la detección intraoperatoria es, en principio, técnicamente más sencilla, siempre que la administración intralesional del radiotrazador, guiada por ecografía, sea correcta. En caso contrario, puede implicar la dispersión de la actividad y la contaminación de los tejidos adyacentes y, en consecuencia, dificultar el proceso de localización quirúrgica de la lesión.
El procedimiento de cirugía radioguiada de paratiroides requiere la estrecha colaboración de los profesionales implicados y puede incorporarse en cualquier unidad de cirugía endocrina. La elección correcta de la técnica, en una valoración preoperatoria multidisciplinar de las distintas técnicas de imagen, es esencial. Cada grupo debe establecer su propia metodología.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.