El receptor de un trasplante hepático de donante vivo en adulto (THDVA) está sometido a grandes cambios hemodinámicos que pueden determinar la aparición del síndrome de «small-for-size» en el postoperatorio como consecuencia de un hiperaflujo portal. El objetivo de este trabajo es evaluar dichos cambios e intentar correlacionarlos con el flujo de la vena porta durante la reperfusión.
Material y métodosDesde el 2003 se lleva a cabo un protocolo de monitorización de distintos datos hemodinámicos hepáticos del receptor de THDVA antes, durante y después de la intervención quirúrgica. Se analiza la evolución hemodinámica del receptor tras el trasplante, y se correlaciona el flujo de la vena porta durante la reperfusión con dichos datos hemodinámicos.
ResultadosNo hubo ningún síndrome de small-for-size. Se halló una correlación significativa del flujo portal durante la reperfusión con la presión de la vena porta al inicio de la intervención (r = 0,46; p = 0,006) y con el flujo del shunt portocava durante la fase anhepática (r = 0,55; p < 0,001). Los receptores mostraron un estado hemodinámico esplácnico normal a los 3 meses del trasplante.
ConclusionesLa monitorización hemodinámica del receptor de THDV es fundamental para evitar el hiperaflujo portal. La correlación entre flujo durante la reperfusión y el flujo a través del portocava nos va a permitir identificar a los pacientes con mayor riesgo de hiperaflujo y poder modularlo antes de la reperfusión.
The recipient of an adult living donor liver transplant (ALDLT) is subjected to great haemodynamic changes that could lead to the appearance of a “small-for-size” syndrome in the post-operative period due to portal hyperflow. The aim of this article is to evaluate these changes, and try to correlate them with portal vein flow during reperfusion.
Material and methodsA protocol for monitoring various liver haemodynamic data of the ALDLT recipient before, during and after surgery has been used since the year 2003. The haemodynamic outcome of the recipient after the transplant, as well as the correlation between the portal vein flow during reperfusion and the collected haemodynamic data is analysed.
ResultsThere was no small for size syndrome. A significant relationship was found between the portal flow during reperfusion and the portal vein pressure at the beginning of the operation (r=0.46, P<.006) and with the portocaval shunt flow during the anhepatic phase (r=0.55, P<.001). The recipients showed a normal splanchnic hemodynamic state at 3 months after the transplant.
ConclusionsHaemodynamic monitoring of the ALDLT recipient is essential to prevent portal hyperflow. The relationship between flow during reperfusion and flow through the portocaval shunt means that patients with a higher risk of hyperflow can be identified and can be modified before reperfusion.
El uso de un injerto parcial en el trasplante hepático de donante vivo en adultos (THDVA) asocia de forma implícita 2 aspectos contrapuestos: la seguridad en el donante y la cantidad de tejido hepático que se trasplanta.
Por un lado, la seguridad en el donante es uno de los factores más importantes en el proceso del THDVA, y debe garantizarse al máximo1. La morbilidad del donante es muy variable en función de las series publicadas, pero se estima que está entre el 20 y el 50%2. Las complicaciones de origen quirúrgico están íntimamente ligadas a la magnitud de la hepatectomía practicada al donante. Esto queda reflejado en una publicación reciente que muestra los resultados en más de 1.200 donantes vivos, con una mayor incidencia de complicaciones biliares en aquellos donantes sometidos a una hepatectomía derecha que en aquellos cuyo hígado izquierdo fue utilizado como injerto (44,2 vs. 18,8%; p < 0,05)3. Las complicaciones biliares también fueron más frecuentes en los donantes de hígado derecho (12,2 vs. 4,9%; p < 0,05). Finalmente, cabe destacar que el proceso de donación hepática en vivo no está exento de mortalidad, con una tasa de mortalidad declarada que oscila entre el 0,15 y el 0,2%4.
Por otro lado, la cantidad de masa hepática, o mejor, la proporción entre el peso del injerto que se implanta y el del receptor (graft to body weight ratio [GBWR]) se asocia de forma directa con la mortalidad postoperatoria. Varios estudios han podido demostrar una peor supervivencia en receptores con injertos cuyo GBWR era inferior al 0,8%5–9. El motivo de esta disminución de la supervivencia es la aparición del síndrome de «pequeño para su tamaño» o «small-for-size syndrome» (SFSS) en aquellos injertos con una GBWR inferior al 0,8%. Pese a no tener todavía unos criterios diagnósticos de consenso total, el SFSS se define como la presencia de signos y síntomas de insuficiencia hepática (hiperbilirrubinemia prolongada, alteración de las pruebas de coagulación, producción de ascitis y encefalopatía) en ausencia de otro factor que lo justifique, en un paciente con un injerto cuyo GBWR sea inferior al 0,8%6. La importancia del SFSS es su elevada mortalidad, de hasta un 50%5 en el periodo postoperatorio, en su mayoría como consecuencia de complicaciones infecciosas.
Habitualmente, el receptor de un trasplante hepático es un paciente con una hepatopatía crónica en fase terminal y que presenta hipertensión portal y un estado circulatorio hiperdinámico. En estos pacientes, debido fundamentalmente a un gasto cardíaco elevado, existe un aumento de la circulación esplácnica y, como consecuencia, del flujo de la vena porta, con la presencia de importantes cambios hemodinámicos durante el trasplante10. Por tanto, en el caso del THDVA, confluyen 2 factores que podrán influir en el desarrollo del SFSS: un flujo portal (FP) elevado y un lecho vascular disminuido debido al injerto parcial. Ambos factores contribuirán a que el FP relativo (FP dividido por masa hepática) sea elevado y que pueda producirse el SFSS.
Durante el THDVA, si se determina un FP excesivo, existe la posibilidad de disminuirlo mediante diversas maniobras quirúrgicas o farmacológicas, lo que se ha denominado modulación del flujo del injerto (MFI)11,12. Hasta la actualidad, la MFI se ha llevado a cabo posteriormente a la reperfusión del injerto, tras constatar un exceso de FP. Dado que la lesión por exceso de hiperaflujo se produce inmediatamente13, un exceso de FP, aunque sea temporal, puede condicionar los resultados del injerto.
En el año 2003 iniciamos un programa de monitorización hemodinámica del receptor del THDVA para poder caracterizar la evolución del receptor desde el punto de vista hemodinámico antes, durante y después del trasplante y poder determinar algún factor hemodinámico relacionado con el FP que tendrá el injerto para poder modificarlo antes de la reperfusión.
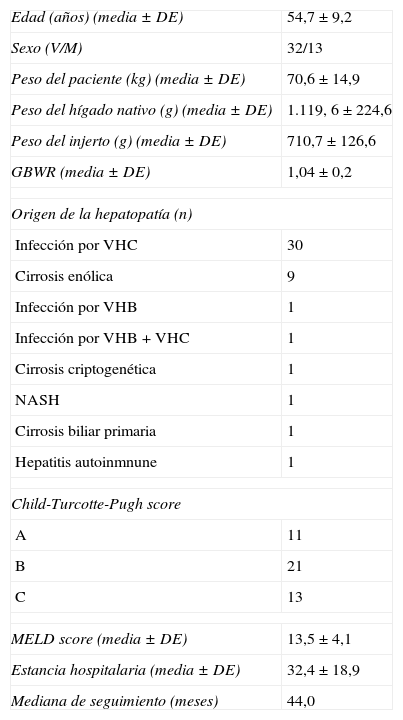
Material y métodosEn el año 2003 se inició el protocolo de monitorización hemodinámica del receptor de THDVA. Desde entonces se han llevado a cabo un total de 45 procedimientos. Los datos hemodinámicos fueron recogidos de forma prospectiva y analizados retrospectivamente. En la tabla 1 se resumen las características demográficas de los receptores.
Características demográficas de los receptores de trasplante hepático de donante vivo
| Edad (años) (media ± DE) | 54,7 ± 9,2 |
| Sexo (V/M) | 32/13 |
| Peso del paciente (kg) (media ± DE) | 70,6 ± 14,9 |
| Peso del hígado nativo (g) (media ± DE) | 1.119, 6 ± 224,6 |
| Peso del injerto (g) (media ± DE) | 710,7 ± 126,6 |
| GBWR (media ± DE) | 1,04 ± 0,2 |
| Origen de la hepatopatía (n) | |
| Infección por VHC | 30 |
| Cirrosis enólica | 9 |
| Infección por VHB | 1 |
| Infección por VHB + VHC | 1 |
| Cirrosis criptogenética | 1 |
| NASH | 1 |
| Cirrosis biliar primaria | 1 |
| Hepatitis autoinmnune | 1 |
| Child-Turcotte-Pugh score | |
| A | 11 |
| B | 21 |
| C | 13 |
| MELD score (media ± DE) | 13,5 ± 4,1 |
| Estancia hospitalaria (media ± DE) | 32,4 ± 18,9 |
| Mediana de seguimiento (meses) | 44,0 |
El procedimiento quirúrgico en el THDVA comprende 2 intervenciones: en la primera, se obtiene el injerto hepático para el receptor, compuesto de los segmentos v-viii de Couinaud; para ello se realiza una hepatectomía derecha reglada al donante, manteniendo en todo momento la circulación en el futuro injerto y preservando la vena hepática media en el donante. Tras haber completado la hepatectomía, se perfunde el injerto con líquido de preservación y se conserva refrigerado a 4°C hasta el momento del implante.
En el receptor, en primera instancia se realiza una hepatectomía total del hígado enfermo y se preserva la circulación esplácnica mediante la realización de un shunt portocava parcial. Posteriormente, se lava el injerto con suero salino templado y se procede al implante. Inicialmente se anastomosa la vena hepática derecha del injerto con la vena hepática derecha del receptor, posteriormente, se secciona el shunt portocava temporal y se realiza la anastomosis portal, procediéndose a reperfundir el injerto. A continuación se realiza la anastomosis arterial y por último se realiza la anastomosis biliar.
Protocolo de monitorización hemodinámicaLa monitorización hemodinámica en el receptor tiene 3 aspectos bien definidos: la monitorización preoperatoria, la intraoperatoria y la postoperatoria.
Monitorización preoperatoriaSe lleva a cabo en el laboratorio de hemodinámica hepática del hospital 24 h antes del trasplante. En ella, se recogen variables hemodinámicas tanto hepáticas como sistémicas bajo sedación consciente, estas últimas recogidas únicamente en 28 pacientes (tabla 2).
Variables analizadas en el protocolo de monitorización hemodinámica
| Monitorizacion preoperatorio |
| Hemodinámica hepática |
| Presión suprahepática enclavada (PSE) |
| Presión suprahepática libre (PSL) |
| Gradiente de presión venosa hepática (GVPH) |
| Hemodinámica cardiopulmonar |
| Presión de la arteria pulmonar (PAP) |
| Presión capilar pulmonar (PCP) |
| Presión de la aurícula derecha (PAD) |
| Gasto cardíaco (GC) |
| Presión arterial media (PAM) |
| Frecuencia cardíaca (FC) |
| Índice cardíaco (IC) |
| Volumen de eyección sistólico (VS) |
| Resistencias vasculares sistémicas (RVS) |
| Índice de resistencias vasculares sistémicas (IRVS) |
| Resistencias vasculares pulmonares (RVP) |
| Índice de resistencias vasculares pulmonares (IRVP) |
| Monitorizacion peroperatoria | |
| Momento de la medición | Variables |
| Inicio de la intervención | Presión de la vena porta |
| Tras shunt portocava | Flujo de la vena porta |
| Tras la reperfusión portal | Flujo de la arteria hepática |
| Tras la reperfusión arterial | Gasto cardíaco |
| Tras ligadura de la arteria esplénica | Presión arterial media |
| Final de la intervención | Presión venosa centralResistencias vasculares |
| Monitorizacion postoperatoria |
| Presión suprahepática enclavada (PSE)Presión suprahepática libre (PSL)Gradiente de presión venosa hepática (GVPH) |
Tras practicar la laparotomía, el primer paso consiste en la colocación de un catéter (Certofix Mono S 330, 16G, L 30cm, Braun, Barcelona, España) en una vena mesentérica que se adelanta hasta la vena porta para poder monitorizar la presión portal (PP) durante el trasplante. Los flujos vasculares portales y arteriales se llevaron a cabo mediante el método de determinación de flujo de tiempo de tránsito con sondas de 8-12mm para la vena porta y 3-5mm para la arteria hepática, monitorizadas a través del aparato Medi-Stim VeriQ System® (Medi-Stim ASA, Oslo, Noruega). Todas las mediciones fueron tomadas 5 min tras haber completado las anastomosis, para conseguir la mayor estabilidad posible. Las mediciones hemodinámicas se realizan en distintas fases de la intervención, que juntamente con los datos hemodinámicos recogidos durante el trasplante se resumen en la tabla 2.
Monitorización postoperatoriaSe realiza una determinación de la hemodinámica hepática a los 3 días y a los 3 meses del trasplante para garantizar la normalización de los mismos tras el trasplante.
Ligadura de la arteria esplénicaTras la fase de reperfusión portal y arterial se midieron los flujos portales y arteriales. De acuerdo con lo publicado14,15, se consideró excesivo un FP superior a aproximadamente 2.000mL/min o 260mL/min/100g de tejido hepático. Un flujo arterial inferior a 100mL/min se consideró insuficiente. En este último caso, se realizó un pinzamiento temporal de la vena porta con el fin de descartar un problema técnico en dicha anastomosis en caso de aumento significativo del flujo arterial. En caso de flujo arterial insuficiente o portal excesivo, se realizó una ligadura de la arteria esplénica (LAE) en su origen en el tronco celíaco.
Evolución clínica y analítica del receptor tras el trasplanteLos receptores de THDVA son trasladados tras la intervención a la unidad de cuidados intensivos, donde permanecen hasta el quinto día posterior al trasplante para después ser llevados a la sala de hospitalización convencional. Durante la estancia hospitalaria, se solicitan determinaciones analíticas diarias de la función hepática (GOT, GPT, fosfatasa alcalina, GGT, bilirrubina, tasa de protrombina), así como la realización de monitorización clínica. Se evalúa la presencia del SFSS según los criterios definidos por Dahm et al.6 (tabla 3).
Criterios del síndrome de small-for-size
| Disfunción por «small-for-size»Disfuncióna de un injerto de pequeño tamaño (GBWR < 0,8%) durante la primera semana postoperatoria tras la exclusión de otras causasb |
| Malfunción por «small-for-size»Falloc de un injerto de pequeño tamaño (GBWR < 0,8%) durante la primera semana postoperatoria tras la exclusión de otras causasb |
Fuente: adaptada de Dahm et al.6.
Disfunción del injerto: presencia de 2 de los siguientes criterios durante 3 días consecutivos: bilirrubina >100μmol/l; INR > 2; encefalopatía grado 3 o 4.
Las diferencias estadísticas entre grupos se analizan con el test de t de Student para las variables numéricas. La correlación estadística entre variables continuas se analiza mediante el test de correlación de Pearson. Todos los resultados se expresan como media ± desviación estándar, salvo en donde se especifica lo contrario. Se considera que una medición es estadísticamente significativa si la p < 0,05. El análisis estadístico de los datos se realiza con el programa informático SPSS Statistics 17.0 (SPSS, Chicago, IL, EE. UU.).
ResultadosResultados generalesLa evolución analítica de los receptores de THDVA fue parecida a la de los receptores de trasplante hepático de donante cadavérico, con un pico máximo de transaminasas entre el primer y segundo día postoperatorio, con una coagulación que asciende progresivamente hasta alcanzar valores normales alrededor de la semana postoperatoria y valores de bilirrubina que tienden a la normalización.
La media del GBWR fue de 1,03 ± 0,22%, con una mediana de 1,03% y un rango de 0,66-1,83%. A pesar de que 4 pacientes presentaron un GBWR inferior al 0,8%, ningún paciente presentó criterios clínicos o analíticos de SFSS según la clasificación de Dahm et al.6. No hubo que realizar ningún retrasplante inmediato. Con una mediana de seguimiento de 39 meses, únicamente ha habido que retrasplantar a un paciente de los 45 receptores como consecuencia de una cirrosis biliar secundaria. Dos pacientes fallecieron a los 3 meses de la intervención, uno a causa de una hepatitis aguda grave no filiada y otro tras presentar complicaciones derivadas de una enfermedad por CMV.
En cuanto a complicaciones vasculares, únicamente hubo una trombosis de la arteria hepática que requirió una reintervención quirúrgica a las 12 h. Un total de 22 pacientes presentaron una complicación biliar en forma de fuga. El origen de la fuga fue principalmente la anastomosis biliar, con 17 casos, seguido de la superficie de transección, con 4 casos y finalmente un paciente el origen de cuya fuga fue el drenaje de Kehr. El tratamiento inicial fue conservador en 18 pacientes y quirúrgico en 4. Todos los pacientes evolucionaron favorablemente hacia la resolución de cuadro.
La supervivencia de los pacientes fue del 93,2, 84,2 y 74,2% al año, 3 y 5 años respectivamente.
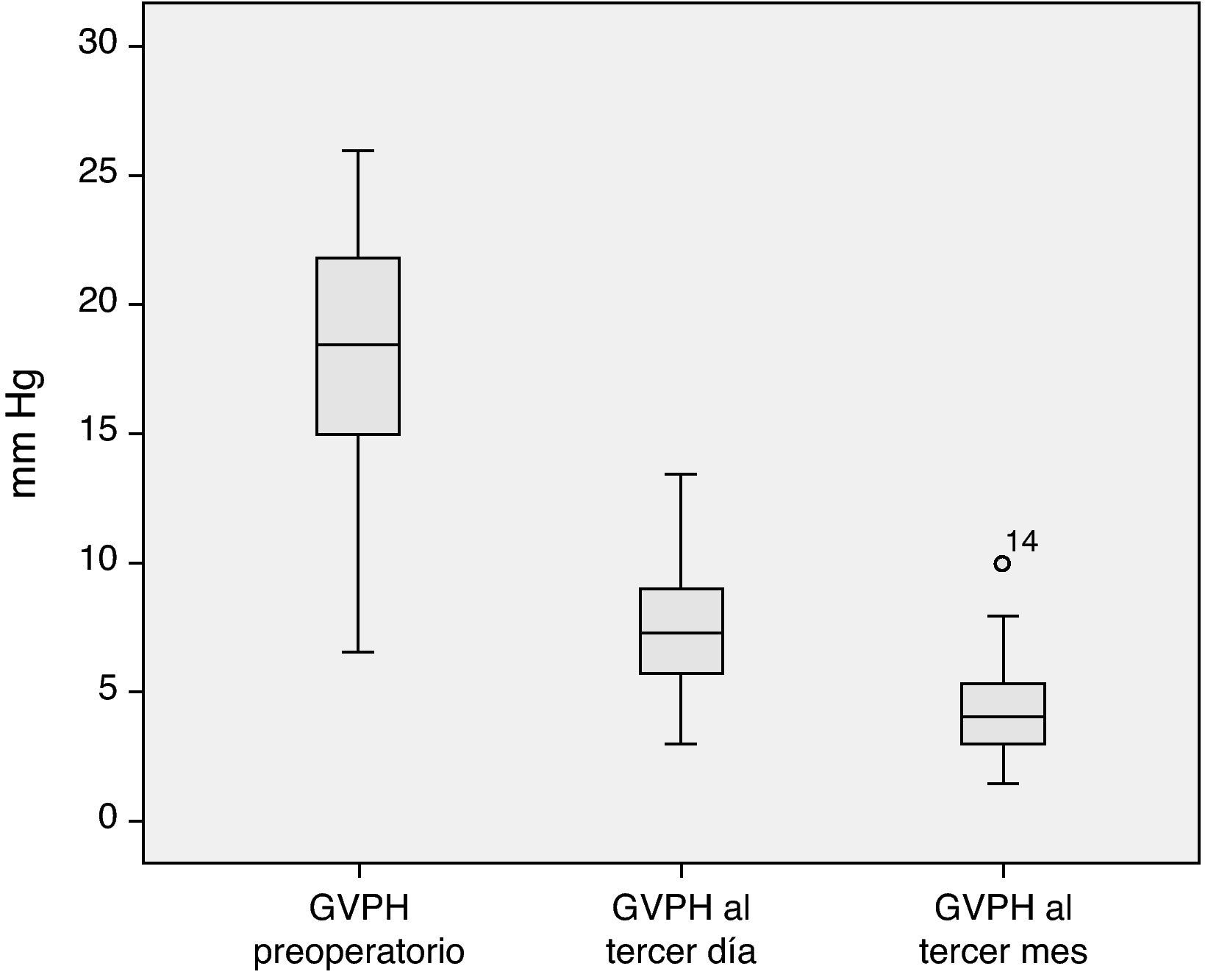
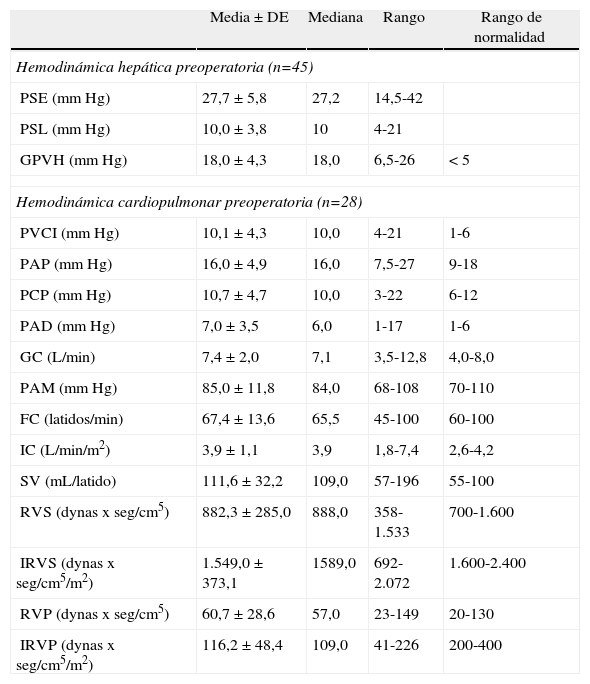
Análisis descriptivo de la monitorización hemodinámicaMonitorización preoperatoriaLa totalidad de los pacientes presentaban hipertensión portal en cuanto a la hemodinámica hepática practicada en el preoperatorio. Además, 40 de los pacientes presentaban una hipertensión portal grave (GVPH > 12mm Hg). El análisis de los parámetros hemodinámicos cardiopulmonares muestra que el conjunto de los receptores de THDVA se caracterizan por una tendencia a la circulación hiperdinámica, con un gasto cardíaco en el lÍmite alto de la normalidad y unas resistencias vasculares pulmonares y sistémicas en el límite bajo del rango de normalidad (tabla 4).
Resultados de los parámetros hemodinámicos preoperatorios
| Media±DE | Mediana | Rango | Rango de normalidad | |
| Hemodinámica hepática preoperatoria (n=45) | ||||
| PSE (mm Hg) | 27,7 ± 5,8 | 27,2 | 14,5-42 | |
| PSL (mm Hg) | 10,0 ± 3,8 | 10 | 4-21 | |
| GPVH (mm Hg) | 18,0 ± 4,3 | 18,0 | 6,5-26 | < 5 |
| Hemodinámica cardiopulmonar preoperatoria (n=28) | ||||
| PVCI (mm Hg) | 10,1 ± 4,3 | 10,0 | 4-21 | 1-6 |
| PAP (mm Hg) | 16,0 ± 4,9 | 16,0 | 7,5-27 | 9-18 |
| PCP (mm Hg) | 10,7 ± 4,7 | 10,0 | 3-22 | 6-12 |
| PAD (mm Hg) | 7,0 ± 3,5 | 6,0 | 1-17 | 1-6 |
| GC (L/min) | 7,4 ± 2,0 | 7,1 | 3,5-12,8 | 4,0-8,0 |
| PAM (mm Hg) | 85,0 ± 11,8 | 84,0 | 68-108 | 70-110 |
| FC (latidos/min) | 67,4 ± 13,6 | 65,5 | 45-100 | 60-100 |
| IC (L/min/m2) | 3,9 ± 1,1 | 3,9 | 1,8-7,4 | 2,6-4,2 |
| SV (mL/latido) | 111,6 ± 32,2 | 109,0 | 57-196 | 55-100 |
| RVS (dynas x seg/cm5) | 882,3 ± 285,0 | 888,0 | 358-1.533 | 700-1.600 |
| IRVS (dynas x seg/cm5/m2) | 1.549,0 ± 373,1 | 1589,0 | 692-2.072 | 1.600-2.400 |
| RVP (dynas x seg/cm5) | 60,7 ± 28,6 | 57,0 | 23-149 | 20-130 |
| IRVP (dynas x seg/cm5/m2) | 116,2 ± 48,4 | 109,0 | 41-226 | 200-400 |
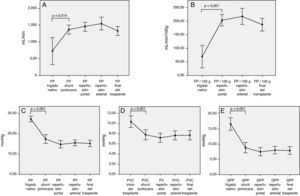
Intraoperatoriamente, la evolución de los parámetros hemodinámicos a lo largo del trasplante tienen un punto de inflexión durante la fase anhepática. Durante este tiempo quirúrgico, se ha procedido a la hepatectomía total del hígado nativo y la circulación esplácnica se preserva a través del shunt portocava temporal.
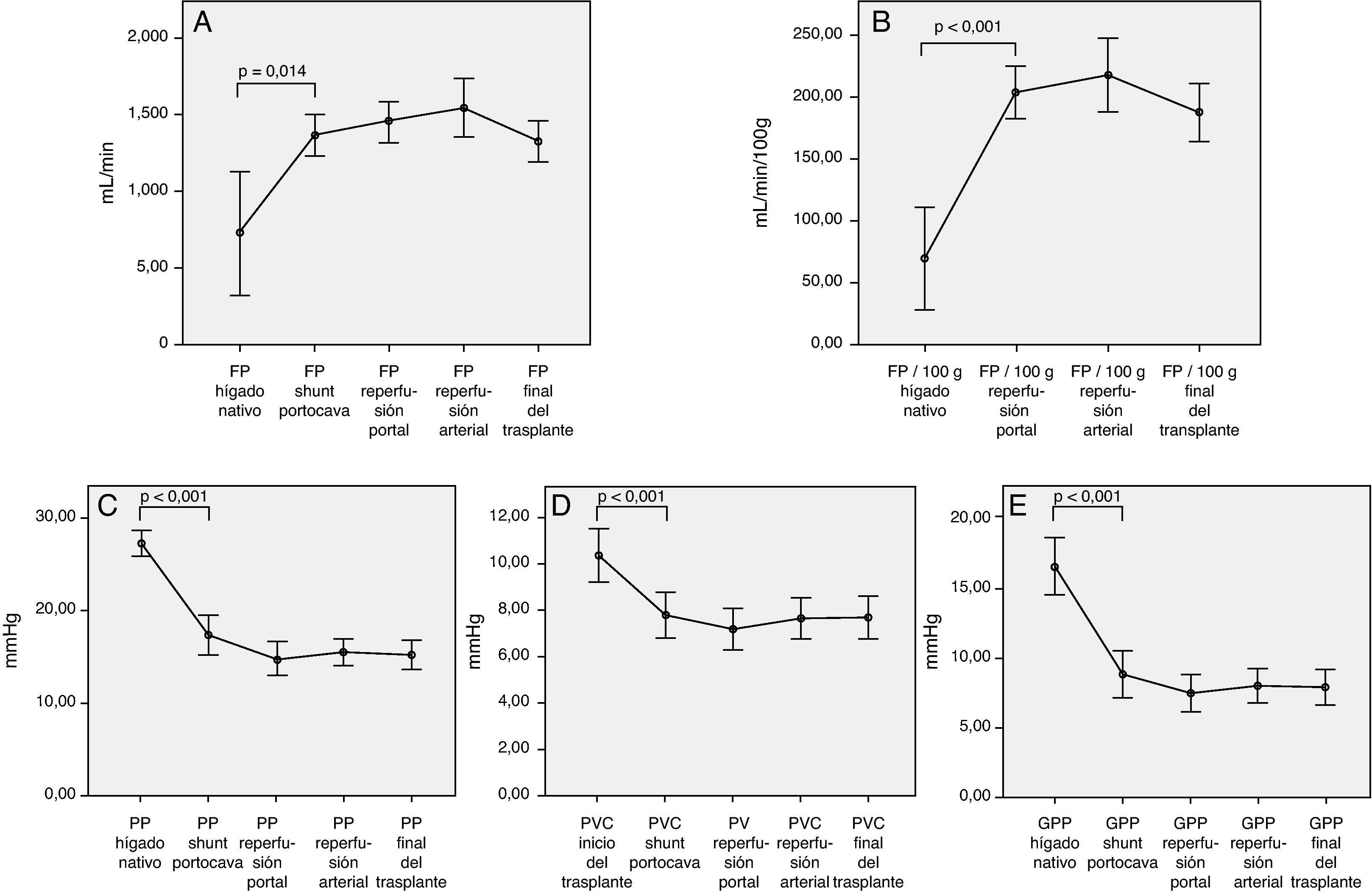
Así, podemos observar cambios hemodinámicos significativos en los siguientes parámetros hemodinámicos al comparar la situación basal y a partir del shunt portocava temporal (fig. 1):
- -
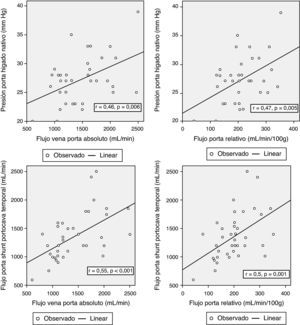
Aumento del flujo de la vena porta total (727 ± 596 vs 1.362,8 ± 410mL/min; p = 0,014) o relativo al peso del injerto (69 ± 62 vs 204,2 ± 72mL/min/100g; p < 0,001).
- -
Disminución de la presión de la vena porta (27,2 ± 4,2 vs 17,4 ± 6,1mm Hg, p < 0,001).
- -
Disminución de la presión venosa central (10,4 ± 3,7 vs 7,8 ± 3,2; p > 0,001)
- -
Disminución del gradiente de PP (16,4 ± 5,9 vs 8,8 ± 5,3mm Hg, p < 0,001)
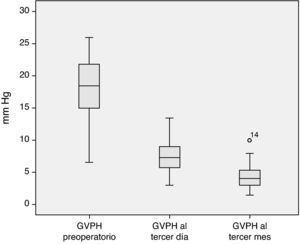
El análisis de la evolución hemodinámica hepática postoperatoria nos muestra una desaparición del estado de hipertensión portal previo a la cirugía, consiguiendo en el tercer mes posterior al trasplante valores dentro de la normalidad (fig. 2).
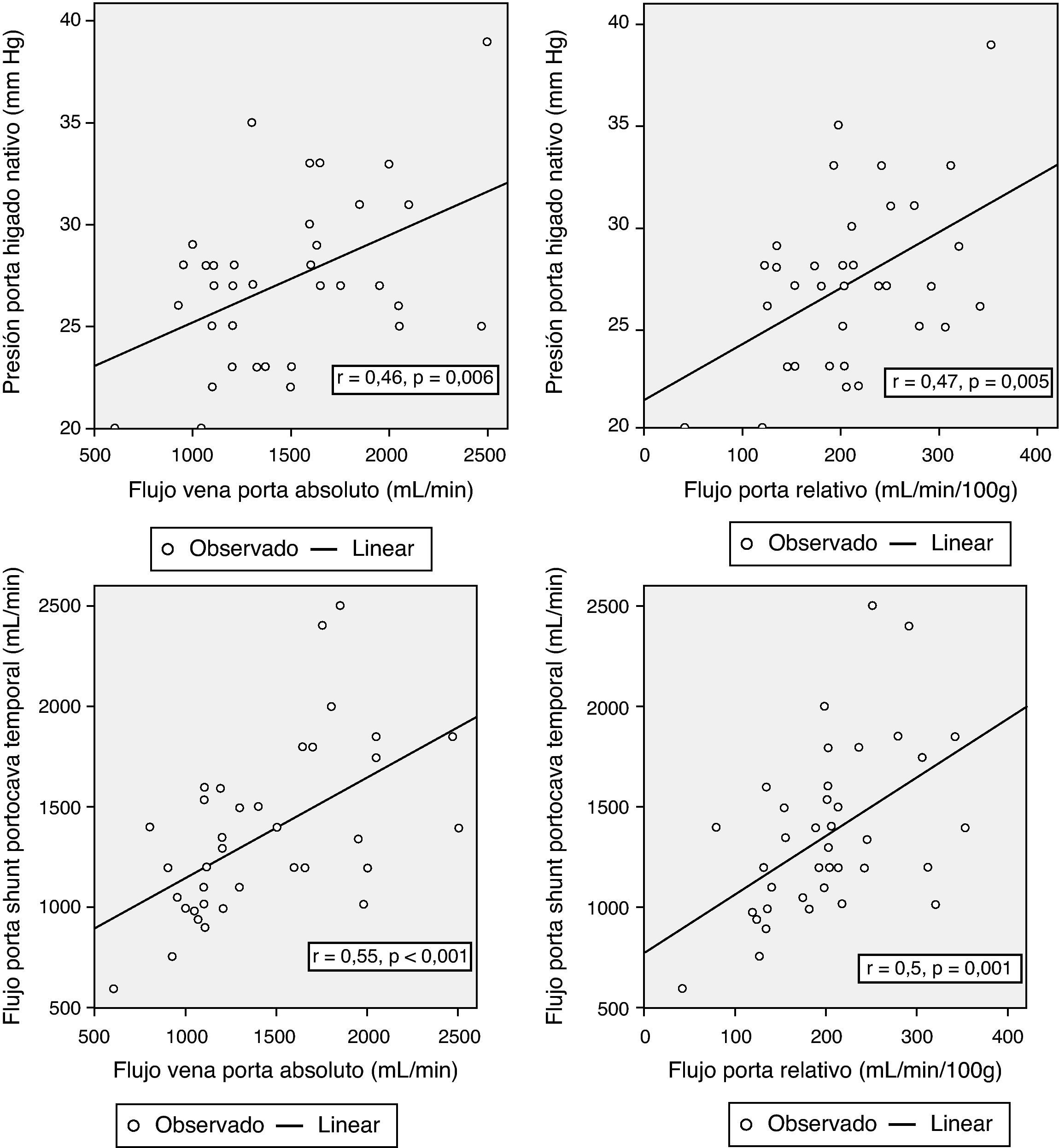
Correlación entre los parámetros hemodinámicos previos a la reperfusión y el flujo portalCon el objetivo de correlacionar el flujo de la vena porta durante la reperfusión y los distintos parámetros hemodinámicos previos a la reperfusión, se encontraron correlaciones significativas entre la presión de la vena porta del hígado nativo al inicio de la intervención y el FP absoluto y relativo al peso del injerto (r = 0,46; p = 0,006 y r = 0,47; p = 0,005, respectivamente). El flujo de la porta durante la reperfusión se correlacionó con el flujo de la vena porta a través del shunt portocava temporal durante la fase anhepática, tanto en términos de FP absoluto (r = 0,55, p < 0,001) como relativo al peso del injerto (r = 0,5, p = 0,001) (fig. 3).
No se encontró ninguna correlación entre una variable hemodinámica preoperatoria y el FP tras la reperfusión del injerto.
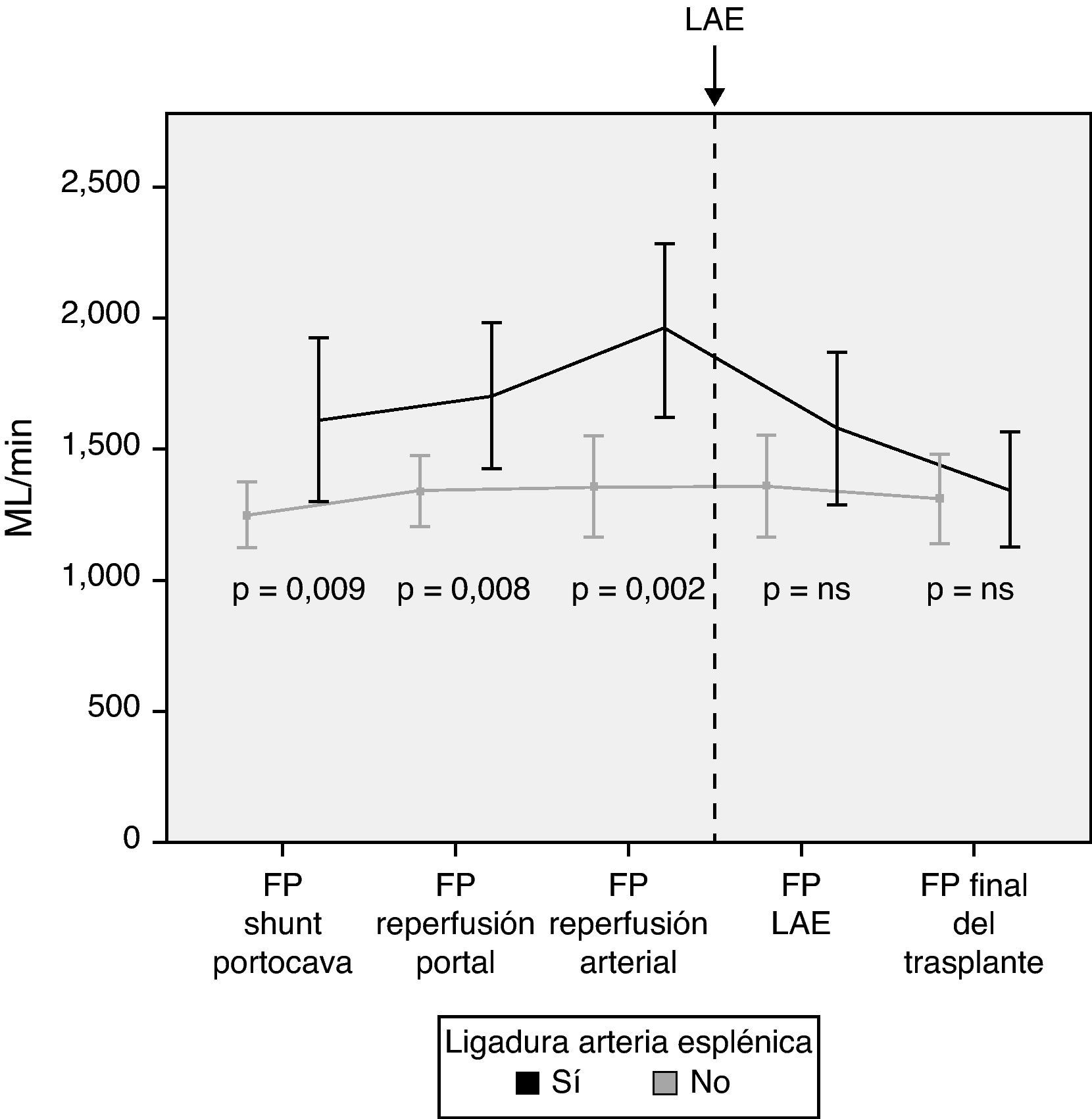
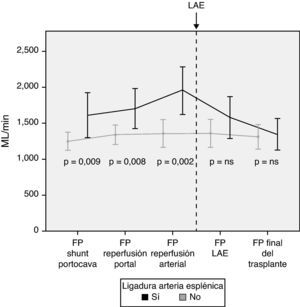
Modulación del flujo portal: ligadura de la arteria esplénicaDe acuerdo con los criterios establecidos en el apartado de métodos, se realizó una LAE en un total de 13 pacientes (29%) durante el acto operatorio. La causa de la ligadura fue por flujo de la vena porta excesivo en 4 pacientes, por flujo de la arteria hepática insuficiente en 5 pacientes y por ambos motivos en 4 pacientes. Tras la LAE, los flujos de la vena porta, que habían sido significativamente mayores en aquellos pacientes que la requirieron, no mostraron diferencias al final de la intervención con aquellos pacientes que no la necesitaron (fig. 4).
DiscusiónEl SFSS se ha estudiado tanto en el ámbito experimental como en el clínico, y parece claro que el factor más importante para su aparición es un exceso de FP durante la reperfusión del injerto. Este exceso de flujo produce una lesión histológica aguda caracterizada por una hemorragia y edema periportal y pérdida del alineamiento normal de las células endoteliales portales que incluso se puede extender hacia las venas centrolobulillares13,16. Se postula que esta lesión, que impide la normal irrigación de los hepatocitos, es la causa del posterior fracaso de la función hepática.
El exceso de perfusión del injerto en el SFSS se ha medido de forma objetiva con la PP o con el FP durante la reperfusión. Los grupos asiáticos son partidarios de monitorizar la PP. De esta forma, han podido relacionar una mejoría en la supervivencia en aquellos receptores que presentan valores de PP inferiores a 20mm Hg al final del trasplante17. Recientemente, el mismo grupo ha publicado su experiencia con THDVA usando injertos de pequeño tamaño (incluso con injertos de GBWR inferior al 0,6%) con control intencional de la PP, con el objetivo de obtener valores <15mm Hg al final del trasplante18. En occidente, sin embargo, el método preferido para la valoración del exceso de perfusión es la medición del FP. Los datos experimentales han podido demostrar por un lado que el flujo refleja de forma más adecuada la situación hemodinámica esplácnica y que la PP y el FP no tienen por qué estar relacionados14, y por otro lado que es necesario un aumento del flujo del orden de 2 veces el basal para obtener buenos resultados16. Desde el punto de vista clínico, se han podido confirmar ambos hechos, habiéndose descrito discrepancias entre ambos parámetros, con una PP normal y un FP excesivo, y con hasta un 25% de los pacientes con PP excesiva (>20mm Hg) y FP bajos (inferiores a 90mL/min/100g), que podrían comprometer la viabilidad del injerto14. En cuanto al aumento moderado de FP en el receptor de THDVA, ha sido bien caracterizado en la clínica hallando cifras entre 2 y 3 veces los valores basales19.
Dado que el problema principal para el desarrollo del SFSS es hemodinámico, se inició el procolo de monitorización hemodinámica con el objetivo de conocer los cambios hemodinámicos que se producen en el receptor en el transcurso del THDVA y de poder determinar algún factor hemodinámico con capacidad de predecir el FP durante la reperfusión. Tanto en un aspecto como en el otro hemos sido capaces de identificar la importancia del shunt portocava temporal en el trasplante hepático de donante vivo.
En nuestro caso practicamos de forma rutinaria un shunt portocava temporal durante la fase anhepática. Descrito inicialmente por Belghiti et al. en el trasplante hepático de injerto completo, bien electivo20 o urgente21, su utilidad ha sido demostrada en estudios posteriores, demostrando su superioridad frente a la técnica de by-pass veno-venoso en términos de estabilidad hemodinámica, reducción de necesidades transfusionales y preservación de la función renal22.
En nuestra experiencia, además de los beneficios anteriormente expuestos, hemos hallado otra razón para practicar de forma sistemática el shunto portocava temporal. Tras analizar la evolución hemodinámica durante el trasplante, queda claro que existe un antes y un después en relación con la práctica del shunt portocava temporal. Durante la fase anhepática, la situación hemodinámica del receptor del trasplante, con una hipertensión portal de largo tiempo de evolución, se ve alterada de forma súbita por la desaparición del hígado nativo, que oponía resistencia al flujo sanguíneo portal. Durante esta fase, desciende de forma significativa la presión y aumenta el flujo sanguíneo a través de la vena porta, que posteriormente se correlacionará con el FP. Este cambio con relación a la situación hemodinámica basal apoya el hecho de que no haya ningún parámetro hemodinámico preoperatorio que presente una correlación con el FP tras la reperfusión.
En caso de demostrar un FP excesivo en quirófano, se pueden practicar distintas maniobras para disminuir el flujo. Nuestra primera opción es la práctica de una LAE por ser un método efectivo y relativamente poco complejo. Trece pacientes precisaron una LAE tras completar las anastomosis portal y arterial y haber analizado los flujos. Los resultados muestran la efectividad de la LAE para disminuir el FP, al observarse una disminución significativa del FP tras su realización.
Debido a la vasta literatura existente sobre la asociación del SFSS con un injerto de pequeño tamaño, un requisito fundamental para aceptar un potencial donante hepático como tal es que el futuro GBWR para el receptor sea superior al 0,8%. No obstante, dado que puede haber pequeños errores en el cálculo volumétrico del injerto, del total de 45 receptores, 4 presentaron un GBWR inferior, sin que afortunadamente hubiera mayores consecuencias por ello. Sin embargo, la correlación demostrada del flujo del shunt portocava y el FP final nos va a permitir identificar a aquellos pacientes con un riesgo de presentar un exceso de flujo durante la reperfusión y por tanto, ser capaces de poder modularlo antes de que produzca la lesión endotelial que conduzca a un SFSS. Como consecuencia de todo ello, la monitorización hemodinámica del receptor de THDVA nos va a permitir usar deliberadamente injertos de menor tamaño, con una disminución esperada de la morbilidad en el donante, mientras mantenemos los resultados en el receptor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.