Las neoplasias quísticas pancreáticas representan un grupo heterogéneo de enfermedades, donde la neoplasia mucinosa papilar intraductal está alcanzando protagonismo. El objetivo del estudio es revisar nuestra serie de neoplasias quísticas pancreáticas intervenidas y valorar la concordancia con las recomendaciones de Fukuoka.
MétodosRevisamos de forma retrospectiva nuestra experiencia analizando los datos clínicos y radiológicos, la indicación quirúrgica y el estudio histológico de los 11 pacientes intervenidos en nuestro centro desde julio de 2011 a julio de 2015 por esta enfermedad, con el objetivo de valorar la concordancia con los consensos actuales.
ResultadosEn nuestra serie la mayoría de los casos (7/11) presentaban síntomas al diagnóstico. El diagnóstico preoperatorio se alcanzó en 10 pacientes mediante radiología y/o ecoendoscopia. Las indicaciones quirúrgicas fueron presencia de síntomas, datos radiológicos de sospecha de malignidad y neoplasia de rama secundaria asintomática mayor a 30mm. Los hallazgos en estudio histológico fueron de malignidad en 6/11 (2 neoplasia invasiva, 4 displasia de alto grado), displasia moderada en 2/11, displasia de bajo grado en 2/11 y ausencia de displasia en un paciente.
ConclusionesLa indicación quirúrgica de las neoplasias mucinosas papilares intraductales de páncreas depende de los síntomas asociados, dimensiones, localización, riesgo y sospecha de malignidad.
Cystic pancreatic neoplasms are a heterogeneous group of pathology, and intraductal papillary mucinous neoplasia is becoming more common. The aim of this study is to review our series of cystic pancreatic neoplasms that underwent surgery and to evaluate the similarities with Fukuoka recommendations.
MethodsRetrospective review of our experience analyzing clinical and radiological data, indication for surgery and pathology study of 11 patients operated on in our centre from july 2011 to july 2015, aiming to evaluate the degree of agreement with the current consensus.
ResultsIn our series the majority of cases (7/11) had symptoms at diagnosis. Preoperative diagnosis was achieved in 10 patients using radiology and/or endoscopy. Indications for surgery were the presence of symptoms, radiological data suspicious of malignancy, and secondary branch neoplasia over 30mm. Pathological findings were malignancy in 6/11 cases (2 invasive neoplasia, 4 high grade dysplasia), moderate dysplasia in 2/11, low-grade dysplasia in 2/11 and no dysplasia in one patient.
ConclusionsSurgical indication of intraductal mucinous pancreatic neoplasms depends on the associated symptoms, size, location, risk and suspicion of malignancy.
Las neoplasias mucinosas papilares intraductales (NMPI) se incluyen dentro de las neoplasias quísticas pancreáticas. Descritas inicialmente por Ohashi en 19821, su diagnóstico diferencial debe incluir pancreatitis crónica, tumores quísticos mucinosos y adenocarcinoma ductal pancreático.
El diagnóstico preoperatorio se basa en determinar su presencia, el tipo de lesión y el riesgo de malignidad que presenta, y su importancia radica en el impacto que tiene sobre el tratamiento y el pronóstico. Uno de los hechos más destacados es la progresión secuencial hasta lesiones malignas, por lo que se considera una lesión precursora de cáncer de páncreas.
Los criterios de Sendai2, con una última actualización con la publicación de los criterios de Fukuoka en 20123, han incrementado la atención sobre esta enfermedad consensuando su tratamiento.
Realizamos una revisión retrospectiva de las NMPI intervenidas en nuestro centro en los últimos años, con el objetivo de valorar la concordancia con las recomendaciones de Fukuoka.
MétodosSe incluyeron los pacientes con diagnóstico histológico de NMPI intervenidos en el Hospital Universitario de Getafe entre julio de 2011 y julio de 2015.
Se trataba de 11 pacientes sobre los que recogimos datos referentes a la edad, el sexo, la presencia de síntomas, el diagnóstico preoperatorio, la indicación quirúrgica e histología de la pieza de resección.
El estudio preoperatorio fue llevado a cabo en función de la presencia o no de síntomas y los hallazgos en las pruebas de imagen, e incluyó marcadores tumorales (CEA, CA 19,9), ultrasonografía abdominal (US), tomografía computarizada, resonancia magnética nuclear (RMN), colangiografía por RMN (C-RMN), ultrasonografía endoscópica (EUS) y punción-aspiración con aguja fina (PAAF) para estudio citológico. Los hallazgos sospechosos de malignidad a nivel radiológico incluyeron la presencia de nódulo parietal y la dilatación del conducto pancreático principal (CPP) mayor a 10mm.
La indicación quirúrgica se basó en la presencia de síntomas asociados, el tamaño de la lesión y el hallazgo de datos indicativos de malignidad.
En cuanto a la técnica quirúrgica se realizó duodenopancreatectomía cefálica, pancreatectomía central, pancreatectomía distal o duodenopancreatectomía total, de acuerdo a la localización de la lesión.
Tras la intervención quirúrgica las NMPI se clasificaron en función de criterios anatómicos (rama principal, rama secundaria o tipo mixto) e histológicos (tipo intestinal, gástrico, pancreatobiliar u oncocítico).
Análisis estadísticoSe realizó un estudio descriptivo de los datos, representando las variables cuantitativas mediante media y rango (mínimo-máximo), no utilizando porcentajes al ser una serie de menos de 25 casos.
ResultadosDe los 11 pacientes intervenidos 8 fueron varones y 3 mujeres, con una edad media de 64,3±8,5 años (rango: 52-79).
En lo referente a la presencia de síntomas 7 pacientes presentaron algún tipo de sintomatología asociada (pancreatitis de repetición en 5, sepsis biliar por ictericia obstructiva en uno, dolor abdominal en otro), mientras que los otros 4 fueron hallazgos incidentales.
Se hallaron niveles elevados de CEA (>5ng/ml) en 2 de ellos y elevación de CA 19,9 (>37U/ml) en uno, donde alcanzó niveles >700U/ml.
El estudio preoperatorio realizado incluyó US abdominal en un paciente, tomografía computarizada abdominal en 7, C-RMN en 11 y EUS en 5. El diagnóstico fue NMPI en 10 casos, siendo 3 de ellos de rama principal y 7 de rama secundaria, y solo en un caso el estudio citológico por PAAF fue definitorio tras radiología dudosa.
El tamaño medio radiológico de las lesiones estudiadas fue de 33,7mm (rango: 20-55) para las NMPI de rama principal y de 26,4mm (rango: 18-35mm) para las de rama secundaria.
En 3 casos se evidenciaron hallazgos radiológicos sospechosos de malignidad: presencia de nódulo parietal en US en uno y dilatación del CPP>10mm en 2 casos.
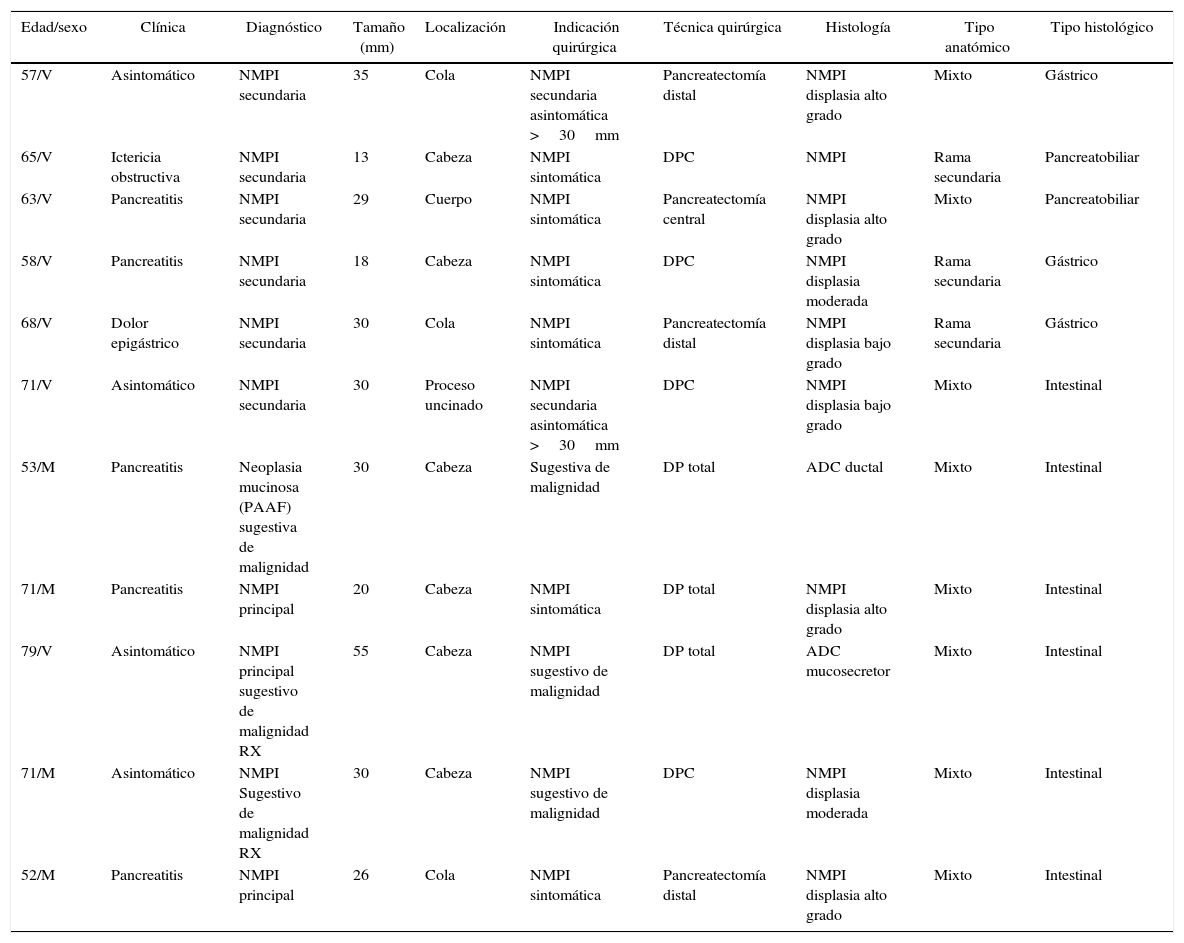
Las indicaciones quirúrgicas y las técnicas realizadas se recogen en la tabla 1, destacando la realización de pancreatectomía total en 3 casos por hallazgo, en un paciente, de multifocalidad en ecografía intraoperatoria y salida de mucina a la sección pancreática en 2 casos.
Serie de casos
| Edad/sexo | Clínica | Diagnóstico | Tamaño (mm) | Localización | Indicación quirúrgica | Técnica quirúrgica | Histología | Tipo anatómico | Tipo histológico |
|---|---|---|---|---|---|---|---|---|---|
| 57/V | Asintomático | NMPI secundaria | 35 | Cola | NMPI secundaria asintomática >30mm | Pancreatectomía distal | NMPI displasia alto grado | Mixto | Gástrico |
| 65/V | Ictericia obstructiva | NMPI secundaria | 13 | Cabeza | NMPI sintomática | DPC | NMPI | Rama secundaria | Pancreatobiliar |
| 63/V | Pancreatitis | NMPI secundaria | 29 | Cuerpo | NMPI sintomática | Pancreatectomía central | NMPI displasia alto grado | Mixto | Pancreatobiliar |
| 58/V | Pancreatitis | NMPI secundaria | 18 | Cabeza | NMPI sintomática | DPC | NMPI displasia moderada | Rama secundaria | Gástrico |
| 68/V | Dolor epigástrico | NMPI secundaria | 30 | Cola | NMPI sintomática | Pancreatectomía distal | NMPI displasia bajo grado | Rama secundaria | Gástrico |
| 71/V | Asintomático | NMPI secundaria | 30 | Proceso uncinado | NMPI secundaria asintomática >30mm | DPC | NMPI displasia bajo grado | Mixto | Intestinal |
| 53/M | Pancreatitis | Neoplasia mucinosa (PAAF) sugestiva de malignidad | 30 | Cabeza | Sugestiva de malignidad | DP total | ADC ductal | Mixto | Intestinal |
| 71/M | Pancreatitis | NMPI principal | 20 | Cabeza | NMPI sintomática | DP total | NMPI displasia alto grado | Mixto | Intestinal |
| 79/V | Asintomático | NMPI principal sugestivo de malignidad RX | 55 | Cabeza | NMPI sugestivo de malignidad | DP total | ADC mucosecretor | Mixto | Intestinal |
| 71/M | Asintomático | NMPI Sugestivo de malignidad RX | 30 | Cabeza | NMPI sugestivo de malignidad | DPC | NMPI displasia moderada | Mixto | Intestinal |
| 52/M | Pancreatitis | NMPI principal | 26 | Cola | NMPI sintomática | Pancreatectomía distal | NMPI displasia alto grado | Mixto | Intestinal |
Tras el estudio histológico de la pieza de resección se evidenció NMPI no invasiva en 9 pacientes y cáncer invasivo en 2. Entre las neoplasias no invasivas se obtuvo displasia de alto grado —carcinoma in situ (CIS) en 4 de los 9 pacientes, de grado moderado—borderline en 2, de bajo grado-adenoma en 2 y sin evidencia de displasia tan solo en un paciente. Entre las neoplasias invasivas, en una de ellas se evidenció un adenocarcinoma ductal infiltrante (pT1N1) y en el otro un adenocarcinoma mucosecretor (pT3N0), ambos casos con sospecha de malignidad previa. Por tanto, la presencia de malignidad, entendida como CIS y neoplasia invasiva, se halló en 6 de los 11 pacientes estudiados. Se halló multifocalidad en 5 casos, en 3 ellos se les había practicado pancreatectomía total por los hallazgos intraoperatorios, y en los otros 2 el margen de resección intraoperatorio fue negativo y no existe recidiva radiológica hasta el momento actual con un año y 4 años de seguimiento.
DiscusiónLas NMPI representan en torno al 1-3% de las neoplasias exocrinas pancreáticas y el 20-50% de las neoplasias quísticas del páncreas, aunque su incidencia real no está clara debido a que en la mayoría de los casos son lesiones pequeñas y asintomáticas4.
Recibieron una gran variedad de nombres hasta que la Organización Mundial de la Salud, en su clasificación publicada en 19985, definió el término como lo conocemos en la actualidad para diferenciarlo principalmente de los tumores quísticos mucinosos. Se definen como neoplasias epiteliales intraductales, caracterizadas por dilatación segmentaria o difusa de ductos pancreáticos, compuestas por células productoras de mucina, con proliferación epitelial papilar, que asocian grados variables de atipia4.
La sintomatología asociada incluye fundamentalmente la pancreatitis de repetición, debida a que la mucina producida por la lesión tapona el CPP o las ramas secundarias, provocando, además, la dilatación del conducto, como ocurre en nuestra serie, donde 6 de los 11 pacientes presentaban el tipo de clínica pancreatobiliar.
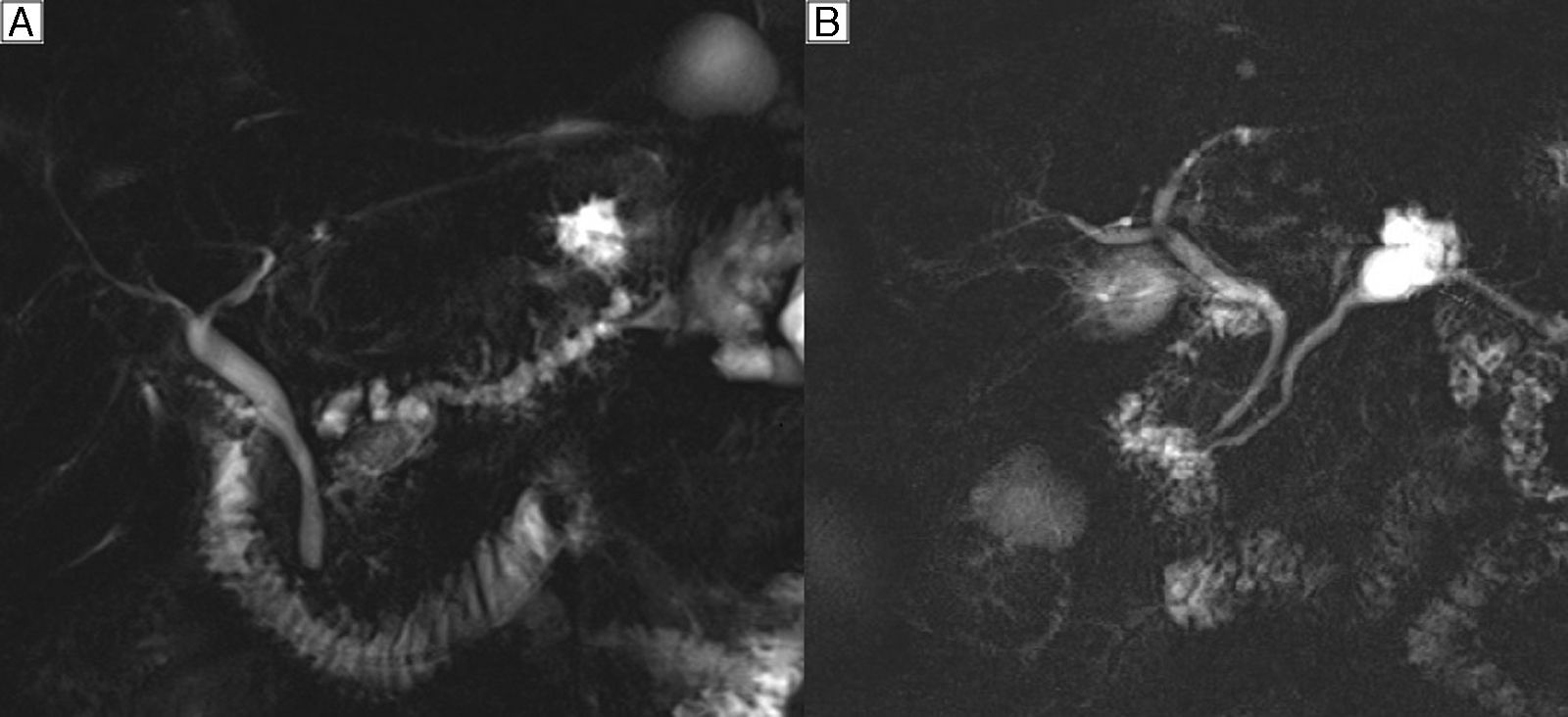
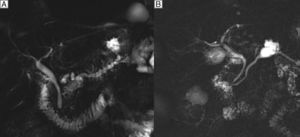
El diagnóstico preoperatorio se basa en determinar su existencia, el tipo anatómico y el riesgo de malignidad. En las NMPI de rama principal (20% en frecuencia) la sospecha diagnóstica se establece por la dilatación del CPP mayor a 5mm sin otra causa de obstrucción (fig. 1A), y en las de rama secundaria (40% en frecuencia) por la existencia de comunicación con un conducto principal menor o igual a 5mm (fig. 1B). En las de tipo mixto (40% en frecuencia) existe afectación tanto de CPP como de ramas secundarias3.
Además, se debe determinar el riesgo de malignidad asociada a la lesión. De forma global, los factores predictivos de malignidad y de carcinoma invasivo en las NMPI hallados en la literatura incluyen la presencia de ictericia, las lesiones de rama principal o mixtas, la presencia de nódulos de murales y la dilatación del CPP6. En las de rama secundaria se debe añadir el tamaño tumoral mayor o igual a 30mm, siendo raro el hallazgo de lesiones malignas en caso de lesiones menores a 20mm6.
En función de estos datos los criterios de Fukuoka, publicados en 2012, determinan como «signos de alto riesgo» la presencia de componente sólido captante en el interior de quiste o la dilatación CPP mayor o igual 10mm. Por otra parte, son «hallazgos preocupantes» un quiste mayor o igual 30mm, paredes quísticas engrosadas, nódulos murales no captantes, diámetro de CPP entre 5-9mm, cambio de calibre abrupto con atrofia distal o presencia de adenopatías3. También recomiendan el estudio radiológico a todo quiste pancreático mayor a 10mm para valorar la existencia de este tipo de hallazgos.
Por el contrario, la guía americana publicada en 20157 no recomienda la evaluación adicional en el caso de lesiones quísticas menores de 30mm sin dilatación de CPP ni presencia de componente sólido. Se recomienda la realización de CRMN sobre otras pruebas de imagen, porque presenta mayor resolución para reconocer la presencia de septos o nódulos y la comunicación con ductos pancreáticos8.
En cuanto a los marcadores tumorales se recomienda la determinación de CEA y CA 19,9, pese que este último está elevado en menos del 20% de las NMPI no invasivas.
En función de los hallazgos anteriores el algoritmo de manejo de NMPI según los criterios de Fukuoka3 incluye:
- •
Tratamiento quirúrgico en caso de síntomas, NMPI de rama principal mayor a 10mm o NMPI de rama secundaria con «hallazgos de alto riesgo» (ictericia obstructiva, signos de alto riesgo en radiología o citología positiva/sospechosa).
- •
Realización de EUS en caso de NMPI de rama secundaria con presencia de «hallazgos preocupantes» en las pruebas de imagen. La PAAF es concluyente en un 40-50% de los casos, sin olvidar que la ausencia de atipia no excluye la presencia de malignidad. En caso de citología sospechosa o positiva, afectación de CPP o nódulos murales en EUS, se recomienda la intervención quirúrgica.
Se recomienda, por tanto, la realización inicial de CRMN y, en función de los hallazgos, indicar cirugía o ampliar estudio con EUS.
En el caso de NMPI de rama secundaria asintomáticos >30mm sin hallazgos de alto riesgo sigue existiendo controversia. La decisión debe individualizarse en función de la edad del paciente y de los hallazgos en EUS/PAAF, planteando la resección sobre todo en pacientes jóvenes, debido al riesgo acumulado de malignidad que presenta (tasa de malignidad anual 2-3%).
En nuestra serie, las indicaciones quirúrgicas seguían las recomendaciones de la guía de 2012, ya que fueron presencia de síntomas y sospecha de malignidad (dilatación CPP o presencia de nódulo parietal). En los casos de NMPI secundaria asintomática >30mm la indicación se basó en un caso en la edad joven del paciente y, en el otro, en el resultado incierto de la citología.
El seguimiento radiológico estaría indicado en caso de NMPI asintomáticas de rama secundaria<30mm y de rama principal menores de 10mm, e incluiría la realización de CT/RMN/C-RMN cada 2 años, entre 10-20mm de forma anual durante 2 años y entre 20-30mm EUS a los 6 meses3, mientras que otros documentos recomiendan la realización de RM al año, y después cada 2 años hasta un total de 5 si no existen cambios7. En caso de cambios en el quiste se recomienda la realización de EUS7.
Las recomendaciones realizadas en la guía se basan en la implicación pronóstica que tiene la clasificación anatómica de las NMPI: las de rama principal presentan una frecuencia de malignidad (CIS y neoplasia invasiva) de 61,6% (rango 36-100%) y una frecuencia de carcinoma invasivo del 43,1% (rango 11-81%), con cifras de supervivencia a 5 años entre 31-54%, mientras que las de rama secundaria (40%) asocian una frecuencia de malignidad del 25,5% (rango 6,3-46,5%), con neoplasia invasiva en 17,7% (rango 1,4-36,7%)3,4. Esta relativa baja frecuencia de malignidad en las lesiones de rama secundaria justificaría la posibilidad de tratamiento conservador en muchas de ellas, independientemente de su tamaño.
En nuestra serie la presencia de neoplasia invasiva se evidenció en 2 casos de los 11 pacientes estudiados, ambos con lesiones sospechosas de malignidad en el preoperatorio, y displasia de alto grado-in situ en 4 pacientes, siendo 3 de ellos sintomáticos y uno indicado por tamaño mayor a 30mm.
En el tipo de resección se mantiene la controversia; en las NMPI de rama principal lo más frecuente es la realización de duodenopancreatectomía cefálica debido a que la mayoría de las lesiones se localizan en la cabeza pancreática-proceso uncinado, y actuar en función de los hallazgos en el margen de resección, mientras que en las de rama secundaria la extensión de la resección se realiza según la localización y el tamaño de la lesión2,3, siendo un tema aún controvertido. En algunos casos podrían realizarse resecciones parciales no anatómicas, siempre que no existan dudas de la malignidad de la lesión, mientras que en caso de multifocalidad se debe plantear la posibilidad de pancreatectomía total vs resección de la lesión de mayor riesgo oncológico y seguimiento.
A nivel histológico las NMPI se clasifican según el tipo de epitelio que presenta la lesión: tipo gástrico (70%), el más frecuente en rama secundaria, relacionado con el desarrollo de carcinoma ductal; tipo intestinal (20%), el más frecuente en ducto principal, mayor relación con carcinoma coloide; tipo pancreatobiliar (7%), relacionado con el desarrollo de carcinoma ductal, y tipo oncocítico (3%), el menos frecuente y menos conocido5.
La implicación pronóstica a nivel anatomopatológico viene dada por la presencia o no de malignidad. Actualmente se plantea que el desarrollo de carcinoma invasivo en el seno de NMPI sigue una secuencia adenoma-carcinoma en aproximadamente 5 años, que implicaría una evolución displasia de bajo grado (adenoma)-displasia moderada (borderline)-displasia de alto grado (carcinoma in situ)-carcinoma invasivo9,10. El carcinoma invasivo puede ser de tipo tubular/ductal, presente en >50% de tipo pancreatobiliar y en un 10-30% de tipo gástrico; o de tipo coloide, en un 30-50% de tipo intestinal, teniendo este último mejor pronóstico.
Las cifras de supervivencia en caso de NMPI invasivo se sitúan en torno a 31-62% a 5 años frente a 9-20% en caso de adenocarcinoma, teniendo en cuenta que el pronóstico se relaciona con tamaño tumoral, presencia de metástasis, grado de diferenciación e invasión perineural o vascular4.
Si bien nuestra serie de casos es limitada en número y se trata de una revisión retrospectiva, existen pocas publicadas en nuestro medio.
Nuestra actitud terapéutica coincide con los criterios de Fukuoka en cuanto a la necesidad de intervención quirúrgica en caso de presencia de síntomas o signos de alto riesgo. A tener en cuenta que en la mayoría de los casos de nuestra serie existía carcinoma infiltrante o displasia. Además, también coincidimos con la indicación de tratamiento individualizado en NMPI de rama secundaria mayor a 30mm.
En conclusión, existe consenso en la actualidad sobre el manejo diagnóstico y las indicaciones quirúrgicas de las NMPI. Sin embargo, hay aún controversia sobre el tipo de cirugía y el manejo en presencia de multifocalidad.
AutoríaDiseño del estudio: Alba Manuel Vázquez, Alberto Carabias Hernández y Paloma Sanz Muñoz.
Adquisición y recogida de datos: Alberto Carabias Hernández, Teresa Carrascosa Mirón, Ainhoa Valle Rubio, Javier Mínguez García, Paloma Sanz Muñoz y Ana Serantes Gómez.
Análisis e interpretación de los resultados: Alba Manuel Vázquez, Teresa Carrascosa Mirón, Ainhoa Valle Rubio, Javier Mínguez García y Ana Serantes Gómez.
Redacción del artículo: Alba Manuel Vázquez.
Revisión crítica y aprobación de la versión final: Alberto Carabias Hernández y José María Jover Navalón.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.