El objetivo de este estudio fue analizar los factores pronósticos que influyen en la supervivencia y en la recidiva en una serie de pacientes diagnosticados de tumores neuroendocrinos de páncreas (TNEP) y tratados mediante resección quirúrgica.
MétodosSerie retrospectiva de 95 pacientes intervenidos y resecados de TNEP. Las variables estudiadas son: edad, sexo, forma de presentación (esporádica/familiar), funcionalidad, tipo de tumor, localización, cirugía realizada, tamaño tumoral, multifocalidad, tasa de curación y de recidiva. Se ha utilizado la nueva clasificación de la OMS en 2010.
ResultadosDe los 95 pacientes, 45 eran varones y 50 mujeres, con una edad media de 47,6 años. Presentación esporádica en 66 pacientes (69,8%) y familiar en los 29 restantes (30,2%), asociados a síndrome MEN 1. El 59% (56 pacientes) eran no funcionantes y el 41% restante funcionantes. Los TNEP funcionantes incluían 20 insulinomas, 16 gastrinomas y 3 glucagonomas. La técnica quirúrgica más utilizada (42 pacientes) fue la pancreatectomía corporocaudal. Según la clasificación de la OMS (2010), 59 pacientes presentaban un TNEP G1, 24 un TNEP G2 y los 12 pacientes restantes un carcinoma pobremente diferenciado. La supervivencia a los 5 años en los tumores bien diferenciados ha sido del 100%, independientemente de la funcionalidad. Los TNE esporádicos suelen ser unifocales (p<0,001) y se asocian a metástasis hepáticas. El seguimiento medio ha sido de 85,3 meses, con una tasa de supervivencia del 65,8% y de recidiva del 24%.
ConclusionesEn nuestra experiencia, la clasificación de la OMS (2010) es un factor pronóstico independiente en la supervivencia de los TNEP.
The aim of this study was to analyze prognostic factors for survival and recurrence in patients with resected pancreatic neuroendocrine tumors (PNT).
MethodsMedical records of 95 patients with resected PNT were retrospectively reviewed. The variables studied were: age, sex, form of presentation (sporadic/familial tumors), functionality, type of tumor, localization, type of surgery, tumor size, multifocal tumors and recurrent rate. The new WHO classification (2010) was used.
ResultsThere were 45 men and 50 women. Mean age was 46.8 years. Regarding the mode of presentation, it was sporadic in 66 patients (69.8%) and 29 cases were familial neuroendocrine tumors (30.2%) in association with MEN 1 syndrome. The 59% of patients suffered from non-functional tumors and 41% were functional: 20 insulinoma, 16 gastrinoma, and 3 glucagonoma. Distal pancreatectomy was the most common surgical procedure, followed by tumor enucleation in 19 patients. According to the WHO classification, 59 patients had a PNT G1, 24 PNT G2 and 12 with a poorly-differentiated carcinoma, respectively. The 5-year survival in well-differentiated tumors was 100%, regardless of the functionality. Sporadic PNT are more commonly unifocal (P<0.001), associating liver metastasis. Survival and recurrence rates after a mean follow-up of 85.3 months were 65.8 and 24%, respectively.
ConclusionsIn our experience, WHO classification was an independent prognostic factor in PNT survival.
Los tumores neuroendocrinos de páncreas (TNEP) son neoplasias poco frecuentes con una baja incidencia anual, entre el 0,32/100.000 en EE. UU.1 y el 1,01/100.000 en Japón2. Representan entre el 1 y el 2% de los tumores primarios malignos pancreáticos, aunque su prevalencia en estudios de necropsias oscila entre el 0,5 y el 10%3–5. Desde la descripción de los tumores carcinoides por Oberndorfer en 19076, los tumores neuroendocrinos se han denominado de diversas formas: tumores carcinoides, apudomas y tumores del sistema endocrino difuso7,8. Actualmente constituyen un grupo de neoplasias integradas dentro de un grupo más amplio conocido como tumores neuroendocrinos gastroenteropancreáticos9–12. La clínica está en función de que sean tumores productores de hormonas (gastrina, insulina, somatostatina, etc.) o no, y cuando no producen hormonas se denominan TNEP no funcionantes. Estos últimos representan el 30-65% de todos los TNEP13,14. Recientemente, en 2010, la OMS propuso una nueva clasificación de los TNEP basada en la proliferación y en la morfología del tumor15. Generalmente, los TNEP son tumores de crecimiento lento y con un mejor pronóstico, incluso con metástasis, que los tumores ductales del páncreas. El mejor tratamiento es la cirugía, siempre que sea resecable16,17. En caso de ser irresecable, se han desarrollado nuevas moléculas (everolimus, sunitinib) que prolongan la supervivencia de los pacientes18,19.
El objetivo de este trabajo es analizar los factores pronósticos que influyen en la supervivencia y en la recidiva de una serie de 95 pacientes diagnosticados de TNEP e intervenidos mediante resección quirúrgica.
MétodosSe ha realizado un estudio retrospectivo de 130 pacientes diagnosticados de TNEP en 22 años. Se han considerado inoperables 24 pacientes por su extensión tumoral e irresecables 11 pacientes por invasión del tronco celíaco y de la arteria mesentérica superior o por carcinomatosis peritoneal. Los 95 pacientes restantes, intervenidos y resecados, constituyen el objeto de nuestro trabajo. Los casos que presentaban signos, síntomas y alteraciones analíticas hormonales, se denominaron tumores funcionantes (TF) y fueron clasificados en función de la alteración hormonal que predominaba. Aquellos en los que no se estableció bioquímicamente una alteración hormonal ni un síndrome clínico específico se clasificaron como tumores no funcionantes (TNF). Respecto a la forma de presentación, los TNEP pueden aparecer de forma aislada sin asociarse a ninguna otra enfermedad o formando parte de un síndrome MEN 1. En nuestra serie, al tratarse de un estudio retrospectivo, los pacientes incluidos en el estudio con TNEP asociado a síndrome MEN 1 familiar fueron diagnosticados previamente de dicho síndrome mediante el estudio genético del gen MEN 1. Este gen está asociado con la región cromosómica 11q13 y se trata de un gen supresor que está formado por 10 exones. El estudio genético se realizó a partir del ADN genómico obtenido de una muestra de sangre periférica del sujeto y sus familiares. El estudio del gen MEN 1 se realizó por secuenciación de los exones 2 a 10 y de las uniones intrón-exón. Las metástasis hepáticas pueden ser sincrónicas o metacrónicas. Además, se ha utilizado la clasificación tumoral de la OMS de 201015. En esta nueva clasificación los TNEP se clasifican en: a) G1 o de bajo grado b) G2 o de grado intermedio y c) G3 o carcinoma pobremente diferenciado. Con el fin de analizar los factores pronósticos que influyen en la supervivencia y en la recidiva de los TNEP estudiamos las siguientes variables: la edad, el sexo, forma de presentación (esporádica/familiar), funcionalidad o no del tumor, localización, tamaño del tumor, metástasis, tipo de cirugía realizada y clasificación de la OMS (2010).
En cuanto a los métodos, se realizaron las siguientes determinaciones analíticas en función de la alteración hormonal diagnosticada: 1) En los insulinomas fueron patológicos niveles séricos de glucemia inferiores a 50mg/dl. Además, se obtuvieron los niveles séricos basales de insulina y péptido C y tras un test del ayuno. 2) En los gastrinomas, se estudiaron niveles séricos de gastrina basal y tras estimulación con secretina, así como determinaciones de pH gástrico. 3) En los vipomas se determinaron los niveles séricos de VIP, en los glucagonomas los niveles séricos de glucagón, en los somatostinomas los niveles séricos de somatostatina y en el VIPoma los niveles séricos de polipéptido pancreático. Otras determinaciones analíticas fueron: el 5-OH indolacético en orina, la cromogranina A en sangre y los siguientes marcadores tumorales: CEA, Ca 19.9 y el Ca 125.
En nuestra serie, se realizó una ecografía abdominal en el 68,4% de los casos (65 pacientes) y una TAC en los 95 pacientes. La RMN se realizó en el 27,3% de los casos (26 pacientes) y la ecoendoscopia en el 34,7% de los casos (33 pacientes). Utilizando las pruebas de imagen, en el 24,2% (23 casos) se realizó una PAAF de la tumoración. Por último, la PET-TAC fue realizada en el 29,4% de los casos (28 pacientes) y solo en el 23% un octreoscan (9 pacientes).
Análisis estadísticoEl programa estadístico utilizado es el IBM SPSS (Statistical Package for Social Sciences Inc, Chicago, Illinois, EE. UU.) versión 19.0 para Mac.20. Se ha realizado una estadística descriptiva, un análisis de tablas de contingencia mediante el test de chi2 cumplimentado con el análisis de residuos, un test de la t de Student y un análisis de regresión logística. Las curvas de supervivencia se han calculado mediante el método de Kaplan-Meier y el test de log-rank ha servido para analizar las diferencias entre ellas. Se consideró nivel de significación el valor p<0,05.
ResultadosEn nuestra serie, 56 de los 95 casos fueron TNF (59%) y los 39 restantes TF (41%), de los cuales 20 eran insulinomas, 16 eran gastrinomas y 3 eran glucagonomas. La edad media fue de 47,6±16,3 años (rango 17-81), sin diferencias estadísticamente significativas (ES) entre TF y TNF. Respecto al sexo, 45 eran varones (47,3%) y 50 eran mujeres (52,7%). En los TF, 19 eran varones y 20 mujeres y en los TNF, 24 eran varones (42,9%) y 32 mujeres (57,1%). En nuestra serie, 66 casos (69,8%) eran formas esporádicas y 29 casos restantes (30,2%) tenían una presentación familiar asociada al síndrome MEN 1.
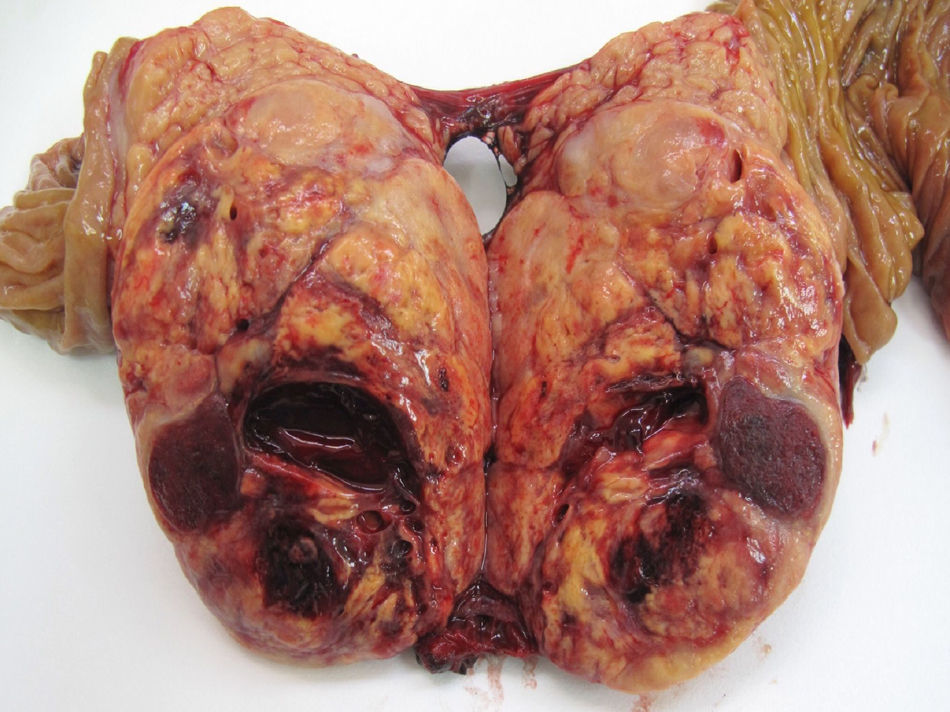
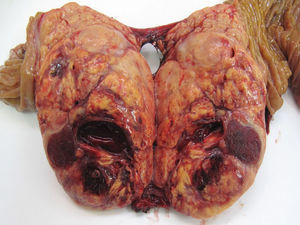
Respecto a la localización, el 51,5% de los casos estaba en cuerpo y cola de páncreas (49 casos), en 30 pacientes (31,7%) fue multifocal y en 16 pacientes (16,8%) estaba en la cabeza pancreática. De los 39 TF, 20 casos se localizaron en cuerpo y cola, 11 casos eran multifocales y los 8 restantes estaban en la cabeza pancreática. De los 56 TNF, 29 casos se localizaron en cuerpo y cola, 19 casos tenían distribución multifocal y los 8 restantes estaban en la cabeza del páncreas. El 72,7% (48 casos) de las formas esporádicas son unifocales, con significación estadística respecto a la forma familiar (p<0,001). El tamaño tumoral medio fue de 3cm (0,4-11cm). Si diferenciamos entre funcionantes y no funcionantes, el tamaño medio de los TF fue de 2,4cm (rango: 0,4-8cm) y en los TNF fue de 3,5cm (rango: 1,2-11cm), con diferencias ES (p<0,001). Respecto a la clasificación histológica, en 59 casos hay un TNEP G1 o de bajo grado (62,1%) (fig. 1), en 24 casos hay un TNEP G2 o de grado intermedio (25,2%) y en 12 casos hay un TNEP G3 o carcinoma pobremente diferenciado (12,6%).
En nuestra serie se realizaron las siguientes técnicas quirúrgicas: 1) una pancreatectomía corporocaudal en 42 casos (44,2% de la serie); 2) una duodenopancreatectomía cefálica en 13 casos (13,7%); 3) una enucleación tumoral en 19 casos (20%), de los que 12 pacientes (12,6%) fueron tratados mediante laparotomía subcostal bilateral y los 7 restantes (7,3%) mediante abordaje laparoscópico; 4) una pancreatectomía corporocaudal + enucleación en 14 casos (14,7%) y 5) una duodenopancreatectomía total en 7 pacientes (7,3%). Además, en 3 de los 7 casos (3,1%) se asoció una resección de vena porta y se realizó una anastomosis terminoterminal (2 casos) y se colocó un injerto de goretex en el caso restante. Respecto al tratamiento de las metástasis hepáticas (17 casos evidenciados), se realizó resección hepática en 7 casos (7,3% de la serie) y trasplante hepático en los 10 casos restantes (10,5% de la serie). Los 10 pacientes tenían tumores esporádicos de bajo grado que no pudieron resecarse al existir multiples metástasis en ambos lobulos hepáticos. Tres de los 10 pacientes tuvieron recidiva entre 18 y 24 meses postrasplante, que fueron tratados con fármacos análogos de la somatostatina.
En nuestra serie, 36 de los 95 pacientes (37,9%) presentaron complicaciones, de los que 25 eran TNF (26,3% de la serie) y los 11 restantes, TF (11,6% de la serie). Las más frecuentes fueron: infecciones de herida quirúrgica en 11 casos (11,6%), hemorragia abdominal postoperatoria en 10 casos (10,5%) y fístula pancreática en 8 casos (2 de 13 duodenopancreatectomías cefálicas y 6 de 42 pancreatectomías corporocaudales). Según la clasificación de Dindo-Clavien21, 8 casos son de grado I, 10 casos de grado II, 12 casos de grado III (5 en IIIA y 7 en IIIB), 5 casos de grado IV y el caso restante de grado V. En cuanto a la mortalidad postoperatoria, solo un paciente falleció por sepsis abdominal secundaria a fístula pancreática y pertenecía a los TNEP no funcionantes.
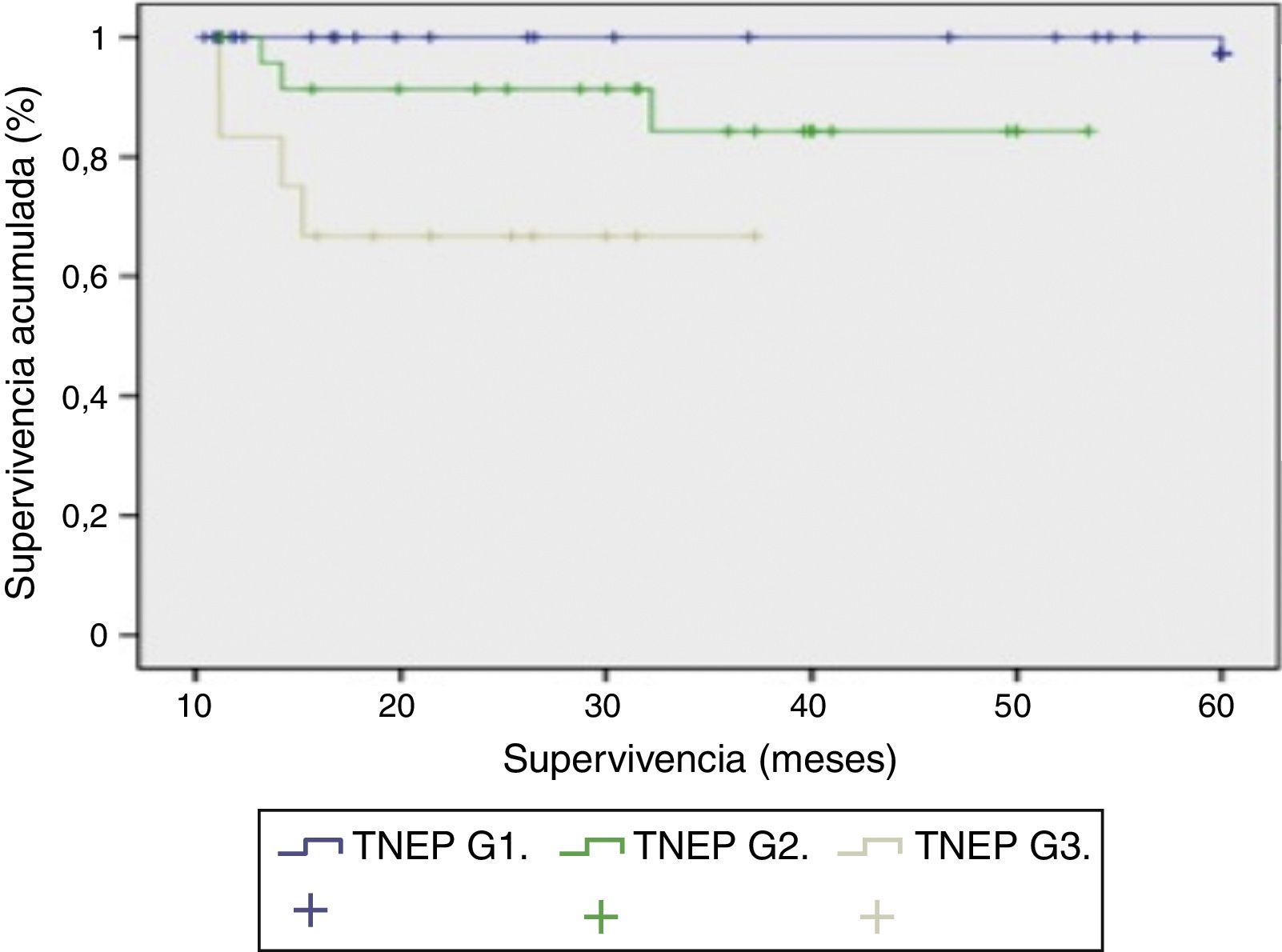
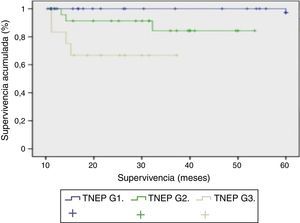
Respecto a la evolución clínica, el seguimiento medio fue de 85,3 meses (rango: 4-240 meses). Durante este seguimiento la tasa de supervivencia fue del 65,8%, con una mortalidad del 34,2% y la tasa de recidiva tumoral fue del 24%. Al estudiar la relación entre funcionalidad y forma de presentación encontramos que los pacientes con presentación esporádica (66 pacientes) eran funcionantes en 23 casos y no funcionantes en 43 casos. Mientras que en los de presentación familiar eran no funcionantes en 13 casos y funcionantes en 16 casos. Si analizamos la clasificación de la OMS (2010) con la supervivencia podemos determinar la supervivencia de los pacientes en función de su grado de diferenciación tumoral con diferencias ES entre las 3 curvas (p<0,001). En la figura 2, los TNEP G1 tienen una supervivencia del 100% a los 5 años. En los TNEP G2 la supervivencia a los 30 meses es del 90% y a los 5 años del 85%. El peor pronóstico lo objetivamos en los TNEP G3 o carcinomas pobremente diferenciados, cuya supervivencia a los 40 meses es del 65%.
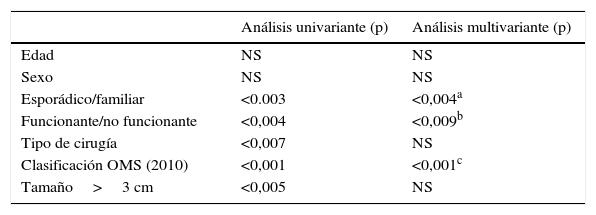
Respecto a los factores pronósticos de supervivencia (tabla 1), ni la edad ni el sexo influyen en la supervivencia. Sin embargo, la forma de presentación, esporádica o familiar, constituye un factor pronóstico de supervivencia, ya que los casos de presentación esporádica se asocian a peor pronóstico que los familiares (p<0,004), odds ratio (OR) de 1,53, con un IC 95%: 0,87-2,69). Tambien la funcionalidad del tumor (funcionante/no funcionante) es un factor determinante de la supervivencia (p<0,001; OR 1,91; IC 95%: 0,95-3,84). Por el contrario, el tipo de cirugía realizada y el tamaño medio del tumor son valores ES en el estudio univariante, mientras que en el estudio multivariante no son factores pronósticos ES. La clasificación de la OMS (2010) sí supone un factor pronóstico determinante en la supervivencia de la TNEP tanto en el estudio univariante como en el multivariante. Cuanto menor es el grado de diferenciación tumoral, peor es el pronóstico (p<0,001; OR 0,59; IC 95%: 0,48-0,74).
Factores pronósticos de supervivencia en una serie de 95 pacientes resecados
| Análisis univariante (p) | Análisis multivariante (p) | |
|---|---|---|
| Edad | NS | NS |
| Sexo | NS | NS |
| Esporádico/familiar | <0.003 | <0,004a |
| Funcionante/no funcionante | <0,004 | <0,009b |
| Tipo de cirugía | <0,007 | NS |
| Clasificación OMS (2010) | <0,001 | <0,001c |
| Tamaño>3 cm | <0,005 | NS |
IC: intervalo de confianza; NS: no significativo; OR: odds ratio.
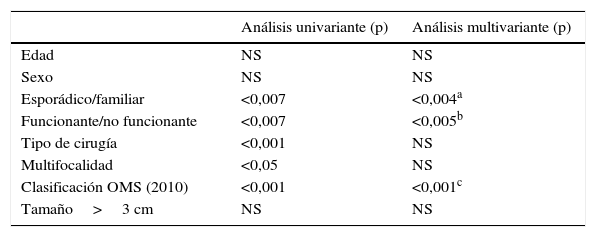
Si analizamos los factores pronósticos en la recidiva tumoral (tabla 2), la edad y el sexo no tienen significado estadístico. El tipo de cirugía realizado y la multifocalidad no son ES en los análisis multivariantes, aunque sí en el análisis univariante. Solo la forma de presentación esporádica o familiar (p<0,004; OR 1,42; IC 95%: 1,08-1,87), la funcionalidad o no del tumor (p<0,005; OR 0,66; IC 95%: 0,46-0,93) y la clasificación de la OMS (2010) (p<0,001; OR 1,61: IC 95%: 1,20-2,17) presentan valores ES en el análisis univariante y multivariante y son factores pronósticos de recidiva tumoral.
Factores pronósticos de recidiva en una serie de 95 pacientes resecados
| Análisis univariante (p) | Análisis multivariante (p) | |
|---|---|---|
| Edad | NS | NS |
| Sexo | NS | NS |
| Esporádico/familiar | <0,007 | <0,004a |
| Funcionante/no funcionante | <0,007 | <0,005b |
| Tipo de cirugía | <0,001 | NS |
| Multifocalidad | <0,05 | NS |
| Clasificación OMS (2010) | <0,001 | <0,001c |
| Tamaño>3 cm | NS | NS |
IC: intervalo de confianza; NS: no significativo; OR: odds ratio.
Los TNEP son neoplasias muy poco frecuentes que tienen su origen en las células de los islotes de Langerhans. Pueden aparecer en cualquier momento de la vida, pero su máxima incidencia es entre la 4.ª y 5.ª décadas1,5,12. Sin embargo, si está asociado un síndrome MEN 1 suelen aparecer, generalmente, antes de los 40 años22,23. En nuestra serie, la edad media fue de 47,6 años con ligero predominio femenino (52,7%) con respecto al masculino (47,3%) lo que coincide con las series publicadas4,5,11. Los TNEP suelen presentarse de forma aislada, pero en el 10-15% de los casos están asociados a un síndrome MEN 1, a un von Hippel-Lindau, a una neurofibromatosis tipo 1 o a una esclerosis tuberosa22–24. El 80-90% de los pacientes con síndrome MEN 1 desarrollarán un TNEP a lo largo de su vida: serán en un 60% TF (generalmente gastrinomas e insulinomas) y, en el 40% restante serán TNF22,25,26. En nuestra serie, los TNEP eran esporádicos en el 69,8% de los casos y asociados al síndrome de MEN 1 en el 30,2% restante.
La utilización de pruebas de imagen (TAC, RMN, etc.) con una mayor sensibilidad ha permitido que, en los últimos años, los TNEP sean diagnosticados más frecuentemente27–29. Así, Thoeni et al.27 señalan que, en su serie de 28 pacientes con sospecha de TNEP, la RMN tiene una sensibilidad del 85% y una especificidad del 100%. Dromain et al.28, en una serie de 64 pacientes que presentaban metástasis hepáticas por TNEP, señalan que la RMN mostró mayor número de lesiones hepáticas que la TAC y el octroescan. Manfredi et al.29 correlacionan los resultados obtenidos con la RMN y el comportamiento biológico de los TNF, estableciendo la malignidad en función de la hiperintensidad y la vascularización de la lesión en T2. En su experiencia, señalan una sensibilidad del 93,3% para detectar tumores de comportamiento maligno. Otras técnicas, como la ultrasonografía endoscópica (USE), han demostrado su utilidad para la detección de lesiones incluso de 2-3mm. Rosch et al.30 y Khashab et al.31 publican una mayor sensibilidad de la USE para la detección de este tipo de tumores con respecto a la TAC, así como para la detección y localización de TNEP en pacientes con síndrome de MEN 132. Para la mayoría de los autores30–35, la USE es una prueba de alta sensibilidad en la detección de los TNEP, que ayuda al diagnóstico histológico, ya que permite la toma de biopsias. En nuestra serie, se ha utilizado sistemáticamente desde que fue implantada en el hospital: es muy útil para determinar la localización y tamaño de la lesión, así como para la toma de biopsia para el estudio histológico previo a la cirugía. En cuanto al octreoscan o la gammagrafía de receptores de somatostatina puede ser útil en el diagnóstico de los TF, aunque los insulinomas, que son los más frecuentes, expresan escasos niveles de receptores de somatostatina. Además, el octreoscan puede ser útil para detectar metástasis a distancia36–38. En cuanto a la PET-TAC con 18F-dihidroxi-fenil-alanina, tiene una mayor sensibilidad (90-97%) para la detección y estadificación de los TNEP39–42 que la gammagrafía y nos permite detectar lesiones de menor tamaño. En nuestra serie, la PET-TAC se ha realizado en el 29,5% de la serie.
Respecto al tratamiento, la cirugía es el tratamiento de elección si se puede resecar la tumoración43–45. El tipo de cirugía depende del tamaño y la localización dentro de la glándula pancreática. Así, en los tumores bien delimitados y de pequeño tamaño, consiste en una enucleación tumoral, mientras que en los tumores que presentan una distribución multifocal debe realizarse una pancreatectomía total. Recientemente, se ha propuesto el abordaje laparoscópico, sobre todo en los tumores inferiores a 3cm y localizados en la cola pancreática46-48. Un metaanálisis realizado por Drymousis et al.49, en el que se incluyen 11 trabajos con un total de 906 casos, recoge que el 22% fueron tratados con cirugía laparoscópica y el 78% con cirugía abierta. Tras comparar el tiempo quirúrgico, la duración de la estancia hospitalaria, la pérdida de sangre intraoperatoria, la morbilidad postoperatoria, las tasas de fístula pancreática y la mortalidad, señalan que la cirugía laparoscópica es una técnica segura en manos expertas y se asocia a una menor tasa de complicaciones y a una menor estancia hospitalaria que la cirugía abierta. En nuestra serie, el 52% de los casos se localizaron en cuerpo y cola, el 32% tuvo una localización multifocal y el 16% restante se localizó en la cabeza pancreática. En función de la resecabilidad y localización de los tumores, las técnicas quirúrgicas más frecuentes fueron la pancreatectomía corporocaudal en 42 casos y la enucleación en 19 casos. El abordaje laparoscópico se realizó en el 7,3% de los casos.
En los TNEP, las metástasis suelen localizarse en el hígado. La capacidad de extensión metastásica viene determinada por el tipo histológico y el índice proliferativo del tumor. Además, tienen un comportamiento biológico peculiar, ya que la enfermedad metastásica suele quedar confinada al hígado durante largos períodos con tasas de supervivencia, aun sin ser tratados, de alrededor del 30% a los 5 años50,51. El tratamiento viene determinado por el número de metástasis y su distribución. Las técnicas quirúrgicas consisten en la resección hepática o en la realización de un trasplante hepático. La resección hepática es el tratamiento de elección con intención curativa, siempre y cuando no exista afectación bilobar difusa, función hepática deteriorada o metástasis extrahepáticas. Sarmiento et al.52 en una serie de 170 pacientes intervenidos mediante resección hepática por metástasis hepáticas de TNEP describen una supervivencia libre de enfermedad a largo plazo de hasta el 20%. En esta serie hay una mejoría clínica en el 90% de los casos, aunque la tasa de recidiva es del 84% y la supervivencia a 5 y 10 años fue del 61 y del 35%, respectivamente. En cuanto al trasplante hepático, Lehnert et al.53 indican que debe realizarse en pacientes jóvenes, sintomáticos, con mala respuesta al tratamiento farmacológico y en ausencia de enfermedad extrahepática. Gedaly et al.54 publican un informe de la United Network for Organ Sharing (UNOS) en el que se realizaron 150 trasplantes hepáticos en pacientes con tumores neuroendocrinos y enfermedad metastásica hepática entre 1988 y 2008. En esta serie, la supervivencia de los pacientes al año, a los 3 y a los 5 años fue del 81, del 65 y del 49%, respectivamente. Estas tasas de supervivencia fueron comparables a las de un grupo de 4.693 pacientes trasplantados por carcinoma hepatocelular durante el mismo período de tiempo. Sin embargo, la mayoría de los pacientes con tumores neuroendocrinos tratados con trasplante hepático presentan recidiva de la enfermedad55–57. En nuestra serie se han detectado metástasis hepáticas en 17 casos: en 7 casos se realizó una resección hepática y en 10 pacientes, un trasplante hepático.
El pronóstico de los TNEP es difícil de determinar y la dificultad reside en definir la benignidad o malignidad de la enfermedad. Se han descrito numerosas clasificaciones de los TNEP y la más utilizada es la publicada por la OMS en 201015. Basándonos en esta clasificación, en nuestra serie el 62,1% de los casos (59 pacientes) son tumores endocrinos bien diferenciados, el 25,2% (24 casos) son carcinomas endocrinos bien diferenciados y en el 12,6% restante (12 casos) son carcinomas endocrinos pobremente diferenciados. Algunos autores58 consideran que en los TNF hay una estrecha relación entre el tamaño tumoral y el riesgo de malignidad, que se incrementa para tumores mayores de 2cm. Bilimoria et al.59, en una serie de 3.851 pacientes, tras un análisis multivariante, consideran que la edad, el grado del tumor y las metástasis son los factores más significativos que influyen en la supervivencia.
Generalmente, la supervivencia de los TNEP a los 5 y a los 10 años es del 65 y del 45%, respectivamente60. En los TF la supervivencia a los 5 años es del 80%, frente al 55% de los TNF. Para diversos autores61–63, la cirugía de resección definitiva del tumor primario, la presencia de metástasis hepáticas y su tratamiento son factores que influyen en la supervivencia de los pacientes con TNEP. Yang et al.64 señalan que el tipo histológico, el índice de proliferación Ki-67, el tamaño, la localización, la edad del paciente, la clasificación TNM y la clasificación de la OMS del 2010 son factores pronósticos que influyen en la supervivencia de los TNEP.
En nuestra serie, los tumores pobremente diferenciados tienen peor pronóstico que los tumores bien diferenciados, ya que tienen una supervivencia a los 5 años inferior al 65% mientras que la supervivencia es del 100% a los 5 años en los tumores bien diferenciados. Además, la tasa de recidiva tumoral es mayor en los pobremente diferenciados. También encontramos que los tumores esporádicos presentan una supervivencia menor que los TNEP asociados a síndrome MEN 1. Esto se debe a que los esporádicos son TNF con más frecuencia que los familiares, su diagnóstico es más tardío y con mayor probabilidad de extensión de la enfermedad.
En conclusión, en nuestra experiencia son factores pronósticos de recidiva tumoral y de supervivencia la forma de presentación, la funcionalidad del tumor y la clasificación de la OMS del año 2010, ya que cuanto menor es el grado de diferenciación tumoral, peor es el pronóstico.
Autoría/colaboraciones- 1.
Diseño del estudio. En este apartado han participado: Sánchez Bueno, Francisco; Rodríguez González, José Manuel; Torres Salmerón, Gloria y Parrilla Paricio, Pascual.
- 2.
Adquisición y recogida de datos. En este apartado han participado Sánchez Bueno, Francisco; Rodríguez González, José Manuel; Torres Salmerón, Gloria; Bernabé Peñalver, Antonio y Balsalobre Salmeron, María.
- 3.
Análisis e interpretación de los resultados. En este apartado han participado Sánchez Bueno, Francisco; Rodríguez González, José Manuel; Balsalobre Salmerón, María; de la Peña Moral, Jesús y Fuster Quiñonero, Matilde.
- 4.
Redacción del artículo. En esta apartado han participado Sánchez Bueno, Francisco; Rodríguez González, José Manuel; Torres Salmerón, Gloria y Bernabé Peñalver, Antonio.
- 5.
Revisión crítica y aprobación de la versión final. En este apartado han participado Sánchez Bueno, Francisco; Rodríguez González, José Manuel y Parrilla Paricio, Pascual.
Declaramos que no hay conflicto de intereses en ninguno de los autores.
1) A la Dra. María Antonia Claver del Servicio de Medicina Nuclear.
2) Al Dr. Eduardo Ortiz del Servicio de Anatomía Patológica.