Con la finalidad de disminuir las deformidades de la mama después de la cirugía conservadora del cáncer, presentamos una nueva técnica de reconstrucción mamaria mediante la restitución del volumen mamario con gel de plaquetas.
Pacientes y métodosEstudio piloto de 20 pacientes con cáncer de mama sometidas a tumorectomía a las que se aplicó en el espacio residual el gel obtenido por plaquetoaféresis de donante alogénico sano. A las pacientes se les realizó un seguimiento clínico, iconográfico e histológico, así como una valoración del resultado estético.
ResultadosLa edad media fue de 50,5±8,65 años (rango 42-70 años) y la mediana del índice de comorbilidad de Charlson fue de 1,15±1,27 (rango 0-5). El volumen medio de la tumorectomía fue de 63,1±31,1ml (rango 30-160ml) y el volumen de restitución con el gel de plaquetas fue de 111,5±60,9ml (rango 40-250ml). Después de una mediana de seguimiento de medio de 17 meses, el 80% de las pacientes preservaron el volumen mamario y no fueron necesarias reintervenciones por afectación de los márgenes quirúrgicos ni se observaron recidivas.
ConclusionesEl gel de plaquetas permite restituir el volumen mamario ajustado al volumen de la tumorectomía, minimizando las retracciones y deformidades habituales de la cirugía conservadora, lo que permite realizar resecciones amplias con márgenes oncológicos de seguridad.
With the aim of decreasing breast defects after conservative cancer surgery, we present a new breast reconstruction technique using breast volume restitution with platelet gel.
Patients and methodA pilot study was conducted on 20 breast cancer patients undergoing tumorectomy with placement a gel obtained by plateletpheresis of a healthy allogeneic donor in the surgical cavity. Patients had a clinical, photographic and histological follow-up, as well as an assessment of the aesthetic outcome.
ResultsThe mean age was 50.5±8.6 years (range 42-70 years) and with a mean Charlson comorbidity index of 1.1±1.2 (range 0-5). The mean tumour volume was 63.1±31.1ml (range 30-160ml) and the mean restitution volume with platelet gel was 111.5±60.9ml (range 40-250ml). After a mean follow-up of 17 months, 80% of the patients maintained the breast volume and no further operations were needed due to surgical margin involvement. No recurrences were observed in any patient.
ConclusionsPlatelet gel allows restitution of the breast volume adjusted to the tumorectomy volume, minimising the usual retractions and deformities after conservative surgery. It enables wide resections and safety margins.
La cirugía conservadora de la mama es actualmente la opción quirúrgica más utilizada para tratar el cáncer de mama a pesar de que no está exenta de secuelas estéticas1.
El interés por sustituir el volumen extirpado de la mama no es nuevo. Los primeros intentos para controlar estos defectos datan de finales del siglo xix, cuando Vicenz Czerny trasplantó, en 1895, un lipoma para rellenar el hueco dejado por el tumor que había sido extirpado2. En 1954 Pagman y Wallace utilizaron la esponja de alcohol de polivilino con la misma intención3. No obstante, este tipo de iniciativas cayeron en desuso ya que su aplicación se acompañaba de secuelas estéticas similares a las de la propia tumorectomía.
Sin embargo, gracias a los avances tecnológicos, en los últimos años se han desarrollado diversas técnicas con este propósito. Ejemplos de ello son los colgajos glandulares, que consisten en la interposición de tejido adiposoglandular propio de la mama en el defecto mamario4; las técnicas oncoplásticas, que permiten remodelar la mama conservando su integridad estética aun a costa de perder volumen, por lo que con frecuencia deben acompañarse de una cirugía en la mama contralateral para mantener la simetría5,6; los colgajos de omento, obtenidos por laparoscopia para los tumores inferiomediales de la mama7; los colgajos miocutáneos de dorsal ancho, indicados en tumorectomías de cuadrantes externos8 y obtenidos también por vía endoscópica9; y los colgajos de músculo pectoral mayor y menor para las tumorectomías de los cuadrantes superiores de la mama10. Otras técnicas recientes intentan, en un segundo tiempo quirúrgico, paliar las deformidades mediante la inyección de células adiposas, como el lipofilling11.
El plasma rico en plaquetas (PRP) se está utilizando con fines terapéuticos en cirugía maxilofacial, en estomatología, en heridas y úlceras crónicas isquémicas o diabéticas, en oftalmología para la regeneración macular así como sellante y hemostático12–15. Las plaquetas, que no presentan rechazo inmunológico alogénico por no expresar el antígeno HLA tipo ii, son una fuente natural de factores de crecimiento que se liberan tras la degranulación plaquetar. Algunos de ellos como el factor de crecimiento derivado de las plaquetas (PDGF), factor de crecimiento epidérmico (EGF), factor de crecimiento del endotelio vascular (VEGF), factor de crecimiento básico fibroblasto (bFGF), factor de crecimiento insulina (IGF-1), factor de crecimiento del tejido conectivo (CTCF) están implicados en la regeneración tisular. Entre las moléculas secretadas por las plaquetas, también encontramos factores de señalización paracrina como citoquinas, neurotrofinas, derivados del ácido araquidónico, así como histamina y otros aminoácidos. Todas estas señalizaciones tienen un efecto global de reparación tisular plasmada en 3 fases principales: la fase de hemostasia e inflamación local (primeras 72h), la fase de proliferación celular (del 4.° al 7.° día) y por último, la fase de remodelación celular (entre el 7.° y el 14.° día)16–18.
El presente trabajo plantea una nueva aplicación del PRP que consiste en restituir el volumen mamario mediante su gelificación e implante inmediato en la cavidad residual tras la tumorectomía. A este procedimiento lo denominamos «cirugía restitutiva del volumen».
Pacientes y métodosPacientes y diseño del estudioEstudio piloto en pacientes con tumores de mama, sometidas a cirugía conservadora, en el Hospital Universitario Germans Trias i Pujol de Badalona entre diciembre del 2008 y septiembre del 2009. El estudio que se presenta incluye las 20 primeras pacientes con un periodo de seguimiento medio de 17 meses, tras haber sido aceptado por el Comité Ético del Hospital.
Criterios de inclusión- -
Carcinomas unilaterales apropiados para un tratamiento quirúrgico conservador (cualquier tipo histológico).
- -
Neoplasias benignas unilaterales adecuadas para una tumorectomía (cualquier tipo histológico).
- -
Independiente de la afectación ganglionar (N0, N1, N2 y N3).
- -
Cualquier volumen mamario.
- -
Aceptación voluntaria para participar en el estudio y firma del consentimiento informado.
- -
Multicentricidad.
- -
Infección activa en la zona quirúrgica.
- -
Alteraciones de la coagulación o toma de anticoagulantes.
- -
Ausencia de un entorno personal y social propicio para el control y seguimiento de las pacientes.
- -
Enfermedad psiquiátrica o condición personal que no permita la comprensión o aceptación de participar en el estudio.
A todas las pacientes se les realizó un estudio de extensión preoperatorio por imagen con mamografía, ecografía mamaria y resonancia magnética nuclear (RMN), para descartar multicentricidad y valorar el volumen de resección así como la localización exacta de la lesión. La comorbilidad de las pacientes se evaluó mediante el índice de Charlson19.
Antes de la intervención quirúrgica se administró la profilaxis antibiótica según protocolo hospitalario. Se realizó la tumorectomía y la biopsia del ganglio centinela en los casos indicados. Una vez extraído el tumor con márgenes quirúrgicos adecuados, se procedió al cálculo de su volumen por inmersión.
Preparación y colocación del gel de plaquetasLas plaquetas utilizadas para el estudio procedían de donante voluntario alogénico sano siguiendo la recomendación del Comité de Ética que desaconsejó el uso de plaquetas autólogas en pacientes neoplásicos. Todos los donantes debían cumplir los siguientes criterios de inclusión validados por el mismo Comité Bioético y el Banco de Sangre y Tejidos (BST): serología infecciosa negativa y ausencia de trombocitopenia, anemia y de dificultad de acceso a vía periférica. El donante se sometió a plasmaféresis el día previo a la intervención.
Para la preparación del gel de plaquetas, el equipo del BST extrajo un volumen predeterminado de PRP del donante (entre 200 y 400ml/sesión de plaquetoaféresis) el día previo a la intervención. Una vez en quirófano y en medio estéril in vitro, se consiguió su gelificación. Posteriormente se procedió a insertar el gel de plaquetas en la cavidad residual cerrando por planos de forma estanca.
Seguimiento clínicoSe diseñó una base de datos para el registro de la evolución postoperatoria de cada paciente, anotando la aparición de complicaciones locales y sistémicas postoperatorias (fiebre, seroma, hematoma u otro signo de infección) y un registro fotográfico con cámara digital (anteroposterior, perfil y oblicuo) preoperatorio y postoperatorio inmediato con luz ambiente sobre fondo de talla verde quirúrgica. Los registros posteriores se realizaron en consultas externas a la semana, al mes, a los 3 meses, a los 6 meses y anualmente.
El seguimiento oncológico incluyó un registro iconográfico comparativo con ecografía cada 3 meses, mamografía y RMN a los 6 meses y al año y, posteriormente, seguimiento anual. Al año de la intervención se realizó un estudio anatomopatológico de la zona quirúrgica en la que se implantó el gel de plaquetas, mediante punción con aguja gruesa y tinción con hematoxilina-eosina.
Evaluación del resultado estético de la mamaEn el primer control anual, se evaluó el resultado estético de la mama tras la intervención quirúrgica mediante la escala de Clough modificada20 que valora el volumen, el perfil, las retracciones y la simetría de las mamas. Los posibles resultados de esta escala son los siguientes: ausencia de deformidades (AD); tipo i: el aspecto general de la mama operada se mantiene, no hay deformidad, hay asimetría mamaria, en forma y/o volumen de la mama operada comparada con la mama sana contralateral), tipo ii: la mama operada presenta una deformidad importante que puede ser corregida sin necesidad de realizar una mastectomía; tipo iii: la deformidad mamaria es tan importante que el tejido mamario conservado no puede ser preservado, la única opción para restablecer la forma y la simetría mamaria es la mastectomía con reconstrucción mamaria inmediata.
Análisis estadísticoLos valores se expresan como media + - desviación estandar (DE) excepto aquellos que no cumplen criterios de normalidad que se expresan como mediana y rango intercuartil (percentil 25-75). Para el análisis estadístico de los datos se utilizó el programa Prism 5 v 5.0b 2009 GraphPad Software, Inc.
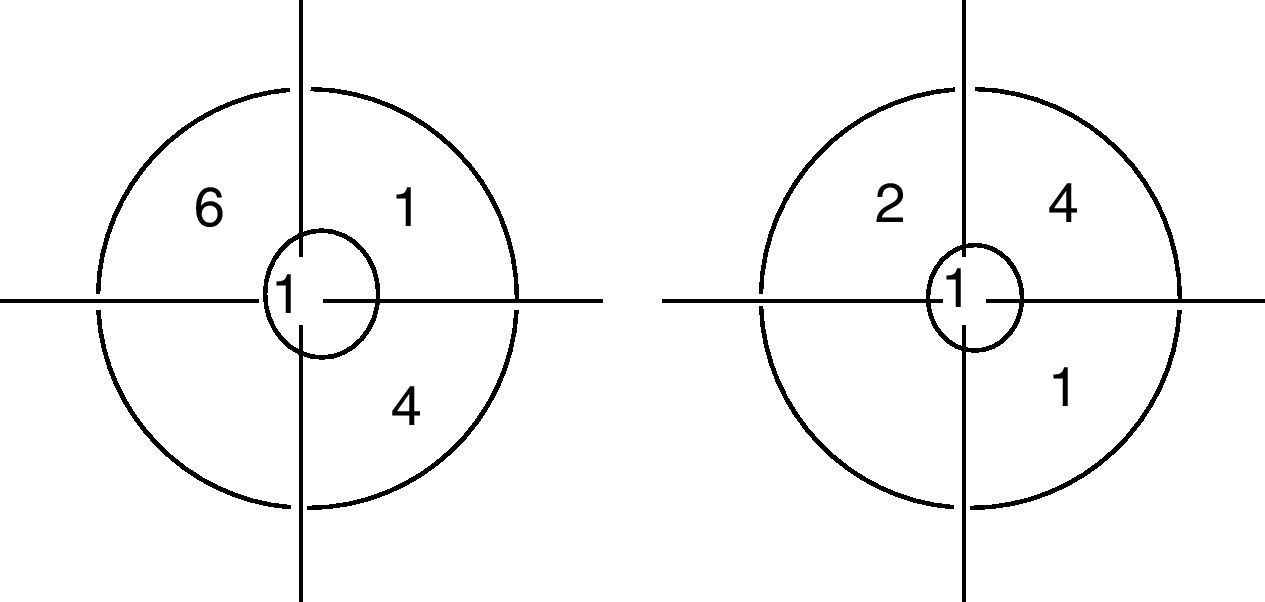
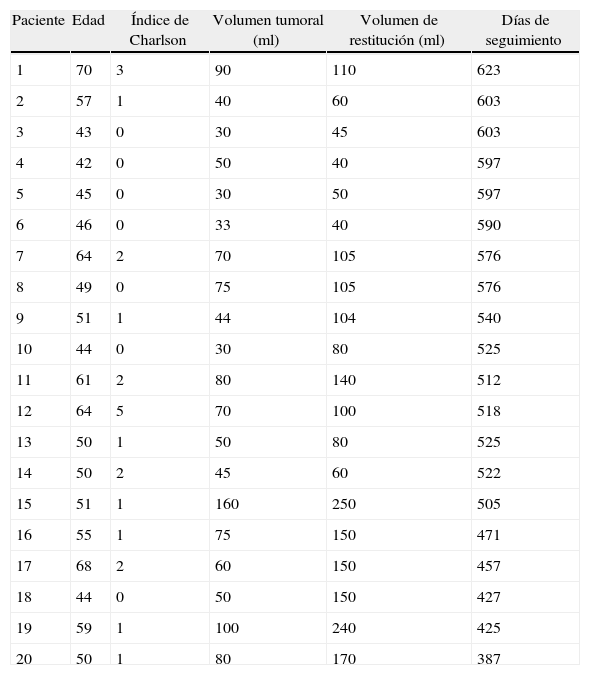
ResultadosDurante el periodo de estudio 20 mujeres fueron tratadas con esta técnica reconstructiva de la mama. La edad media fue de 50,5±8,65 años (rango, 42-70 años). El índice medio de comorbilidad de Charlson19 fue de 1,15±1,27 (rango 0-5). En 18 de los 20 casos la indicación quirúrgica fue por enfermedad maligna y en 2 casos por enfermedad benigna. El seguimiento medio fue de 17 meses (529±68,17 días, rango 387-623, IC95%: 497-560). La figura 1 muestra la distribución de los tumores en los distintos cuadrantes de la mama. El volumen medio de las tumorectomías fue de 63,10±31,09ml (rango 30-160ml, IC95%: 48,55-77,65) y el volumen de restitución de plaquetas fue de 111,50±60,86ml (rango 40-250ml, IC95%: 82,97-139,90) (tabla 1).
Localización de los tumores en los diferentes cuadrantes (1 en cuadrante superior interno de la mama derecha, 6 en cuadrante superior externo de la mama derecha, 4 en el cuadrante inferior interno de la mama derecha, 2 en el cuadrante superior interno de la mama izquierda, 4 en cuadrante superior externo de la mama izquierda y 1 en el cuadrante inferior externo de la mama izquierda) y en 2 casos retroareolar (1 en la mama derecha y 1 en la mama izquierda).
Relación de edades, índice de Charlson, volúmenes tumorales y de restitución plaquetar y días de seguimiento
| Paciente | Edad | Índice de Charlson | Volumen tumoral (ml) | Volumen de restitución (ml) | Días de seguimiento |
| 1 | 70 | 3 | 90 | 110 | 623 |
| 2 | 57 | 1 | 40 | 60 | 603 |
| 3 | 43 | 0 | 30 | 45 | 603 |
| 4 | 42 | 0 | 50 | 40 | 597 |
| 5 | 45 | 0 | 30 | 50 | 597 |
| 6 | 46 | 0 | 33 | 40 | 590 |
| 7 | 64 | 2 | 70 | 105 | 576 |
| 8 | 49 | 0 | 75 | 105 | 576 |
| 9 | 51 | 1 | 44 | 104 | 540 |
| 10 | 44 | 0 | 30 | 80 | 525 |
| 11 | 61 | 2 | 80 | 140 | 512 |
| 12 | 64 | 5 | 70 | 100 | 518 |
| 13 | 50 | 1 | 50 | 80 | 525 |
| 14 | 50 | 2 | 45 | 60 | 522 |
| 15 | 51 | 1 | 160 | 250 | 505 |
| 16 | 55 | 1 | 75 | 150 | 471 |
| 17 | 68 | 2 | 60 | 150 | 457 |
| 18 | 44 | 0 | 50 | 150 | 427 |
| 19 | 59 | 1 | 100 | 240 | 425 |
| 20 | 50 | 1 | 80 | 170 | 387 |
ml: mililitros.
Se observó un caso de celulitis postoperatoria de la mama intervenida, que se trató con antibioterapia parenteral durante 7 días. El estudio histopatológico reveló 17 casos de carcinoma ductal infiltrante, un caso de carcinoma in situ, un caso de fibroadenoma gigante (6cm) y un caso de tumor phyllodes de gran tamaño (9cm).
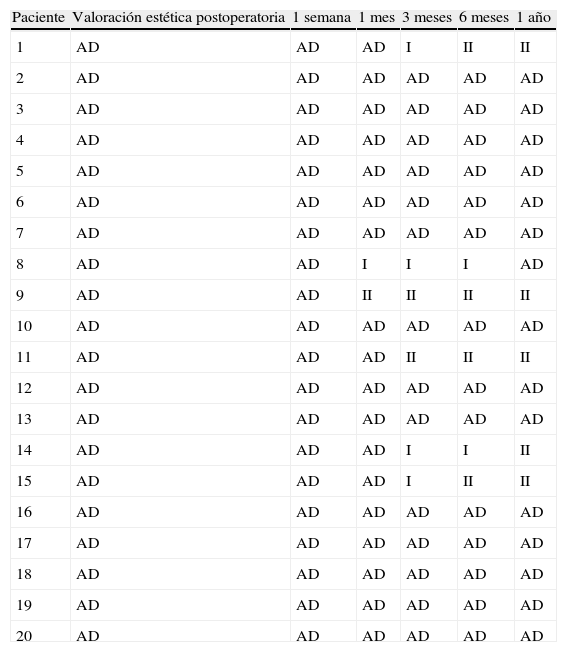
Valoración del resultado estéticoLos resultados estéticos tras la reconstrucción volumétrica con gel de plaquetas se muestran en la tabla 2. Se observa que al año de seguimiento postoperatorio, el 75% de las pacientes presentaban una mama de aspecto normal con ausencia de deformidades. En el grupo de pacientes en las que se observaron algunas alteraciones morfológicas, estas no difieren de las que hallamos habitualmente en las pacientes a las que se les practica una tumorectomía.
Valoración estética durante el seguimiento
| Paciente | Valoración estética postoperatoria | 1 semana | 1 mes | 3 meses | 6 meses | 1 año |
| 1 | AD | AD | AD | I | II | II |
| 2 | AD | AD | AD | AD | AD | AD |
| 3 | AD | AD | AD | AD | AD | AD |
| 4 | AD | AD | AD | AD | AD | AD |
| 5 | AD | AD | AD | AD | AD | AD |
| 6 | AD | AD | AD | AD | AD | AD |
| 7 | AD | AD | AD | AD | AD | AD |
| 8 | AD | AD | I | I | I | AD |
| 9 | AD | AD | II | II | II | II |
| 10 | AD | AD | AD | AD | AD | AD |
| 11 | AD | AD | AD | II | II | II |
| 12 | AD | AD | AD | AD | AD | AD |
| 13 | AD | AD | AD | AD | AD | AD |
| 14 | AD | AD | AD | I | I | II |
| 15 | AD | AD | AD | I | II | II |
| 16 | AD | AD | AD | AD | AD | AD |
| 17 | AD | AD | AD | AD | AD | AD |
| 18 | AD | AD | AD | AD | AD | AD |
| 19 | AD | AD | AD | AD | AD | AD |
| 20 | AD | AD | AD | AD | AD | AD |
AD: ausencia de deformidad.
Fuente: según la clasificación de Clough et al.20.
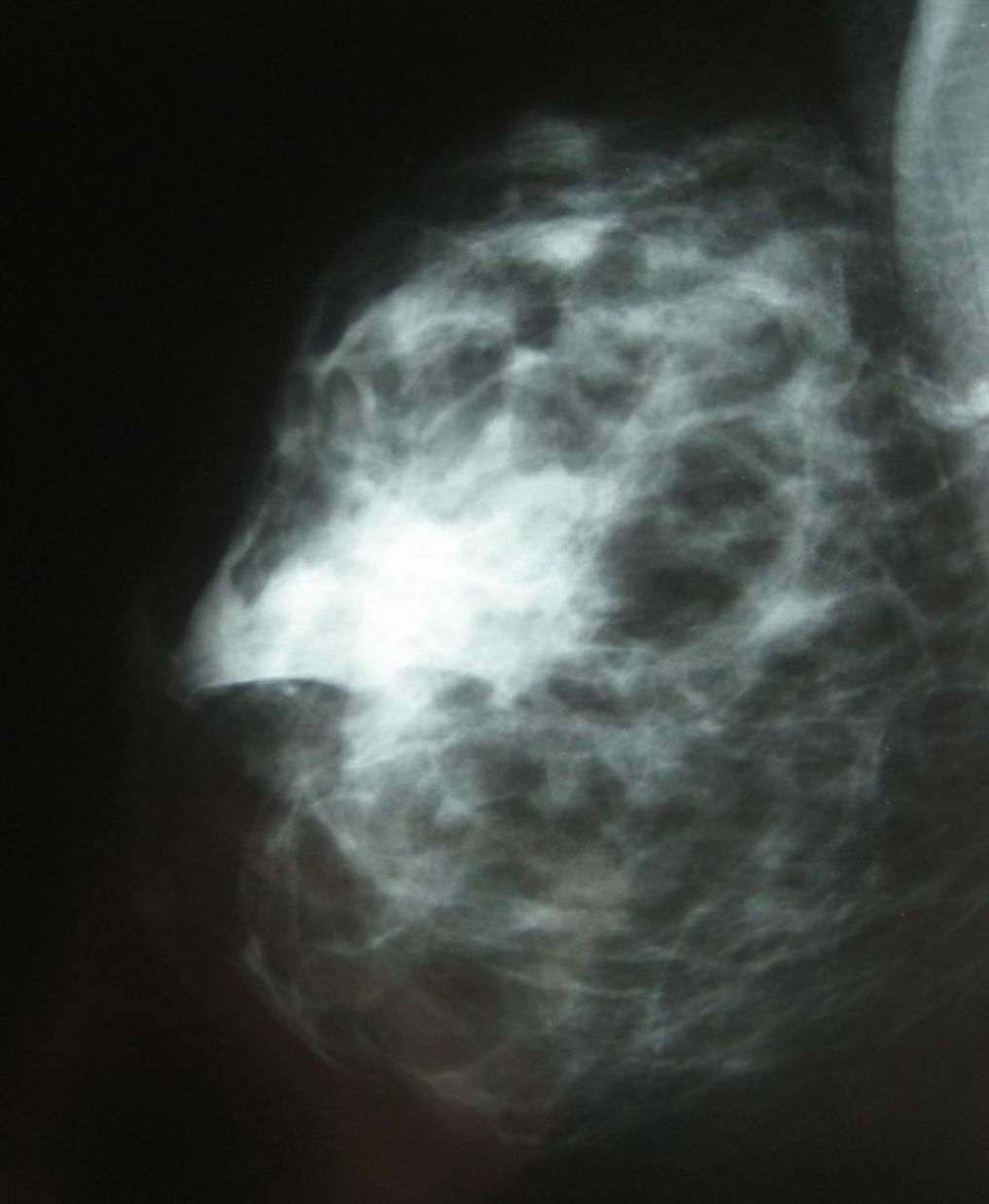
En las mamografías (fig. 2) se identificó una imagen nodular ovalada de contornos parcialmente bien definidos en la zona donde se implantó el gel de plaquetas. En mamas con patrón denso, los cambios fueron prácticamente imperceptibles, simulando un patrón glandular normal. En una paciente se observó la presencia de macrocalcificaciones, lo que no afectó el correcto seguimiento oncológico al no tratarse de microcalcificaciones.
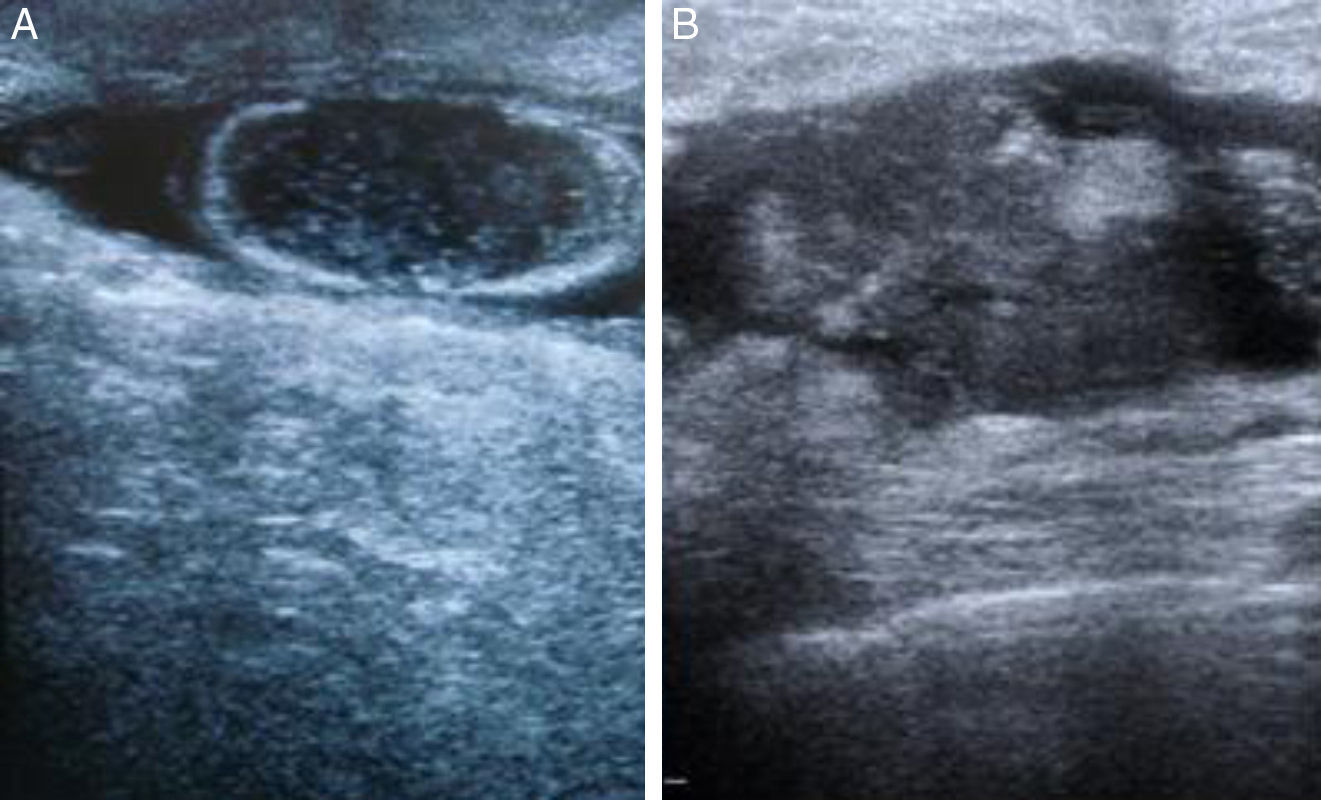
La ecografía mamaria, a los 2 meses de la implantación del gel de plaquetas, identificaba un nódulo ovalado, hipoecoico y bien delimitado, con ecos en su interior y refuerzo posterior así como un halo hiperdenso (fig. 3A). En el seguimiento al año se observó que la cavidad hipoecoica se había reducido de tamaño y que el nódulo inicialmente hipoecoico mostraba un material heterogéneo con ecos en su interior (fig. 3B).
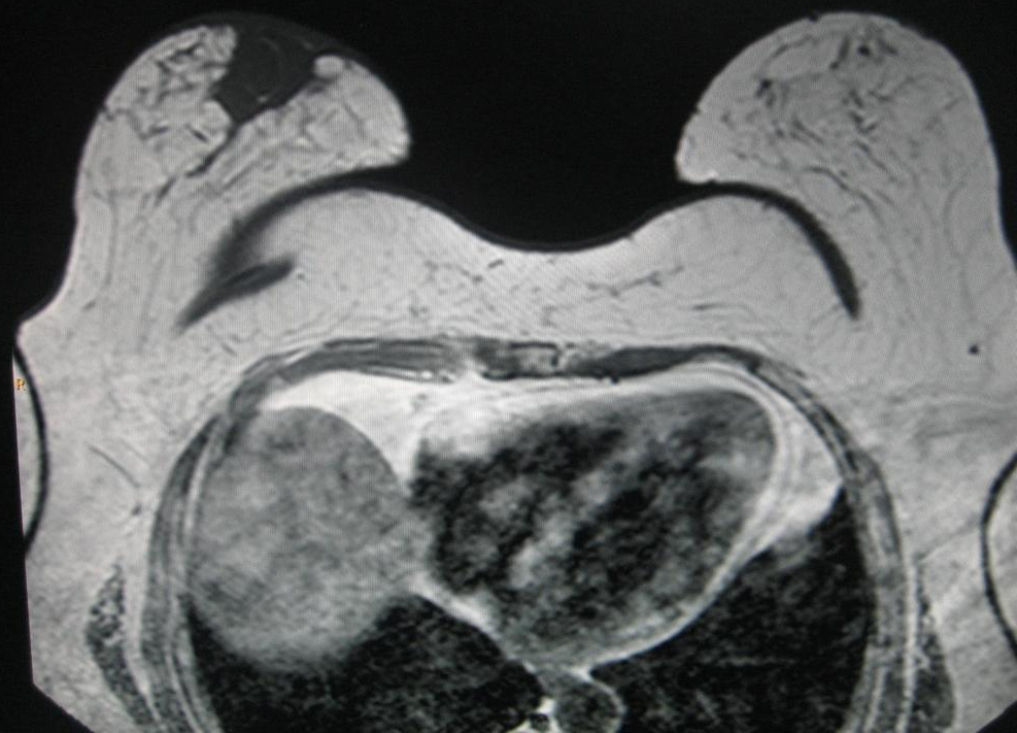
En la RMN (fig. 4) se identificó una imagen nodular generalmente ovalada de contornos lisos y bien definidos, de señal homogénea, y se identificaron señales hipointensas en T2 con un fino halo hipertenso en T1 sugestivas de hematoma postquirúrgico.
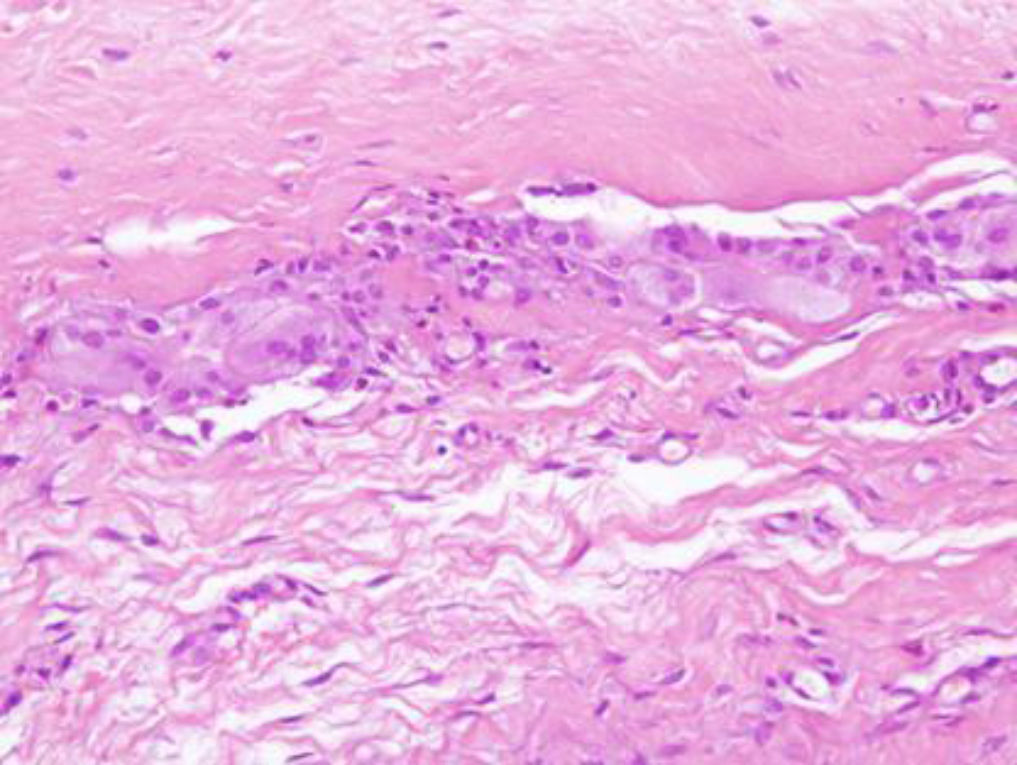
Estudio histopatológicoLas biopsias obtenidas al año de seguimiento de las 20 pacientes mostraron la presencia de un patrón normal de tejido adiposo, rodeado por histiocitos con citoplasma espumoso y aparición de células gigantes multinucleadas a cuerpo extraño (cambios observados habitualmente en la necrosis grasa, la ectasia ductal o biopsias recientes) (fig. 5).
Asimismo se apreció tejido fibroso con abundantes fibroblastos activados que reflejan un tiempo de cicatrización corto, así como la presencia de colágeno denso de aspecto evolucionado. Destacó, en un caso, la presencia de microcalcificaciones tanto de oxalato cálcico (que se depositan habitualmente en áreas donde hay componentes lípídicos), como de fosfato cálcico (que suelen verse en relación con restos de material necrótico amorfo) que no tuvieron traducción radiológica.
DiscusiónLa cirugía conservadora en el tratamiento del cáncer de mama supone un gran reto para el cirujano: conseguir unos márgenes libres que garanticen el éxito de la intervención, evitando resecciones demasiado amplias que conlleven alteraciones morfológicas y morfométricas de la glándula mamaria.
Si nos atenemos a las cifras reflejadas en la literatura, que varían entre un 10 y un 35% en la tasa de reintervenciones por márgenes afectos y entre un 20 y un 40% en la tasa de alteraciones cosméticas postoperatorias, podemos constatar que se trata de un problema de considerables dimensiones21,22.
En la actualidad disponemos de diversas técnicas para minimizar las retracciones, deformidades y asimetrías de la mama operada. Sin embargo, estas técnicas conllevan a menudo cirugías largas y complejas que requieren de un equipo quirúrgico especializado, con una morbilidad y defectos en la zona donante no menospreciables23.
De entre estas técnicas, se está empleando desde hace algunos años el uso de adipocitos centrifugados para recuperar volumen mamario (lipofilling) en pacientes que muestran defectos morfológicos tras la tumorectomía. A pesar de tener una buena aceptación y difusión, implica someter a la paciente a una o más intervenciones posteriores. No obstante, el seguimiento de las pacientes se ve dificultado por el artefacto de las microcalcificaciones que, con frecuencia, aparecen en las mamografías y que dificulta el seguimiento oncológico11.
La nueva técnica quirúrgica restitutiva del volumen con gel de plaquetas que proponemos nos permite realizar una exéresis de los tumores con un margen de seguridad ampliado, lo que disminuye la probabilidad de enfermedad residual en el lecho tumoral y, a la vez, consigue recuperar el volumen mamario en el mismo acto quirúrgico. No hemos tenido que reintervenir ninguna paciente por márgenes afectos y, en el seguimiento radiológico de las pacientes, no se ha evidenciado la aparición de microcalcificaciones ni de otras alteraciones que dificultan el seguimiento oncológico. Se trata pues de un procedimiento simple, económico, rápido y adecuado al tamaño del tumor. En nuestra experiencia esta técnica es una alternativa válida en la cirugía conservadora del cáncer de mama por su bajo número de complicaciones y por sus resultados estéticos.
Otro aspecto relevante de este nuevo procedimiento es que se podría realizar cirugía conservadora en tumores, que cumplen los criterios de inclusión y exclusión, de mayor tamaño (> a 3cm) que hoy en día son tributarios de mastectomía. Esto supondría una disminución en las indicaciones de la mastectomía, que actualmente representa todavía un 30-35% de la cirugía oncológica mamaria24.
Queremos destacar que la aplicación del gel de plaquetas, no solo supone la posibilidad de recuperar el volumen mamario de manera sincrónica a la cirugía exerética, sino que las pacientes no tienen sensación de cuerpo extraño y la palpación de la zona es similar a la del tejido mamario circundante. Además, los resultados anatomopatológicos obtenidos mediante una BAG al año de la intervención muestran, en la mayoría de los casos, un efecto reparador tisular con producción de tejido conectivo y cicatricial en el lecho quirúrgico.
A nivel bioquímico, se conoce que los factores de crecimiento que liberan las plaquetas pueden tener un efecto inmunovigilante hacia la transformación neoplásica de las células del lecho quirúrgico, así como un efecto inmunomodulador en la respuesta inflamatoria. Durante los 17 meses de seguimiento medio no hemos observado ni una sola recidiva.
En referencia al tratamiento postoperatorio con radioterapia, este no se vio alterado por la presencia del gel de plaquetas en el lecho quirúrgico ya que el gel muestra un efecto blanco para la radiación. Pero es que, además, el hecho de obtener unos márgenes más amplios permitiría evitar el boost que se lleva a cabo en la zona donde hay menor margen de seguridad25.
Finalmente, se deben considerar las limitaciones del estudio al presentar los primeros resultados preliminares con un tamaño muestral pequeño y corto periodo de seguimiento.
FinanciaciónEl proyecto fue financiado inicialmente por el Banco de Sangre y Tejidos (BST), siendo posteriormente aceptado para la financiación con fondos Europeos del Programa Valtec 2009 (ACC10) de la Generalitat de Catalunya.
Conflictos de interésLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la participación en el estudio de los siguientes especialistas: Dra. Esther y Óscar Bascuñana (Banco de Sangre y Tejidos); Dr. G. Cuyás, Dra. Torres, Dra. Guardia y Dr. Haetta (Servicio de Cirugía General); Dra. Vizcaya y Generosa de Dios (Unidad de Patología Mamaria); Dra. Sánchez y Dr. Arce (Servicio de Radiología); Dra. Cirauquí y Dra. Margelí (Servicio de Oncología); Dra. Vallejo y Dra. Solà (Servicio de Medicina Nuclear), Dra. Castellà (Servicio de Anatomía Patológica) del Hospital Germans Trias i Pujol.