Actualmente en cirugía del cáncer de páncreas se considera margen de resección afecto (R1) la presencia de células tumorales a <1mm del borde de resección. El objetivo principal del estudio es analizar el impacto del margen de resección en la supervivencia.
MétodosAnálisis retrospectivo con análisis de regresión multivariante de una base de datos prospectiva (2008-2017), donde se incluye el margen de resección, el margen de resección ampliado (R1<1mm), la resección vascular, la afectación linfática, las complicaciones quirúrgicas, la diferenciación tumoral y el tratamiento adyuvante.
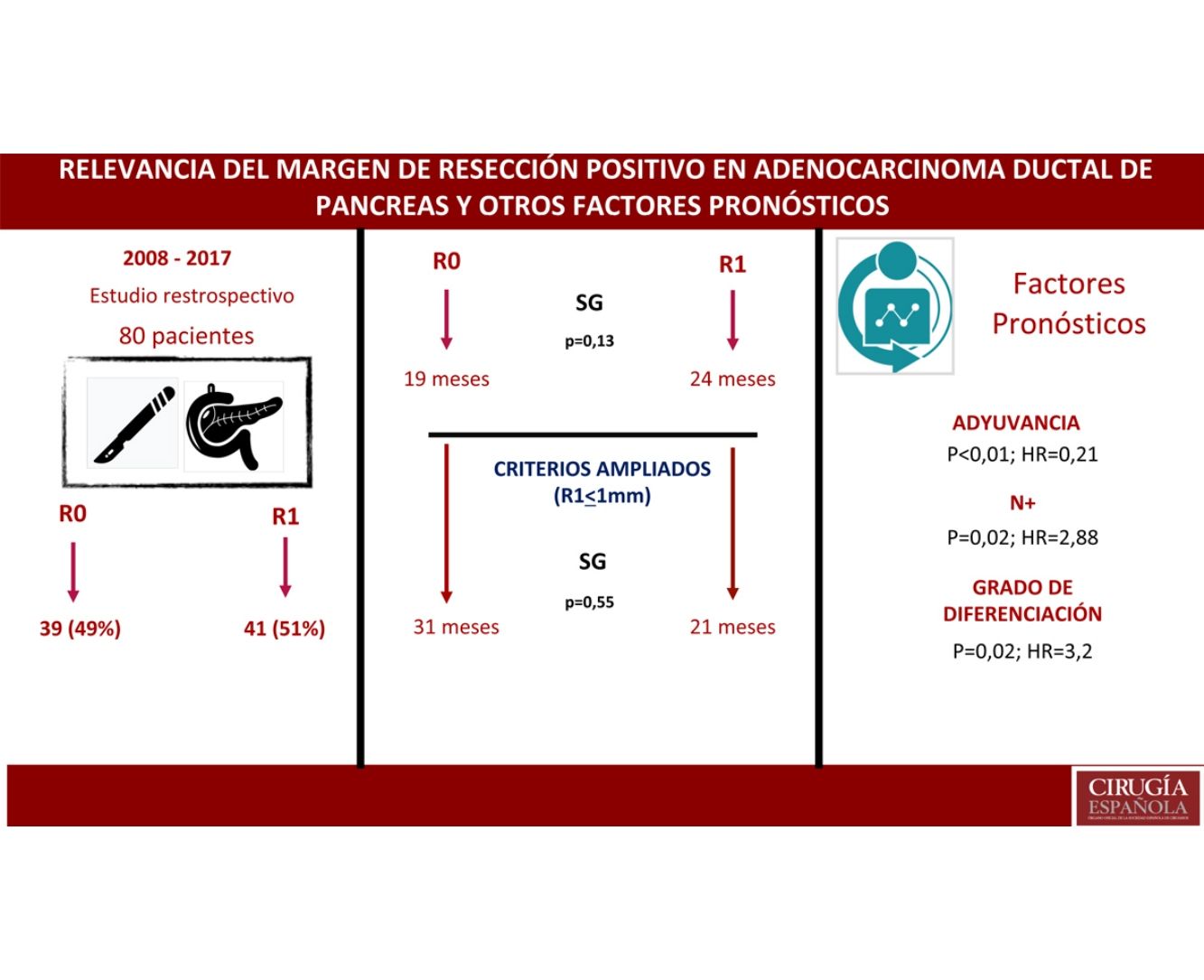
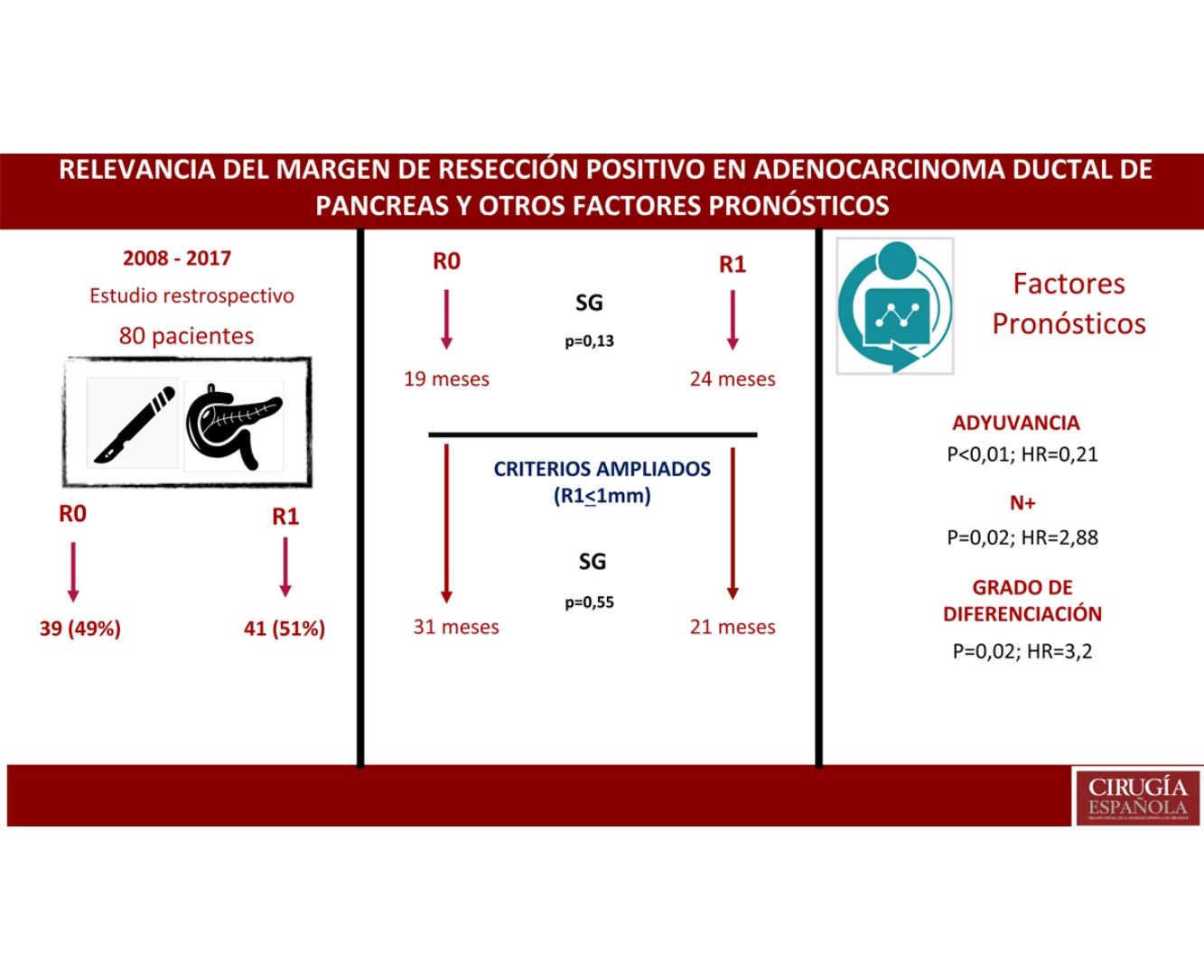
ResultadosUn total de 80 pacientes fueron analizados, 42 (52%) R1 y 38 (48%) R0. No se encontraron diferencias en la composición de ambos grupos salvo en la resección vascular, que fue mayor en el grupo R1, 12 (21%) vs. 2 (3%). La supervivencia en el grupo R0 fue de 19 meses vs. 24 meses en el grupo R1 (p=0,13). El margen ampliado (R1<1mm) tuvo una supervivencia de 21 meses vs. 31 meses en R0 ampliado (p=0,55). En el análisis multivariante solo se encontraron la afectación ganglionar (p=0,02; HR=2,88), la diferenciación tumoral (p=0,02; HR=3,2) y la adyuvancia (p<0,01; HR=0,21) como factores pronósticos de supervivencia.
ConclusionesEn el estudio la resección R1 no supone un factor pronóstico. La afectación ganglionar, el grado de diferenciación y el tratamiento adyuvante son factores pronósticos. Debe demostrarse el beneficio de ampliar los márgenes de resección. Son necesarios más estudios para valorar el impacto del margen de resección.
Currently, R1 resection is defined by the presence of tumor cells within <1mm of the resection margin. The main aim of this study was to analyze the impact of positive margins (R1) on survival outcomes in pancreatic cancer.
MethodsWe performed a retrospective analysis with multivariate regression analysis of a prospective database from 2008-2017, which included resection margin status, expanded resection margin (R1<1mm), vascular resection, lymphatic involvement, surgical complications, tumor differentiation grade and adjuvant treatment.
ResultsA total of 80 patients were analyzed: 42 (52%) R1; 38 (48%) R0. No differences were found in the composition of the two groups except for the vascular resection, which was more frequent in the R1 group: 12 (21%) vs 2 (3%). Overall survival in the R0 group was 19 months vs 24 months in the R1 group (p=0.13). Wide R1 (R1<1mm) had an overall survival of 21 months versus 31 months in wide R0 (p=0.55). In the multivariate analysis, only lymph node involvement (p=0.02, HR=2.88), tumor differentiation (p=0.02, HR=3.2) and adjuvant therapy (p<0.01; HR=0.21) were found to be factors related to survival.
ConclusionsR1 resection is not an independent risk factor. Lymph node involvement, differentiation grade and adjuvant treatment are prognostic factors. The benefit of expanding the resection margins should be demonstrated. More studies are needed to assess the impact of the resection margin
Cada año se producen más de 270.000 nuevos diagnósticos de cáncer de páncreas en todo el mundo, suponiendo un 10% de todos los cánceres digestivos1 y la cuarta causa de muerte relacionada con cáncer en Occidente2. A pesar de los avances médicos y tecnológicos, hasta la fecha la mediana de supervivencia por cáncer de páncreas es de aproximadamente 20 meses, con una supervivencia a 5 años de alrededor del 20%3. La cirugía es un elemento fundamental para conseguir mejoras en la supervivencia a largo plazo en estos pacientes, asociando tratamiento quimioterápico o radioquimioterápico. La posibilidad de curación se ha relacionado de forma clásica con la extirpación del tumor con márgenes quirúrgicos libres de afectación4, considerando los márgenes de resección libres de tumor (R0) como criterio de calidad quirúrgica5. Desde hace unos años el concepto de margen de resección ha cambiado, ampliándose hasta considerarse margen afecto (R1) cualquier presencia de celularidad tumoral a <1mm del borde quirúrgico6-10.
Actualmente es aceptado como óptimo un porcentaje de márgenes de resección positivos superiores al 60% en la mayoría de los trabajos, aunque es continuo objetivo de debate el valor pronóstico del mismo y su influencia tanto en la disminución de la recaída local como a distancia. Los resultados quirúrgicos fueron evaluados por Hishinuma et al. en un trabajo donde realizaron autopsias a 24 pacientes fallecidos por causas no oncológicas con antecedente de resección pancreática potencialmente curativa con márgenes de resección libres tras diagnóstico de cáncer de páncreas, y encontraron hasta en un 75% de los casos recaída local de la enfermedad y hasta en un 50% enfermedad a distancia11.
El objetivo principal del estudio es establecer el valor pronóstico del margen de resección en el adenocarcinoma de cabeza de páncreas en la supervivencia global (SG) y la supervivencia libre de enfermedad (SLE). El estudio tiene como objetivos secundarios la determinación de factores pronósticos de supervivencia a largo plazo y determinar el impacto de la reestadificación del margen de resección.
MétodosEl diseño del estudio es un análisis retrospectivo de una base de datos recogida de forma prospectiva. Los datos de los pacientes se han extraído de la base de datos de tumores pancreáticos de un único centro hospitalario, seleccionando los pacientes con diagnóstico de adenocarcinoma de cabeza de páncreas intervenidos quirúrgicamente mediante duodenopancreatectomía cefálica (DPC) entre los años 2008 y 2017. Todos los pacientes incluidos han sido intervenidos en el mismo centro hospitalario de tercer nivel por la unidad de cirugía biliopancreática tras la valoración por parte del comité multidisciplinar.
Los criterios de inclusión en el estudio han sido el diagnóstico preoperatorio de adenocarcinoma de cabeza de páncreas, la realización de DPC electiva por cirujanos de la unidad especializada, la resección macroscópica del tumor (R0 y R1), no siendo criterios de exclusión ninguno de los parámetros demográficos, la realización de resección vascular venosa asociada o la elección del tipo de tratamiento adyuvante o neoadyuvante. Los principales criterios de exclusión han sido la localización del tumor en cuerpo o cola pancreático, la histología tumoral diferente a adenocarcinoma y la resección macroscópica incompleta (R2).
Se ha considerado R1 cualquier tipo de afectación <1mm desde el borde de sección, considerando resección R0 la ausencia de celularidad tumoral a partir de 1mm desde el borde de sección quirúrgica6. Los bordes analizados por anatomía patológica son el margen posterior y AMS, medial y eje VP/VMS y borde de sección pancreático. Cada margen se ha analizado de forma independiente10. La reestadificación del margen de resección ampliado en más de 1mm se ha realizado a partir de los análisis anatomopatológicos, no realizados ad hoc. Todas las muestras fueron analizadas por el equipo de anatomía patológica especializado en análisis de tumores hepatobiliopancreáticos.
La clasificación TNM se ha realizado según los criterios establecidos por parte del AJCC cáncer staging manual, 7.a edición12. La diferenciación celular del tumor se establece en tres grupos: bien diferenciados (G1), moderadamente diferenciados (G2) o pobremente diferenciados (G3).
Las complicaciones han sido recogidas tanto de forma global como independiente. Se ha considerado la definición de fístula pancreática recogida en los criterios modificados del ISGPS 201612,13.
Se incluyen pacientes con tratamiento neoadyuvante y adyuvante, elegido según criterio del servicio de oncología médica y aprobación del comité multidisciplinar.
La SG se establece en el período entre el diagnóstico y el fallecimiento. La SLE se define entre el período del diagnóstico y la presencia de recaída tumoral tanto a distancia como local.
El análisis estadístico se ha llevado a cabo con el programada SPSS Statistics® v20. Las estimaciones de supervivencia se han realizado con el método Kaplan-Meier. La comparativa entre subgrupos, mediante el test log rank. El análisis de regresión multivariable se ha llevado a cabo mediante el empleo de los modelos proporcionales de Cox. Chi cuadrado y test Fisher fueron utilizados para el análisis de las variables categóricas. El nivel de significación estadística ha sido considerado para resultados p<0,05. Los intervalos de confianza (IC) se encuentran en una probabilidad del 95%.
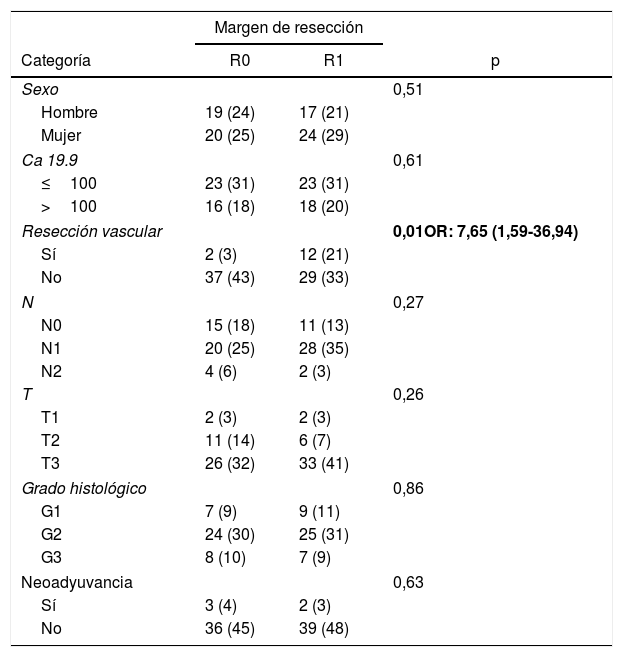
ResultadosDesde enero de 2008 hasta enero de 2017, 80 pacientes han sido incluidos: 41 pacientes (51%) con resección R1 (IC: 39,3-62,5) y 39 pacientes (49%) con resección R0 (IC: 35,5-58,8). La distribución de las características estudiadas entre ambos grupos (R0 y R1) es homogénea, excepto en el número de pacientes intervenidos mediante resección vascular (tabla 1): 2 pacientes (3%) en el grupo de R0 y 12 (21%) en el grupo de R1 (p=0,01; OR=7,65, IC: 1,69-36,94). El resto de parámetros estudiados son el sexo: 19 hombres (24%) y 20 mujeres (25%) con R0, 17 hombres (21%) y 24 mujeres (30%) con R1; la presencia de marcador tumoral Ca 19.9 por encima de 100U/mL, presente en 15 pacientes (18%) con resección R0 y 17 con resección R1 (20%) (p=0,61); 15 pacientes (18%) con afectación N0 y resección R0 y 11 con resección R1 (13%); en el grupo de N1, 20 pacientes (25%) con R0 y 28 con R1 (35%) y en el grupo de N2, 4 con R0 (6%) y 2 con R1 (3%). La distribución según el estadio T fue: en T1, 2 pacientes (3%) tanto en el grupo de R0 como de R1; en T2, 11 (14%) y 6 (7%) pacientes en los grupos de R0 y R1, respectivamente; en T3, 26 (32%) y 33 (41%) pacientes en los grupos de R0 y R1, respectivamente. La distribución según el grado histológico fue: en el grupo de G1, 7 (9%) y 9 (11%) pacientes en los grupos de R0 y R1; en G2, 24 (30%) y 25 (31%) pacientes en R0 y R1; y en G3, 8 (10%) y 7 (9%) en R0 y R1, respectivamente. Un total de 5 (7%) pacientes recibieron tratamiento neoadyuvante: 3 en el grupo R0 (4%) y 2 pacientes en el grupo de R1 (3%), no existiendo diferencias estadísticas en la composición de ambos grupos (p=0,63).
Características de los pacientes según el margen de resección
| Margen de resección | |||
|---|---|---|---|
| Categoría | R0 | R1 | p |
| Sexo | 0,51 | ||
| Hombre | 19 (24) | 17 (21) | |
| Mujer | 20 (25) | 24 (29) | |
| Ca 19.9 | 0,61 | ||
| ≤100 | 23 (31) | 23 (31) | |
| >100 | 16 (18) | 18 (20) | |
| Resección vascular | 0,01OR: 7,65 (1,59-36,94) | ||
| Sí | 2 (3) | 12 (21) | |
| No | 37 (43) | 29 (33) | |
| N | 0,27 | ||
| N0 | 15 (18) | 11 (13) | |
| N1 | 20 (25) | 28 (35) | |
| N2 | 4 (6) | 2 (3) | |
| T | 0,26 | ||
| T1 | 2 (3) | 2 (3) | |
| T2 | 11 (14) | 6 (7) | |
| T3 | 26 (32) | 33 (41) | |
| Grado histológico | 0,86 | ||
| G1 | 7 (9) | 9 (11) | |
| G2 | 24 (30) | 25 (31) | |
| G3 | 8 (10) | 7 (9) | |
| Neoadyuvancia | 0,63 | ||
| Sí | 3 (4) | 2 (3) | |
| No | 36 (45) | 39 (48) | |
OR: odds ratio.
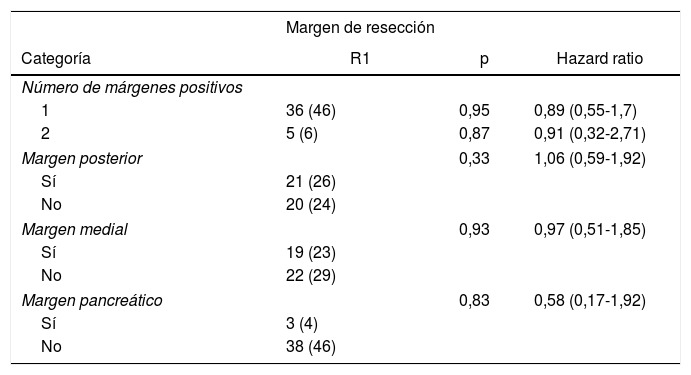
En el análisis univariante de la SG y los márgenes de resección hubo 36 pacientes (46%) con un único margen afecto (p=0,95; HR=0,89, IC: 0,55-1,70) y 5 pacientes (6%) con dos márgenes de resección afectos (p=0,87; HR=0,91, IC: 0,32-2,71). La afectación R1 según los márgenes afectos fue de 21 pacientes (26%) (p=0,33) en el margen posterior, 19 (23%) en el margen medial (p=0,93) y 3 (4%) en el margen pancreático (p=0,83), no encontrándose ninguna asociación entre el margen afectado y la supervivencia (tabla 2).
Análisis univariante de los márgenes de resección y supervivencia global
| Margen de resección | |||
|---|---|---|---|
| Categoría | R1 | p | Hazard ratio |
| Número de márgenes positivos | |||
| 1 | 36 (46) | 0,95 | 0,89 (0,55-1,7) |
| 2 | 5 (6) | 0,87 | 0,91 (0,32-2,71) |
| Margen posterior | 0,33 | 1,06 (0,59-1,92) | |
| Sí | 21 (26) | ||
| No | 20 (24) | ||
| Margen medial | 0,93 | 0,97 (0,51-1,85) | |
| Sí | 19 (23) | ||
| No | 22 (29) | ||
| Margen pancreático | 0,83 | 0,58 (0,17-1,92) | |
| Sí | 3 (4) | ||
| No | 38 (46) | ||
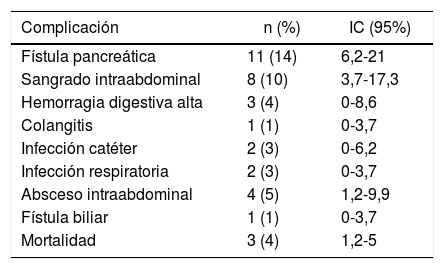
Las complicaciones quirúrgicas presentadas en el postoperatorio de DPC por adenocarcinoma de cabeza de páncreas en la serie se muestran en la tabla 3. Las complicaciones más frecuentes fueron: la fístula pancreática en 11 pacientes (14%) (IC: 6,2-21), el sangrado intraabdominal en 8 pacientes (10%) y el absceso intraabdominal en 4 pacientes (14%) (IC: 1,2-9,9). Tres de los pacientes (4%) (IC: 1,2-5) fallecieron en el postoperatorio y 32 (40%) tuvieron alguna complicación, de las cuales, 27 (33%) casos fueron ≥IIIA según la clasificación Clavien-Dindo.
Complicaciones quirúrgicas asociadas a duodenopancreatectomía cefálica
| Complicación | n (%) | IC (95%) |
|---|---|---|
| Fístula pancreática | 11 (14) | 6,2-21 |
| Sangrado intraabdominal | 8 (10) | 3,7-17,3 |
| Hemorragia digestiva alta | 3 (4) | 0-8,6 |
| Colangitis | 1 (1) | 0-3,7 |
| Infección catéter | 2 (3) | 0-6,2 |
| Infección respiratoria | 2 (3) | 0-3,7 |
| Absceso intraabdominal | 4 (5) | 1,2-9,9 |
| Fístula biliar | 1 (1) | 0-3,7 |
| Mortalidad | 3 (4) | 1,2-5 |
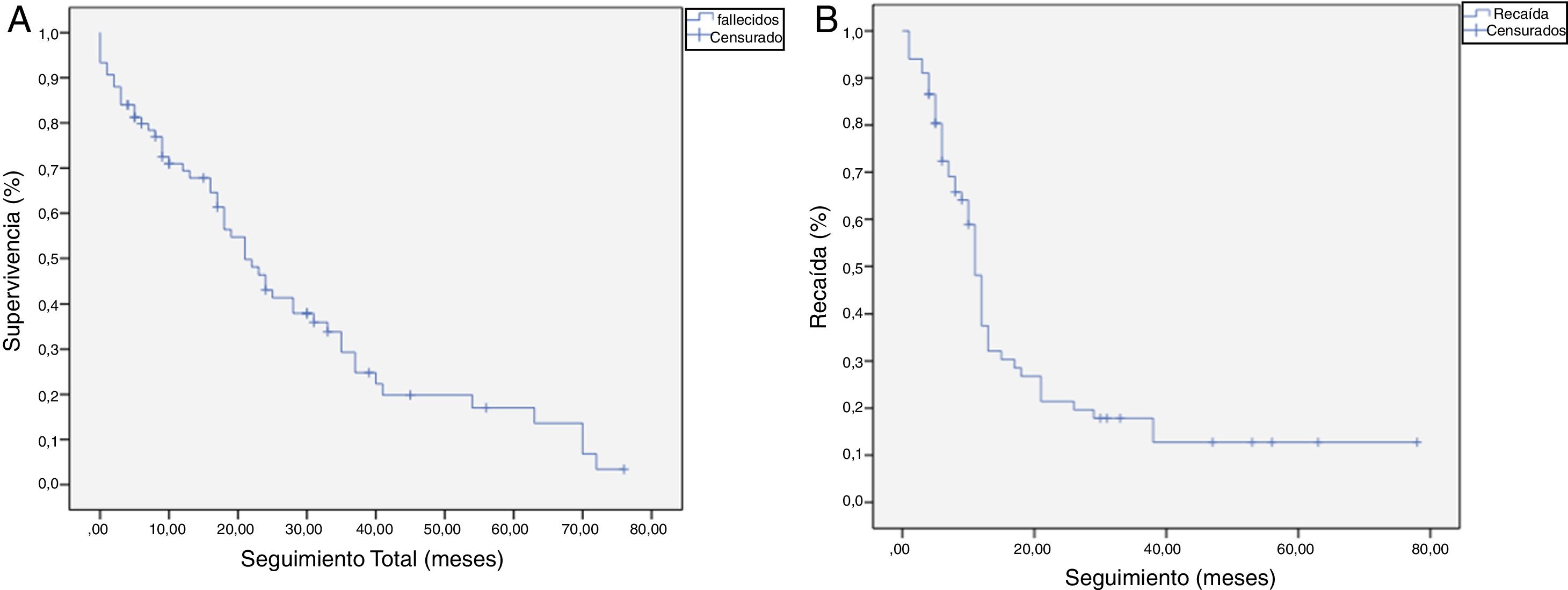
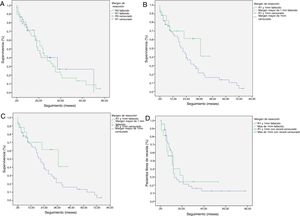
La mediana de SG fue de 21 meses (IC: 15,49-26,50) (fig. 1); en el grupo de R0 fue 19 meses (IC: 14,4-23,6) y en el grupo de R1, 24 meses (IC: 17,34-30,66), no encontrándose diferencias significativas entre ambos grupos en el análisis multivariante (p=0,13; HR=1,09, IC: 0,75-1,90) (fig. 2). La SLE tuvo una mediana de 11 meses (IC: 9,81-12,18) (fig. 1). En los pacientes R0 la SLE tuvo una mediana de 12 meses (IC: 10,12-13,87) en comparación con los pacientes R1, con una mediana de SLE de 11 meses (IC: 9,94-12,056), sin diferencias encontradas entre ambos grupos (p=0,84; HR=0,94, IC: 0,54-1,64).
Curvas de supervivencia Kaplan-Meier. Supervivencia general (SG) y supervivencia libre de enfermedad (SLE) en pacientes con adenocarcinoma de cabeza de páncreas tras duodenopancreatectomía cefálica. A) SG en pacientes con R0 y R1 (mediana de 37 meses vs. 21 meses) (p=0,13). B) SLE en pacientes R0 y R1 (mediana de 12 meses vs. 11 meses) (p=0,84). C) SG en pacientes R0 ampliado con mediana de 37 meses (10,04-63,96) vs. R1 ampliado ≤1mm con mediana de 21 meses (14,65-27,34) (p=0,55). D) SLE en pacientes con R0 ampliado vs. R1 ampliado (12 meses vs. 11 meses) (p=0,73).
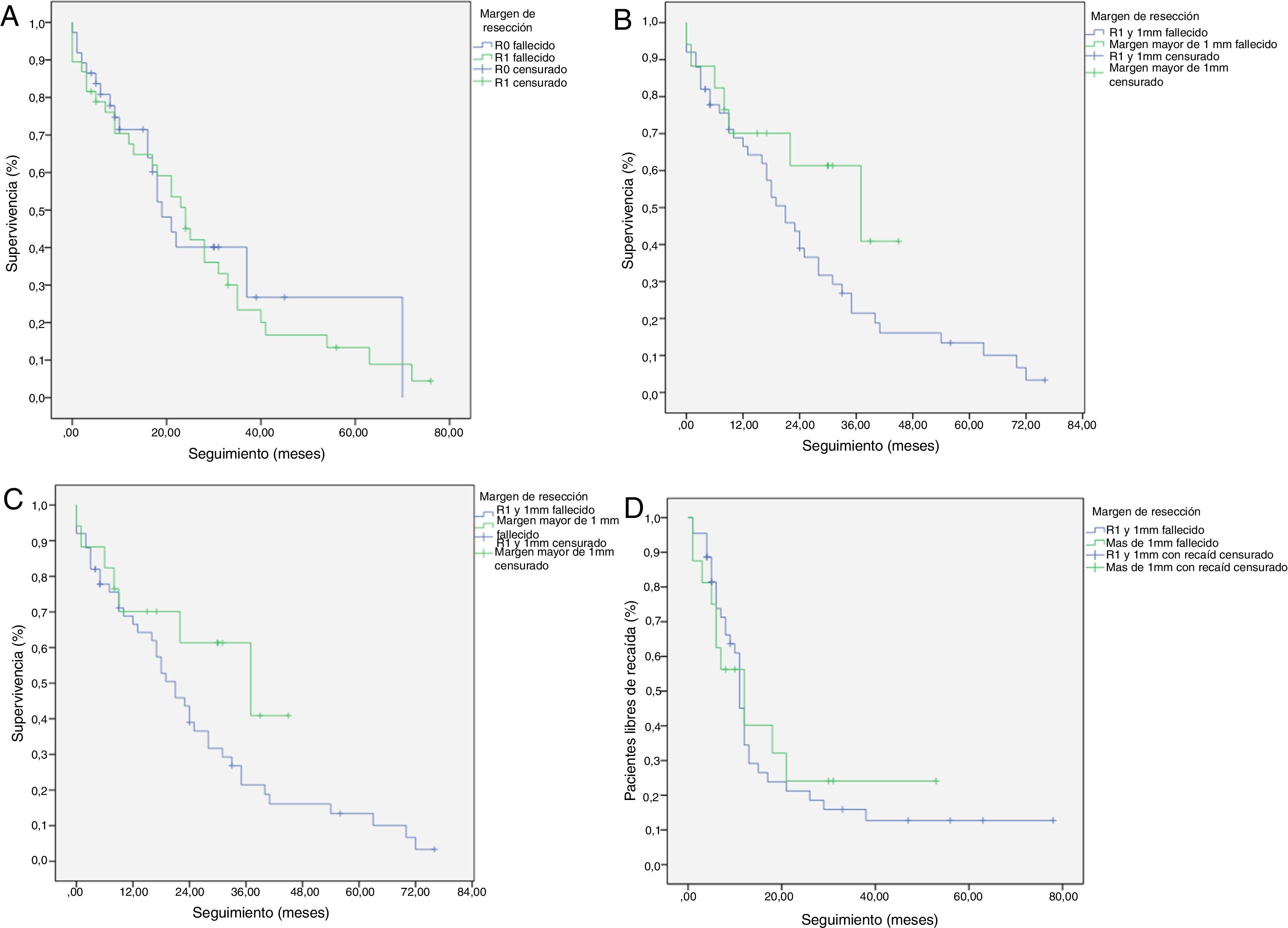
Se ha analizado el impacto que tiene la reestadificación del margen de resección (fig. 2) en la SG y SLE, comparando aquellos pacientes R0 ampliado >1mm con aquellos que tienen R1 ampliado ≤1mm. El grupo R0 ampliado fueron 23 pacientes (26,4%) (IC: 16,7-26,1), con una mediana de SG de 37 meses (IC: 10,04-63,96). El grupo R1 ampliado fueron 57 pacientes (73,6%) (IC: 63,9-83,3), con una mediana de SG de 21 meses (IC: 14,65-27,34). La SG fue mayor en el grupo con margen de resección ampliado (>1mm) que en el grupo de R1 (≤1mm), con 37 meses vs. 21 meses, respectivamente, aunque sin alcanzar significación estadística en la SG (p=0,55; HR=0,55, IC: 0,24-1,24) ni en la SLE (p=0,73; HR=0,89, IC: 0,45-1,76), con una mediana de 11 meses en R1 ampliado vs. 12 meses en R0 ampliado.
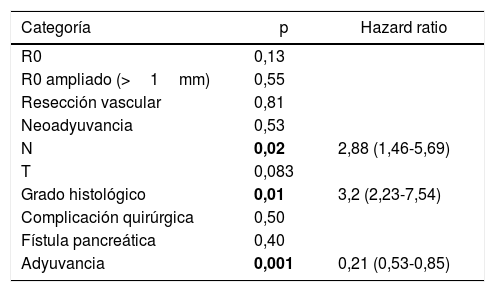
Se construyó un modelo de análisis multivariante (tabla 4) incluyendo el margen de resección (R0 y R1 <1mm), la presencia de resección vascular, el tratamiento neoadyuvante, la estadificación T y N, el grado histológico, la presencia de complicación quirúrgica, la presencia de fístula pancreática en el postoperatorio y el tratamiento adyuvante. En el análisis de riesgo observado se mostraba que tanto la afectación ganglionar (N) (HR=2,88; IC: 1,46-5,69) como el grado histológico del tumor (HR=3,2; IC: 2,23-7,54) estaban asociados con la mortalidad por adenocarcinoma de cabeza de páncreas, mientras que en el análisis el tratamiento adyuvante con quimioterapia se muestra como el único factor protector (HR=0,21, IC: 0,53-0,85) que puede disminuir la mortalidad en el cáncer de páncreas, según este análisis. No se encuentra relación en el estudio entre el margen de resección y la SG (p=0,13) ni entre la realización de resección vascular (p=0,81). Las complicaciones quirúrgicas no mostraron tener impacto en la supervivencia, tanto de forma general (p=0,53) como específicamente la fístula pancreática (p=0,4).
Análisis multivariante de supervivencia global
| Categoría | p | Hazard ratio |
|---|---|---|
| R0 | 0,13 | |
| R0 ampliado (>1mm) | 0,55 | |
| Resección vascular | 0,81 | |
| Neoadyuvancia | 0,53 | |
| N | 0,02 | 2,88 (1,46-5,69) |
| T | 0,083 | |
| Grado histológico | 0,01 | 3,2 (2,23-7,54) |
| Complicación quirúrgica | 0,50 | |
| Fístula pancreática | 0,40 | |
| Adyuvancia | 0,001 | 0,21 (0,53-0,85) |
El análisis del margen de resección tras DPC se debe hacer de forma sistemática y de acuerdo con la evidencia actual6,12-16. Aceptar de forma errónea un margen libre no aporta datos correctos para el tratamiento del paciente17-19. Los márgenes más comúnmente afectados son los márgenes posterior y medial7,8,20, al igual que en este estudio, 26% y 23% respectivamente.
Un estudio anatomopatológico estandarizado aumenta el porcentaje de resecciones R1 respecto a los criterios anteriores. Tanto los resultados de Esposito et al.9, donde se objetivó un aumento del 14 al 76% en resecciones R1 tras adaptar los criterios (R1<1mm) respecto a los anteriores (R1 afectación directa del margen), como de Verbeke et al.10, que también observaron en su revisión sistemática un aumento del 18 al 85% en R1, fueron fundamentales para determinar un cambio global en el análisis e interpretación de los márgenes de resección en la cirugía del cáncer de páncreas. En un primer momento en los países del entorno europeo6 y en el último año en el ámbito americano (AJCC)12,15 se ha aceptado de forma más global el mismo margen de resección.
En un estudio previo a la adopción del margen de resección actual, Raut et al. estudiaron en 360 pacientes (R1: 16,7%) el impacto del margen de resección en la supervivencia y concluyeron que R0 no afecta a la supervivencia, mientras que encontraron como factores pronósticos: la afectación ganglionar, la presencia de complicaciones mayores y la mayor pérdida de sangre21, hallazgos confirmados en el estudio aleatorizado controlado ESPAC-1, donde se encontraban diferencias entre R0 y R1 (16 meses vs. 10 meses), aunque con una supervivencia inferior a otros estudios en el grupo de R022. Por otro lado, asumiendo el mismo criterio de margen de resección, Howard et al., en 226 pacientes, de los cuales el 30% eran R1, concluyeron que la resección R0 en estos casos era un factor pronóstico favorable en la supervivencia5.
Varios trabajos muestran que la resección R0 según los criterios actuales supone un beneficio en resultados a largo plazo. Hartwig et al. publicaron una serie de 1.071 pacientes donde se encontró que R0 tenía un beneficio en la supervivencia respecto a R1 (30,9 meses vs. 19,7 meses)23, hallazgos confirmados por otros trabajos como el de Strobel et al., que demostró una mejoría en la supervivencia en R0 con margen ≥1mm respecto a R1<1mm y R1 de afectación directa24 o el de Tummers et al., con resultados similares25. Otros trabajos no encontraron esa diferencia en la supervivencia entre R0 y R1 (<1mm) de forma significativa22-26. Uno de los trabajos más recientes del ESPAC encontró mejor supervivencia en pacientes con R0 y con R1<1mm sin afectación directa del margen, con supervivencia similar entre ambos grupos y significativamente mejor que aquellos pacientes con afectación directa27. Estos resultados son similares a los encontrados en nuestro estudio, donde la supervivencia en pacientes con R0, mediana de 19 meses (IC: 14,4-23,6), no es mayor que la supervivencia en los pacientes con R1, mediana de 24 meses (IC: 17,34-30,66), entendiendo la evidente limitación derivada de su carácter retrospectivo con el consecuente deterioro de la evidencia científica. En el estudio se obtiene una resección con margen afecto (R1) en 42 pacientes (52,5%) compatible con las cifras presentadas en los trabajos que incluyen el concepto de R1<1mm6,9,22-24,28-30.
En trabajos publicados recientemente han intentado valorar el impacto que tendría la ampliación de la distancia del margen de resección20,31. Chang et al., en 365 pacientes, concluyen que la ampliación del margen de resección hasta 1,5mm mejora significativamente la supervivencia. Nuestro estudio muestra unos resultados similares en cuanto a la mejoría en la reestadificación del margen de resección, comparando los resultados a largo plazo entre los pacientes con un margen de resección de 1mm y >1mm, con una mediana de supervivencia en el grupo R0>1mm de 37 meses (IC: 10,04-63,96) vs. 21 meses (IC: 14,65-27,34) en el grupo de 1mm, aunque sin encontrar diferencias significativas, en probable relación con el tamaño muestral.
Existen factores pronósticos importantes, presentes en gran parte de los estudios, como son la afectación linfática y el grado de diferenciación tumoral5,21-23,31. En nuestro estudio, se identifica en el análisis multivariable la afectación linfática (p=0,02; HR=2,88, IC: 1,46-5,69) y el grado de diferenciación (p=0,02; HR=3,2, IC: 2,23-7,54) como factores de mal pronóstico, mientras que el tratamiento adyuvante mejora el pronóstico (p<0,01; HR=0,21, IC: 0,53-0,85). Probablemente, tanto la afectación linfática como el grado de diferenciación tumoral informen de la agresividad del tumor y por tanto se presentan como factores de mal pronóstico.
Establecer un criterio global de margen de resección óptimo resulta fundamental a la hora de aplicar los tratamientos y diseñar futuros estudios orientados hacia la individualización en el tratamiento de estos pacientes. El trabajo a partir del cual se adoptó el tratamiento con gemcitabina adyuvante evidenciaba tan solo un 17% de R132, muy por debajo de lo que se considera razonable tras un análisis estandarizado de la pieza quirúrgica9,10. En cambio, posteriores trabajos han reconocido el margen R0≥1mm a la hora de analizar los resultados33.
En este trabajo no se trata el efecto de la neoadyuvancia en el margen de resección. Dado el limitado número de pacientes incluidos, 5 (7%), no se pueden extraer conclusiones. El papel de la neoadyuvancia tendrá mayor importancia de forma progresiva34,35, existiendo trabajos que muestran una mejoría en los márgenes de resección R036, siendo necesarios estudios aleatorizados controlados, bien diseñados para aceptar esa afirmación.
Los resultados de este estudio deben ser analizados entendiendo las limitaciones del mismo, como son el carácter retrospectivo y un pequeño tamaño muestral, en comparación con otras series publicadas en este ámbito.
En conclusión, en este estudio no se encuentran mejores resultados a largo plazo en el grupo de pacientes con margen de resección R0 según los estándares actuales, no suponiendo un factor pronóstico en el análisis multivariable. Puede ser necesario redefinir el concepto R0, aunque este estudio, dado su carácter retrospectivo, no puede concluirlo. Son necesarios estudios prospectivos, con mayor número de pacientes, para mejorar la evidencia actual en el margen de resección. Tanto la afectación ganglionar como el grado de diferenciación tumoral son factores pronósticos en el adenocarcinoma de cabeza de páncreas.
Conflicto de interesesNinguno de los autores declara conflicto de intereses.