Introducción
La obesidad tiene una prevalencia en España del 15,7% en mujeres y del 13,4% en varones, y en cuanto a la obesidad mórbida, la prevalencia es del 0,7% en mujeres y el 0,3% en varones1, con un incremento progresivo debido a los malos hábitos alimentarios y la vida sedentaria. Las instituciones de salud pública están preocupadas por este incremento de la obesidad y han recomendado el mantenimiento de un peso sano y un tratamiento enérgico de la obesidad.
Para el tratamiento de la obesidad mórbida, las medidas médicas basadas en dietas, cambios de hábitos alimentarios, ejercicio, fármacos, balón intragástrico, etc., fracasan en más del 95% y la única opción terapéutica eficaz en la actualidad es la cirugía bariátrica2. Esta cirugía se ha desarrollado en los últimos 50 años de una manera exponencial; el bypass gástrico es la intervención quirúrgica más realizada para el tratamiento de la obesidad mórbida: el 54% según la SECO (Sociedad Española de Cirugía de la Obesidad) y el 61% según el IBSR (International Bariatric Surgical Registry)3.
En la actualidad hay publicaciones de los resultados del bypass gástrico a corto-medio plazo4,5, pero a largo plazo las publicaciones son escasas y los resultados están menos documentados6,7.
La cirugía de la obesidad se inició en nuestro hospital en el año 1997 en el contexto de un equipo multidisciplinario. Desde entonces hemos evolucionado en el manejo del paciente, en su evaluación perioperatoria y aspectos técnicos de la intervención, y en la actualidad consideramos el bypass gástrico por laparoscopia la técnica de elección para el paciente con obesidad mórbida.
En este artículo presentamos la experiencia con el bypass gástrico laparoscópico de un mismo equipo quirúrgico a lo largo de 7 años, con un seguimiento del 97% de los pacientes.
Pacientes y método
Desde marzo de 2000 hasta mayo de 2007, en nuestro hospital, el mismo equipo quirúrgico realizó 508 bypass gástricos por vía laparoscópica. Se seleccionó a los pacientes según los criterios establecidos por el NIH (National Institutes of Health) en el año 19918. No se excluyó a los pacientes con cirugía abdominal previa. Antes de la intervención el endocrinólogo, el psiquiatra, el anestesista y el cirujano evaluaron a los pacientes para descartar contraindicaciones para la cirugía. Asimismo se les informaba de la intervención a realizar, con los riesgos y posibles secuelas. Preoperatoriamente se realizaba una ecografía abdominal para descartar colelitiasis y una endoscopia para descartar afección gastroduodenal.
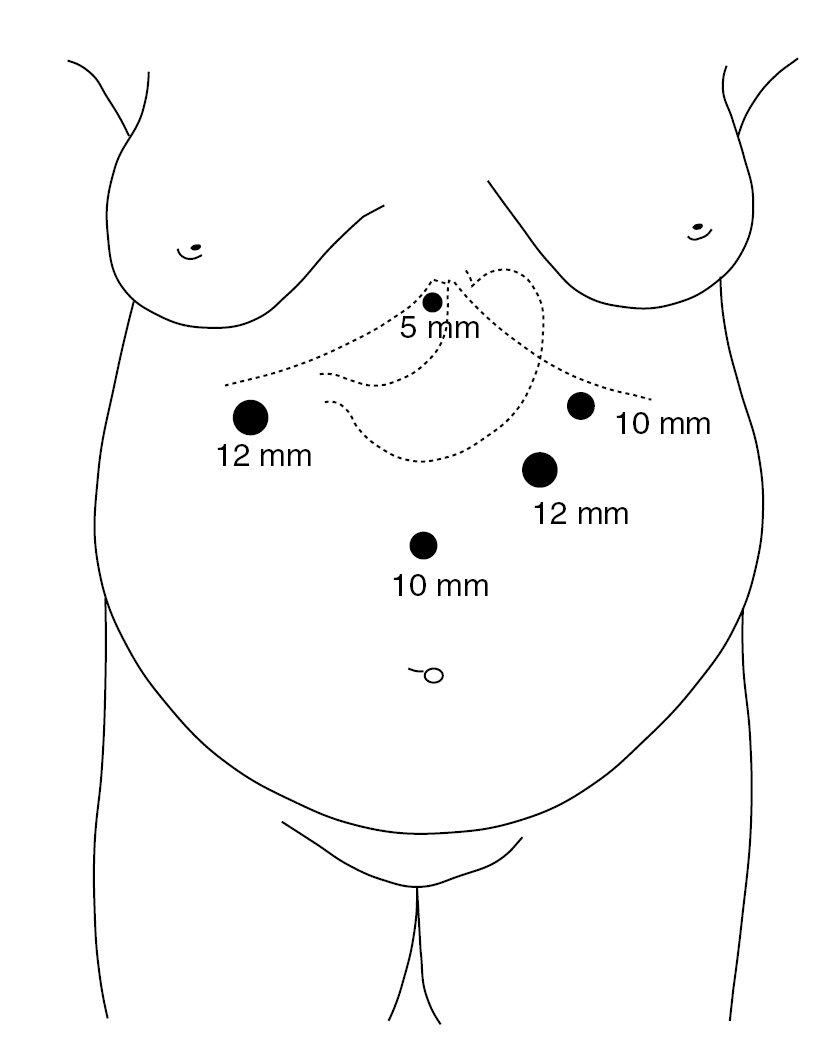
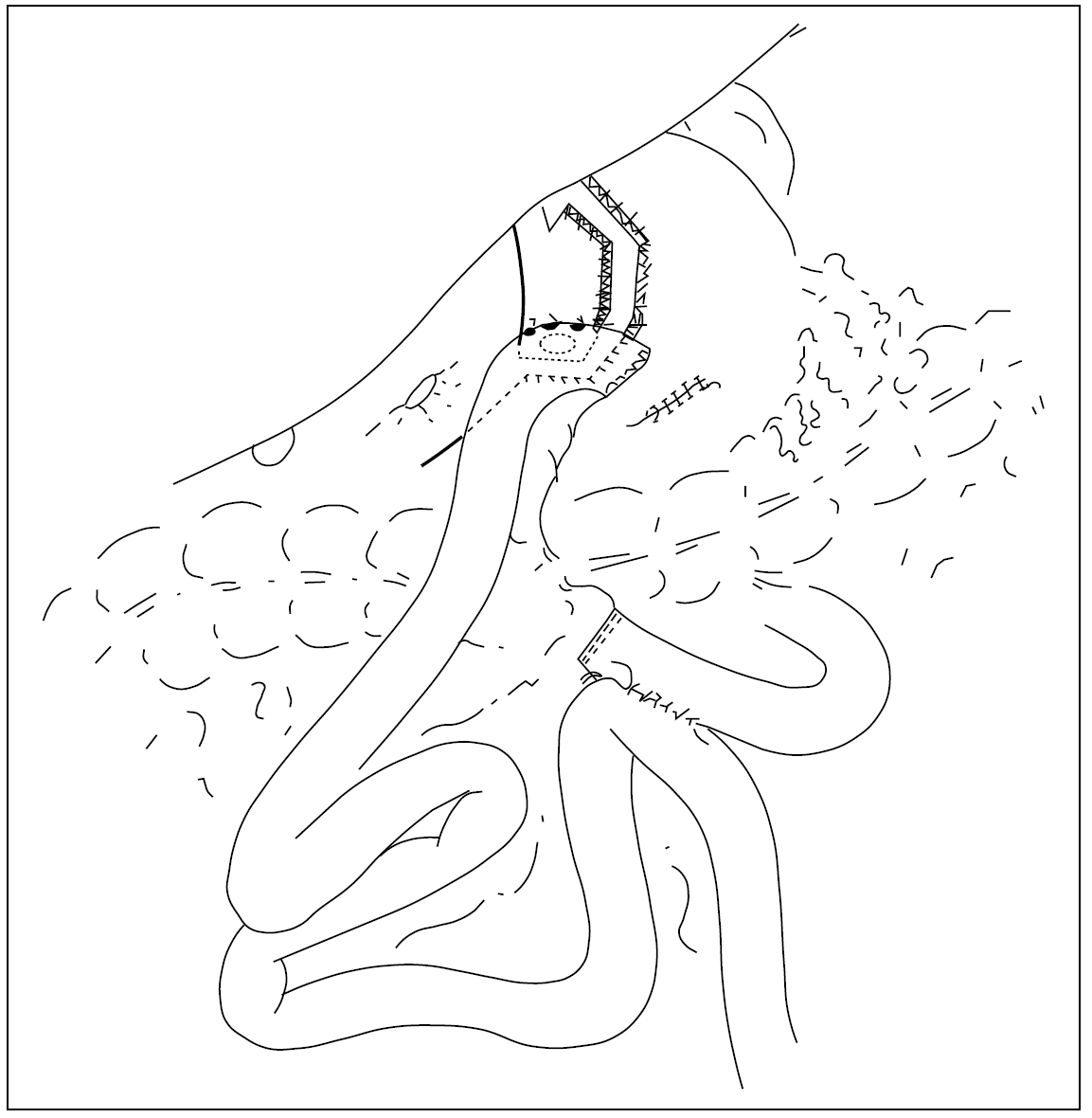
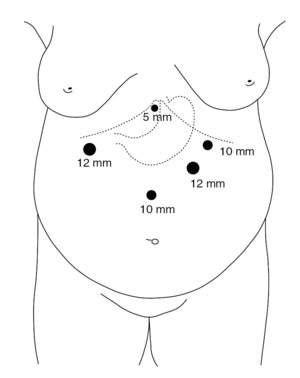
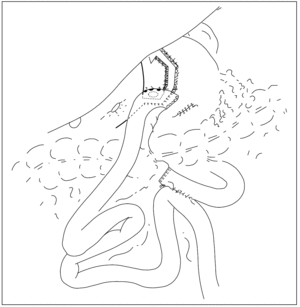
La técnica quirúrgica realizada se ha descrito previamente9 con algunas modificaciones: el paciente se sitúa en decúbito supino con las piernas cerradas, el cirujano a la derecha del paciente y los 2 ayudantes a la izquierda, la colocación de los trocares es diferente (fig. 1), y la realización del bypass es similar, salvo que el ascenso del asa en Y de Roux se hace antecólica antegástrica y se cierra el defecto mesentérico creado al realizar la gastroenteroanastomosis (fig. 2).
Fig. 1. Colocación de los trocares.
Fig. 2. Técnica quirúrgica.
Todos los pacientes recibieron una dosis profiláctica antibiótica con amoxicilina-clavulánico y antitrombótica con heparina de bajo peso molecular y compresión neumática intermitente de extremidades inferiores. La conducta a seguir en el postoperatorio se ha descrito en la vía clínica publicada recientemente10.
Durante el seguimiento medimos la pérdida de peso mediante el porcentaje de sobrepeso perdido (PSPP) y el porcentaje de exceso de índice de masa corporal (IMC) perdido (PEIMCP). Los cambios en las comorbilidades se clasificaron en: curación (normalización de la comorbilidad sin requerimiento de medicación), mejoría (mejor control de la comorbilidad con el mismo tratamiento o reducción de medicación) e igual (ninguna evidencia de resolución o mejora de la comorbilidad).
Todos los datos se expresan en media ± desviación estándar con el rango.
Resultados
De los 508 pacientes sometidos a bypass gástrico laparoscópico, 353 (69,5%) eran mujeres y 155 (30,5%), varones, con una media de edad de 40 (16-71) años, un peso medio preoperatorio de 131,3 ± 24,5 (80-230) kg y un IMC medio de 48,3 ± 7 (34-78).
Entre las enfermedades asociadas destacan la hipertensión arterial (HTA) en el 40,6% de los pacientes, la diabetes en el 17,9% y el síndrome de apnea obstructiva del sueño (SAOS) en el 21,5%.
El tiempo operatorio medio fue de 125,8 ± 35,6 (60-300) min. En el 99% de los pacientes el bypass se finalizó por vía laparoscópica. Sólo 4 pacientes requirieron de conversión a cirugía abierta; estas conversiones ocurrieron en los primeros 30 pacientes de la serie por las siguientes razones: gran hepatomegalia, hipertensión portal secundaria a cirrosis hepática, problemas anestésicos (hipercapnia) y lesión esplénica durante la disección del ángulo de His.
Hubo complicaciones precoces (< 30 días) en el 14,7% de los pacientes (tabla 1). Las complicaciones hemorrágicas ocurren normalmente en el postoperatorio inmediato y a todos los pacientes se les suspende la heparina de bajo peso molecular. En las hemorragias digestivas altas, de los 12 pacientes, 7 precisaron de esclerosis endoscópica y transfusión y 5, sólo esclerosis endoscópica. Asimismo, necesitaron transfusión sanguínea 3 pacientes de los 7 con hemorragia digestiva baja y 5 pacientes de los 14 con hemorragia intraabdominal, manifestada por el drenaje hemático; uno de ellos necesitó reintervención quirúrgica, ya que la hemorragia era secundaria a la herida del trocar por la que se extrajo el drenaje.
De los pacientes con fuga en la gastroenteroanastomosis, 2 se detectaron durante un tránsito de control realizado en el postoperatorio inmediato, los pacientes estaban totalmente asintomáticos y se resolvieron favorablemente con tratamiento conservador. Otro paciente reingresó a los 10 días con dolor epigástrico y fiebre, sin repercusión hemodinámica y buen estado general. Con la tomografía computarizada (TC) se detectó una colección epigástrica con dehiscencia de la gastroenteroanastomosis, que evolucionó favorablemente con drenaje radiológico, reposo intestinal y antibioterapia. Otros 3 pacientes presentaron dehiscencia a los 7, 15 y 22 días de la intervención, que se manifestó con clínica de dolor abdominal difuso, vientre en tabla y neumoperitoneo. Se los intervino por vía laparoscópica y se halló perforación libre de la cara anterior de la gastroenteroanastomosis; se realizó sutura simple y lavado de la cavidad abdominal. Todos los pacientes evolucionaron favorablemente. No ocurrieron fugas en la enteroanastomosis.
Presentaron estenosis de la gastroenteroanastomosis 8 pacientes, todas dilatadas por endoscopia de forma ambulatoria sin complicaciones; ningún paciente necesitó una segunda dilatación.
De forma ambulatoria, a 15 pacientes se les drenó una colección de la herida del trocar de hipocondrio izquierdo (12 abscesos y 3 hematomas), con lo que precisaron de curas locales diarias.
Ocurrieron problemas respiratorios en 6 pacientes, 2 con clínica y diagnóstico de tromboembolia pulmonar que evolucionaron satisfactoriamente (uno con heparinización y otro con heparinización y colocación de filtro de cava); 2 con diagnóstico de neumonía, que se resolvió con tratamiento antibiótico; otro paciente presentó una atelectasia pulmonar y el restante falleció por una sepsis nosocomial de origen respiratorio; este paciente fue el único de la serie que precisó estancia prolongada en UCI.
Una paciente de 62 años falleció súbitamente en el primer día postoperatorio, sin hallazgos en la autopsia macroscópica y microscópica.
En total, 5 pacientes precisaron reoperación en el postoperatorio inmediato (< 30 días) (tabla 2), 3 por dehiscencia de la gastroenteroanastomosis, uno por hemorragia intraabdominal secundaria a sangrado del trocar y otro por dolor abdominal intenso al cuarto día del postoperatorio sin que se encontrara etiología; todos ellos se resolvieron por vía laparoscópica.
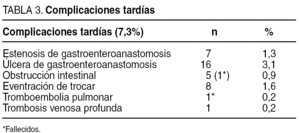
Las complicaciones tardías (> 30 días) ocurrieron en el 7,3% de los pacientes (tabla 3). La más frecuente fue la úlcera de boca anastomótica que ocurrió en 16 (3,1%) pacientes; en 6 (1,2%) se inició como perforación: en 5 secundaria a la ingesta de gastroerosivos y en 1 sin causa. Las otras 10 se diagnosticaron por endoscopia debido a que los pacientes presentaban malestar-dolor en el hemiabdomen superior: 2 pacientes tenían historia de ingesta de gastroerosivos, 3 por Helicobacter pylori y el resto sin causa que la justificara.
Hubo 5 casos de obstrucción intestinal que precisaron de intervención quirúrgica: 1 caso por adherencias; 3 casos por hernia interna, uno a través del orificio del mesocolon y 2 por el defecto del mesenterio, uno de ellos necesitó resección intestinal, y el restante presentó una hernia interna entre el mesocolon y el meso del intestino delgado (espacio de Peterson), que causó una obstrucción del asa alimenticia, lo que produjo una perforación de la anastomosis gastroentérica con una peritonitis aguda. Se intervino al paciente, y en el postoperatorio presentó un fracaso multiorgánico y falleció a las 48 horas.
Hay 8 casos de eventración de trocar (4 del trocar de hipocondrio izquierdo y 4 del supraumbilical).
El 1,3% de los pacientes presentaron estenosis de la gastroenteroanastomosis, que se resolvió con dilatación endoscópica; 2 de los 7 pacientes necesitaron dos sesiones de dilatación.
La estancia hospitalaria media fue 3 ± 2,6 (1-40) días. La mortalidad de la serie es del 0,8%, y sólo un caso está relacionado con la técnica quirúrgica.
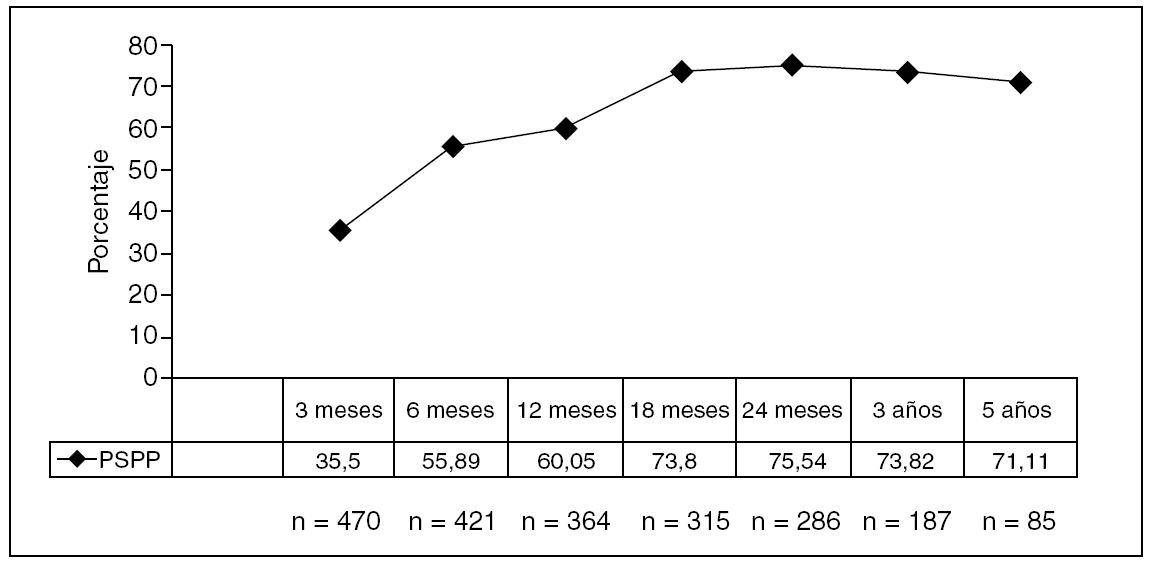
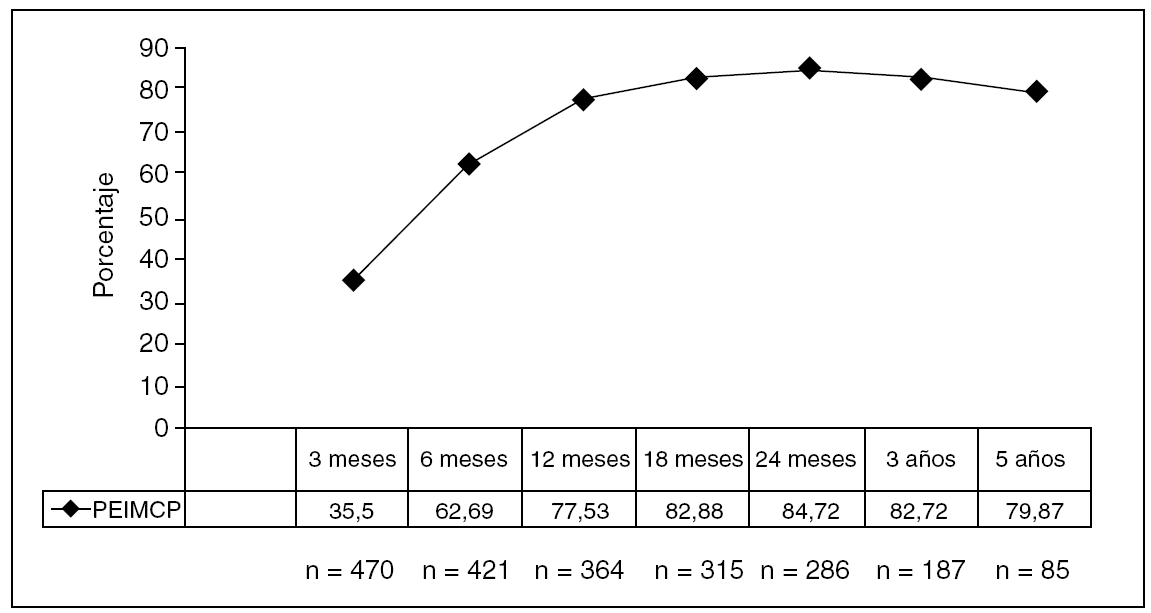
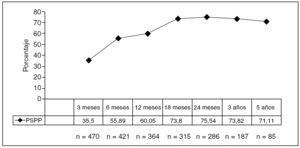
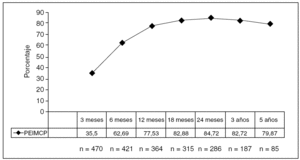
El PSPP y el PEIMCP a los 3 y 5 años ha sido del 77,8 y el 75,1% (fig. 3) y del 82,7 y el 79,8%, respectivamente (fig. 4), con un seguimiento medio de 33,7 ± 22,6 (0,9-87,32) meses, y una pérdida sólo del 3% de los pacientes (n = 15).
Fig. 3. Porcentaje de sobrepeso perdido (PSPP).
Fig. 4. Porcentaje de exceso de índice de masa corporal perdido (PEIMCP).
Antes de la cirugía, 91 pacientes presentaban diabetes y a los 5 años tras la cirugía el 72,5% (n = 66) curó y el 16,4% (n = 15) mejoró. De los 215 pacientes con HTA el 59,5% (n = 128) curó y el 16,3% (n = 41) mejoró tras 5 años y de los 111 pacientes con SAOS, el 73,8% (n = 82) curó.
Discusión
Hay un incremento en la realización de la cirugía bariátrica, debido al aumento de cirujanos y centros hospitalarios que han comenzado a practicarla11. Ello se debe al aumento de la demanda de la cirugía bariátrica por los pacientes debido, por un lado, a los beneficios que ofrece al paciente la pérdida de peso, tanto físicos, psíquicos como sociológicos, y por otro lado, el atractivo que supone realizar esta cirugía por vía laparoscópica.
De todas las técnicas quirúrgicas, el bypass gástrico es la realizada con mayor frecuencia y algunos autores la consideran el estándar de la cirugía de la obesidad12. Nuestros datos así lo confirman, al presentar unos buenos resultados, tanto en complicaciones a corto y largo plazo como en pérdida de peso y mejora de comorbilidades a largo plazo.
El bypass gástrico se había realizado por vía abierta hasta que Wittgrove realizó el primer bypass por vía laparoscópica13. Aunque en un principio le atribuyeron un aumento de complicaciones, principalmente la fuga de la gastroenteroanastomosis, con un posible aumento de la mortalidad, diversos estudios han demostrado que la vía laparoscópica es tan segura y eficaz como la abierta, incluso con disminución de las complicaciones, principalmente las relacionadas con la pared abdominal y respiratorias, además de una rápida incorporación a la actividad física habitual y menor estancia hospitalaria14,15. Es por ello que si el estándar de la cirugía bariátrica es el bypass gástrico, éste debe realizarse por vía laparoscópica.
La complicación precoz más temida por los cirujanos es la fuga anastomótica, que ocurre en el postoperatorio inmediato y precisa de una actuación rápida en su resolución16. En nuestro caso hubo fuga anastomótica en el 1,2% de los pacientes. Es una complicación que debe sospecharse ante cualquier alteración del curso postoperatorio del paciente, y obliga a poner en marcha las exploraciones necesarias para el diagnóstico (TC, tránsito con Gastrografin®). Si las exploraciones son negativas y hay una alta sospecha de fuga, la laparoscopia diagnóstica forma parte importante del algoritmo de sospecha de fuga, aunque esto suponga realizar en algunos casos una laparoscopia "blanca", como ocurrió en uno de nuestros pacientes. Es preferible operar a un paciente y no encontrar nada que dejar sin intervenir a un paciente con una dehiscencia, ya que estos pacientes están muy afectados en su estado metabólico y cardiorrespiratorio, y un retraso en el diagnóstico y el tratamiento puede ser crucial para su pronóstico.
Puede ayudar a prevenir esta complicación el refuerzo de la sutura mecánica con puntos sueltos en la cara anterior con el objetivo de disminuir la tensión. Además, creemos que el drenaje perianastomótico es esencial, ya que en el caso de una fuga, si está bien drenada y el paciente está estable, se puede tratar de forma conservadora, como ocurrió en 2 de nuestros pacientes.
Cuando hay una fuga anastomótica y está indicada la revisión quirúrgica, la vía laparoscópica es la indicada en principio, siempre que no exista contraindicación anestésica. Por vía laparoscópica se puede identificar la localización de la fuga, repararla con varios puntos, hacer plastia con epiplón y lavar meticulosamente la cavidad abdominal. En 3 de nuestros pacientes se indicó la cirugía, que se realizó por vía laparoscópica sin incidencias.
Una de las complicaciones más frecuente de nuestra serie ha sido la hemorragia, tanto alta como baja o intraabdominal, esta última se puso de manifiesto con débito alto y rojo por el drenaje en el postoperatorio. Pensamos que una de las causas principales de las hemorragias es la alta dosis de heparina utilizada en estos pacientes. La mayoría de las hemorragias cedieron al suspender la heparina sin necesidad de transfusión y 7 pacientes con hemorragia digestiva alta precisaron de tratamiento endoscópico con esclerosis. Sólo un paciente con hemorragia intraabdominal precisó de reintervención quirúrgica laparoscópica; la causa de la hemorragia fue una arteriola del orificio de extracción del drenaje.
Para disminuir la incidencia de esta complicación, hay autores que sólo utilizan las medias de compresión neumática para prevención de tromboembolia pulmonar17. También se puede recurrir a la anastomosis de forma manual, que es más hemostática que la mecánica, pero más difícil técnicamente y de mayor tiempo de realización. Otro de los mecanismos de prevención de las hemorragias intraabdominales es la utilización de sellantes biológicos y los refuerzos con material biológico o sintético que se aplican directamente en los cartuchos de las endocortadoras tanto lineales como circulares y quedan incorporados en la línea de grapado18, o bien la realización de una sutura manual continua hemostática en las líneas de sección gástrica, como estamos realizando últimamente, con lo que se observa una disminución importante de las hemorragias intraabdominales19.
El tratamiento conservador de la dehiscencia de anastomosis y hemorragia es aceptable y seguro como vemos en nuestra serie donde sólo se reintervino a 5 (1%) pacientes, antes de los 30 días; la tasa de reoperaciones oscila entre el 0,5 y el 3%20.
Las hernias internas son la causa más frecuente de obstrucción intestinal en estos pacientes, sobre todo si el bypass gástrico se ha realizado por vía laparoscópica16,21, debido a que la formación de adherencias es menor y habitualmente no se cierran los defectos mesentéricos creados durante la realización del bypass gástrico ya que es dificultoso y exige una mayor habilidad. En nuestra serie, comenzamos a realizar el bypass gástrico con ascenso del asa transmesocólica y cierre del defecto creado en el mesocolon transverso, pero cambiamos al ascenso antecólico antegástrico debido a que se visualiza el ascenso del asa en Y de Roux evitando su rotación, la anastomosis es más visible ante posibles complicaciones, y además evitamos el defecto del mesocolon y el espacio de Petersen como focos de hernias internas, disminuyendo la incidencia de obstrucción intestinal, cuando se compara el ascenso antecólico antegástrico con el ascenso transmesocólico22.
Otra de las complicaciones relevantes es la estenosis de la gastroenteroanastomosis. Los factores que se han involucrado incluyen errores de técnica, fugas subclínicas de la anastomosis, isquemia por alteración vascular del asa de yeyuno, tensión en la anastomosis o retraso en la cicatrización tras úlcera marginal16. En nuestra serie hay una tasa relativamente baja de estenosis a ese nivel (2,9%), y cuando se producen son de fácil tratamiento con dilatación endoscópica, ya que ningún paciente precisó de reintervención quirúrgica.
Nuestros datos, al igual que otras series de bypass gástrico por laparoscopia, presentan una disminución de la incidencia de complicaciones no relacionadas con la técnica quirúrgica, cuando se compara con el bypass gástrico abierto14,15. Las más destacadas son las relacionadas con la pared abdominal (infección de pared abdominal, hernias y evisceraciones) que son frecuentes en el bypass gástrico tanto a corto como a largo plazo, y que disminuyen de forma importante con la vía laparoscópica, como lo demuestra nuestra serie, con una incidencia de infección de herida operatoria del 2,9%, evisceración del 0% y hernias de puerta de entrada del 1,6%.
Las complicaciones cardiopulmonares después del bypass gástrico son raras, tanto en el abierto como en el laparoscópico, pero cuando ocurren pueden llegar a ser una complicación grave y causar la muerte del paciente, más aún si estos pacientes tienen problemas pulmonares previos como el SAOS. Debido a su baja frecuencia, la comparación entre abierto y laparoscópico puede ser dificultosa, pero algunas series presentan una disminución de la incidencia de complicaciones pulmonares y una disminución de estancia en UCI23. Es lógico pensar que si los pacientes intervenidos por vía laparoscópica tienen una estancia disminuida en UCI, menos dolor y se movilizan antes, la incidencia de complicaciones cardiopulmonares debe ser menor.
En la actualidad para hacer posible la comparación entre series y distintas técnicas quirúrgicas, se han establecido el PSPP y las variaciones del PEIMCP como indicadores de pérdida ponderal en estos pacientes tras la cirugía24; los resultados se clasifican de excelentes si son superiores al 65%, buenos o aceptables si están en el 50-65% y fracasos si son inferiores al 50%. Nuestros resultados a medio y largo plazo, con un seguimiento del 97% de los pacientes, son similares a los publicados en series de bypass gástrico abierto y laparoscópico4,5-25, con un PSPP del 77,8 y el 75,1% a los 3 y 5 años, y un PEIMCP catalogado como excelente24 del 82,7 y el 79,8% a los 3 y 5 años, respectivamente. Una de las causas de estos resultados es el seguimiento constante que llevamos de los pacientes, tanto endocrinólogos como cirujanos, ya que el control estricto tras la cirugía hace que la pérdida de peso se mantenga más a largo plazo26.
La mejora e incluso la resolución de comorbilidades, como hipertensión y diabetes, está asociada con la mejora de calidad y expectativa de vida25. Se ha visto que el bypass gástrico lleva a la curación a largo plazo del 85% de los pacientes con diabetes tipo 2 y prevención de la intolerancia a la glucosa25. Similares resultados se han visto en la resolución y mejora del control de hipertensión25.
Como conclusión podemos decir que el bypass gástrico por laparoscopia es una técnica eficaz para el tratamiento a largo plazo de la obesidad mórbida, con escaso número de complicaciones, baja mortalidad, excelente pérdida de peso y curación o mejora de las comorbilidades asociadas en estos pacientes.
Correspondencia: Dr. J. Luján Mompeán.
Servicio de Cirugía General y Aparato Digestivo I.
Hospital Universitario Virgen de la Arrixaca.
Carretera Cartagena, s/n. 30120 El Palmar. Murcia. España.
Correo electrónico: juanlujan@telefonica.net
Manuscrito recibido el 9-9-2007 y aceptado el 16-10-2007.