Introducción
Las técnicas mínimamente invasivas han mostrado claras ventajas sobre la cirugía tradicional en patología benigna. Pero esos mismos beneficios no han estado tan claros en la patología neoplásica y su práctica es controvertida. Azagra et al1 realizaron la primera gastrectomía total laparoscópica en 1993. Más tarde presentaron una primera serie de gastrectomías por cáncer gástrico por laparoscopia. Los cirujanos japoneses han constatado los beneficios quirúrgicos del procedimiento y lo han ido aplicando con continuidad a sus pacientes con tumores incipientes2. La incidencia limitada de esta enfermedad en comparación con otras localizaciones tumorales y la complejidad en el aprendizaje de la técnica han colaborado a su escaso desarrollo en occidente. La ausencia de datos acerca de la idoneidad oncológica del procedimiento en tumores más avanzados se ha sumado para retrasar su implantación.
Nuestro grupo de cirugía esofagogástrica incorporó la cirugía laparoscópica para completar la estadificación de los pacientes antes de proceder a la cirugía exerética reglada. Su uso sistemático desde el año 1998 permitió evitar algunas laparotomías innecesarias. La posterior introducción progresiva de las técnicas mínimamente invasivas en el tratamiento quirúrgico del cáncer gástrico nos ha permitido llegar a realizar el procedimiento completo minimizando las consecuencias de su aprendizaje. El objetivo de este artículo es presentar la experiencia de nuestro grupo en este procedimiento y aportar los primeros datos de supervivencia general de la serie operada por cirugía laparoscópica.
Material y método
Pacientes
Presentamos una revisión de nuestra experiencia con los primeros 56 pacientes con cáncer gástrico, intervenidos en nuestra unidad, a los que se les ha practicado una resección oncológica de su afección neoplásica (resección R0) con técnicas de cirugía videoasistida (laparoscopia). Las intervenciones se han practicado entre diciembre de 2002 y julio de 2007. Se incluyó a 19 mujeres y 37 varones con edades comprendidas entre los 32 y los 85 años (edad media, 61,8 ± 13,5).
El diagnóstico se estableció siempre con endoscopia y biopsia. La estadificación inicial se realizó mediante estudio analítico completo con marcadores nutricionales y tumorales (CEA y CA 19.9), tránsito baritado y tomografía computarizada (TC) toracoabdominal y en 8 (14%) pacientes, ecoendoscopia gástrica y, finalmente, laparoscopia.
Se ha incluido en este grupo a todos los pacientes con tumores con una estadificación local T1 a T3, y posibles adenomegalias sólo en los territorios extirpables con una linfadenectomía D2. Es decir, todos aquellos en que era presumible realizar una resección completa (R0). Los pacientes con tumores T4 o adenopatías positivas (biopsia peroperatoria) en territorios alejados han pasado a tratamiento neoadyuvante tras la laparoscopia de estadificación.
La localización de los tumores fue: 24 en el antro gástrico, 26 en el cuerpo, 3 en el fundus y 3 en el cardias y la zona subcardial inmediata. Los de esta última localización han sido incluidos en este estudio sólo si afectaban exclusivamente a la vertiente gástrica. En cuanto a su clasificación histológica: 24 eran adenocarcinomas de patrón difuso y otros 23 tenían un patrón intestinal (clasificación de Lauren). En 2 pacientes la gastrectomía se realizó porque presentaban una displasia de alto grado y en otro paciente por un linfoma gástrico. En este tipo tumoral sólo realizamos una gastrectomía cuando hay un riesgo alto de complicaciones locales durante el tratamiento quimiorradioterápico. La linfadenectomía en este caso es D1. En los adenocarcinomas de patrón intestinal localizados en el antro gástrico se ha efectuado una gastrectomía subtotal y la reconstrucción mediante una gastroyeyunostomía en Y de Roux transmesocólica. En los de patrón difuso se realizó una gastrectomía total. En los tumores localizados en la zona subcardial, fundus gástrico y tercio medio se practicó una gastrectomía total. La linfadenectomía ha sido igual en todos los casos. Se ha incluido los grupos ganglionares 1 a 9 y el grupo 11 proximal, lo que ha supuesto una linfadenectomía D2 completa en los tumores de antro y D1 con los grupos 7, 8, 9 y 11 proximal en los de cuerpo y fundus. En todos los casos se ha realizado fisioterapia respiratoria preoperatoria.
Técnica quirúrgica
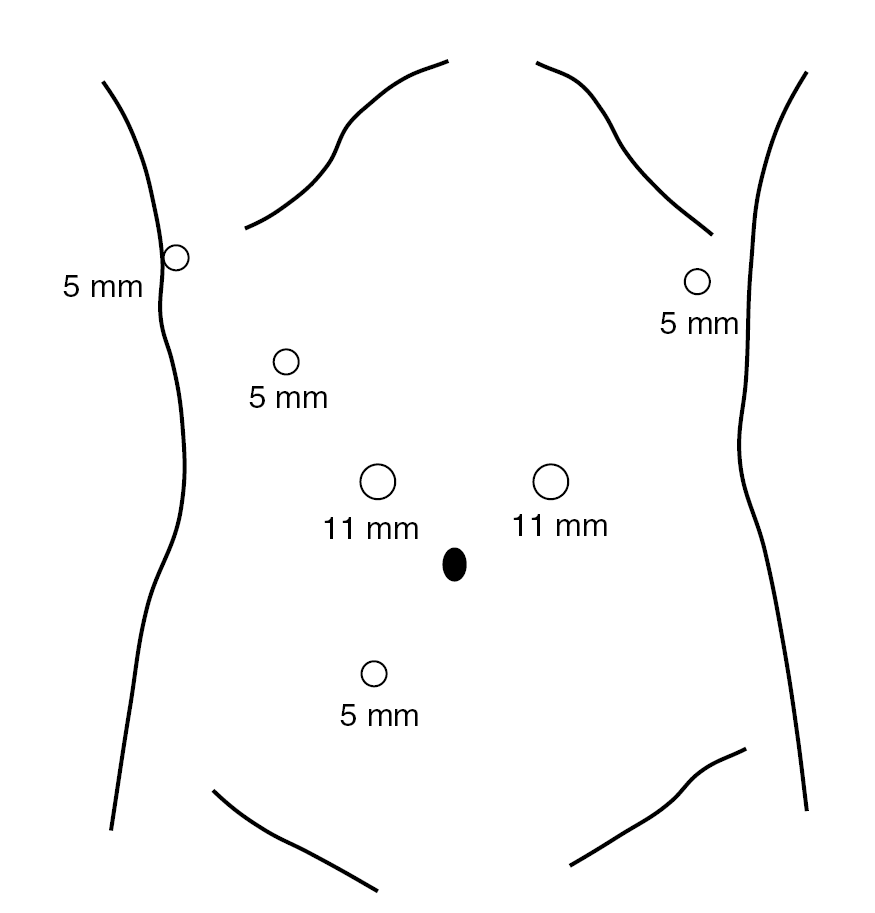
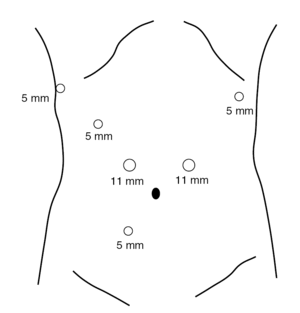
En ambos tipos de resección se parte de la colocación de 6 trocares (2 de 12 mm y 4 de 5 mm) en el hemiabdomen superior (5) e inferior (1) (fig. 1). La técnica en la gastrectomía total se inicia por la separación del omento del colon transverso y la prolongación craneal de la disección con sección de los vasos cortos hasta llegar al pilar diafragmático izquierdo. Posteriormente se progresa en sentido caudal hasta seccionar la arteria gastroepiploica derecha en su origen, incluyendo los ganglios del grupo 6. Se identifica y secciona la arteria pilórica en el borde superior de la primera porción duodenal lo que nos permitirá efectuar la sección duodenal con sutura mecánica (endograpadora lineal, carga blanca). Inmediatamente realizamos la disección de los grupos ganglionares 8 y 9, esqueletizando el tronco celíaco, y procedemos a seccionar la arteria gástrica izquierda en su origen. El estómago queda completamente liberado y sin vascularización, unido al paciente sólo por el esófago. Procedemos, entonces, a seleccionar un segmento de yeyuno a unos 25 cm del ángulo de Treitz donde se secciona su continuidad (endograpadora lineal, carga blanca) y se prolonga la sección a una parte de su meso para facilitar su ascenso. La parte distal del intestino seccionado se pasa a través del mesocolon transverso hasta el compartimento supramesocólico y el cabo proximal se anastomosa laterolateral con sutura mecánica (endograpadora lineal, carga blanca) al yeyuno, a unos 50 cm del margen intestinal ascendido. Se secciona el esófago 1 cm por encima del cardias con endotalladora con carga azul. Se practica una pequeña incisión transversa de 6 cm aprovechando la incisión previa de uno de los trocares colocados en el hemiabdomen izquierdo. La colocación de un mecanismo de asistencia manual permite proteger la pared abdominal al extraer la pieza (estómago con omento y el producto de la linfadenectomía), y colocar de nuevo el trocar inicial para seguir trabajando por cirugía laparoscópica. Se pasa a través de la boca del paciente una sonda que lleva aplicada en su extremo el cabezal de la sutura circular de 25 mm. Una vez extraída la sonda y encajado el mecanismo en el fondo de saco esofágico se practica una pequeña sutura en bolsa de tabaco alrededor del yunque. La máquina de sutura circular se entra por la incisión de la pared en la que está el mecanismo de asistencia manual, entra unos centímetros por el cabo yeyunal ascendido y, atravesando su pared, se encaja al cabezal para efectuar una anastomosis esofagoyeyunal.
Fig. 1. Colocación de los 6 trocares para la gastrectomía laparoscópica.
En los casos en que se efectúa una gastrectomía subtotal se siguen los mismos pasos descritos deteniendo la disección de la curvatura mayor en la zona de transición de cuerpo a fundus y respetando, por tanto, los vasos cortos. En la curvatura menor se siguen también los mismos pasos con la linfadenectomía de los grupos ganglionares 8 y 9 y posterior sección de la arteria gástrica izquierda en su origen con inclusión en la resección de todo el tejido linfograso de la curvatura menor (grupos ganglionares 3 y 7). La sección del estómago se hace 3-4 cm por debajo del cardias con sutura mecánica (endograpadora lineal, carga azul) y se efectúan las dos anastomosis que requiere la técnica, también por vía laparoscópica. El pie del asa es una yeyunoyeyunostomía laterolateral 45 cm por debajo del margen del asa ascendida. La anastomosis alta es una gastroyeyunostomía laterolateral en la cara anterior gástrica. Se realizan ambas con sutura mecánica cerrando los orificios resultantes de la introducción de las endograpadoras con puntos de material reabsorbible. El asa ascendida pasa a nivel transmesocólico. Se coloca el producto de resección en una bolsa protectora y se realiza una incisión abdominal transversa de unos 6 cm aprovechando una de las puertas de entrada sólo para extraer la pieza.
Datos analizados
Hemos llevado a cabo una evaluación descriptiva de los resultados obtenidos. Se evalúa el número de pacientes en los que ha sido posible aplicar estos procedimientos en relación con la totalidad de pacientes estudiados en nuestra unidad y un estudio de los resultados obtenidos tras la aplicación de la cirugía mínimamente invasiva.
Resultados
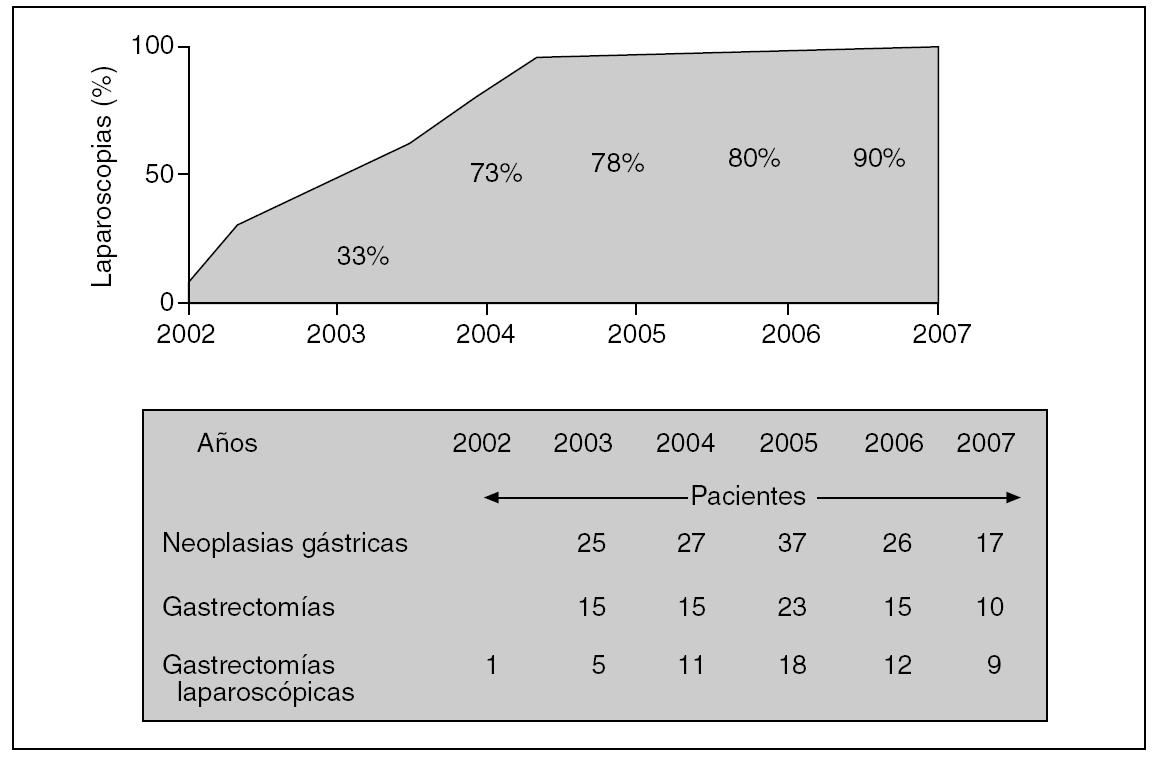
Hemos incrementado el número de procedimientos videoasistidos en el tratamiento quirúrgico del cáncer gástrico desde su inicio en el año 2002 hasta el final del trabajo (junio de 2007). De aplicarse en el 33% de los pacientes gastrectomizados en 2003, se ha pasado al 80% en 2006 y al 90% en 2007 (fig. 2). Los pacientes que configuran este estudio son los primeros 56 a quienes se ha aplicado un procedimiento videoasistido completo.
Fig. 2. Proporción de gastrectomías realizadas por cirugía laparoscópica en nuestra unidad en los últimos años. Relación de pacientes con cáncer gástrico, gastrectomías y gastrectomías por vía laparoscópica.
En 41 (73%) pacientes se ha realizado una gastrectomía total y en 15 (27%), una gastrectomía subtotal. El tiempo operatorio medio fue 223 ± 35 (rango, 170-320) min y la pérdida hemática media de 320 ± 220 (rango, 100-650) ml. La analgesia epidural por catéter se ha mantenido una media de 2,2 (rango, 1-4) días.
El estudio anatomopatológico de la pieza de resección mostró: tumores T1 en 17 pacientes, T2 en 8 pacientes y tumores T3 en 28 pacientes. No hemos operado por laparoscopia a ningún paciente con tumores T4. El grado de afección ganglionar ha sido: 23 pacientes con N0, 18 pacientes con N1, 7 pacientes con N2 y 5 pacientes con N3. La estadificación (TNM) de los pacientes ha sido: 14 pacientes en estadio IA, 5 en estadio IB, 11 en estadio II, 13 en estadio IIIA, 5 en estadio IIIB y 5 en estadio IV.
El número medio de ganglios extraídos por paciente fue 26,6 ± 12. Sólo el 22,6% de las piezas estudiadas tenían menos de 15 ganglios. La N ratio de los pacientes ha sido: 0 en 22 pacientes, 1 (1-10%) en 6 pacientes, 2 (11-25%) en 10 pacientes y 3 (> 25%) en 15 pacientes.
La morbilidad general registrada en esta serie ha sido del 19,6%. Cabe destacar dos grupos diferentes. El primero de complicaciones inherentes al inicio de esta nueva técnica: una hemorragia y una estenosis del pie de asa, una estenosis del paso transmesocólico y un hemoperitoneo tardío. Otro grupo de complicaciones generales: un fallo de muñón duodenal, 3 abscesos en la herida, una peritonitis, una bronconeumonía y un shock cardiogénico. Estos últimos 2 pacientes han sido las dos únicas defunciones de la serie, lo que da una mortalidad general del 3,5%, y se corresponden con los pacientes de mayor edad. La estancia postoperatoria media ha sido de 9,2 días.
Se debió reintervenir precozmente a 5 (8%) pacientes por las complicaciones citadas anteriormente. La resolución en estos casos fue por cirugía convencional.
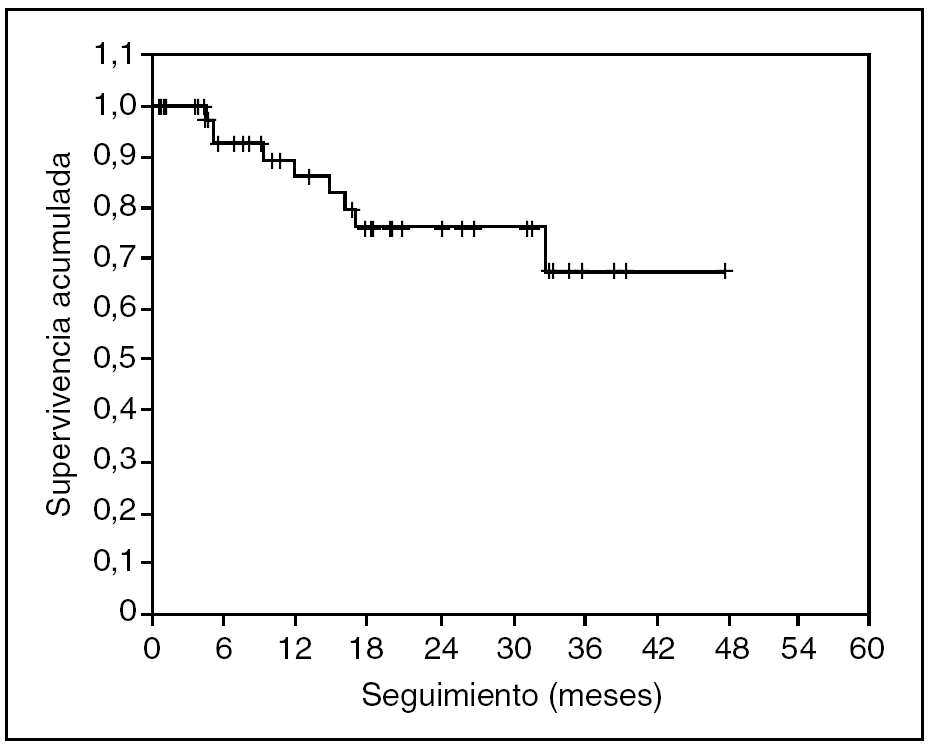
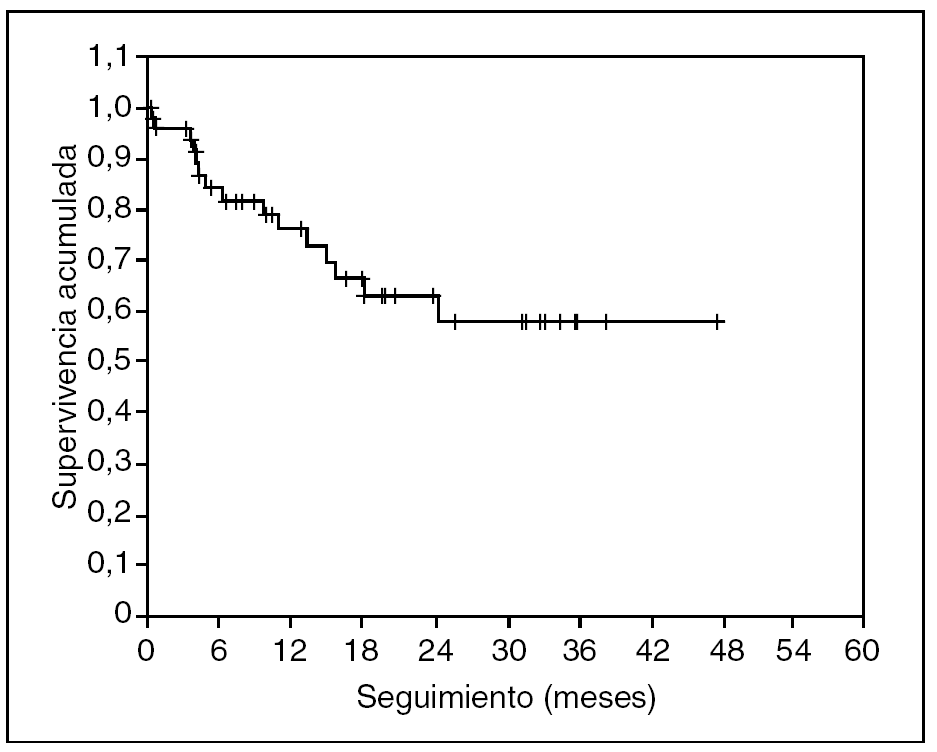
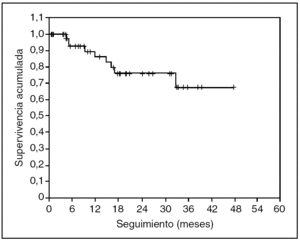
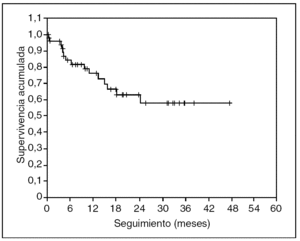
No se ha registrado ningún caso de recidiva neoplásica en las cicatrices de los trocares. En las figuras 3 y 4 se representan, respectivamente, las curvas de supervivencia acumulada (el 66% a 4 años) y de supervivencia libre de enfermedad (el 57% a 4 años) de Kaplan-Meier. El seguimiento medio del grupo es de 19 (rango, 2-54) meses.
Fig. 3. Supervivencia acumulada de la serie. Seguimiento medio de 19 meses.
Fig. 4. Supervivencia libre de enfermedad. Seguimiento medio de 19 meses.
Discusión
El papel de la cirugía en el cáncer gástrico está en constante evolución debido, en parte, al creciente protagonismo de los tratamientos adyuvantes. No obstante, continúa siendo el mejor procedimiento curativo en los tumores localizados3.
Sobre la extensión de la resección, hay autores que prefieren realizar una gastrectomía total en todos los tumores, incluidos los de la parte distal. Los argumentos a favor son la multifocalidad del proceso y su diseminación por vía submucosa. Pero hay trabajos4,5 que siguen defendiendo la idoneidad oncológica de las resecciones subtotales asegurando unos márgenes adecuados. La incorporación del bazo en la resección no se ha demostrado que mejore el pronóstico de los pacientes y conlleva morbilidad6.
A pesar de que las disecciones D2 se han convertido en una práctica estándar en Japón, la evaluación prospectiva de la linfadenectomía en términos de resultados oncológicos sólo se ha realizado fuera de sus fronteras. Dent et al7 realizaron en Sudáfrica el primer estudio aleatorizado sobre la disección ganglionar ampliada. Confirmaron que la morbilidad y la mortalidad hospitalaria seguían siendo inconvenientes importantes en las disecciones D2. No se pudo demostrar el beneficio indicado anteriormente en términos de supervivencia, pero el estudio era demasiado pequeño para analizar este aspecto. Los estudios más extensos sobre disecciones D1 y D2 fueron realizados casi simultáneamente en Países Bajo y Reino Unido. En el Dutch Gastric Cancer Trial (DGCT)8, 80 hospitales aleatorizaron a 1.078 pacientes. El análisis mostró mayor número de complicaciones en la disección D2 (43%) frente a la D1 (25%) y más muertes operatorias (el 10% en D2 frente al 4% en D1). La hospitalización también fue mayor (16 días frente a 14 días en D1). No hubo diferencia en cuanto a supervivencia a los 5 años: el 45% para los D1 y el 47% para los D2. El ensayo del Medical Research Council (MRC)9 aleatorizó a 400 pacientes. Aparecieron complicaciones posquirúrgicas en el 28% de los D1 y el 46% de los D2. La mortalidad hospitalaria fue del 6,5% en los D1 y del 13% en los D2. Con una mediana de seguimiento de 6,5 años, la supervivencia acumulada a los 5 años fue del 35% para el grupo D1 y del 33% para el D2. Por tanto, según los datos publicados de ensayos aleatorizados, no se puede decir que la indicación de la linfadenectomía esté basada en la evidencia. No obstante, la disección ganglionar ampliada sigue teniendo mucho apoyo entre los cirujanos asiáticos y en muchos países occidentales. Esto se debe a que la morbilidad y la mortalidad asociadas a la disección ganglionar ampliada en los estudios aleatorizados son mayores que en los estudios de cohortes publicados, la mayoría unicéntricos. La mortalidad media ponderada en éstos es sólo del 3,9%10.
En nuestra experiencia, la linfadenectomía D2 completa para los tumores de antro y D1 ampliada a los grupos 7, 8, 9 y 11 proximal en los tumores de cuerpo y fundus no incrementa la morbimortalidad y permite una información tumoral muy buena para aplicar procedimientos adyuvantes. Se necesitan aún más trabajos para clarificar la utilidad y la extensión de esta práctica.
El tiempo transcurrido y los estudios publicados en resecciones gástricas regladas por laparoscopia son más que suficientes para confirmar que la técnica es perfectamente reproducible, tanto la resección como la linfadenectomía que se proponga realizar el cirujano11,12. La mayoría de los trabajos publicados hacen referencia aun a resecciones parciales, y nuestro grupo es uno de los primeros en describir y realizar la gastrectomía total con reconstrucción intraabdominal laparoscópica13. Puede resultar útil al principio realizar alguna de las anastomosis a través de la laparotomía practicada para la extracción de la pieza. La práctica continuada nos ha demostrado que se puede realizar cómodamente dentro del abdomen con la misma seguridad y empleando el mismo tiempo que exteriorizándola.
La cirugía laparoscópica que cuenta con gran respaldo de los cirujanos japoneses en los tumores gástricos incipientes, aún no ha recibido el respaldo definitivo en estadios más avanzados. Los grupos occidentales, que llevamos varios años utilizándola en tumores con mayor progresión local, carecemos del volumen necesario de pacientes para aportar en poco tiempo series aleatorizadas comparativas entre cirugía abierta y laparoscópica. No obstante, empiezan a aparecer los primeros estudios comparativos con un reducido número de pacientes, pero con resultados muy satisfactorios14,15. Huscher et al16 han sido los primeros que aportan datos de supervivencia a 5 años con resultados superponibles. Nuestra serie es de las primeras en nuestro país con resultados de supervivencia tras gastrectomía por laparoscopia en cáncer gástrico y hemos podido comparar los resultados de supervivencia de este primer grupo con nuestra serie histórica obteniendo también resultados idénticos.
La realización de la técnica exige un proceso de aprendizaje por parte de todo el equipo quirúrgico. Hemos podido constatar un descenso en el tiempo operatorio, en la aparición de complicaciones y en la estancia media de los últimos pacientes. Este hecho coincide con otros autores, que fijan el número mínimo de resecciones en 50 para asumir una habilidad óptima en el procedimiento. Según Kim et al17, a partir de las primeras 10 resecciones el tiempo medio desciende de 240 min/operación de media a menos de 200 min/operación.
Las ventajas aportadas por la cirugía mínimamente invasiva, apuntadas por las primitivas publicaciones, se han ido confirmando en los diferentes estudios publicados. En un reciente metaanálisis, Hosono et al18 revisan 1.611 procedimientos en 12 estudios retrospectivos y 4 prospectivos aleatorizados. Entre sus conclusiones constatan menor morbilidad, menor dolor postoperatorio, mayor rapidez para recobrar la función intestinal y una estancia hospitalaria menor. Es probable que estos primeros metaanálisis adolezcan aún de ciertos problemas: diferentes niveles de linfadenectomía, diferente grado de experiencia del equipo y que no son aleatorizados. Probablemente con el tiempo las ventajas de la laparoscopia lleguen a ser aún más claras.
Los primeros trabajos sobre la calidad de vida tras la gastrectomía laparoscópica también aportan resultados interesantes. La mayoría de los pacientes pueden consumir una dieta normal y experimentan una pérdida de peso no mayor de 5 kg. Un análisis de 22 parámetros muestra unos resultados comparables con los obtenidos en cirugía abierta. Además, la incidencia de obstrucciones intestinales postoperatorias disminuye tras cirugía laparoscópica19.
En la actualidad no hay una selección de pacientes, en nuestra unidad de cirugía esofagogástrica, tributarios de estos procedimientos. La laparoscopia forma parte del procedimiento sistemático en el cáncer gástrico. Su realización puede ser sólo el último paso de la estadificación de un paciente (en tumores T4) que pasará a iniciar tratamiento neoadyuvante, pude servir para realizar cirugía paliativa o bien puede ser un medio para una exéresis con plenas garantías oncológicas y quirúrgicas en pacientes con tumores T1 a T3. No existen contraindicaciones para su utilización y sólo en algunos pacientes con cirugía previa del espacio supramesocólico debemos desistir tras un primer intento.
Nuestra experiencia, tras una serie inicial de 56 pacientes, indica que la cirugía por procedimientos mínimamente invasivos obtiene unos resultados comparables con los de la cirugía convencional con una serie de ventajas adicionales. Se ha podido incorporar las diferentes fases del procedimiento sin reflejar en los resultados generales el período de aprendizaje inherente a toda nueva técnica. También ha sido posible conservar las mismas resecciones y linfadenectomías que realizábamos en cirugía abierta en función de la localización del tumor. Los resultados oncológicos a medio y largo plazo, aún en fase de revisión y análisis, no muestran diferencias con los que obteníamos en cirugía abierta ni con los que presentan otros grupos.
Correspondencia: Dr. J. Roig García.
Oriol Martorell, 70, 4.o, 3. 17003 Girona. España.
Correo electrónico: jroigg@ono.com
Manuscrito recibido el 22-8-2007 y aceptado el 2-10-2007.